基于FAERS数据库的吡仑帕奈致药品不良事件信号挖掘与分析Δ
陈世祺,陶 婧,杭永付,谢 诚,朱建国,缪丽燕
(苏州大学附属第一医院药学部,江苏 苏州 215006)
1 资料与方法
1.1 数据提取和筛选
OpenVigil 2.1是德国基尔大学Böhm等学者开发的药物警戒工具[8]。本研究通过OpenVigil 2.1数据平台来查询FAERS数据库,通过检索药品名称“perampanel”和商品名“Fycompa”筛选出吡仑帕奈的相关ADE,结合该药上市时间,统计分析2013年第1季度至2022年第1季度共37个季度的数据。
1.2 信号检测方法
在临床上,患者经常存在联合用药的情况,在利用FAERS数据库探讨“药品-不良事件”关联时,容易产生假阳性信号。目前,国际上多采用比值失衡法挖掘药物ADE信号,具有灵敏度高、可消除大量偏倚等优点[9-10]。本研究通过比值失衡法中的比例报告比值法(PRR)和报告比值比法(ROR)进行信号挖掘,信号数值越大表示信号越强,说明吡仑帕奈与目标ADE的统计学关联越强。其算法基于四格表,见表1—2;其中,a、b、c、d分别代表目标药品和其他药品的目标不良事件和其他不良事件报告数量。

表1 比值失衡法四格表

表2 计算公式及信号检测阈值标准
1.3 ADE信号分类法
根据《国际医学用语词典》(MedDRA)25.0版中的首选术语(PT)和系统器官分类(SOC)对ADE的分布情况进行分类和描述,将ADE记录在27个SOC分类上进行统计。为减少适应证偏倚(即将处方药物的适应证报告为ADE)的影响,本研究将与癫痫相关的PT从分析中剔除。
1.4 结局指标
对符合风险信号检测标准的吡仑帕奈ADE报告进行提取分析,并与药品说明书对比,挖掘新的ADE并分析其规律。
2 结果
2.1 吡仑帕奈相关ADE报告的基本情况
本研究数据来源为FAERS数据库,通过公开的OpenVigil 2.1数据平台提取数据,该平台只加载具有完整病例信息的报告,故仅有约67.5%的病例报告被纳入并进行后续清洗[11]。由于剔除了信息不完整的报告,因此数据的质量可能更加可靠。通过检索和筛选后共提取吡仑帕奈相关ADE报告2 386份,除去未知性别的患者425例,剩余报告中女性患者略多于男性患者;除去年龄未知的患者889例,剩余报告中患者年龄主要分布在>18~<60岁;在报告角色代码中,吡仑帕奈主要被列为首要怀疑药品,见表3。

表3 吡仑帕奈相关ADE报告的基本情况
2.2 ADE信号挖掘结果
本研究通过数据挖掘获得吡仑帕奈相关ADE 933个,以散点图和列表的形式分别进行结果展示。图1展示了吡仑帕奈的ADE信号挖掘整体结果,其中横坐标为log2PRR,纵坐标为log2(χ2),图中圆点表示挖掘出的所有ADE信号,添加的纵轴为log2PRR=1,横轴为log2(χ2)=2,右上象限表示与吡仑帕奈有关的阳性信号。
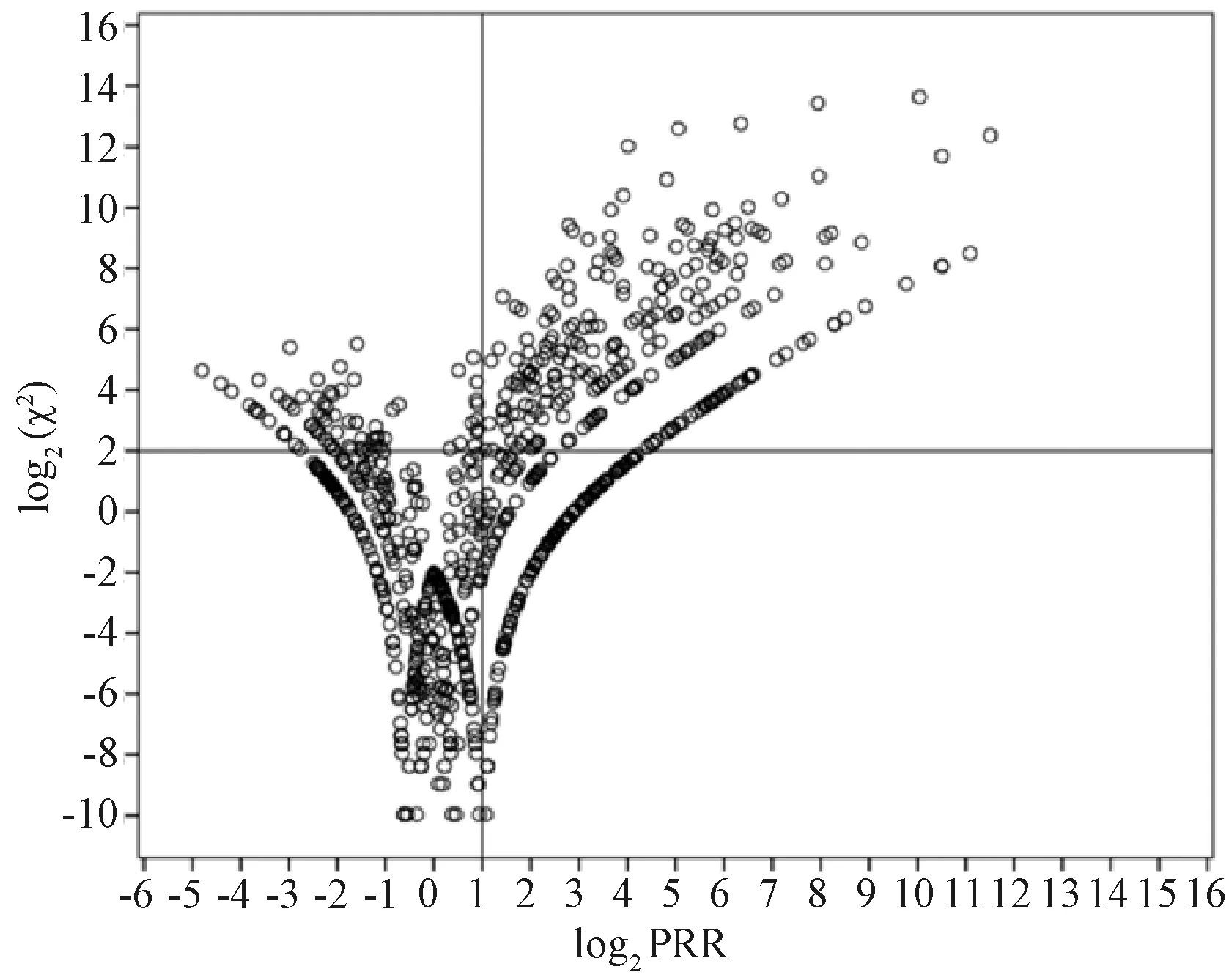
图1 吡仑帕奈的ADE信号挖掘结果
将933个吡仑帕奈相关ADE报告按报告数(a)的前20位进行PT信号排序,发现吡仑帕奈常见ADE为药物无效(253例)、攻击性(250例)、嗜睡(176例)等,见表4。按照χ2>4、PRR>2以及ROR的95%CI下限>1的筛选条件来挖掘吡仑帕奈的ADE信号,并与药品说明书内容进行比对。吡仑帕奈的药品说明书中列出的不良反应有自杀想法、各类神经系统疾病(头晕、嗜睡)、可能降低激素避孕药的有效性、跌倒、攻击性、愤怒、易激惹、情绪改变、暴力、滥用可能性、肝毒性、严重皮肤不良反应(药物反应伴嗜酸粒细胞增多和全身性症状、史蒂文斯-约翰逊综合征)以及受细胞色素CYP3A酶诱导性药物影响等。本研究数据挖掘获得报告频次排序居前20位的ADE基本集中在精神和神经系统症状、药物相互作用等方面,与药品说明书基本一致,证实了本研究信号挖掘的可靠性。
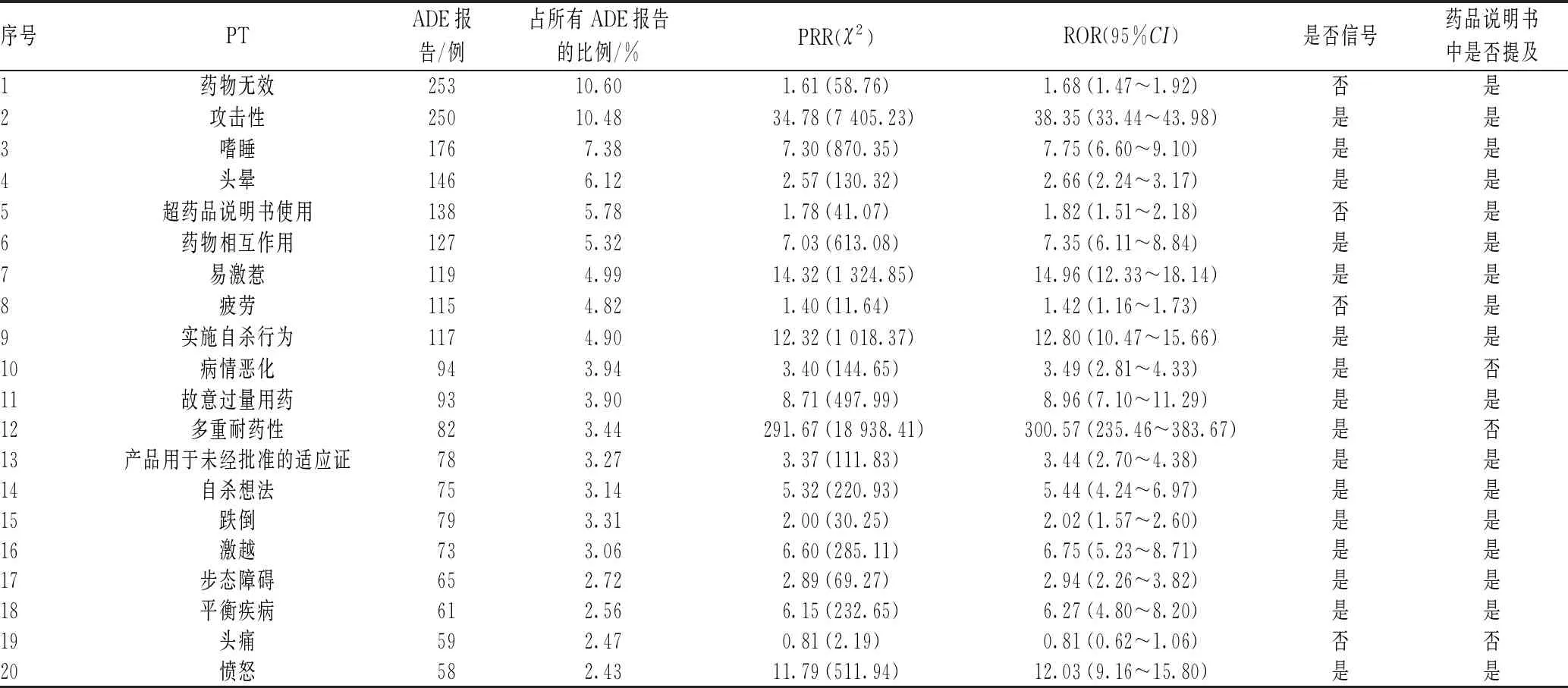
表4 吡仑帕奈ADE报告中频数排序居前20位的PT
结合ROR和χ2的大小,对挖掘出的ADE信号进行信号强度排序,将信号强度排序居前20位的PT信号(a>3)进行SOC分类排序,发现主要集中在神经系统疾病、药物相互作用、生殖毒性、代谢及营养类疾病等方面,见表5。值得注意的是,本研究挖掘出了新的ADE,如高血氨脑病、凝视麻痹、眨眼过度、铁代谢疾病和直立性震颤等。
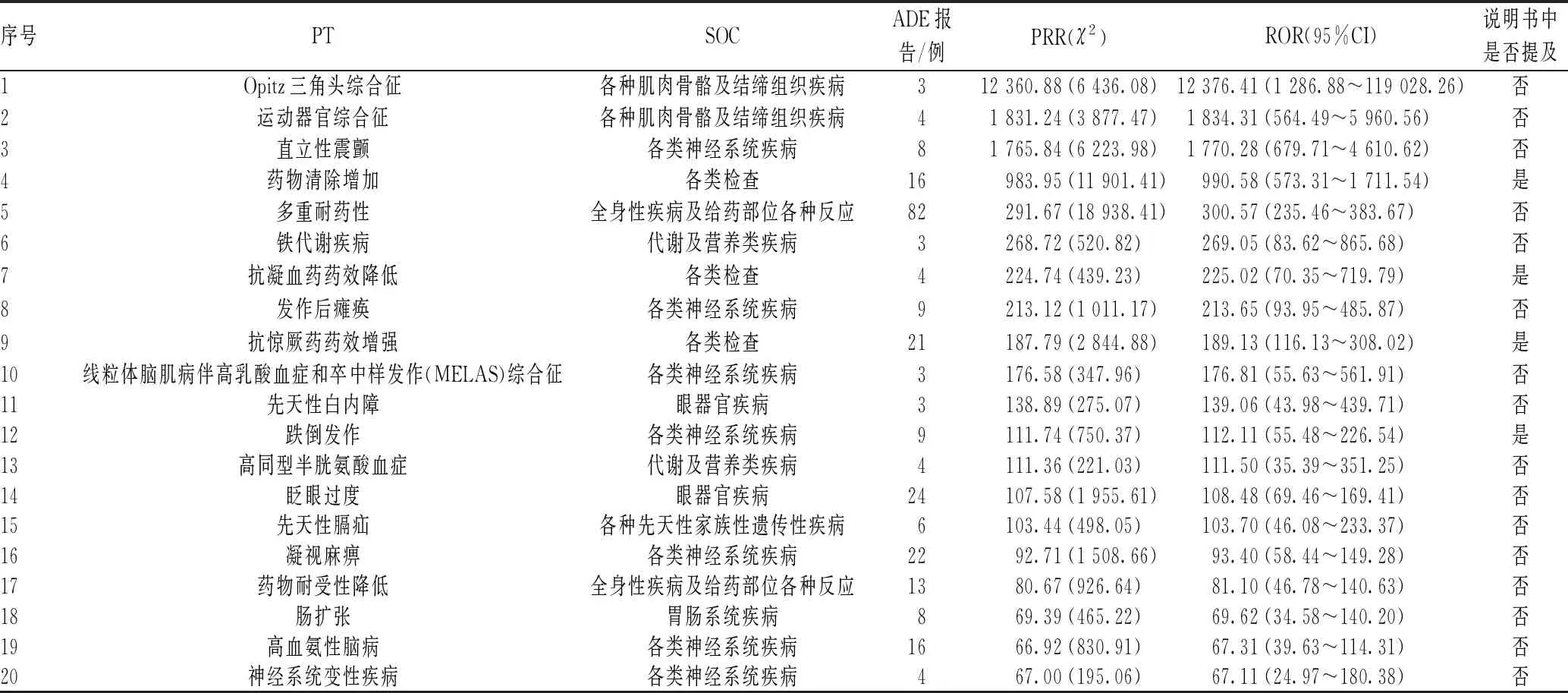
表5 吡仑帕奈ADE报告中主要累及系统的信号强度
3 讨论
吡仑帕奈是目前国内外广泛使用的第3代抗癫痫药,本研究利用比值失衡法对吡仑帕奈的ADE进行分析,FAERS数据库中新的ADE主要为神经系统疾病、生殖毒性、多重耐药性及抗凝血药药效降低、代谢及营养类疾病,由于发生率较低以及伦理问题等,一般均无法在上市前获得临床试验证据。而基于真实世界不良反应数据库挖掘新的ADE及其与日剂量的相关性,可以更好地完善对于新药安全性的认知。
3.1 神经系统不良反应
吡仑帕奈的神经系统新的ADE主要包括头痛、直立性震颤、发作后瘫痪、MELAS综合征、凝视麻痹、高血氨脑病以及神经系统变性疾病等。涉及MELAS综合征的报告中均未有剂量上报,跌倒发作的日剂量最高为6 mg,其他不良反应的日剂量为2或4 mg。跌倒发作及发作后瘫痪均有2例为单药治疗,治疗剂量不详,其余病例均合并使用其他抗癫痫药。可见,运动障碍相关ADE在低剂量用药时即有可能发生。
吡仑帕奈导致的神经系统不良反应发生率随血药浓度的升高而升高,而过快地增加药物日剂量和过高的血药浓度可能导致更严重的ADE和更高的ADE发生率[3-4]。一项纳入儿童、青年和成人癫痫患者的巢式病例对照研究结果显示,吡仑帕奈血药浓度>600 ng/mL患者的ADE发生率是血药浓度<200 ng/mL患者的5.1倍[12]。目前推荐一般起始剂量≤6 mg,日剂量每2周(或更久)增加2 mg[3-4]。但在联合应用具有肝酶诱导作用的抗癫痫药、癫痫持续状态、脑肿瘤相关癫痫或其他紧急情况下,剂量需根据实际情况进行调整[4]。
3.2 生殖毒性
信号挖掘发现的生殖毒性方面的ADE主要包括Opitz三角头综合征、先天性白内障、先天性膈疝等先天性疾病。进一步分析了各病例的联合用药及使用剂量,其中3例Opitz三角头综合征患者均联合应用了拉莫三嗪及托吡酯,其中1例患者的吡仑帕奈日剂量为6 mg;3例先天性白内障患者均联合应用了拉莫三嗪及拉考沙胺,其中2例患者的吡仑帕奈日剂量为6或8 mg;6例先天性膈疝患者均联合应用了拉莫三嗪、左乙拉西坦、阿司匹林,其中5例患者的吡仑帕奈日剂量均为10 mg。患者使用的吡仑帕奈日剂量较高,其中先天性膈疝患者的日剂量高于其余2种疾病。妊娠期患者,特别是日剂量较高者,应充分告知其不良反应风险,嘱定期孕检。同时,对于避孕的女性,药品说明书中注明吡仑帕奈日剂量12 mg会显著降低左炔诺孕酮和炔雌醇的最大血药浓度,因此,使用日剂量12 mg的女性应考虑含孕酮的激素避孕药疗效降低的可能性[13]。随着吡仑帕奈在真实世界的使用和研究,将获得更多的生殖安全性证据,从而为患者做出更合理的选择。
3.3 多重耐药性及抗凝血药药效降低
吡仑帕奈的蛋白质结合率约为95%,半衰期约为105 h,主要通过细胞色素CYP3A酶介导代谢[14]。在体外模型评估中,吡仑帕奈(30 μmol/L)对肝细胞色素P450酶系统(CYP)和尿苷二磷酸葡萄糖醛酸基转移酶(UGT)中的CYP2C8和UGT1A9产生弱抑制作用;与阳性对照(包括苯巴比妥、利福平)相比,吡仑帕奈对CYP2B6(30 μmol/L)和CYP3A4/5(≥3 μmol/L)产生弱诱导作用[12]。本研究挖掘出的新ADE信号多重耐药性(82例,PRR=291.67,χ2=18 938.41)可能与药物相互作用相关。另外,新ADE信号抗凝血药药效降低(4例,PRR=224.74,χ2=439.23)在药品说明书中未提及,根据本研究结果,建议患者同时使用吡仑帕奈和华法林等抗凝血药时应加强监测。
3.4 代谢及营养类疾病
药品说明书未提及但信号强度高的代谢及营养类ADE有高同型半胱氨酸血症和铁代谢疾病。分别以吡仑帕奈和上述不良反应为关键词,在中国知网和PubMed等数据库中检索,均未得到相关结果。但已有多项研究探讨抗癫痫药丙戊酸、卡马西平、奥卡西平、苯妥英钠等与高同型半胱氨酸血症的关系[15-18]。因此,对于长期服用吡仑帕奈及其他抗癫痫药的患者,可定期筛查同型半胱氨酸,有利于降低心血管疾病风险[19]。
本研究为回顾性研究,存在着一定的局限性。(1)研究数据来自自发呈报系统,存在信号低估的可能,而部分不良反应与疾病本身的进展及伴发症状难以区分,这些信号存在高估的可能[8];(2)本研究数据来源于FAERS数据库,其纳入的患者信息大部分来自美洲地区,亚洲人群尤其是我国人群很少,结果可能存在人种和地域的差异,后续可尝试基于我国的不良反应/事件报告数据进行研究分析;(3)数据挖掘只能发现药品与不良事件存在统计学关联,并不能提供因果关系的证据,其因果关系仍需进一步评估和验证。
综上所述,本研究基于FAERS数据库,采用比值失衡法对吡仑帕奈的ADE进行了信号挖掘,着重发现并讨论了信号较强的新ADE,如直立性震颤、高血氨脑病和生殖毒性等,为药品说明书提供了来自真实世界的数据补充,为临床安全用药提供了客观资料。建议临床应用吡仑帕奈时,重点关注精神疾病不良反应[20]、多重耐药性及抗凝血药药效降低等,加强监护,保障患者安全。对一些特殊群体,如有精神疾病史的人群、妊娠期妇女,使用吡仑帕奈前需权衡不良反应风险,探索最佳药物治疗剂量,从而进行个体化治疗。在用药过程中,尽早识别相关不良反应信号,为患者安全用药护航。

