Tatarinan O通过SMAD信号通路抑制TGF-β1诱导的非小细胞肺癌A549细胞上皮间质转化的研究Δ
吴 迪,陈英华,杨 彦#
(1.重庆市急救医疗中心药剂科,重庆 400014; 2.重庆市急救医疗中心肿瘤科,重庆 400014)
肺癌是全球死亡率最高的恶性肿瘤,其中非小细胞肺癌是其恶性程度最高的一种病理类型[1]。在非小细胞肺癌晚期,转化生长因子β(TGF-β)刺激肿瘤血管生长,降低细胞间的黏附以及合成细胞外基质等,为肺癌的生长、转移提供微环境,使肺癌更具侵袭性[2-3]。目前,针对肿瘤治疗的TGF-β抑制剂的研发备受关注,已有多个项目进入临床试验[4-6]。中药及中药中分得的单体化合物对TGF-β信号通路的抑制作用也有较多报道,但其作用靶点并不清楚[7]。
天南星科的多年生草本植物石菖蒲(AcorustatarinowiiSchott)是一味常用中药,具有化湿开胃、开窍豁痰和醒神益智的功效[8]。研究结果发现,石菖蒲中的木脂素类单体活性组分具有一定的神经保护作用、抗氧化和抗炎活性[9-11]。Tatarinan O(TO)是石菖蒲根茎中以细辛脑为母核的木脂素类单体组分,具有较强的抗炎活性,且细胞毒性极低[12]。细辛脑作为活性天然产物被广泛研究,曾有报道β-细辛脑能够抑制人神经胶质瘤U251细胞上皮间质转化(EMT)的发生[13]。但对于TO相关的报道很少。本研究利用TGF-β1诱导构建非小细胞肺癌A549细胞EMT以及迁移模型,并探讨了TO对其的抑制作用。
1 材料与方法
1.1 细胞株
人肺癌A549细胞株购于中国科学院上海细胞生物学研究所细胞库。细胞株用含10%胎牛血清RPMI-1640培养液,在37 ℃、5%CO2饱和湿度的环境下常规培养,取对数生长期的细胞进行实验。
1.2 仪器
SpectraMax® iD5型多功能酶标仪(美国Molecular Devices公司);DMi1型倒置显微镜、TCS SP8型激光共聚焦显微镜(德国Leica公司);LI-COR Odessey® DLx型双色红外激光成像仪(美国LI-COR Biosciences公司)。
1.3 药品与试剂
TO(分子量:624.77,纯度>99%)由重庆康桥制药股份有限公司提取并分离纯化。RPMI 1640培养液(批号:11875119)和胎牛血清(批号:10100147C)购自美国Gibco公司;甲基偶氮唑蓝(MTT,批号:475989)、TGF-β1冻干粉(批号:475989)、4′, 6-二脒基-2苯基吲哚(DAPI,批号:D9542)以及TGF-β1抑制剂SB431542(批号:116150)购自美国Sigma公司;SMAD2(批号:5339S)、磷酸化SMAD2(p-SMAD2)(Ser465/Ser467)(批号:18338S)、波形蛋白(Vimentin,批号:5741S)兔抗人及E-钙黏蛋白(E-cadherin)鼠抗人单克隆抗体(批号:14472S)购自美国CST公司;山羊抗兔及山羊抗鼠IgG(IRDye 800CW)(批号:C50331-05/C50113-06)近红外二抗购自美国LI-COR公司。
1.4 增殖抑制实验
取生长状态良好的非小细胞肺癌A549细胞,按8 000个/孔接种至96孔板。待细胞贴壁后,加入不同浓度的TO作用于细胞24 h,每个浓度设置3个复孔。孵育结束后,弃去上清液,并加入PBS润洗细胞2次。加入含MTT的1640培养基(0.5 mg/mL MTT),100 μL/孔。将96孔板置于培养箱孵育4 h,小心弃去上清液,每孔加入100 μL的DMSO并避光振荡5 min至紫色结晶完全溶解。采用多功能酶标仪测量490 nm波长处吸光度(A),计算出各浓度TO对细胞的增殖抑制率,抑制率=(1-A药物组/A对照组)×100%。使用Prism Graphpad 5.0软件拟合TO对不同细胞的半数抑制浓度(IC50)。
1.5 细胞形态学分析
取生长状态良好的非小细胞肺癌A549细胞接种至6孔板,待细胞贴壁后,加入TO(5 μmol/L)预先干预2 h,然后使用TGF-β1(10 ng/mL)刺激48 h以诱导细胞发生EMT。采用倒置光学显微镜拍摄细胞照片。
1.6 细胞划痕实验
取生长状态良好的非小细胞肺癌A549细胞接种至6孔板,待细胞贴壁生长密度达到80%,采用无血清培养基饥饿培养24 h。使用无菌200 μL枪头垂直六孔板均匀划线,用PBS洗去脱落细胞,加入含有不同浓度TO的低血清培养基预先作用2 h,然后加入TGF-β1(10 ng/mL)刺激细胞48 h。实验结束后在倒置光学显微镜下拍摄照片,测量划痕区域面积变化。
1.7 蛋白质印迹法
取生长状态良好的非小细胞肺癌A549细胞按2×106个/孔接种至6孔板。待细胞贴壁后更换低血清培养基饥饿12 h。加入不同浓度TO(10、25和50 μmol/L)预先处理细胞2 h,然后使用TGF-β1(5 ng/mL)诱导1 h。诱导结束后收集细胞提取细胞总蛋白,蛋白变性后保存至-80 ℃冰箱。蛋白按20 μg上样并进行聚丙烯酰胺凝胶电泳分离。电泳结束后,采用湿转法将蛋白质至硝酸纤维素膜,5% BSA室温(25 ℃)封闭1 h,采用p-SMAD2,SMAD2、Vimentin、E-cadherin以及β-actin一抗4 ℃过夜孵育,采用相应的IRDye® 800CW近红外标记二抗,室温避光孵育1 h。目标蛋白条带采用LI-COR Odessey® DL成像系统检测,以蛋白灰度值/β-actin灰度值表示蛋白相对表达量。
1.8 免疫荧光实验
取生长状态良好的非小细胞肺癌A549接种至覆有盖玻片的6孔板,制备细胞爬片。待细胞贴壁后更换低血清培养基饥饿12 h。加入TO(10、25和50 μmol/L)预先处理细胞2 h,然后使用TGF-β1(10 ng/mL)进行诱导。诱导结束后PBS清晰爬片,在4 ℃条件下,采用4%多聚甲醛固定细胞30 min,0.1% TritonX-100室温穿膜10 min,5% BSA室温封闭1 h,SMAD2、Vimentin以及E-cadherin一抗4 ℃过夜孵育,次日选用相应的Alexa Fluor Plus 594二抗室温避光孵育1 h,DAPI(0.5 μg/mL)复染细胞核,最后采用抗荧光猝灭剂封片于显微镜载玻片。采用激光扫描共聚焦显微镜采集图像并拍照记录。
1.9 统计学方法

2 结果
2.1 TO抑制TGF-β1诱导非小细胞肺癌A549细胞EMT
TO的化学结构式及剂量抑制曲线见图1。TGF-β1(10 ng/mL)诱导细胞48 h后,非小细胞肺癌细胞出现较为明显的形态学改变,大部分细胞失去了圆形及长触角形态,表现为长梭形或者纺锤形;同时,细胞间距增大且连续松散,呈明显间质形态,见图2(A)。然而,预先2 h给予25 μmol/L的TO[无毒剂量,见图1(B)]进行干预则能够在A549细胞形态学上逆转TGF-β1诱导的EMT,见图2(A)。TO能够下调非小细胞肺癌A549细胞中TGF-β诱导的蛋白Vimentin的表达,上调蛋白E-cadherin的表达,在25、50 μmol/L的TO作用下,Vimentin、E-cadherin表达水平与0 μmol/L的TO相比,差异有统计学意义(P<0.05),见图2(B)。免疫荧光实验也得到了相似的结果,见图2(C)。

A.TO的化学结构式;B.TO作用非小细胞肺癌A549细胞48 h的剂量抑制曲线
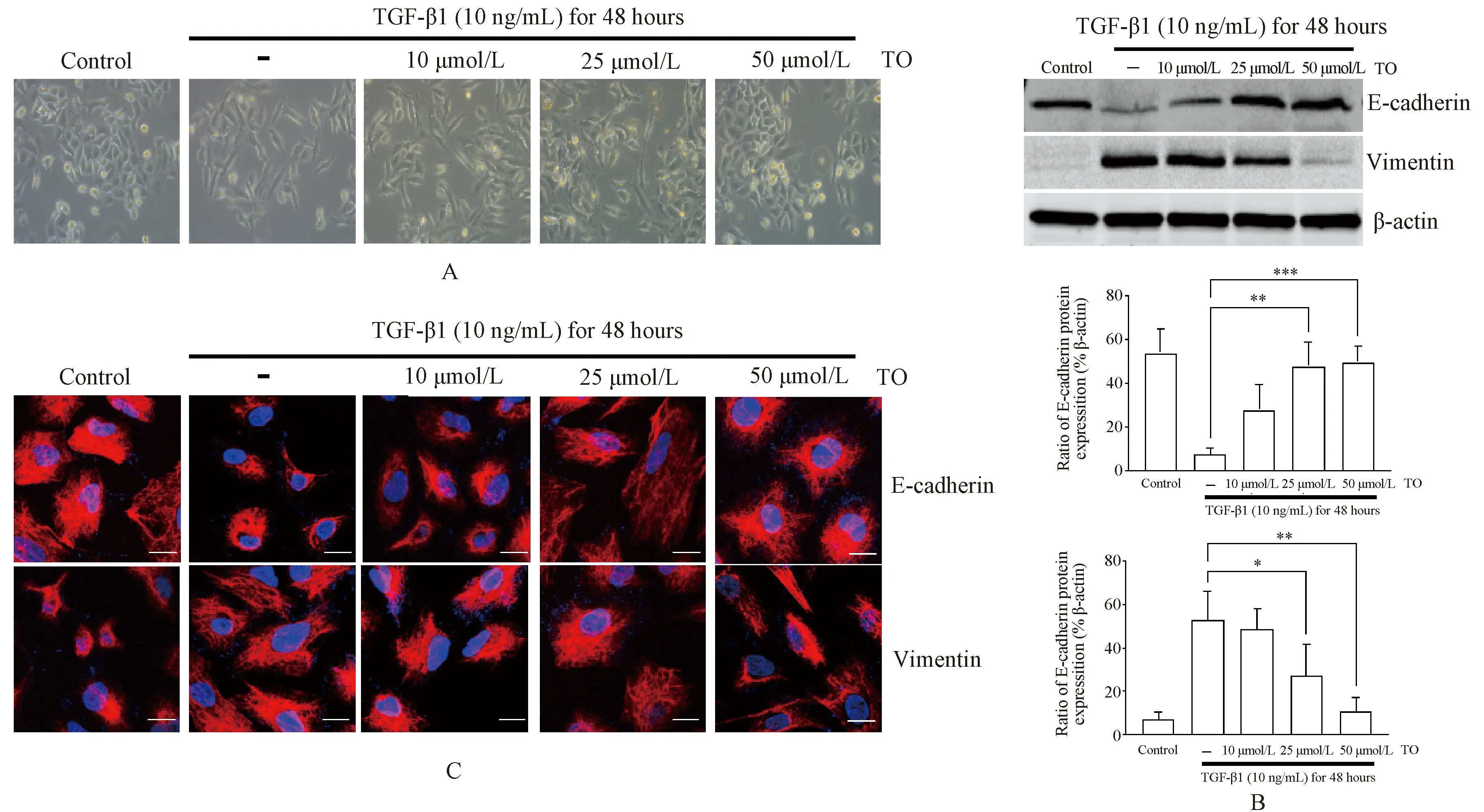
A.TO抑制TGF-β1诱导的A549细胞形态学的变化;B.蛋白质印迹法验证TO干预后EMT标志物E-cadherin和Vimentin的变化;C.激光共聚焦显微镜观察E-cadherin和Vimentin表达的改变[上半部分为E-cadherin(红色)和细胞核(蓝色),下半部分为Vimentin(红色)和细胞核(蓝色)];*P<0.05,**P<0.01,***P<0.001
2.2 TO抑制TGF-β1诱导的SMAD2蛋白磷酸化并阻断其核转位
TGF-β1(5 ng/mL)诱导A549细胞中SMAD2蛋白磷酸化,预先2 h给予TO或者阳性对照SB431541(2 μmol/L)进行干预能够剂量依赖地抑制SMAD2蛋白磷酸化,而SMAD2蛋白的表达量未受到影响,见图3(A)。SMAD2以及SMAD3的磷酸化能够帮助其富集胞质中SMAD4蛋白并形成复合物,SMADs复合物进入细胞核并促进其下游基因的表达。免疫荧光实验结果表明,TO(25 μmol/L)能够抑制SMAD蛋白复合物的核转位,从而阻断其下游基因转录的激活,见图3(B)。
2.3 TO能够抑制非小细胞肺癌细胞迁移
上皮细胞间质化直接促进了肿瘤细胞的转移[6]。细胞划痕实验结果表明,预先2 h给予TO进行干预能够剂量依赖地抑制TGF-β诱导的非小细胞肺癌细胞迁移,见图3(C);单独给予TGF-β1刺激组划痕区域面积缩小,而给予TO干预后(25、50 μmol/L组)能够抑制细胞迁移,有效阻止细胞进入划痕区域。

A.蛋白质印迹法验证TO对SMAD2蛋白磷酸化的影响;B.激光共聚焦显微镜观察TO对SMAD2蛋白核转位的影响[SMAD2蛋白(红色)和细胞核(蓝色)];C.细胞划痕实验;*P<0.05,**P<0.01,***P<0.001
3 讨论
TGF-β/SMADs信号转导通路是TGF-β受体激活后一条重要通路。TGF-β受体激活后,形成异源二聚体(TGF-β RⅠ/RⅡ),TGF-β RⅡ使得TGF-β RⅠ磷酸化,然后招募受体特异性的R-SMADs(主要是SMAD2和SMAD3)并使其磷酸化。活化的SMAD2/3与普通SMAD4形成复合物SMAD2/3/4,SMADs复合物进一步入核并与DNA中的SMAD结合元件结合调控其下游基因的表达。本研究结果发现,TO能够剂量依赖地抑制TGF-β1诱导SMAD2的磷酸化,并阻止SMAD2的入核行为。
TGF-β的众多生物活性中,其诱导的EMT在肿瘤和纤维化疾病中发挥了重要作用[14]。由图2(A)可见,TGF-β诱导上皮细胞发生EMT后,细胞形态变得细长,细胞间间隙增大,细胞间连结变得松散。同时,细胞运动功能增加,对凋亡抵抗增加,侵袭和迁移能力增强。上皮细胞标志分子包括E-cadherin、闭锁连接蛋白和Ⅳ型胶原等表达降低[15-17];相反,间质细胞标志分子如Vimentin、成纤维细胞特异性蛋白1、α-平滑肌肌动蛋白、N-钙黏蛋白及Ⅰ、Ⅲ型胶原等表达增加[18-22]。EMT是引起肿瘤细胞侵袭和转移的重要因素之一,还可改变肿瘤细胞外基质的组成并造成细胞间质液压力升高而阻碍抗肿瘤药的进入,还可使肿瘤细胞获得“类干细胞”的特性[23]。本研究结果发现,TO能够抑制Vimentin的表达以及E-cadherin的降低;同时,划痕试验结果也表明,TO能够抑制肿瘤细胞迁移。然而,TO逆转这些变化的上游机制仍需继续探索。
综上所述,TO能够有效抑制TGF-β诱导的非小细胞肺癌细胞EMT及其侵袭与转移的发生,或可为TO在非小细胞肺癌分子靶向治疗的应用提供新的理论依据。

