细胞外基质刚度调控压电型机械敏感离子通道组件1对神经干细胞分化的影响*
徐汪洋 黄丽珊 姚 舜 黄子祥 张 力 张 辉 王业杨
(广东省第二人民医院骨科中心,广州 510317)
脊髓损伤(spinal cord injury,SCI)是脊柱损伤后严重的中枢神经系统创伤性疾病,具有极高的致残、致畸与死亡率,往往引起患者机体运动功能及感觉功能损伤,给社会及家庭带来沉重的经济负担,严重影响患者的身心健康[1-2]。神经干细胞(neural stem cells,NSCs)一直是SCI研究的热点,但外源干细胞移植面临着免疫排斥和移植后肿瘤形成的风险[3]。从医学转化角度来看,如何激活内源性NSCs产生神经元和神经胶质,以进行脊髓修复值得探究。研究表明,与正常的脊髓组织相比,受伤的脊髓基质刚度明显降低[4-5]。细胞周围基质刚度的变化对骨髓间充质干细胞及肿瘤细胞的分化和激活产生影响[6-8]。但脊髓基质刚度如何影响NSCs细胞分化激活,以及细胞如何将细胞外力学刺激信号转导为细胞内生化信号还有待研究。
压电型机械敏感离子通道组件1(piezo type mechanosensitive ion channel component 1,Piezo1)是一种机械敏感性阳离子通道,可以响应机械信号并通过调节钙离子的流入进而调节细胞密度和干细胞活化。在多种细胞中,Piezo1都可调控力学刺激引起的阳离子内流,且其是神经发育过程中的重要调节器,参与轴突生长、少突胶质细胞的髓鞘形成和祖细胞分化[9]。Piezo1介导视网膜神经节细胞机械敏感性,Piezo1敲低改变了大脑的刚度,导致轴突生长减缓[10]。体内外实验也表明,药理性激活Piezo1可诱导脱髓鞘,而抑制Piezo1减轻中枢神经系统的脱髓鞘[11]。激活Piezo1通道会减慢脂多糖刺激的星形胶质细胞的迁移速度及细胞因子和趋化因子的释放[12]。上述研究提示Piezo1调节的局部组织刚度参与神经发育过程。本文拟研究基质刚度变化及Piezo1响应细胞外基质刚度变化对NSCs分化的影响,以期为基于生物材料的脊髓损伤治疗提供新的视角。
1 材料与方法
1.1 材料
SD大鼠购自南方科技大学实验动物中心。兔抗Piezo1多克隆抗体购自英国Abcam公司;兔抗双皮质醇(doublecortion,DCX)单克隆抗体及兔抗胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)抗体购自美国Cell Signaling Technology公司;辣根过氧化物酶标记的抗兔或抗羊IgG、IV型胶原(collagen IV)及纤连蛋白(fibronectin)抗体购自英国Abcam公司;过硫酸铵购自北京化学试剂公司;四甲基乙二胺和重组纤连蛋白购自美国Sigma公司;LipofectamineTM2000购自美国Invitrogen公司;Piezo1短发夹RNA(short hairpin RNA,shRNA)质粒由上海吉凯公司制备。
1.2 大鼠脊髓损伤模型的构建
麻醉后将大鼠(2月龄)剪除手术切口周围2 cm范围毛发,消毒,定位T8~T10位置后行背部正中切口,长约2 cm,剪开皮肤,钝性分离皮下筋膜组织,将T9~T11椎板全切除后暴露相应节段脊髓,显露硬脊膜并保持其完整和表面干洁,采用10 g×25 mm致伤势能对大鼠脊髓进行垂直坠落打击损伤,打击完毕后可见损伤区硬膜下血肿、大鼠双后肢抽搐及鼠尾痉挛性摆动后下垂,大鼠苏醒后双后肢呈瘫痪状态表示造模成功。空白对照(sham)组大鼠仅行T9~T11椎板切除术,不损伤脊髓。每组3只大鼠。本研究获得广东省第二人民医院动物实验伦理委员会批准(批准号:2022-DW-SB-94),所有动物实验遵循国家及医院实验动物福利伦理审查指南。
1.3 大鼠脊髓NSCs的分离与细胞分组
出生1~2 d大鼠以脱颈椎法处死,75%酒精常规消毒皮肤。无菌PBS清洗后,剥离背部皮肤,剥离椎板、硬脊膜,分离出脊髓组织,用DMEM/F12液冲洗3~4遍,去除脊髓组织表面的血细胞和杂质。用眼科剪将脊髓组织剪碎至大约0.5 mm2的小块,吹打成细胞悬液。收集细胞悬液过筛网(200目铜网过滤),获得单细胞悬液。然后采用1 200 r/min离心8 min,获细胞沉淀。将细胞重悬于无血清NSCs基础培养液中,进行细胞计数,调整细胞浓度为(4~5)×108/L。
取刚分离或第二代脊髓NSCs悬液,置入装有0.1%多聚赖氨酸处理过盖玻片的3.5 cm培养皿中,培养条件为无血清NSCs基础培养液,37℃、5%CO2培养箱培养。
细胞分组如下:0.7 kPa组、20 kPa组、40 kPa组(NSCs分别培养于0.7、20、40 kPa刚度基底);sh-NC组(20 nmol/L sh-NC转染NSCs细胞,并培养于40 kPa刚度基底下);sh-Piezo1组(20 nmol/L Piezo1 shRNA转染NSCs细胞,并培养于40 kPa刚度基底下)。
1.4 免疫组织化学
大鼠麻醉处死,快速开胸,经心灌注生理盐水约200 ml以置换出血液,然后在冰上以损伤处为中心取出长约1 cm脊髓组织。多聚甲醛固定后OCT包埋。制备冰冻切片。经复温,PBS漂洗,0.3% Triton X-100通透后,10%正常山羊血清的PBS液室温封闭1 h。然后用羊抗鼠Piezo1(1∶200)一抗4℃孵育过夜,加入稀释后的30 μl抗鼠IgG二抗(1∶200),PBS漂洗后,DAPI复染。封片后,于显微镜下观察并拍照。
1.5 不同刚度的基质制备
聚丙烯酰胺凝胶基底的制备方法参考Tse等[13]的研究。具体配方见表1。配好相应刚度的溶液后,加入10%的过硫酸铵(北京化学试剂公司)和0.1%的四甲基乙二胺(美国Sigma公司),快速混匀。将混合液加入间隔为0.75 mm的平行制胶板中静置1 h使其凝固。将水凝胶切成合适大小的圆形,PBS清洗后,将光交联剂(Sulfo-SANPA)均匀滴于胶表面,紫外灯照射30 min,活化聚丙烯酰胺胶以便与胶原连接。PBS清洗3次,在胶的表面铺上合适体积的I型胶原蛋白(collagen I,25 mg/L),4℃孵育过夜。

Table 1 Polyacrylamide gel formulations with different elastic modulus
1.6 Piezo1及重组纤维连接蛋白处理NSCs细胞
根据Invitrogen公司说明书,用LipofectamineTM2000将20 nmol/L sh-Piezo1或sh-NC分别转染NSCs细胞,孵育48 h。对于重组纤维连接蛋白处理NSCs细胞,50 mg/L重组纤维连接蛋白加入40 kPa聚丙烯酰胺凝胶基底,37℃处理4 h,PBS清洗后紫外杀菌30 min。
1.7 蛋白质免疫印迹(Western blot)
RIPA裂解液在冰上裂解NSCs细胞,BCA试剂盒测定蛋白质浓度。随后取10 μg蛋白质经聚丙烯酰胺凝胶电泳,电转至12% PVDF膜上,10%牛血清白蛋白封闭1 h。加入Piezo1一抗稀释液,4℃孵育过夜。次日加入二抗,ECL发光试剂盒检测目的蛋白的表达。以β-actin作为内参蛋白,Image-Pro Plus 6.0软件进行定量分析。
1.8 免疫荧光检测DCX和GFAP阳性细胞百分比
将1×104个NSCs细胞培养在不同刚度的基底上48 h后,吸弃培养板内的促分化培养基;4%多聚甲醛固定后0.5% Triton X-100室温通透20 min;10%山羊血清的PBS溶液室温封闭30 min,随后滴加兔抗小鼠DCX一抗(1∶800)或GFAP一抗(1∶200),4℃孵育过夜;滴加Alexa Fluor® 594标记的荧光二抗,室温孵育1 h;DAPI(0.1 µg/L)避光孵育10 min,封片后,于Olympus IX53显微镜下观察并拍照。重复3次。
1.9 统计学分析
采用SPSS 19.0软件进行数据的统计分析。脊髓损伤大鼠损伤组织Piezo1表达采用独立样本t检验进行两组间比较,其他实验数据均采用单因素方差分析及Bonferroni事后检验进行多组间比较。P<0.05为差异具有统计学意义。
2 结 果
2.1 硬基质刚度促进NSCs向神经元细胞分化
将NSCs分别培养于0.7、20、40 kPa刚度基底上,免疫荧光法检测神经元标志物DCX和星形胶质细胞标志物GFAP阳性细胞百分比。如图1所示,与0.7 kPa组相比,20 kPa组和40 kPa组DCX阳性细胞数增加(图1a,b),而GFAP阳性细胞数减少(图1c,d)。NSCs培养96 h时,DCX阳性细胞数较培养48 h增加(图1a,b),而GFAP阳性细胞数较培养48 h减少(图1c,d)。

Fig. 1 Matrix stiffness affects differentiation of NSCs
2.2 Piezo1在脊髓损伤大鼠损伤组织的表达
免疫组织化学结果显示,与sham组比较,脊髓损伤大鼠损伤组织Piezo1蛋白表达上调(图2a)。Western blot结果与免疫组织化学结果一致(图2b,c)。

Fig. 2 Expression of Piezo1 in rat spinal cord tissue
2.3 硬基质刚度促进Piezo1蛋白表达
Western blot结果表明,与0.7 kPa基质刚度相比,随着基质刚度上升,Piezo1蛋白表达量显著上调(图3)。与培养48 h相比,NSCs在相应刚度基质上培养96 h时Piezo1表达量更高(图3)。

Fig. 3 Effect of matrix stiffness on expression of Piezo1 in NSCs
2.4 Piezo1沉默逆转了硬基质刚度对NSCs分化的影响
为了检测Piezo1是否参与基底刚度调节的NSCs细胞分化,NSCs细胞转染sh-Piezo1质粒并于40 kPa基质刚度条件下培养。Western blot实验表明,sh-Piezo1转染后Piezo1蛋白表达量降低,sh-Piezo1 #1的沉默效率高于sh-Piezo1 #2(图4a,b),因此用sh-Piezo1 #1干扰质粒进行后续实验。免疫荧光结果显示,40 kPa基质刚度条件下沉默Piezo1后,DCX阳性细胞数减少(图4c),而GFAP阳性细胞数增加(图4d)。上述结果说明,沉默Piezo1会逆转硬基质刚度引起的NSCs向神经元细胞分化。

Fig. 4 Piezo1 directs neuronal-glial lineage choice in NSCs
2.5 纤连蛋白逆转Piezo1对NSCs分化的影响
据报道,在Piezo1敲除人胶质母细胞瘤中,包括细胞外基质形成、胶原分解代谢、细胞黏附、ECM-受体相互作用在内的多种通路成分下调[14]。Western blot实验表明,40 kPa基质刚度条件下沉默Piezo1后,细胞外基质IV型胶原及纤连蛋白表达下降(图5a~c)。与sh-Piezo1处理的NSCs相比,重组纤连蛋白处理NSCs后,DCX阳性细胞数增加(图5d),而GFAP阳性细胞数减少(图5e)。
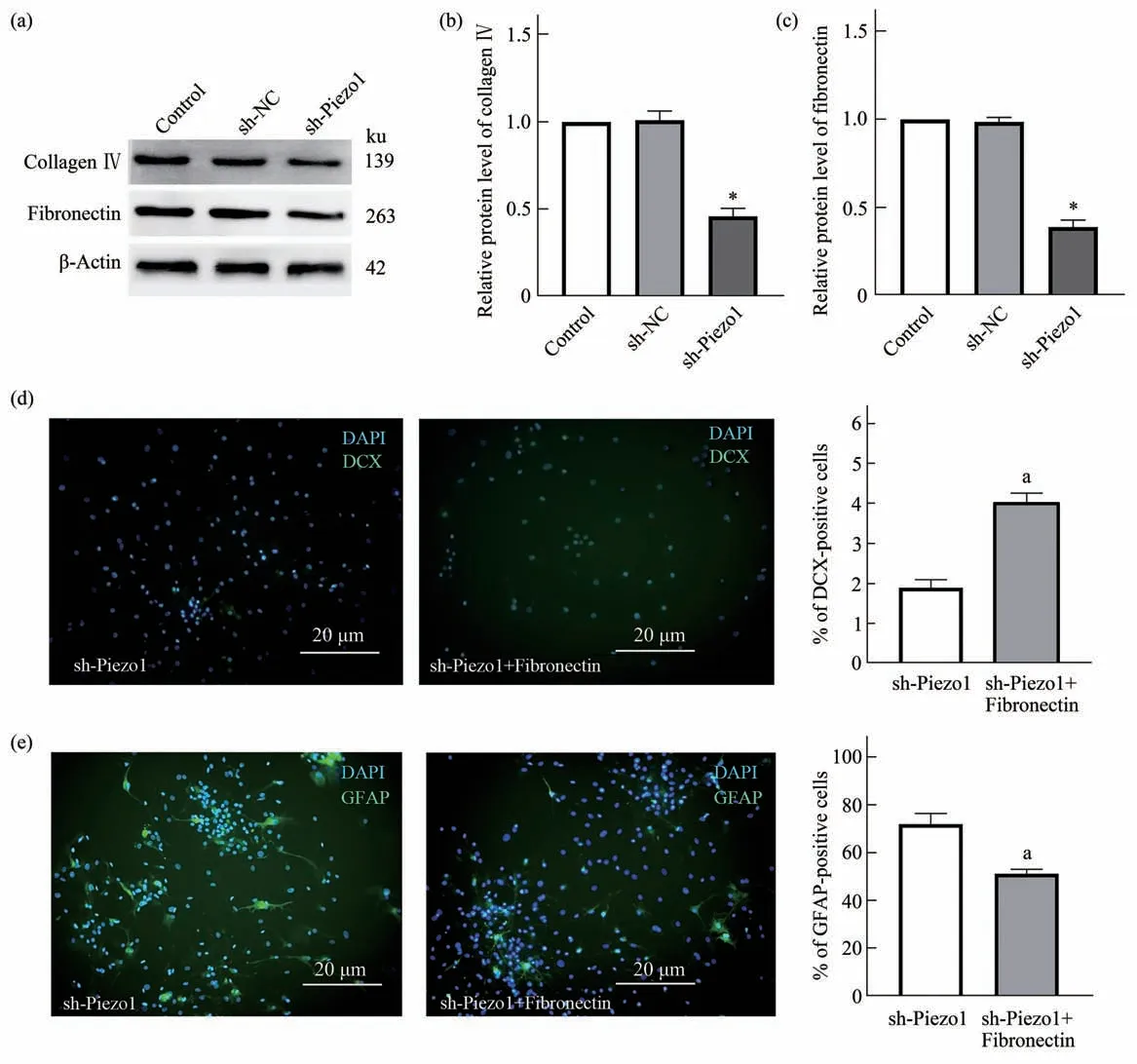
Fig. 5 Fibronectin reversed the effect of Piezo1 on NSCs differentiation
3 讨 论
本文研究发现,较硬的基底刚度使NSCs向神经元分化,并能显著上调NSCs细胞Piezo1的表达。沉默Piezo1可通过下调IV型胶原及纤连蛋白表达逆转硬基底刚度对NSCs分化的影响。
内源性NSCs的激活及分化一直是脊髓损伤研究的重点[15]。然而现有研究多以生物化学手段为主,机械力学因素对NSCs分化的调控研究较少。研究表明,与正常的脊髓组织相比,受伤的脊髓基质刚度明显降低[4-5]。且随着脊髓受力增加,脊髓刚度降低[16]。本文用0.7 kPa基底刚度模拟受伤脊髓组织的强度,用40 kPa基底刚度模拟正常脊髓组织的强度。研究发现,40 kPa基底刚度使NSCs向神经元分化,而0.7 kPa基底刚度使NSCs向星形胶质细胞分化。这解释了为什么受伤后NSCs更趋向于向星形胶质细胞而非神经元分化的原因。最新的研究表明,软基质支持多能细胞的成脂分化和软骨分化,而硬基质调节成骨细胞增值[17]。基底刚度对不同组织细胞分化的影响有很大差异,如大脑在软基质刚度下表现为神经源性,而肌肉在较硬基质刚度下表现为肌源性[18]。另有研究指出,神经植入物的表面刚度适应神经组织的表面刚度可以最大程度地减少炎症反应并改善生物相容性[19]。综上所述,脊髓、大脑组织相关的组织工程材料需更多考虑软基质刚度。
本文研究发现,基底刚度调控NSCs分化可能与Piezo1有关。Piezo1是一种机械敏感性阳离子通道,可以通过调节钙离子的流入进而调节细胞密度和干细胞活化,在动物生物力学中起着重要的作用[20]。Piezo1对机械刺激有反应,并在星形胶质细胞反应性中起作用[21]。临床研究发现,骨质疏松的病人Piezo1表达下降与成骨功能减弱相一致,在成骨细胞中敲除Piezo1的小鼠出现严重的骨发育缺陷,成骨细胞功能显著降低[22]。Lee等[23]报道,小鼠关节软骨受到力学刺激时Piezo1表达量增加,引发钙离子转运的增强;在遭受过度应力时,可通过抑制Piezo1调控的力传导减轻软骨损伤和创伤性关节炎。本文研究发现,Piezo1参与基底刚度对NSCs分化的调节。首先,在脊髓损伤患者损伤组织Piezo1表达显著升高;基底刚度增加时Piezo1表达量增加。其次,沉默Piezo1逆转硬基底刚度对NSCs分化的影响,使之向胶质细胞分化。以上结果说明,硬基底刚度通过促进Piezo1表达促进其神经生成。这一研究结果与Pathak等[24]的研究结果一致,即抑制Piezo1抑制神经生成,促进胶质生成。另有研究指出,老年大鼠少突胶质细胞祖细胞可以在新生大鼠的大脑中被激活,且Piezo1蛋白可以告诉细胞周围环境是柔软的还是僵硬的。抑制Piezo1蛋白的表达可以促使老化的中枢神经系统中的少突胶质细胞恢复再生能力[25],提示Piezo1可能调控细胞外基质刚度。
细胞外基质影响干细胞分化的研究已有报道[26]。体内外实验发现,纤连蛋白是细胞分化成为特定细胞类型的关键[27]。缺乏ECM蛋白时,Piezo1受体对机械力刺激不敏感,因而难以被机械力激活;而IV型胶原增加Piezo1受体对机械力刺激的敏感性[28]。本文研究表明,敲低Piezo1后,纤连蛋白表达下降;重组纤连蛋白处理可逆转Piezo1对NSCs的影响,促进其向神经元分化。新生小鼠的脊髓损伤模型表明,新生小鼠的脊髓修复不伴随瘢痕形成,这与小胶质细胞的短暂激活及纤连蛋白的表达增高有关,从而促进大量神经轴突穿过损伤区域[29]。Piezo1介导的纤连蛋白改变是否会促进神经轴突穿过脊髓损伤区域值得进一步研究。
当然,2D维度环境无法概括3D维度环境所发现的所有信息[30]。因此,在解释生物学数据并将体外研究结果转换为体内实验时,维度是重要的考虑因素,也是后续工作需要研究的一个重点。
4 结 论
综上所述,本文发现沉默Piezo1可逆转硬基底刚度对NSCs分化的影响。机制研究表明,Piezo1通过上调纤连蛋白表达促进NSCs神经元分化。这一发现,为基于生物材料治疗脊髓损伤提供了新的视角。

