模拟酶解优化鸽血红蛋白抗氧化肽酶法制备
力俊琛,高昕悦,江晨怡,杨云顺,赛买提·艾则孜,刘雅娜,巴吐尔·阿不力克木
(新疆农业大学 食品科学与药学学院,新疆 乌鲁木齐 830052)
血液是肉类工业中最主要的副产品,屠宰过程中产生的畜禽血液量大且资源丰富[1]。血液中含有高质量的蛋白质,湿基得率约为15%~18%,包括人体必需的氨基酸、维生素、无机盐等[2-3]。目前部分的畜禽血液被遗弃造成环境污染,只有少部分被食用或药用,如加工成血肠[4]、血豆腐[5]、血糕[6]、血布丁[7]或制备成酒[8]等。禽类血液含有部分酶类及活性肽等功能性物质,可用作营养强化剂和增色剂等,有抗氧化、调节免疫等作用[1]。在中国,养殖肉鸽具有悠久的历史,中国的肉鸽产业销售量和饲养量都位居世界之首[9]。
近年的研究发现,许多从食物中的天然蛋白质中提取的生物活性肽比化学合成的多肽更易吸收、更温和且更安全[10-12]。因此,从动植物中提取的抗氧化肽得到了广泛的研究,如植物源的大豆蛋白[13]、玉米蛋白[14]、水稻蛋白[15],以及动物源的肌肉蛋白[16]、胶原蛋白[17]、鸡蛋蛋白[18]等已用于制备生物活性肽。随着自由基理论的提出,越来越多的研究表明活性氧的产生与机体的衰老有关,如超氧阴离子自由基(·O2-)、羟基自由基(·OH)等[12]。体内过量的自由基可以通过摄入高活性的抗氧化剂清除。抗氧化肽是近年来被广泛研究的一类天然生物活性肽,可通过提供还原力、清除自由基、螯合金属离子、氧化损伤保护以及调节机体抗氧化酶活性等多种方式发挥抗氧化作用[19]。以畜禽血液(如牛血[20]、鸭血[21-22])为原料制备抗氧化肽,原料易得,具有高附加值、高利用性等特点。酶解法是制备抗氧化肽的主要方法,较其他方法安全性高、条件温和、专一性强、易于控制[23]。生物信息学工具是近年来抗氧化肽研究的一种新兴方法,为抗氧化肽的预测、分析和筛选提供了一种经济有效的手段[19]。不同于耗时繁琐且高成本的传统方法,生物信息学的使用让研究过程简单、系统且可设计,具有十分广泛的应用前景[24]。
本研究采用计算机模拟酶解和多步虚拟筛选的方法获得酶解鸽血红蛋白的最佳酶。在单因素试验基础上,通过响应面法优化酶解条件制备鸽血红蛋白源抗氧化肽,在为消费者提供容易消化吸收的抗氧化肽的同时,也为合理利用肉鸽屠宰加工过程中的副产品提供新思路。
1 材料与方法
1.1 材料与试剂
肉鸽(检疫合格):市售,通过割喉放血的方式收集新鲜血液,通过纱布过滤后收集于含有5%肝素钠的容器中。
肝素钠注射液:江苏省万邦生化医药集团有限责任公司;蛋白酶K(20 mg/mL):北京庄盟国际生物基因科技有限公司;DPPH自由基清除能力测定试剂盒:南京建成生物工程研究所;十二烷基硫酸钠-聚丙烯酰胺 (sodium laurylsulfonate-polyacrylamide gel electrophoresis,SDS-PAGE)凝胶制备试剂盒、彩虹180广谱蛋白Marker(11 kDa~180 kDa)、牛血红蛋白、牛血清白蛋白(97.0%)、丝氨酸(99.0%)、酪氨酸(99.0%)、福林酚、邻苯二甲醛(98.0%,o-phthaldialdehyde,OPA)、二硫苏糖醇(99.0%):北京索莱宝科技有限公司。
1.2 仪器与设备
ME204E/02电子天平:梅特勒-托利多仪器(上海)有限公司;UV1800紫外可见分光光度计:上海菁华科技仪器有限公司;KQ-250DE型数控超声波清洗器、FD-1A-50冷冻干燥机:上海豫明仪器有限公司;SF-GL-16A高速冷冻离心机:上海菲恰尔分析仪器有限公司;HH-S4数显恒温水浴锅:金坛市医疗仪器厂;testo205 pH/温度测量仪:德图仪表(深圳)有限公司;DYCZ-24DN型电泳仪、DYY-7C型电泳仪电源:北京市六一仪器厂。
1.3 试验方法
1.3.1 鸽血红蛋粉的制备
参考王铮等[25]的方法并稍作修改。采集新鲜鸽血,通过纱布过滤后放入含有5%肝素钠的容器中,4 000 r/min,离心15 min,吸走上清液,保留下层红细胞,加入3倍的蒸馏水,超声波清洗仪(40℃,200 W),处理20 min。4℃,10 000 r/min,离心10 min,得到上清液为鸽血红蛋白溶液,沉淀为细胞膜及杂质,冷冻干燥(-50℃)得到鸽血红蛋白粉,放入超低温冰箱(-20℃)保存。
1.3.2 鸽血红蛋白的模拟酶解
采用数据库UniProt(https://www.uniprot.org/)获得鸽血血红蛋白一级结构,选取鸽血血红蛋白亚基α-A[(protein information resource,PIR):JC5514]、鸽血血红蛋白亚基α-D(PIR:JC5515)、鸽血血红蛋白亚基β(PIR:A61432)作为抗氧化肽的原料蛋白,其氨基酸数分别为 142、140、146。采用 PeptideCutter 在线软件(https://web.expasy.org/peptide_cutter/) 进行胰蛋白酶(EC 3.4.21.4)、 蛋白酶K(EC 3.4.21.62)、 胃蛋白酶(pH1.3,pH2,EC 3.4.23.1)、低特异性糜蛋白酶(C 端指FYWML,不在P之前,EC 3.4.21.1)以及高特异性糜蛋白酶(C端指FYW,不在P之前,EC 3.4.21.1)模拟酶解。
1.3.3 预测肽段的生物活性、水溶性、毒性和致敏性
整理模拟酶解鸽血红蛋白获得的所有肽段,通过在线软件 Peptide Ranker(http://distilldeep.ucd.ie/PeptideRanker/)预测生物活性,筛选生物活性评分大于0.5,即有潜在生物活性的多肽。将有潜在生物活性的肽段通过Innovagen在线软件(http://www.innovagen.com/proteomics-tools)预测水溶性。通过ToxinPred在线 软 件(https://webs.iiitd.edu.in/raghava/toxinpred/design.php)预测其毒性。采用AllerTOP在线软件(http://www.ddg-pharmfac.net/AllerTOP/)预测肽段的致敏性。通过多轮筛选选取模拟酶解结果较优的蛋白酶进行下一步研究。
1.3.4 鸽血红蛋白的含量测定
参照GB 5009.5—2016《食品安全国家标准食品中蛋白质的测定》[26],采用分光光度法,测定血红蛋白含量。
1.3.5 蛋白酶活力测定
参照GB/T 34800—2017《蛋白酶K酶活力及杂质检测方法》[27],采用分光光度法,测定蛋白酶活力。
1.3.6 蛋白水解度的测定
采用OPA法[28]测定蛋白水解度。
1.3.7 DPPH自由基清除率测定
参照DPPH自由基清除率测定试剂盒说明书测定DPPH自由基清除率。
1.3.8 单因素试验设计
参考刘丹等[29]的方法并稍作修改。称取一定量的鸽血红蛋白粉配成水溶液。水浴锅加热至设定温度,采用选定的蛋白酶进行酶解。到设定时间后,迅速放入沸水中保持10 min使酶失活,酶解液在4 000 r/min冷冻离心10 min,取上清液待测。
1.3.8.1 酶解时间
固定鸽血红蛋白浓度1 g/100 mL,pH8,酶添加量400 U/g,酶解温度为60℃,设置不同的酶解时间为1、2、3、4、5 h,酶解后测定鸽血红蛋白酶解物水解度和DPPH自由基清除率。
1.3.8.2 酶添加量
固定鸽血红蛋白浓度1 g/100 mL,pH8,酶解温度为60℃,酶解时间3 h,设置不同的酶添加量为240、320、400、480、560 U/g,酶解后测定鸽血红蛋白酶解物水解度和DPPH自由基清除率。
1.3.8.3 酶解温度
固定鸽血红蛋白浓度1 g/100 mL,pH8,酶添加量400 U/g,酶解时间3 h,设置不同酶解温度为40、50、60、70、80℃,酶解后测定鸽血红蛋白酶解物水解度和DPPH自由基清除率。
1.3.9 响应面优化试验
在单因素试验的基础上,设定响应值为DPPH自由基清除率,采用软件Design Expert 8.0.6,根据Box-Behnken中心组合试验设计原理,通过三因素三水平响应面试验,设计筛选出最优的鸽血抗氧化肽酶解工艺。

表1 响应面试验因素及水平编码Table 1 Factors and level code of independent variables used for response surface test
1.3.10 SDS-PAGE凝胶电泳
配制15%分离胶和5%浓缩胶。浓缩胶80 V,50 min;分离胶 120 V,2.5 h。 电泳结束后,染色 1 h,用脱色液脱色至条带清晰。
1.4 数据处理
每项试验均重复测定3次,采用SPSS 26.0进行数据分析,GraphPad 8.0.2进行制图,Design Expert 8.0.6进行响应面设计及结果分析。
2 结果分析
2.1 模拟酶解结果
通过模拟酶解可知,胰蛋白酶酶解得到多肽41种,共计61条。使用蛋白酶K酶解得到多肽88种,共计312条。胃蛋白酶在pH1.3时酶解得到多肽63种,共计140条;在pH>2时酶解得到多肽77种,共计170条。低特异性糜蛋白酶酶解得到多肽78种,共计147条。高特异性糜蛋白酶酶解得到多肽33种,共计49条。结果表明,蛋白酶K通过模拟酶解,得到的肽段数量和种类多于其他5种蛋白酶。
2.2 生物活性、水溶性、毒性和致敏性的预测结果
将模拟酶解获得的882条肽段在Peptide Ranker程序中进行生物活性预测,筛选生物活性评分大于0.5的肽段,即为有潜在生物活性的肽段。预测分数大于0.5的肽段共88条。在此基础上,对肽段进行水溶性、毒性以及致敏性的预测。
采用 Innovagen在线软件(http://www.innovagen.com/proteomics-tools)预测所收集得到活性肽的水溶性,胰蛋白酶酶解血红蛋白亚基α-A产生的肽段Leu-Arg(LR)、Tyr-Arg(YR)和酶解血红蛋白亚基 α-D产生的肽段YR水溶性好;蛋白酶K酶解血红蛋白亚基 α-A 产生的肽段 Arg-Leu(RL)、Gly-Asp-Leu(GDL)、Asp-Lys-Phe(DKF),酶解血红蛋白亚基 α-D产生的肽段 RL、DKF、Arg-His-Pro-Asp-Cys-Gly-Ala(RHPDCGA),酶解血红蛋白亚基β产生的肽段RL、Gln-Arg-Phe(QRF)、Asp-Cys-Gly-Ala(DCGA)、Gly-Lys-Asp-Phe(GKDF)水溶性好;胃蛋白酶在pH1.3和pH>2时酶解,结果均为血红蛋白亚基β产生的肽段RL、Ala-Arg-Leu(ARL)水溶性好;低特异性糜蛋白酶酶解血红蛋白亚基α-A产生的肽段DKF,酶解血红蛋白亚基α-D产生的肽段DKF,酶解血红蛋白亚基β产 生 的 肽 段 RL、ARL、Thr-Gln-Arg-Phe(TQRF)、GKDF水溶性好;高特异性糜蛋白酶酶解血红蛋白亚基α-A产生的肽段Ala-Lys-Ile-Gly-Gly-Gln-Ala-Gly-Asp-Leu-Gly-Gly-Glu-Ala-Leu-Glu-Arg-Leu-Phe(AKIGGQAGDLGGEALERLF),酶解血红蛋白亚基α-D产生的肽段DKF、Glu-Lys-Val-Ile-Arg-His-Pro-Asp-Cys-Gly-Ala-Glu-Ala-Leu-Glu-Arg-Leu-Phe(EKVIRHPDCGAEALERLF),酶解血红蛋白亚基β产生的肽段TQRF、GKDF水溶性好。将水溶性好的活性肽通过 ToxinPred在线软件(https://webs.iiitd.edu.in/raghava/toxinpred/design.php)预测其毒性,发现除肽段Arg-His-Pro-Asp-Cys-Gly-Ala(RHPDCGA)之外,其余肽段均无毒性。将无毒性的肽段通过AllerTOP在线软件(http://www.ddg-pharmfac.net/AllerTOP/)预测其致敏性,结果如表2所示,共有11条肽段水溶性好、无毒且非过敏原。

表2 虚拟筛选鸽血红蛋白源多肽Table 2 Screening of peptides derived from pigeon hemoglobin in silico
通过模拟酶解试验发现,使用蛋白酶K对鸽血血红蛋白进行酶解,酶解位点最多,获得的肽段数目较其他5种蛋白酶多,且得到的生物活性好、水溶性好、毒性低、致敏性低的肽段也较多。通过模拟酶解和虚拟筛选的方法,可优化传统的酶解方法,可以使筛选蛋白酶的过程更具有目的性。生物信息学工具的使用可以大大缩短试验周期,同时也节省了试验经费,更经济、更直观且目的性更强。综上所述,选用蛋白酶K进行下一步研究。
2.3 单因素试验结果
2.3.1 酶解时间
酶解时间对鸽血红蛋白酶解物水解度和DPPH自由基清除率的影响如图1所示。
由图1可知,酶解时间为1 h~3 h时,鸽血红蛋白酶解物的DPPH自由基清除率和水解度均呈现出增长趋势,在3 h后稍有降低,3 h时达到顶点。这与徐杨林等[30]酶解制备苦杏仁醇溶蛋白抗氧化肽时的研究结果一致。可能原因为随着酶解时间的增加,蛋白质酶解生成的多肽含量增加,DPPH自由基清除率增加,继续水解使蛋白质的酶解程度增大,得到的多肽被酶解,成为游离氨基酸,导致多肽含量下降,抗氧化肽的含量也随之下降。结合酶解的效率和成本分析,选择酶解时间为3 h进行后续试验。

图1 酶解时间对鸽血红蛋白酶解物水解度和DPPH自由基清除率的影响Fig.1 Effect of enzymolysis time on the hydrolysis degree and DPPH free radical scavenging rate
2.3.2 酶添加量
酶添加量对鸽血红蛋白酶解物水解度和DPPH自由基清除率的影响如图2所示。

图2 酶添加量对鸽血红蛋白酶解物水解度和DPPH自由基清除率的影响Fig.2 Effect of enzyme addition on the hydrolysis degree and DPPH free radical scavenging rate
由图2可知,酶添加量为240 U/g~400 U/g时,水解度与酶添加量成正比,超过400 U/g增长速度减缓,变化幅度较低。酶添加量为240 U/g~400 U/g时,DPPH自由基清除率与酶添加量成正比,在400 U/g时达到顶点,400 U/g后成反比。可能的原因是随着酶添加量的增多,蛋白质酶解程度增加,生成的多肽的数量也增加,水解度和DPPH自由基清除率呈现出增长的趋势。DPPH自由基清除率达到顶点时,酶添加量相当于底物而言近似饱和,。酶添加量继续增加,水解程度加大,一些具有抗氧化活性的多肽酶解,导致DPPH自由基清除率受到影响。这与孙敏[31]酶解乳清蛋白制备抗氧化肽的结论相似。结合试验结果分析,选择酶添加量为400 U/g进行后续试验。
2.3.3 酶解温度
酶解温度对鸽血红蛋白酶解物水解度和DPPH自由基清除率的影响如图3所示。

图3 酶解温度对鸽血红蛋白酶解物水解度和DPPH自由基清除率的影响Fig.3 Effect of enzymolysis temperature on the hydrolysis degree and DPPH free radical scavenging rate
由图3可知,随着酶解温度的增加,酶解物的水解度和DPPH自由基清除率的趋势均为先升高后下降,分别在70℃和60℃时达到顶点。推测可能原因为高温导致蛋白酶的次级键断裂,改变酶的结构,使酶的活性降低,影响反应体系。结合上述情况综合分析,选取酶解温度为65℃进行下一步试验。
2.4 响应面试验结果
由软件Design-Expert 8.0.6进行响应面分析,结果如表3所示,回归方程方差分析如表4所示。

表3 响应面试验结果Table 3 Results for response surface test

表4 回归方程方差分析Table 4 Analysis of variance of regression equation
如表4所示,DPPH自由基清除率二次多项回归模型方程为Y=32.77-0.18A+0.19B+1.3C-1.72AB+1.58AC+1.10BC-4.42A2-1.9B2-2.36C2。对此模型进行方差分析,模型 p<0.01,表示为极显著;失拟项 p=0.074 9>0.05,表示为不显著,该模型建模成功。模型的回归系数为R2=0.948 6,表明该模型拟合程度较好,具有统计学意义,可用于模拟鸽血红蛋白制备抗氧化肽的最优工艺。对DPPH自由基清除率影响顺序为C>B>A,即酶添加量>酶解时间>酶解温度。模型中一次项C,交互项AB、AC,二次项 A2、B2、C2对试验结果影响显著(p<0.05或 p<0.01)。
2.5 响应面交互作用分析
响应面交互作用结果如图4~图6所示。
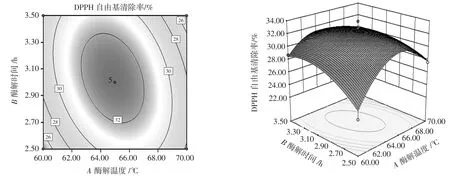
图4 酶解时间与酶解温度的交互作用Fig.4 Interaction between enzymolysis time and enzymolysis temperature

图5 酶添加量与酶解温度的交互作用Fig.5 Interaction between enzyme addition and enzymolysis temperature

图6 酶添加量与酶解时间的交互作用Fig.6 Interaction between enzyme addition and enzymolysis time
各个因素交互作用时响应值发生变化,形成立体的空间曲面,响应面可较为直观的反应两因素间交互作用是否明显。三维图中的曲面倾斜度越大,表现在二维图中的颜色越深,图形越近似椭圆,等高线之间的距离也越近,说明两因素间的交互作用越明显,反之则交互作用不显著[33]。由图4~图6可知,酶添加量与酶解时间(BC)的交互作用与其他2组相比更弱。
2.6 响应面验证试验
通过分析响应面试验结果,得到鸽血红蛋白制备抗氧化肽的最优工艺条件为鸽血红蛋白浓度1 g/100 mL、pH8、酶解时间3.07 h、酶解温度65.04℃、酶添加量415.54 U/g,DPPH自由基清除率的预测值为32.99%。结合实际操作,将此条件修订为鸽血红蛋白浓度1 g/100 mL、酶解时间3 h、酶解温度65℃、pH8、酶添加量415.54 U/g,在该条件下进行响应面验证试验,实际测得DPPH自由基清除率为(33.21±0.68)%,接近于预测值,表明该模型可较好地反映各因素与响应值之间的关系。
2.7 SDS-PAGE凝胶电泳试验结果
SDS-PAGE凝胶电泳试验结果如图7所示。

图7 鸽血红蛋白酶解前后SDS-PAGE图谱Fig.7 SDS-PAGE map of pigeon hemoglobin before and after enzymolysis
将最优工艺酶解后的鸽血红蛋白酶解液与酶解前的鸽血红蛋白溶液做对比。由图7可以清晰的看出鸽血红蛋白酶解前后的条带量和分子量分布,泳道2的条带数目明显少于泳道3,目的条带消失。说明在最优工艺条件下,蛋白酶K能够很好的对鸽血红蛋白进行酶解,使最优工艺条件得到了进一步的验证。
3 结论
本研究通过计算机模拟酶解结合传统酶解方法制备鸽血红蛋白抗氧化肽。通过模拟酶解和虚拟筛选,结果显示选用蛋白酶K可以得到更多种类和更多数量的小分子肽,故而选取蛋白酶K为最佳蛋白酶。试验结果表明,鸽血红蛋白酶解物具有一定的抗氧化活性,在单因素试验的基础上进行响应面优化试验,探究酶解时间、酶添加量和酶解温度对鸽血红蛋白酶解物DPPH自由基清除率的影响,最终得到的最优工艺条件为鸽血红蛋白浓度1 g/100 mL、pH8、酶解时间3 h、酶添加量415.54 U/g、酶解温度65℃。在此条件下,通过验证试验得出响应值DPPH自由基清除率(33.21±0.68)%,与预测值相差较小,证明此条件为最优工艺。采用SDS-PAGE凝胶电泳试验,对比最优工艺条件下鸽血红蛋白酶解前后的情况,发现目的条带消失,进一步验证该方法为酶解鸽血红蛋白源抗氧化肽的最优工艺,本研究结果可以为合理利用鸽屠宰加工过程中的副产品提供一定的参考。

