新型国产脉冲电场消融系统治疗阵发性心房颤动安全性和可行性的初期研究
乔宇,付明鹏,刘可,杨克,陈旭华,赵震,郭雨龙,郭金锐,牛国栋,华伟,郭涛
近年来,经导管消融已经成为心房颤动(房颤)的重要治疗手段,肺静脉隔离在房颤的经导管消融中处于基石地位[1-3]。目前,应用于肺静脉隔离的器械包括射频导管和冷冻球囊,前者是应用阻抗式加热和传导式加热使心房肌组织产生凝固性坏死,而后者是应用深低温冷冻的方式使心房肌组织产生凋亡。二者在临床应用中会产生肺静脉狭窄、心包填塞、膈神经麻痹、食道损伤等围术期并发症[1,4]。而脉冲电场的原理是通过对心房肌组织应用超高频电场,使其细胞膜发生不可逆性穿孔,最终导致细胞死亡[5-6]。动物实验和临床研究已经证实基于脉冲电场的经导管消融(PFA)应用于房颤经导管消融中的安全性和有效性[7-10],而本研究旨在评估一种新型国产PFA 系统(REMD-G5,上海睿刀医疗)在阵发性房颤经导管消融中的安全性和可行性。
1 资料与方法
1.1 研究对象
本研究是一项多中心、前瞻性、单臂、观察性研究中牵头单位的初期结果,入选2022 年6 月至2022 年8 月于云南省阜外心血管病医院心律失常中心接受首次PFA 治疗的阵发性房颤患者10 例。入选标准为:(1)年龄在18 岁至75 岁之间;(2)诊断为阵发性房颤入组前12 个月内至少有1 次心电图或心律监测记录到房颤发作;(3)至少服用1 种Ⅰ类或Ⅲ类抗心律失常药物治疗效果不佳或不能耐受或拒绝药物治疗;(4)能够理解试验目的,自愿参加试验并签署知情同意书。排除标准为:(1)各种继发性房颤包括但不限于甲状腺功能亢进症、急性酒精中毒、电解质失衡、心脏外科术后房颤等;(2)持续性房颤或永久性房颤;(3)既往曾接受过经导管消融或左心房外科手术的房颤患者;(4)既往接受过心脏瓣膜修补或者置换手术,或接受过经导管或者外科进行房间隔缺损、卵圆孔未闭的修补或封堵术,左心耳封堵或闭合手术;(5)严重器质性心脏病,包括中-重度二尖瓣关闭不全或狭窄、肥厚型心肌病(心肌厚度>15 mm)、风湿性心脏病等;(6)有抗凝治疗禁忌证,既往有出血或凝血异常病史;(7)签署知情同意书前6 个月内接受过颈动脉支架置入术或颈动脉内膜剥脱术;(8)严重的肺部疾病、肺动脉高压或任何可以引起呼吸困难的肺部疾病;(9)签署知情同意书前6个月内出现的任何形式的心肌梗死、冠状动脉旁路移植术或经皮冠状动脉介入治疗;(10)签署知情同意书前6 个月内有血栓栓塞事件,如脑卒中或短暂性脑缺血发作病史;(11)术前有严重的全身性感染未得到纠正改善;(12)肾功能明显异常(血肌酐高于正常值上限的2 倍);(13)超声心动图检查提示左心房前后径≥50 mm;(14)影像学检查证实左心房/左心耳存在血栓;(15)入院时NYHA 心功能分级≥Ⅲ级或左心室射血分数<40%;(16)有心脏起搏器、心律转复除颤器、心脏再同步化治疗或任何类型的植入性设备植入史;(17)频发性室性早搏;(18)本次拟行房颤消融及左心耳封堵一站式手术;(19)已知受试者需要进行肺静脉外或三尖瓣峡部消融(如房室折返性心动过速、房室结折返性心动过速、房性心动过速、心房扑动、室性心动过速、预激综合征);(20)术前联合3种抗高血压药物治疗依然不能控制的高血压;(21)术前经心电图或 24 小时动态心电图证实存在典型房扑或合并其他室上性心动过速(持续时间>30 s);(22)手术前或术中发现患者存在血栓、肿瘤或解剖畸形导致导管不能进入或者无法进行治疗;(23)合并其他严重疾病,预期寿命<12 个月;(24)孕期、哺乳期及准备妊娠或在试验期间无法使用避孕措施的女性;(25)入组前3 个月内曾参加或正在参加其他药物或器械等干预类临床研究;(26)其他经研究者评估不适合纳入本研究的情况,如精神障碍或心理障碍;(27)对比剂过敏。所有患者均签署知情同意书,该研究经过云南省阜外心血管病医院学术委员会和伦理委员会批准(项目编号:2022-014-01)。
1.2 术前准备
患者术前14 d 内需完善24 小时动态心电图以除外其他需经导管射频消融干预的心律失常,同时完善经胸超声心动图评估左心房大小及心功能情况。术前48 h 内完善左心房增强CT 及经食道超声心动图除外左心房/左心耳血栓形成。术前常规进行抗凝治疗,若采用非维生素K 拮抗剂口服抗凝药物或低分子肝素抗凝,则术前12 h 停用一次;若采用华法林抗凝治疗,则无需停用,维持术晨国际标准化比值(INR)2.0~2.5。术前需禁食水8 h。
1.3 手术过程
手术在深度镇静镇痛结合局部麻醉下进行,术前静脉给予阿托品、地塞米松,经左股静脉放置冠状静脉窦、右心室心尖标测电极,经右股静脉穿刺房间隔,立即给予普通肝素100 IU/kg,并维持激活的凝血时间(ACT)在250~350 s,随后进行肺静脉造影。更换可调弯鞘管(FlexCath,美敦力公司,美国)后,送入PFA 导管(PAC-31-14A 或PAC-35-14A,上海睿刀医疗)及8 极环形标测电极(Achieve,美敦力,美国),将PFA 导管连接至PFA 消融仪(REMD-G5,上海睿刀医疗),在三维标测系统(Ensite-NavX,雅培公司,美国)指导下建立左心房、肺静脉电解剖模型,电压定义如下:瘢痕区<0.1 mV、低电压区0.1~0.5 mV、正常电压区≥0.5 mV。在X 线指导下分别将PFA 导管放置于左上肺静脉(LSPV)、左下肺静脉(LIPV)、右上肺静脉(RSPV)及右下肺静脉(RIPV),对每根肺静脉口部及前庭进行消融,消融肺静脉口部时导管呈纺锤形,消融肺静脉前庭时导管呈花形(图1),每个部位消融2 次,每次消融时间为7 s,消融过程中消融仪的电压设置为800~1 200 V(双相波),每支肺静脉消融完成后记录肺静脉电位变化情况,若未达到肺静脉隔离,则再次对该肺静脉重复上述消融操作,具体的重复次数及部位由术者决定。其中前3 例患者,还应用心腔内超声导管(Cartosound,强生公司,美国)监测消融过程中是否有左心房微气泡产生(表现为一过性散在或密集的点状高回声信号)。全部消融完成后再次对左心房和肺静脉进行电解剖标测,对比各支肺静脉及前庭电压变化情况。延长观察时间,若肺静脉电位无恢复,则结束手术。
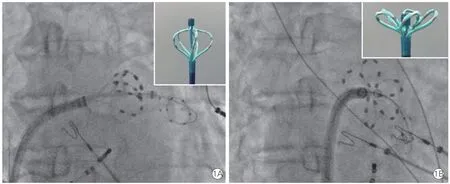
图1 脉冲电场消融不同部位影像
1.4 术后处理
患者术后48 h 内完成头颅MRI[平扫+弥散加权成像(DWI)+液体衰减反转恢复序列(FLAIR)]检查,术后常规进行抗心律失常和抗凝治疗,具体用药由临床医师决定。围术期并发症定义为院内出现的并发症,包括死亡、心包填塞、出血、血栓栓塞事件、无症状性脑梗死、膈神经损伤、食道损伤及穿刺相关并发症等。
1.5 统计学方法
所有统计分析均采用SPSS 22.0 统计软件进行。符合正态分布计量资料用均数±标准差表示,如果不符合正态分布,则采用中位数(P25,P75)表示,计数资料以例或百分比表示。
2 结果
2.1 10 例阵发性房颤患者的基线资料
共纳入阵发性房颤患者10 例,其中7 例为男性,年龄为(53.3±9.6)岁,体重指数为(25.0±3.2)kg/m2,CHA2DS2-VASc 评分为0(0,2)分,HAS-BLED 评分为0(0,0.5)分,左心房前后径为(34.2±4.6)mm,左心室舒张末期内径为(47.3±5.1)mm,左心室射血分数为(67.7±2.1)%。合并高血压、糖尿病及冠心病的患者分别有3 例、1 例和1 例。无患者合并血栓栓塞病史。
2.2 10 例阵发性房颤患者的术中情况(表1)
表1 10 例阵发性心房颤动患者的术中情况()
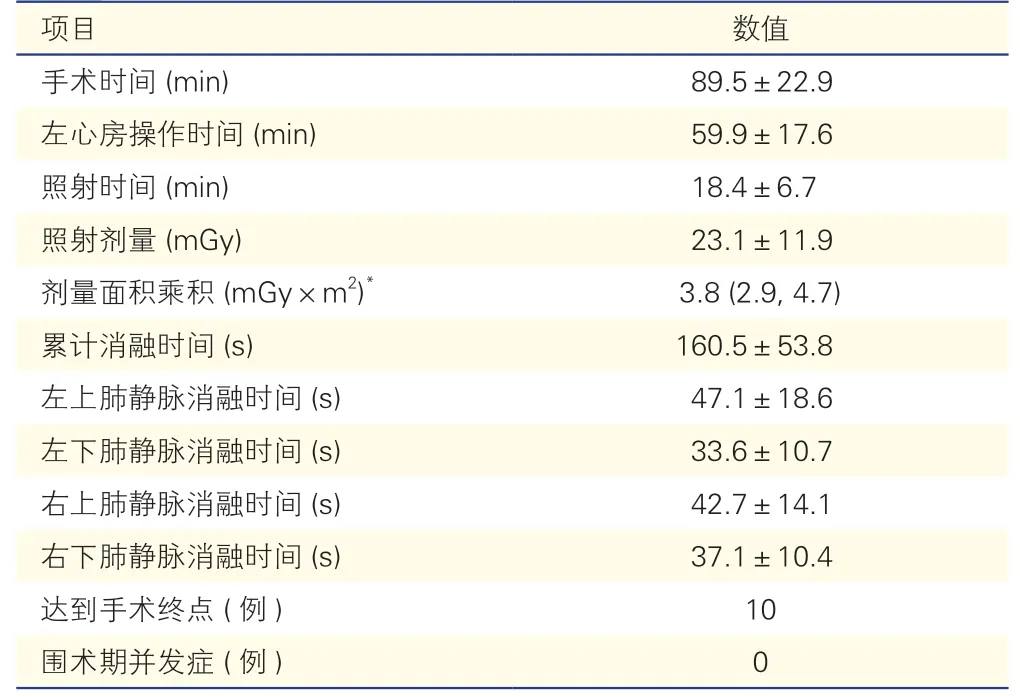
表1 10 例阵发性心房颤动患者的术中情况()
注:*:以中位数(P25,P75)表示
手术时间为(89.5±22.9)min,左心房操作时间为(59.9±17.6)min,照射时间为(18.4±6.7)min,照射剂量为(23.1±11.9)mGy,剂量面积乘积为3.8(2.9,4.7)mGy×m2。共对40 支肺静脉进行了PFA 操作,累计消融时间为(160.5±53.8)s,其中LSPV 消融时间为(47.1±18.6)s、LIPV 消融时间为(33.6±10.7)s、RSPV 消融时间为(42.7±14.1)s、RIPV 消融时间为(37.1±10.4)s。全部(100%)肺静脉均实现肺静脉隔离的手术终点。
图2 为1 例患者术前(2A)及术后(2B)的左心房电解剖标测图,术前四支肺静脉内均可见高频、高幅电位(即肺静脉电位),而术后四支肺静脉电位均消失。
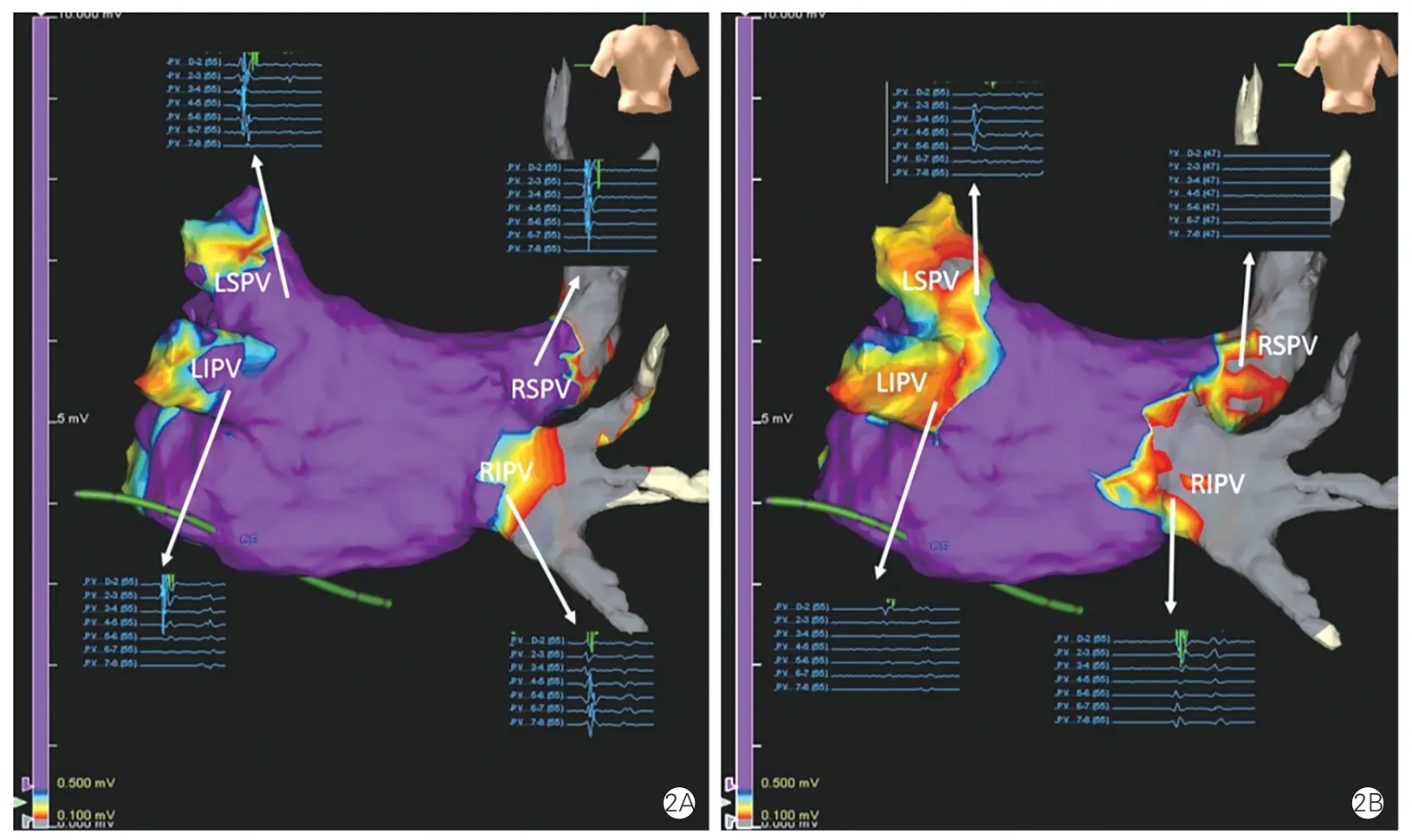
图2 脉冲电场消融前后左心房电解剖标测结果
2.3 围术期安全性
术中有2 例患者在消融左侧肺静脉时出现迷走反射,表现为2:1 房室阻滞,需心室起搏支持。围术期无死亡、心包填塞、出血、血栓栓塞事件、无症状性脑梗死、膈神经损伤、食道损伤及穿刺相关并发症发生。在前3 例患者消融的全过程中,应用心腔内超声导管监测未发现左心房微气泡征象。
3 讨论
3.1 PFA 的安全性
直流电是早期应用于心脏经导管消融的能源,但由于其安全性较差,所以被射频、冷冻等能源替代。而PFA 是在直流电消融基础上进行改良,其安全性大大提高,目前已经成为应用于房颤经导管消融的新型能源。其作用机制为通过对心房肌组织施加短时程超高频直流电场,使细胞膜磷脂双分子层结构发生不可逆性电穿孔,增加细胞膜通透性,从而导致心房肌组织坏死,达到治疗目的[5-6]。该能源应用于经导管消融的主要优势如下:首先,脉冲电场对组织损伤具有组织特异性,不同组织出现电穿孔、坏死所需的最低电场强度具有明显差异,而心肌细胞的电穿孔阈值要显著低于其他组织[11],因而PFA 输出的电场强度不会对周围组织造成损伤;其次,PFA 造成的心肌损伤为非温度依赖性,因而不会通过热量传导而影响毗邻结构。因此,与射频或冷冻能源相比,脉冲电场理论上更为安全。
在IMPULSE、PEFCAT 和PEFCAT Ⅱ研究中,Reddy 等[12]通过单相波或双相波对共计121 例阵发性房颤患者进行PFA 治疗,结果发现仅有1 例患者出现术中心包填塞。而Cochet 等[13]通过对PFA 术后患者进行胸部MRI 检查,发现没有患者出现食道损伤,相反,应用射频或冷冻能源进行经导管消融的患者有相当大比例出现术后食道损伤(43%),可见PFA 在房颤经导管消融中具有独特的安全性优势。MANIFEST-PF 研究[14]是至今为止最大的一项关于PFA 的回顾性研究,共纳入1 758 例患者,结果显示围术期主要并发症的发生率为1.6%(包括心包填塞、脑卒中、死亡),而次要并发症(包括血管并发症和膈神经麻痹)的发生率为3.9%。在本研究中,全部10 例患者均未出现围术期并发症,术后头颅MRI 未发现无症状脑梗死或脑损伤灶,且前3 例患者应用心腔内超声亦未见微气泡征象,这与此前报道的两项我国自主知识产权PFA 导管的上市前研究(样本量分别为5 例和17 例)[15-16]结果相一致,提示REMD-G5 系统应用于房颤经导管消融具有较好的安全性,当然还需要更大样本量的临床研究加以证实。
3.2 PFA 的有效性
关于PFA 的即刻有效性已经得到大量研究的证实[10-12,17],几乎全部研究结果均显示:平均消融时间<3 min/例即可达到100%的肺静脉隔离成功率,本研究结果与此一致,累计消融时间为(160.5±53.8)s,全部40 支肺静脉均实现肺静脉隔离。因而,REMD-G5 系统具有和其他PFA 系统同样高的即刻有效性。值得一提的是,在初期应用800~1 000 V 消融输出时,可观察到肺静脉电位恢复并需要额外消融,而在后期消融电压增加到1 000~1 200 V 时未见肺静脉电位恢复表现,且肌颤及患者耐受性无明显改变,提示后者可能为更适宜的输出能量,但由于样本量较小无法进行统计学分析。
Reddy 等[12]在IMPULSE、PEFCAT 和PEFCAT II 研究中对110 例接受PFA 的患者在术后2~3 个月进行了左心房二次标测,结果显示84.1%的患者和96.0%的肺静脉实现了持续性肺静脉隔离,而术后1 年的整体成功率为78.5%。由于PFA 在国内的应用时间较短,因而尚无关于国产PFA 器械长期有效性的报道,目前本研究的入选患者尚在随访阶段,因而有待长期随访的结果来评估该系统的长期有效性和安全性。
此外,目前PFA 导管的术中操作仍存在一定缺陷。首先,PFA 导管的电极只有消融而无实时记录电位的功能,只能通过放置另外的标测电极(如Lasso、Achieve 电极等)来记录肺静脉电位;其次,PFA 导管的操作只能通过X 线透视下完成,而无法在三维系统中显示。因此,未来的PFA 导管在实时记录电位和三维可视方面仍有较大改进空间。
3.3 REMD-G5 系统特性
相较于其他PFA 系统,REMD-G5 系统具有以下特性:(1)PFA 导管直径为10.5 F,较其他消融导管更细,因而提高操作安全性,同时改善了导管在可调弯鞘内的操作空间;(2)该导管具有双向控弯,提高了左心房内的操作性能,更容易到达不同肺静脉内;(3)PFA 导管采用偏转网篮的设计,使其在管身扭曲下花形打开和稳定性更佳;(4)PFA 导管花形呈微上翘形态,更容易观察导管贴靠形变;上述改进可进一步提高PFA 导管的操控性能。
本研究存在一定局限性。首先,本研究是一项小样本量的初期临床观察,该消融系统的有效性和安全性有待全部中心入组结束后进一步加以验证;其次,本研究为急性期观察,仅分析了患者的院内数据,而无后续随访数据,因此仍需长期随访来评估其长期有效性和安全性。
综上,新型PFA 系统(REMD-G5)的初步临床应用结果显示其应用于阵发性房颤患者的导管消融的即刻成功率高、且无围术期并发症发生,因而具有较高的安全性和可行性,但仍需大样本及长期随访的结果验证。
利益冲突:所有作者均声明不存在利益冲突

