复方莪术油乳膏对IMQ诱导小鼠银屑病疗效观察及其对ICAM-1和NO的影响*
钱 英,代 义,喻慧琳,格汝娜姆,赵婷婷
(1.遵义医科大学附属医院,贵州 遵义 563000;2.重庆医科大学,重庆 400016;3.重庆医科大学实验教学管理中心,重庆 400016)
银屑病是一种慢性炎症性疾病,临床表现为红色斑块、鳞屑和瘙痒。在银屑病皮损部位角质形成细胞与树突状细胞、免疫细胞等串扰,形成炎症的恶性循环。而白细胞介素-23(IL-23)/IL-17炎症轴在驱动银屑病的发生、发展中发挥着重要作用。内、外源性刺激(如遗传因素和皮肤屏障破坏等)均会诱导浆细胞样树突状细胞等释放IL-23,激活辅助性T淋巴细胞17分泌IL-17和肿瘤坏死因子-α(TNF-α)等促炎性细胞因子,进而促进角质细胞过度增殖并分泌其他炎症介质[1]。其中细胞间黏附因子-1(ICAM-1)参与了T淋巴细胞的激活、迁移、黏附和再激活,介导斑块的形成和维持[2]。ICAM-1以可溶性ICAM-1(sICAM-1)在血清中被检测到。sICAM-1不仅在一定程度上反映表皮中ICAM-1表达水平,且与病情严重程度及活动度密切相关[3-4]。此外,银屑病中的内源性一氧化氮(NO)在角质形成细胞的增殖、分化及炎症调节中发挥着复杂的双相作用。低水平NO 诱导角质形成细胞增殖,加重炎症;高水平NO诱导角质形成细胞分化,有助于表皮屏障恢复[5]。因此,促进NO释放可能是减轻银屑病炎症及修复皮肤屏障的新方向。
网络药理学分析表明,莪术油可作用于合成NO的诱导型一氧化氮合酶(iNOs)和内皮型一氧化氮合酶(eNOs),且含有莪术醇、β-榄香烯和吉马酮等多种成分,具有抗炎、抗肿瘤、抗氧化和抗菌等生物活性[6-7]。其中β-榄香烯及相关衍生物可能通过激活磷酸肌醇-3激酶/蛋白激酶B/eNOs信号通路诱导NO释放,改善内皮功能障碍[8-9]。以β-榄香烯为母体化合物引入呋喃烷 NO 供体基团开发出的β-榄香烯杂合体,显示出了显著的抗肿瘤活性[10]。莪术油可能是作用于银屑病的潜在NO供体,从而达到治疗银屑病的作用。
据文献报道,莪术油外用治疗银屑病具有较好的疗效,且不良反应较小,适合银屑病稳定期患者长期维持用药,以预防皮损复发,但其降低银屑病炎症并抑制表皮增厚的作用机制尚不明确[11-12]。本研究通过建立咪喹莫特乳膏(IMQ)诱导的小鼠银屑病皮损模型,初步探讨了莪术油对银屑病稳定期小鼠血清ICAM-1、NO水平的调节作用,现报道如下。
1 材料与方法
1.1材料与仪器 BALB/c小鼠44只(雄性、体重18~25 g),由重庆医科大学实验动物中心提供[实验动物使用许可证号:SYXK(渝)2018-0003],严格按实验动物3R原则给予实验动物人道主义关怀。莪术油购于江西省吉水县健民天然香料油厂,IMQ购于四川明欣药业有限责任公司,凡士林购于联合利华(中国)有限公司,乳膏基质为遵义医科大学附属医院自制,ICAM-1、NO酶联免疫吸附(ELISA)试剂盒均购于江苏酶免实业有限公司,光学显微镜购自宁波舜宇仪器有限公司,KD-BM组织包埋机购自浙江省金华市科迪仪器设备有限公司,Leica RM2255(徕卡)组织切片机购自徕卡显微系统(上海)贸易有限公司,MULTISKAN GO酶标仪购自赛默飞世尔科技(中国)有限公司,均由重庆医科大学创新实验室提供。
1.2方法
1.2.1动物造模、分组和给药 适应性饲养小鼠1周后刮除背部绒毛,形成大小2 cm×3 cm暴露区域。将44只BALB/c小鼠随机打上1~44号耳标,采用计算机Excel表格函数生成44个随机不重复整数。按照空白对照组、IMQ模型组、乳膏基质对照组、5%莪术油组和10%莪术油组的顺序依次完成随机分组,IMQ模型组12只,其余每组8只。随机适应性饲养3 d后除空白对照组涂抹凡士林外,其余4组连续14 d每天于小鼠背部裸露皮肤涂抹5% IMQ 62.5 mg,于第7天开始分别给予凡士林、乳膏基质、5%莪术油、10%莪术油进行治疗,用量均为12.5 mg/cm2。
1.2.2皮损严重程度评估及取材 根据银屑病面积和严重程度指数(PASI),于第2、4、6、8、12、14天进行评分,皮损红斑、鳞屑、浸润增厚程度均为0~4分,三者评分相加即为总评分。具体评分标准:无皮损计0分,轻度皮损计1分,中度皮损计2分,重度皮损计3分,极重度皮损计4分。给药第8、11天随机抽取2只IMQ模型组小鼠处死,余下实验动物于第15天全部处死。眼球取血,2 000 r/min离心10 min,吸取上清液备用。同时,迅速剥离小鼠背部裸露皮肤组织,游标卡尺测量皮肤厚度,每只小鼠取3个表皮位置进行测量,取平均值,然后置于4%多聚甲醛中固定备用。剥离小鼠脾脏组织,观察脾脏长度并称重,计算脾指数(脾脏重量/体重)。评估莪术油抗银屑病活性实验设计见图1。
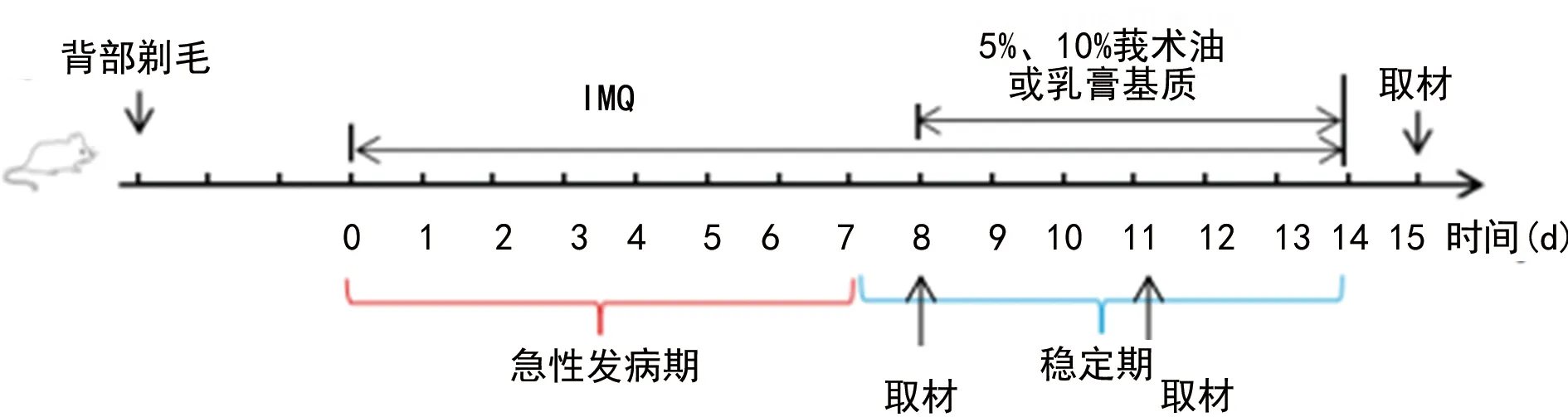
图1 评估莪术油抗银屑病活性实验设计
1.2.3苏木精-伊红(HE)染色及组织病理观察 皮肤组织用4%多聚甲醛固定,经脱水后包埋在石蜡中。使用HE染色对5 μm石蜡切片进行染色。在光学显微镜下评估银屑病的组织病理学特征,包括过度角化、颗粒层变薄或消失、棘层肥厚、表皮波浪状起伏并向真皮下延伸,以及皮脂腺增多、炎性细胞浸润等。
1.2.4ELISA检测血清ICAM-1、NO表达 使用ELISA法对各组小鼠血清ICAM-1、NO水平进行定量分析,具体操作步骤严格按试剂盒说明书进行。
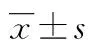
2 结 果
2.1各组小鼠不同时间点PASI评分比较 各组小鼠第0~8天均逐渐出现红斑、浸润、鳞屑等。IMQ模型组小鼠第8~14天PASI评分出现下降,但仍明显高于空白对照组,差异均有统计学意义(P<0.05)。乳膏基质对照组、5%莪术油组、10%莪术油组小鼠PASI评分均高于IMQ模型组,差异均有统计学意义(P<0.05)。见图2。

注:A.不同时间点PASI总分;B.治疗后PASI总分;aP<0.05。
2.2各组小鼠不同时间点表皮厚度比较 IMQ模型组小鼠不同时间点表皮厚度均明显高于空白对照组,差异均有统计学意义(P<0.05)。见图3。IMQ模型组、乳膏基质对照组、5%莪术油组、10%莪术油组小鼠表皮厚度均明显高于空白对照组,差异均有统计学意义(P<0.05);与IMQ模型组比较,5%莪术油组小鼠表皮厚度明显降低,差异均有统计学意义(P<0.05);与乳膏基质对照组比较,5%莪术油组、10%莪术油组小鼠表皮厚度均明显降低,差异均有统计学意义(P<0.05)。见表1、图4。

注:aP<0.05。
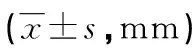
表1 各组小鼠表皮厚度比较
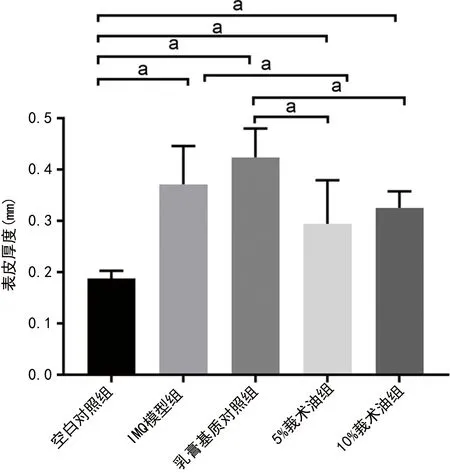
注:aP<0.05。
2.3各组小鼠皮肤组织病理学特征比较 与空白对照组比较,IMQ模型组、乳膏基质对照组、5%莪术油组、10%莪术油组小鼠均出现不同程度表皮增厚、角化过度、角化不全、颗粒层变薄、棘层肥厚、表皮突呈杵状向真皮下延伸等。此外,皮脂腺增多,出现Munro微脓肿和大量炎性细胞浸润。见图5。

图5 各组小鼠皮肤组织病理学特征比较(HE染色,200×)
2.4各组小鼠脾肿大情况比较 与空白对照组比较,IMQ模型组小鼠脾脏大小和重量均明显增加,且脾指数也增加,差异均有统计学意义(P<0.05);与IMQ模型组、乳膏基质对照组比较,5%莪术油组、10%莪术油组小鼠脾脏大小和重量均明显降低,且脾指数也降低,差异均有统计学意义(P<0.05)。见表2,图6、7。
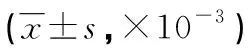
表2 各组小鼠脾肿大情况比较
图6 各组小鼠脾脏大小比较
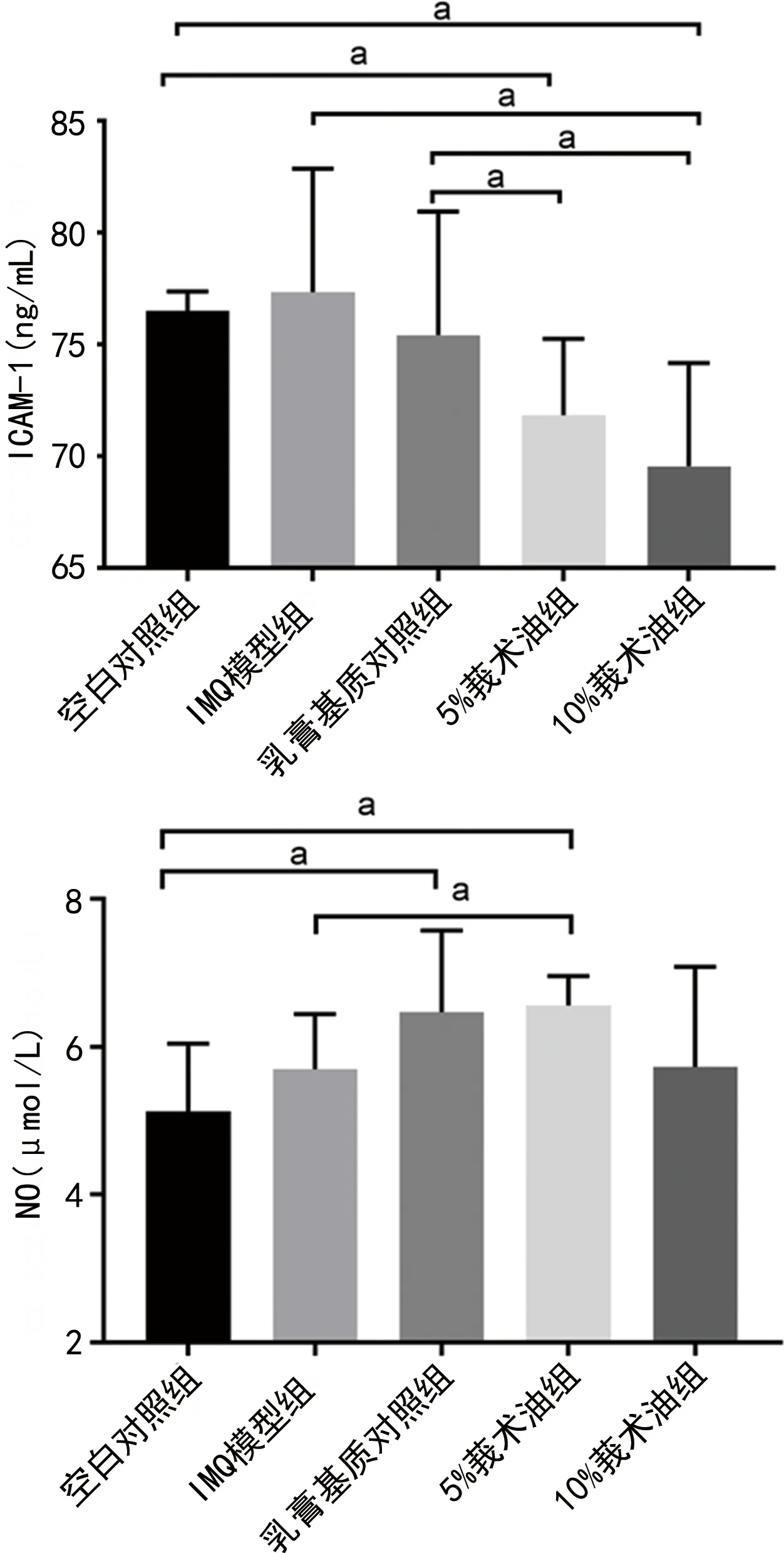
2.5各组小鼠不同时间点血清ICAM-1、NO水平比较 IMQ模型组小鼠第0、8、11、15天血清ICAM-1、NO水平见表3、图8。IMQ模型组小鼠血清ICAM-1、NO水平与空白对照组比较,差异均无统计学意义(P>0.05);与空白对照组、乳膏基质对照组比较,5%莪术油组、10%莪术油组小鼠血清ICAM-1水平均明显降低,差异有统计学意义(P<0.05);与IMQ模型组比较,10%莪术油组小鼠血清ICAM-1水平明显降低,差异有统计学意义(P<0.05);与空白对照组比较,乳膏基质对照组和5%莪术油组小鼠血清NO水平均明显升高,差异均有统计学意义(P<0.05);与IMQ模型组比较,5%莪术油组小鼠血清NO水平明显升高,差异有统计学意义(P<0.05)。见表4、图9。
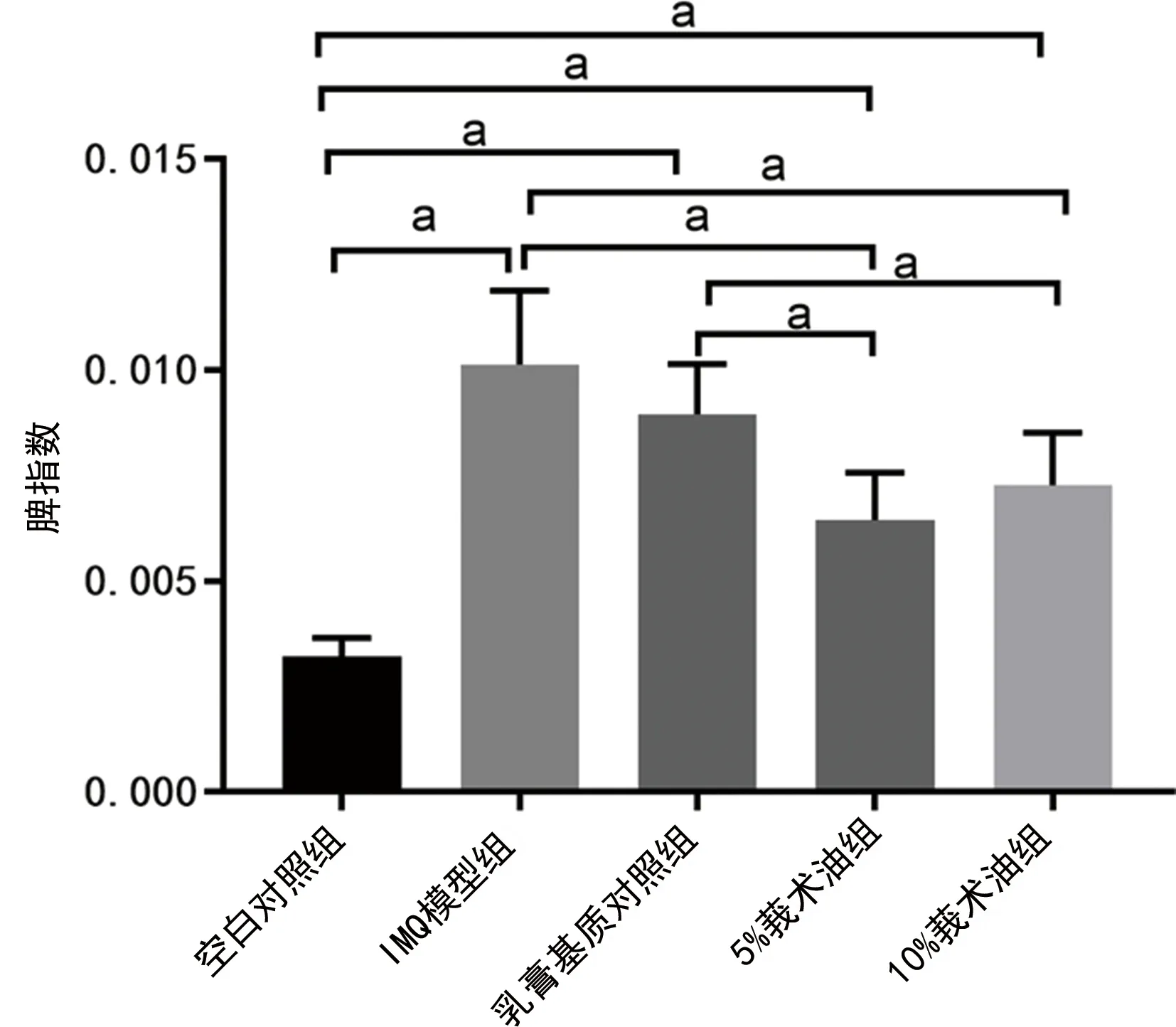
注:aP<0.05。
表3 IMQ模型组小鼠不同时间点血清ICAM-1、NO水平

图8 IMQ模型组不同时间点血清ICAM-1、NO水平
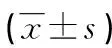
表4 各组小鼠血清ICAM-1、NO水平比较
注:aP<0.05。
3 讨 论
银屑病是一种慢性炎症疾病,分为急性发病期、稳定期和消退期。IMQ诱导的银屑病小鼠模型可模拟与人类相似的银屑病病程。在银屑病急性发病期IMQ激活Toll样受体7/8,通过IL-23/IL-17炎症轴激活下游炎症级联反应,并招募中性粒细胞和树突状细胞等免疫细胞迁移至表皮[1]。而在银屑病稳定期,尽管局部炎性细胞因子,如IL-22和TNF-α短暂增加后降低,但表皮中浸润的免疫细胞与持续激活的转录激活因子1(STAT1)、STAT3,以及腺苷受体共同维持了稳定期银屑病局部皮损[13-14]。此外,IMQ诱导的小鼠银屑病复发模型表明,即使肉眼观察皮损消退,小鼠局部皮肤仍保留银屑病的病理改变,病灶中浸润的记忆CD8+T淋巴细胞容易再次被IMQ激活而复发银屑病[15]。
目前,银屑病无法治愈,银屑病患者需接受持续治疗,以防止复发。急性模型不适合长期治疗药物的研究。因此,本研究连续7 d涂抹IMQ诱导小鼠急性发病期银屑病皮损,再通过维持剂量IMQ模拟慢性炎症稳定期,即第8~14天,以更好地模拟慢性银屑病患者体内的长期炎症状态[16]。本研究结果显示,IMQ持续作用7 d诱发小鼠背部皮肤的红斑、鳞屑和浸润,第8~14天IMQ模型组小鼠银屑病皮损消退,但仍表现出严重的表皮组织病理学改变,以及脾指数的明显增加。涂抹5%、10%莪术油乳膏治疗后可明显减少小鼠表皮厚度、减轻炎性细胞浸润和脾脏肿大,而乳膏基质对照组小鼠PASI评分仍高于IMQ模型组,可能是因为乳膏基质对皮肤存在较轻微的刺激性。因此,推测PASI评分在IMQ诱导的银屑病稳定期小鼠模型中可能存在不准确性,尤其是当稳定期IMQ模型组的肉眼造模效果下降时治疗药物对皮肤的不良反应可能会干扰对药物疗效的评估。
本研究结果显示,涂抹5%、10%莪术油乳膏治疗后小鼠血清ICAM-1水平明显低于空白对照组和IMQ模型组,提示莪术油可能具有较强抑制银屑病病灶内免疫细胞黏附的作用。而5%莪术油组小鼠血清NO水平明显高于空白对照组和IMQ模型组,可能与莪术油作用于iNOs、eNOs有关。另外,乳膏基质成分中常见的成分为石蜡,可激活多环芳烃芳香烃受体,诱导NO释放。表明莪术油乳膏可能上调NO水平抑制角质细胞增殖并促进其分化,逆转低水平NO引发的炎性反应。
急性期和缓解期银屑病患者血清中均可检测到显著升高的sICAM-1[17]。在受到γ干扰素和TNF-α等炎性细胞因子刺激后角质细胞及真皮层中微血管内皮细胞上的膜型ICAM-1会脱落释放sICAM-1[18]。病灶中增高的基质金属蛋白酶-9切割 ICAM-1胞外域也会促进内皮细胞释放sICAM-1[19]。鉴于sICAM-1常被认为是动态观测银屑病疗效及预后的炎症标志物,抑制其释放可能是一种有效的抗银屑病策略[20]。本研究结果显示,莪术油明显降低了血清ICAM-1水平,发挥了抗炎作用。此外,莪术油可能作为一种停用依法珠单抗(阻断淋巴细胞功能相关抗原-1 α亚基CD11a与配体ICAM-1结合)后的过渡性治疗药物,持续靶向ICAM-1以阻止T淋巴细胞和树突状细胞流入皮肤,进而延长缓解期,增强生物制剂的疗效。
银屑病局部皮损中核因子κB、Janus激酶/信号转导子与转录激活子等炎症通路诱导iNOs表达[21-22],但过表达精氨酸酶1与其竞争底物L-精氨酸,最终导致iNOs活性降低,产生较低水平的NO,刺激角质形成细胞过度增殖,并增加血管通透性,促进炎症介质渗出[23]。另外,银屑病局部病灶中缺氧、高氧化应激、精氨酸酶活跃的微环境诱导eNOs解偶联,产生超氧化物而不是NO,同样会导致NO的生物利用度降低[24-26]。而较高水平NO则可抑制角质形成增殖并促进其正常的分化和凋亡,诱导角化包膜及丝聚蛋白表达,有助于表皮屏障稳态恢复[5]。高水平NO还显著抑制角质细胞产生ICAM-1[27]。此外,临床使用局部NO供体显著改善了银屑病皮损的红斑、脱屑等[28]。结合iNOs、eNOs对表皮渗透屏障潜在的正向调节作用[29-30],本研究假设莪术油可能通过调控iNOs、eNOs上调血清NO水平,进而抑制角质形成细胞增殖并促进其分化。
综上所述,本研究证明了复方莪术油乳膏对IMQ诱导的银屑病稳定期小鼠的治疗作用。复方莪术油乳膏不仅下调血清ICAM-1水平,阻止免疫细胞迁移,而且诱导高水平NO抑制角质细胞增殖,最终降低银屑病体内炎症水平和表皮厚度。

