退化高寒草甸斑块根—土复合体特征研究
杜晨璐,乔一诺,赵理荣,陈瀚文,曹孟阳,刘 玉
(西北农林科技大学水土保持研究所, 黄土高原土壤侵蚀与旱地农业国家重点实验室,陕西 杨凌 712100)
三江源区地处我国青藏高原腹地,分布区域广阔,发育环境多样,在涵养内陆河水源、碳汇和生物多样性保护等方面具有重要的生态屏障作用[1-2]。由于气候寒冷、降水稀少、植被生长季短、土壤养分贫瘠、风蚀水蚀强烈[3],导致生态系统具有敏感度高、稳定性弱、修复能力差等独特特征[4-5]。加之,鼠虫危害和人类活动加剧等诸多因素的综合影响,三江源高寒草甸区面临着水土流失日趋严重、土地贫瘠化、植物多样性减少等环境生态问题[1,6]。据不完全统计,青藏高原退化草地约有4.5×107hm2,约占青藏高原草地总面积的1/3,其中严重退化的次生裸地—“黑土滩”,约占退化草地面积的16.5%[7]。
人工恢复退化草地,利用植被涵水固土,防止区域环境生态进一步恶化逐渐成为目前区域生态环境问题研究热点[8-9]。明确草甸斑块植物-土壤相互作用及其抗侵蚀能力,对深入理解退化高寒草甸水土流失防治具有重要意义。研究表明植物通过地下根系加筋锚固牵拉坡体、增加土体的抗剪强度来控制边坡的浅层滑动和崩塌[10-11],一方面根系穿插、缠绕土壤过程中,颗粒表面的摩擦力以及根系与土壤颗粒间嵌入作用产生的咬合力直接提高土壤抗剪强度[12-13];另一方面根系通过改善土壤环境,促进团聚体形成,增大了颗粒间的滑动摩擦和咬合摩擦,从而间接提高土壤抗剪强度[14]。植物根径、抗拉力、抗拉强度是反映植物根系力学特性的重要指标,也是定量计算植物根系对土体抗剪强度贡献的主要参数[15]。国内外学者从根-土复合体抗剪试验和植物单根抗拉试验对植物根系控制边坡滑塌方面开展了大量的理论和实践研究,根系能够有效提高根-土复合体抗剪强度[16],同时抗剪强度随着根系密度的减少而减小[17-18]。草本植物根系具有较好的抗拉强度和良好的固土能力[19-20]。单根抗拉力随根径增大而增大,抗拉强度则随根径增大而减小[21-22]。
目前关于植被根-土复合体对土壤抗侵蚀性能方面的研究多针对于基础设施建设边坡、流域河岸边坡、黄土高原陡坡土坎等区域[23-25],鲜有涉及三江源区高寒草甸斑块根-土复合体的抗侵蚀效应方面的研究,特别是关于草甸斑块的植物根系单根力学强度特性以及根-土复合体的抗剪强度的综合研究相对较少,而草甸斑块是退化高寒草甸的典型景观,对草地水土流失过程及水文连通性具有决定性作用。基于此,本研究选取高寒草甸斑块不同位置和不同深度土层,通过室外生物量采集、室内土壤物理性质测定试验、单根抗拉试验及根-土复合体直剪试验,分析草甸斑块单根抗拉强度大小及变化规律,以及土壤物理性质、植被生物量与根-土复合体抗剪强度之间的关系,在此基础上探讨了植物根系对高寒草甸斑块抗侵蚀性的影响,以期为提高退化高寒草甸斑块的水土保持效益,加快高寒生态系统恢复提供科学依据。
1 材料与方法
1.1 研究地点概况
研究地点位于青海省果洛藏族自治州达日县窝赛乡(99°47′ E,33°37′ N;海拔4 200 m),属于高寒半湿润气候区,无明显四季之分。自然环境恶劣,气候寒冷,无绝对无霜期,年平均气温在-0.1℃~-3.5℃之间,冷季8个月,最冷月1月均温-12.9℃,暖季烈日暴晒干旱,最热月7月均温9.1℃,年均降水量为540.6 mm,年日照时数2 466.5 h,年均蒸发量为1 109.07 mm,雨热同季[26-28]。窝赛乡小流域处于中度退化状态,尤其以下坡位退化严重,植被覆盖度较低,遍布大面积裸露斑块,石头分布密集,生物多样性低[29]。高寒草甸发育的土壤为高山草甸土[27],代表性植物主要有矮嵩草(Kobresiahumilis)、小嵩草(Kobresiapygmaea)、异针茅(Stipaalliena)、委陵菜(PotentillaaiscolorBunge)、苔草(Carextristachya)、山生柳(Salixoritrepha)、金露梅(PotentillafruticosaL)等[28]。
1.2 研究方法
1.2.1试验设计 由于过度放牧、鼠害爆发以及人类活动的影响,研究区部分退化草地严重退化为不规则且形状复杂的岛状斑块[30]。植被斑块是指某些物种高度聚集,植被与周围区域在植物物种构成、群落外貌和高度等方面均有明显不同,且其内部植被构成呈均质性特征[31]。斑块边缘处由于矮嵩草草甸、小嵩草草甸的退化剥蚀,地表发育有生物结皮,且多为黑色膜质的蓝藻等形成的黑斑以及由壳状地衣构成白色菌斑[32](图1)。试验选取下坡位中度退化草甸的内部生长植被、边缘被覆黑斑或白色菌斑、且斑块面积约1.0 m×1.0 m的草甸斑块样地。鉴于斑块边缘多已发生侵蚀,厚度不足20 cm,且斑块内部草甸植物根系90%以上分布在0~20 cm土层[33],故为探究斑块不同位置、深度根—土复合体的抗侵蚀能力,选择在斑块边缘生物土壤结皮0~10 cm土层以及斑块中心0~10 cm、10~20 cm土层处取样,并在每个样地的斑块边缘和中心分别设置一个0.5 m×0.5 m群落样方。本研究共选取6个退化斑块样地作为重复。

图1 群落样方调查及土层取样
1.2.2地上及地下生物量 地上生物量:在0.5 m×0.5 m群落样方内进行植物群落调查,主要分析群落组成差异。分拣出样方内的凋落物,并用剪刀齐地面剪去植被地上部分,根据不同物种分别装袋并标记。将生物量样品带回实验室称量地上生物量鲜重,烘箱中105℃杀青,65℃烘干至恒重,称量地上生物量。
地下生物量:在样地斑块边缘0~10 cm土层、斑块中心0~10 cm土层和10~20 cm土层分别收集5×5×10 cm3的根-土复合体,放置在自封袋内并标记,带回实验室。根-土复合体中的根系经清洗后装入信封,在75℃的烘箱内烘至恒重,称量地下生物量。
1.2.3根重密度 根据烘干根系的生物量,可计算根重密度为:
(1)
式中,ρm为根重密度(mg·cm-3),m为环刀内烘干根系生物量(mg),V为环刀体积(cm3)。
1.2.4单根拉伸试验 从清洗过后的植物根系中,分别随机选取样地斑块边缘0~10 cm土层、斑块中心0~10 cm、10~20 cm土层的优势植物矮嵩草的各种形态特征、长度约10 cm的30条根段作为试验对象。首先用精确度为0.01 mm的数字游标卡尺在每条根的任意3个位置测量植物根段直径,并将其平均值作为根系直径。然后利用精确度为0.01 N的单根拉伸仪器进行单根拉伸试验,单根拉伸仪器由拉伸系统和数据采集系统组成。测量时,先将植物根段夹持于夹头两端,扭动螺母使根段两端被固定于夹头处,待根段固定结束后,匀速拉伸根系,使根系受到张拉。在根系拉伸过程中,数据采集系统自动收集并记录根系受到的拉力和相应的伸长量,直至整个根段发生断裂。挑选植物单根在夹具中间或接近中间位置发生断裂的试验结果进行分析。根据测得的根系直径、单根抗拉力,计算单根抗拉强度:
(2)
式中,tr为单根抗拉强度(MPa);Rr为根径断裂时的抗拉力(N);dr为根系直径(mm)。
1.2.5土壤基本特征 利用环刀法(体积100 cm3)采集样地斑块边缘0~10 cm土层、斑块中心0~10 cm和10~20 cm土层土壤样品,带回实验室并称重(M0);然后揭去上底盖,仅留有滤纸的带孔下底盖,放置盆内,注入水并保持水层高度至环刀上沿,使其吸水达24 h,此时土壤中所有非毛管孔隙及毛管孔隙均充满水分,水平取出,擦干环刀外的水后,盖上上底盖,称重(M1);将上述环刀,揭去下底盖,继续放置在铺有干土的平底盘中8 h,盖上下底盖称重(M2);最后将环刀在75℃的烘箱内烘至恒重,称重(M′)。按照下列公式分别计算含水率、总孔隙度、毛管孔隙度、非毛管孔隙度及容重:
(3)
(4)
(5)
φ3=φ1-φ2
(6)
(7)
式中:ω为土壤含水率(%);φ1为总孔隙度(%);φ2为毛管孔隙度(%);φ3为非毛管孔隙度(%);M为环刀重量(g);D为土壤容重(g·cm-3);V为环刀体积(cm3)。
1.2.6根-土复合直接剪切试验 在样地斑块边缘0~10 cm土层、斑块中心0~10 cm和10~20 cm土层收集5×8×5 cm3的原状根-土复合体,放置在铝盒内带回实验室,采用ZJ型四联应变控制直剪仪(南京土壤仪器厂),对土样进行不固结不排水、快剪试验。试验环刀底面积30 cm2,高为2 cm,垂直应力设定100,200,300,400 kPa,量力环率定系数分别为1.56 kPa/0.01 mm,1.56 kPa/0.01 mm,1.45 kPa/0.01 mm,1.54 kPa/0.01 mm,试验剪切速率为2.4 mm·min-1。在剪切试验完成后,读取并记录百分表峰值,试验土样所受抗剪强度为:
(8)
式中:τf为土壤抗剪强度(kPa);R为量力环测表的读数(0.01 mm);C为量力环校正系数;A0为试验样品受力面积(cm2)。
抗剪强度指标粘聚力和内摩擦角φ为:
τf=c+σtanφ
(9)
式中:τf为土壤的抗剪强度(kPa);c为土壤的粘聚力(kPa);σ为剪切面的法向压力(kPa);φ为土壤的内摩擦角(°)。
2 结果与分析
2.1 草甸斑块中心与边缘植物生物量及根系分布特征
高寒草甸退化过程中,草甸斑块边缘区域退化程度大于中心区域,斑块中心区域的植物群落由草本植物和灌丛植物组成,斑块边缘区域的群落组成仅有草本植物且具有裸露的结皮层。矮嵩草为高寒草甸斑块的优势物种,斑块中心与边缘的群落差异主要存在于优势植物矮嵩草和灌丛植物的分布,灌丛植物山生柳只分布在斑块中心区域,斑块边缘无灌丛分布且地上生物量小于斑块中心区域(表1)。矮嵩草的生物量在斑块中心达到了497.7 g m-2约是斑块边缘生物量的2.5倍。

表1 斑块地上生物量分布
草甸斑块中心的根重密度主要分布在0~10 cm土层,根重密度达143.60 mg·cm-3,显著高于10~20 cm土层的31.76 mg·cm-3(P<0.05)。斑块边缘区域0~10 cm土层的平均根重密度为83.42 mg·cm-3显著低于斑块中心0~10 cm土层(表2)。
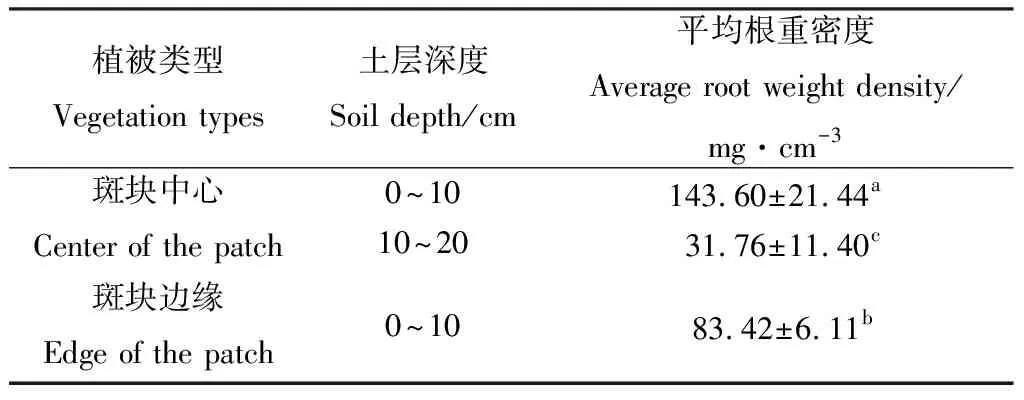
表2 不同土层根重密度
2.2 土壤物理性质
斑块中心和斑块边缘0~10 cm土层容重、总孔隙度、毛管孔隙度和非毛管孔隙度均没有显著性差异。斑块中心区域10~20 cm的土壤容重高于表层0~10 cm(P<0.05),但土壤含水率、土壤总孔隙度、毛管孔隙度、非毛管孔隙度均表现出相反趋势(表3)。

表3 不同土层土壤基本物理性质
2.3 土壤抗剪指标分析
高寒草甸斑块中心区域10~20 cm土层的土壤粘聚力和内摩擦角较表层0~10 cm分别降低了6.35%和75.85%。斑块边缘0~10 cm土层的土壤内摩擦角最小而粘聚力最大,与斑块中心相比,分别降低了46.82%和增加了133.28%(表4)。

表4 不同深度土层抗剪强度指标
2.4 根系参数对土壤抗剪强度的影响
高寒草甸斑块中心0~20 cm土层和斑块边缘0~10 cm土层根系直径无显著差异。斑块中心和边缘0~10 cm土壤根系的平均单根抗拉力均显著高于斑块中心10~20 cm(P<0.05);平均单根抗拉强度表现出相同趋势(表5)。

表5 不同深度土层根系直径及其抗拉性能参数
以根系直径为横轴,以单根抗拉力为纵轴,绘制散点图并对二者的数量关系进行拟合表明,植物根系的单根抗拉力均随着根径的增加而增大,斑块中心0~10 cm土层的根系平均单根抗拉力显著高于斑块中心10~20 cm(P<0.05)。

图2 不同深度土层单根抗拉力与根系直径之间的拟合关系曲线
由单根抗拉力与根系截面面积比值求得单根抗拉强度。以根系直径为横轴,以单根抗拉强度为纵轴,绘制散点图并对二者的数量关系进行拟合表明,单根抗拉强度随着根径的增大而减小,斑块中心0~10 cm土层的根系平均抗拉强度显著大于斑块中心10~20 cm(P<0.05)。
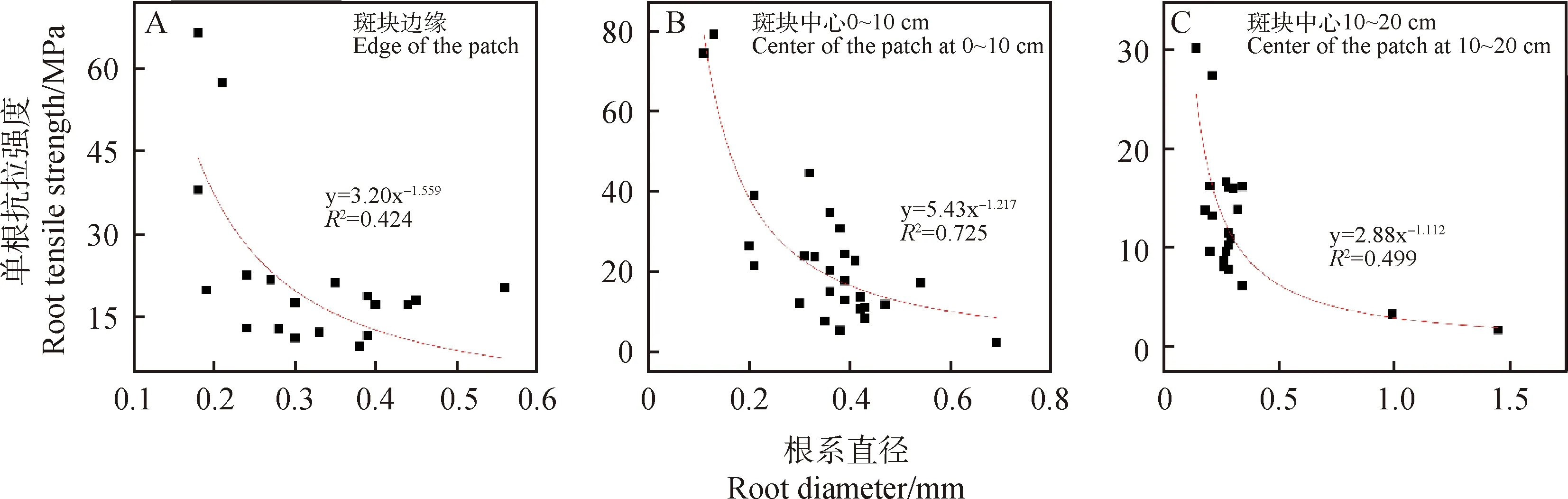
图3 不同深度土层单根抗拉强度与根系直径之间的拟合关系曲线
3 讨论
根系是植物生长发育的重要器官之一,根系的分布特征及其与土壤环境之间的复杂关系也影响着地上部分植物的生长[34]。本研究中,高寒草甸根系浅层化分布,主要分布在0~10 cm土壤。一方面可能是高寒草甸植物群落对高寒低温环境的适应性调节的结果[35]。根系的发展和存活受土壤温度的影响,冻土在反复冻融过程中的水热变化会影响植物根系的生长发育过程,植物为了满足生长需要,充分利用高寒草甸水热同季的条件,在浅层土壤发展根系,导致10 cm以下土层根密度显著降低[36-37]。另一方面,高寒草甸根系分布浅层化是植物根系适应土壤水分、养分表层化而形成的适应特征[38]。0~10 cm土层具有较好的保水和保肥功能,植物根系集中分布在该土层有利于获取更多的养分和水分,同时浅层土壤中的植物根系可以获得更多的氧气,有利于根系的呼吸[39]。
植物根系能够被周围土粒包裹锚固在土壤中,提高土壤的粘聚力,使得根-土复合体抗剪强度显著高于不含根的素土[40-41]。根系生物量是反映根系生长状况及固持土体能力的一个重要指标[42]。植物根系在土体中穿插、缠绕、网络、固结使土体抵抗风化吹蚀、流水冲刷和重力侵蚀的能力增强,从而能够有效地提高土壤的抗侵蚀性能[43]。植物根系对土壤抗侵蚀性能的增强效应随着根系生物量的增加而增加,呈现比较明显的线性关系[44]。本研究中,斑块中心0~10 cm土层的根重密度最大,10~20 cm土层的根重密度最小,即随着土壤深度的增加,土壤含根量减少,抗剪强度随之减小。
斑块边缘部位植被覆盖度低,含根量较少,内摩擦角最小但粘聚力最大。斑块边缘覆盖有以苔藓结皮为主的生物结皮[32],结皮中的植物根系、菌丝对土壤颗粒有缠绕、包裹作用,且微生物生理活动产生的分泌物以及腐烂的生物体能够增加土壤有机质含量[45],促进土壤颗粒间的胶结作用。结皮层下土壤水分含量较高,促进有机物分解、提高有机质含量,从而增大团聚体稳定性[46],进而提高了草甸斑块边缘部位的土壤粘聚力,增强土壤抗剪强度。
土壤含水率是影响土壤抗剪强度的重要因素之一[47]。在高寒草甸斑块中心,0~10 cm土壤含水率高于10~20 cm。抗剪强度随土壤深度增加而减小。高寒草甸水源涵养主要通过活根系吸附水分,草毡层持水,进而维持高寒草甸贮水功能[48],使表层土壤含水率较高。土壤含水率会影响土壤的抗剪强度特性,水的存在增强了土壤颗粒之间及土壤颗粒与植物根系之间的润滑,使根系的拉拔阻力和土壤颗粒间的摩擦阻力减小,从而呈现出含水率越高,土壤的抗剪强度特性越低的规律[49]。本研究中,随着土壤含水率的下降,土壤抗剪强度随之减小,因为土壤含水率在适宜范围内能够促进根-土复合体粘聚力的增加,从而使土壤抗剪强度增强[50]。
根系抗拉强度与根-土复合体的抗剪强度呈正比例关系,相同的根面积比下,较多的细根和较少的粗根,表现出更为显著的固土能力[51]。本研究中,根系单根抗拉力随着根系直径的增大而增大,单根抗拉强度随着根系直径的增大而减小,但根系直径与单根抗拉强度未显示出明显的幂指数关系,这可能是因为青藏高原地区冻土表层在植物生长季最先具备适宜植物根系生长的条件,活动层土层越深土壤融化期越短,在冻融交替过程中土层强烈的物理变化和极端的土壤温度变化会导致根系死亡[36],导致较深土层的根系平均单根抗拉力和平均单根抗拉强度降低。
土壤含水率并非是决定退化高寒草甸土壤抗剪强度的最主要因素。根系对抗剪强度具有显著性影响,土壤深度增加,含根量逐渐减少,粘聚力随之呈现减小的趋势[17]。土壤含水率的增加,会使土壤的粘聚力均减小,在高含水率情况下,根系对土体抗剪强度的贡献更为突出[48]。本研究结果表明,斑块中心和边缘,及不同深度含水量未表现出显著差异,但各部分的根系量差异显著,导致抗剪强度的变化,说明草甸斑块植物根系对抗剪强度的作用效果大于含水率,在草甸斑块抗侵蚀过程中有重要作用。此外,土壤孔隙度、粘粒含量、容重等物理性质也是影响土壤抗剪强度的重要因素[52]。但本试验中,孔隙度、容重与土壤抗剪强度并未表现出显著的相关性,将在后续研究中进一步探讨粘粒含量与土壤抗剪强度的关系。
4 结论
根系分布是影响根-土复合体抗侵蚀能力的主要因素,草甸斑块植物根系主要分布在0~10 cm土层,使斑块中心区域的土壤抗剪强度、内摩擦角和粘聚力均随着土层深度的增加而减小。平均单根抗拉力均随根径的增大而增大,平均单根抗拉强度均随根径的增大而减小,草甸斑块植物根系对土壤抗剪强度作用效果大于土壤含水率,在草甸斑块抗侵蚀过程中有重要作用。因此,本研究结果为提高三江源区退化高寒草甸斑块的水土保持效益提供了一定参考依据。

