分子动力学模拟抗坏血酸对木瓜蛋白酶 活性的影响
万正洋,黄业传*,彭春雷,李 宁,程雨姗,陈 丹,张克媛,程佳琪
(荆楚理工学院生物工程学院,湖北 荆门 448000)
从番木瓜中提取的木瓜蛋白酶能有效降解肉类中含有的肌肉纤维[1],其原理在于肉中的部分弹性蛋白和胶原蛋白能被蛋白酶水解,使肉制品软化,口感更嫩滑、细腻,利于咀嚼[2]。肉类腌制或加工时除了加入嫩化酶外,还会加入一些植物性辅料,其中可能含有VC、多酚、植物黄酮等[2],这些小分子物质会和木瓜蛋白酶结合,影响蛋白的结构,进而影响蛋白酶的活性和嫩化效果,如木瓜蛋白酶与茶多酚[3]结合后其结构发生改变,酶活力增强;乙二醇[4]会抑制木瓜蛋白酶活性表达;壳聚糖[5]可使木瓜蛋白酶实现良好的固定化。很多学者就小分子对蛋白酶活性的影响机制进行了较深入的研究。褚盼盼[6]发现,黑豆皮花青素对酪氨酸酶活性有抑制作用。肖会芝[7]发现,单宁酸对α-葡萄糖苷酶的抑制效果强于其他标准抑制剂(阿卡波糖)。王丽丽等[8]发现,白茶中乙酸乙酯层的小分子可抑制猪胰弹性蛋白酶的活性。目前使用的实验手段虽然可以判断小分子对蛋白酶活性的激活或抑制作用,但不能从微观上探究蛋白酶活性改变的原因,而分子动力学模拟和分子对接技术可以呈现二者的结合机制,进一步分析蛋白结构的具体变化。分子对接是根据几何匹配、能量匹配和化学环境匹配的原理,寻找受体和配体之间的最佳结合模式。如Kanakis[9]、Li Ti[10]等分别用分子对接研究茶多酚、黄酮与β-乳球蛋白的结合过程。分子动力学模拟能将小分子和蛋白的结合过程更直观地呈现出来,如Gholami等[11]研究柚皮苷与β-乳球蛋白的结合,发现结合位点在β-乳球蛋白的外表面。蛋白与多酚类物质结合的分子模拟报道较多,如茶多酚、花青素等,而蛋白与抗坏血酸等小分子的结合机制却鲜有报道。
不同小分子对各种蛋白酶的作用机制不同[12-14],具体到木瓜蛋白酶,何平等[15]发现,木瓜蛋白酶在体积分数小于10%的低疏水参数有机溶剂中酶活力提高。张存滢等[16]发现,随着木瓜蛋白酶分子构象有序度的增加,其酶活性也相应提高,且用邹氏酶活性不可逆改变动力学模型能很好解释双金属离子与木瓜蛋白酶结合的动力学规律。鉴于抗坏血酸和木瓜蛋白酶经常存在于同一食品体系中,而目前关于抗坏血酸影响木瓜蛋白酶活性的报道较少,因此研究其与木瓜蛋白酶结合的相关分子机制对提高肉类的嫩化效果及品质有重要意义。本研究考察3 种浓度(0.1、0.2、0.3 mmol/L)抗坏血酸处理木瓜蛋白酶后对其酶活性的影响,并采用分子动力学模拟和分子对接技术研究抗坏血酸和木瓜蛋白酶的结合机制。
1 材料与方法
1.1 材料与试剂
木瓜蛋白酶(80 万U/g) 北京索莱宝科技有限公司;DL-半胱氨酸、L-酪氨酸(均为99%生物技术级别)、L-抗坏血酸、二水合磷酸氢二钠、三氯乙酸、干酪素、十二水合磷酸氢二钠(均为分析纯) 上海麦克林生化科技有限公司。
1.2 仪器与设备
TP-1901紫外分光光度计 北京普析通用仪器有限责任公司。
1.3 方法
1.3.1 木瓜蛋白酶酶活力测定
标准曲线的绘制:配制100 μg/mLL-酪氨酸溶液,取0、1、2、3、4、5 mL于6 支试管中,依次加水至体积为10 mL,得到质量浓度分别为0、10、20、30、40、 50 μg/mL的L-酪氨酸标准溶液,再依次于275 nm波长处测定吸光度,以L-酪氨酸质量浓度为横坐标,吸光度为纵坐标绘制标准曲线。
酶活力的测定:配制0.3 mg/mL的木瓜蛋白酶液,取1 mL酶液分别加入4 支带塞试管(A、B、C、空白管),再配制浓度分别为0.1、0.2、0.3 mmol/L的3 种抗坏血酸溶液,每种浓度取0.2 mL对应加入试管A、B、C与酶液混匀,加入5 mL 6.0 g/L酪蛋白溶液,在37 ℃条件下反应10 min,用5 mL 0.1 mol/L三氯乙酸溶液终止反应;空白管先加入5 mL 0.1 mol/L三氯乙酸溶液使木瓜蛋白酶失去活性,以阻止蛋白酶的水解反应,再加入5 mL 6.0 g/L酪氨酸溶液混匀。4 支试管在37 ℃条件下放置40 min,最后过滤分离沉淀物,取滤液,用紫外分光光度计于275 nm波长处测定吸光度,纯水作空白。木瓜蛋白酶酶活力按下式计算。

式中:X为木瓜蛋白酶酶活力/(U/g);V1为溶解木瓜蛋白酶所用容量瓶的体积/mL;A为木瓜蛋白酶样品稀释液的酶活力/(U/mL),通过标准曲线计算;V2为试管中反应液的总体积/mL;n为酶液稀释倍数;t为酪蛋白与木瓜蛋白酶的作用时间(10 min);m为称取木瓜蛋白酶的质量/g。
1.3.2 分子动力学模拟
从RCSB数据库下载木瓜蛋白酶结构(ID号:1ppn),手动去除结晶水和杂离子,并补全缺失的原子,再将抗坏血酸用分子对接的方法结合到木瓜蛋白酶中,探究最佳结合位置。抗坏血酸用ChemDraw Professional 17.1和Chem3D 17.1准备,并用其自带的MM2力场进行结构优化。通过AutoDock Tools软件[17]对木瓜蛋白酶和抗坏血酸小分子进行预处理,分别生成二者的pdbqt文件。然后进行木瓜蛋白酶和抗坏血酸的分子对接,小分子设置为全柔性,盒子大小设定为32×32×32 Å,中心坐标为默认值,设置间隔为1 Å。对接时采用AutoDock Vina[18]搜索前20 个 得分最高的对构象,对接参数Energy_Range设置为5,Exhaustiveness设置为100。
分子对接结束后,采用Gromacs软件[19],用最优构象进行分子动力学模拟,小分子的Top文件在ATB网站生成。本研究选用GROMOS54a7力场描述相互作用[20],采用SPC水模型将结合体浸入立方体形状的周期水盒中,利用最速下降法对体系进行能量最小化,以缓解不利的相互作用[21-22]。先在NVT和NPT系综下分别进行400 ps的平衡,最后进行150 ns的分子动力学模拟,模拟步长为2 fs,每10 ps储存1 次数据。模拟结束后,使用gmx的rms命令分析模拟过程中体系的均方根误差(root mean square deviation,RMSD)[23];并用gmx的相应命令分析木瓜蛋白酶结构在0~150 ns内的蛋白残基均方根波动(root mean square fluctuation,RMSF)、二级结构、蛋白溶剂可及表面积等,而对于氢键数量和RMSF,只分析蛋白结构稳定后100~150 ns区间的数据,分析时每100 ps选取1 个数据点,所得数据结果用Origin 9.1软件进行图表绘制,选用Excel 2019系统软件比较多组数据的差异性,数据用平均值±标准差表示。
2 结果与分析
2.1 抗坏血酸对木瓜蛋白酶活性的影响
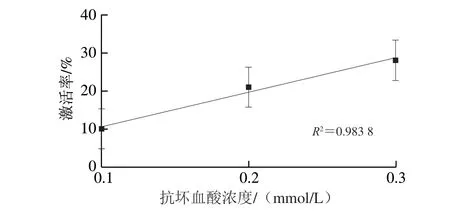
图 1 不同浓度抗坏血酸对木瓜蛋白酶的激活率Fig. 1 Percentages of activation of papain by ascorbic acid at different concentrations
有相关研究[24]表明,木瓜蛋白酶的激活剂多具有还原性,这些还原性化合物能将酶活性中心的反应基团还原,使其被激活。由图1可知,选取3 种浓度的抗坏血酸(0.1、0.2、0.3 mmol/L)加入到酶反应体系中,平均激活率分别为10%、21%、28%,均呈激活作用,且抗坏血酸浓度越高,激活作用越明显。与之类似的还有邵法都等[25]发现,低浓度的抗坏血酸能有效促进木瓜蛋白酶活性。Ol’Shannikova等[26]发现,在壳聚糖微粒与木瓜蛋白酶复合前加入抗坏血酸,能使木瓜蛋白酶活力增强。这些都与本研究的分析基本一致。Ockerman等[27]发现,2.5 mmol/L抗坏血酸会抑制木瓜蛋白酶活性,这与本研究的结果不一致,这可能与该研究添加的抗坏血酸浓度约为本研究的10 倍有关,本研究选用的抗坏血酸最高浓度为0.3 mmol/L。
2.2 木瓜蛋白酶与抗坏血酸结合的分子动力学
2.2.1 木瓜蛋白酶与抗坏血酸的结合位点
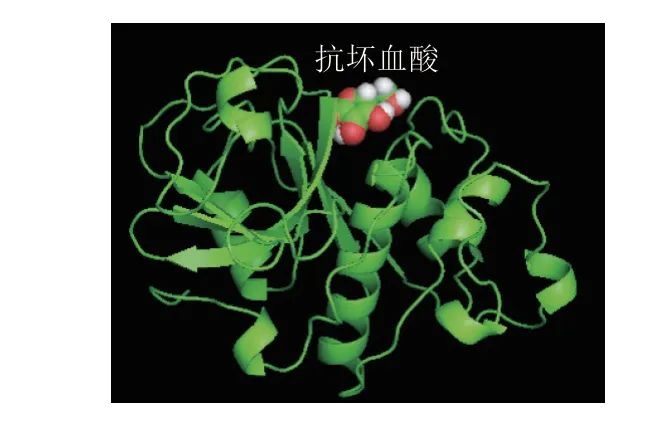
图 2 抗坏血酸与木瓜蛋白酶结合构象Fig. 2 Binding conformation between ascorbic acid and papain

图 3 抗坏血酸与木瓜蛋白酶的结合位点Fig. 3 Binding sites between ascorbic acid and papain
由图2可知,抗坏血酸主要结合在木瓜蛋白酶的活性中心附近。由图3可知,213号位为小分子抗坏血酸,活性位点由3 个氨基酸构成:Asp158、His159、Cys25。相关研究[25-26]也表明,在木瓜蛋白酶的活性位点中,Cys25在催化反应中发挥主要作用。抗坏血酸与木瓜蛋白酶结合后,与活性中心的距离较近,易对活性中心产生一定作用,进而影响木瓜蛋白酶的酶活性。
2.2.2 RMSD在模拟过程中的变化
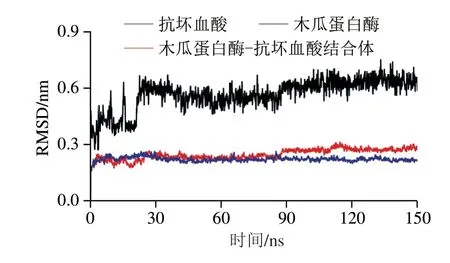
图 4 木瓜蛋白酶和抗坏血酸模拟分子对接过程中RMSD的变化Fig. 4 Changes in RMSD during molecular docking between papain and ascorbic acid
RMSD可体现蛋白质原始构象与在特定时间其结构的平均偏差[27],是评价研究体系是否稳定的重要指标。由图4可知,结合前木瓜蛋白酶的RMSD变化程度最小,在0.2 nm左右。而小分子抗坏血酸前期波动较大,在70 ns后基本保持稳定,其总体波动明显高于木瓜蛋白酶分子。与抗坏血酸结合后,木瓜蛋白酶的RMSD变化可分为2 个阶段:前70 ns,结合体的RMSD与木瓜蛋白酶很接近;70~150 ns时,由于抗坏血酸波动较大,引起结合体后期波动略大于木瓜蛋白酶,曲线整体呈略微上升的趋势,并趋于平稳,说明木瓜蛋白酶的结构此时已得到充分弛豫,但总体看来,加入抗坏血酸没有影响到木瓜蛋白酶的结构稳定性,原因可能是木瓜蛋白酶结构较小,只含有212 个氨基酸[28],结构相对稳定,抗坏血酸并不会影响木瓜蛋白酶的α-螺旋和β-折叠,木瓜蛋白酶的二级结构在与抗坏血酸结合过程中保持较好。孔庆新等[29]进行茶多酚与β-乳球蛋白结合的分子模拟,发现结合过程中小分子仅在有限pH值范围内波动,不会对蛋白质结构产生较大影响。钟姝凝[30]模拟人参皂苷与β-葡萄糖苷酶的分子对接时发现,结合较平稳,RMSD较小。这些都与本研究的结论相似。
2.2.3 RMSF在模拟过程中的变化
RMSF可体现蛋白质中各氨基酸残基的波动情况[31],反映相比于平均构象蛋白质中每个氨基酸残基的位置变化。抗坏血酸和木瓜蛋白酶结合100 ns后结构才比较稳定,所以取100~150 ns数据进行计算。
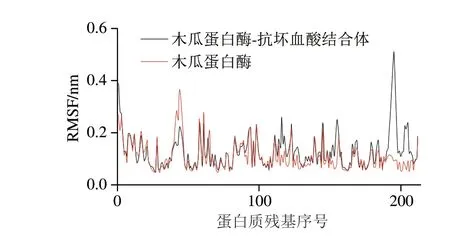
图 5 木瓜蛋白酶和抗坏血酸模拟分子对接过程中RMSF的变化Fig. 5 Changes in RMSF during molecular docking between papain and ascorbic acid
由图5可知,在结合前,木瓜蛋白酶大部分氨基酸的RMSF较小,自由程度低,表明主体结构较稳定,这一模拟结果与刘金珂[32]研究木瓜蛋白酶在弛豫过程中RMSF的变化趋势一致。而与抗坏血酸结合后,木瓜蛋白酶RMSF波动程度明显增大,第193~197号位残基波动相对较大,第195号位残基波动最大,其RMSF在结合前后增大0.423 nm,而木瓜蛋白酶活性中心上的3 个氨基酸的RMSF也都在结合后略微变大,说明在与小分子结合后蛋白质分子内部有部分作用力会丢失,导致天然构象的稳定性降低。周冠宇等[33]发现,角蛋白酶的部分残基RMSF变大后,蛋白酶的灵活性会提高,进而增强酶活力,这与本研究的结论基本一致。
2.2.4 抗坏血酸对木瓜蛋白酶回旋半径的影响
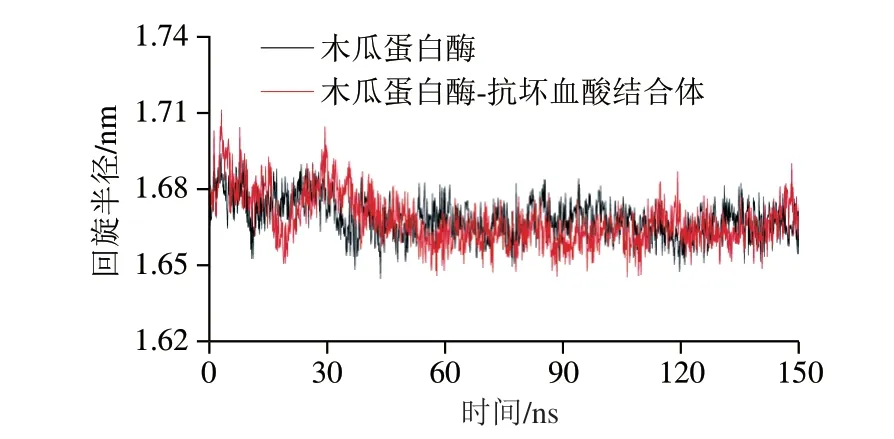
图 6 木瓜蛋白酶与木瓜蛋白酶-抗坏血酸结合体的回旋半径Fig. 6 Comparison of gyration radius between papain and papainascorbic acid conjugate
回旋半径越小,表明蛋白结构越致密,反之则越膨胀。由图6可知,整体来看,木瓜蛋白酶与抗坏血酸结合后的回旋半径随模拟时间的延长缓慢下降。回旋半径曲线在0~70 ns波动较为剧烈,整体呈下降趋势,在70 ns之后波动减小,逐渐趋于稳定。而木瓜蛋白酶在0~70 ns的回旋半径曲线虽然也呈下降趋势,但波动与结合体相比更平缓。整体来看,0~150 ns,木瓜蛋白酶与结合体的回旋半径相差不大,回旋半径均较小,蛋白结构较致密。Sahihi等[34]发现,β-乳球蛋白与黄酮类化合物络合时,蛋白的回旋半径较平稳,变化较小,结合前后都稳定在1.40~1.45 nm,这与本研究的结论基本一致。
2.2.5 抗坏血酸对木瓜蛋白酶氢键的影响
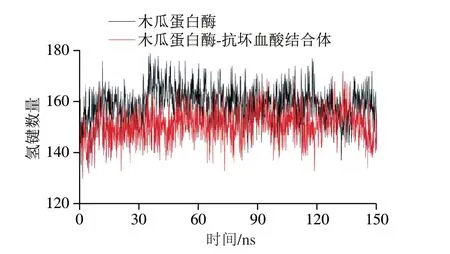
图 7 木瓜蛋白酶与木瓜蛋白酶-抗坏血酸结合体的氢键数量Fig. 7 Comparison of the number of hydrogen bonds between papain and papain-ascorbic acid conjugate
氢键是一种重要的非共价结合力,影响蛋白质结构的稳定性。由图7可知,对100~150 ns区间数据计算得到,与抗坏血酸结合后,木瓜蛋白酶之间的氢键数量变少,结合前氢键数量的平均值为146,而加入抗坏血酸之后的平均值为143。可能是随着模拟进程的不断推进,抗坏血酸和木瓜蛋白酶之间能够形成氢键的原子发生位移,其距离或角度只要到达形成氢键的范围内就可以进一步形成氢键。根据以上结果可合理推断出,木瓜蛋白酶与抗坏血酸结合后,木瓜蛋白酶与抗坏血酸间也形成氢键,导致木瓜蛋白酶间的氢键数量减少,结合后 木瓜蛋白酶内部分子间部分作用力丢失。李有花[35]经过统计也发现,木瓜蛋白酶上多种氨基酸残基在对接过程中可与配体分子形成氢键。Rao等[36]发现,配体色素可与木瓜蛋白酶上的268位酪氨酸相互作用形成氢键,钟姝凝[30]发现,人参皂苷可与β-葡萄糖苷酶在结合过程中形成14 个氢键,这些都与本研究的分析结果相一致。
2.2.6 抗坏血酸对木瓜蛋白酶可及表面积的影响由表1可知,与抗坏血酸结合后,木瓜蛋白酶的总可及表面积和疏水表面积均增加,这可能是由于加入抗坏血酸后木瓜蛋白酶上肽链延伸,暴露出结构中的亲水基团,从而提高活性部位与底物的接触面积,酶的水解效率提高。疏水区域的可及表面积变化较小,抗坏血酸结合后基本不会影响木瓜蛋白酶的疏水性。木瓜蛋白酶的亲水表面积始终大于疏水表面积,因此木瓜蛋白酶与抗坏血酸结合的过程中表现出亲水性大于疏水性,相关研究[28,37]也表明,木瓜蛋白酶表面有较多极性基团,疏水性区域较少。木瓜蛋白酶在整个模拟过程中为水溶性,表明与抗坏血酸结合并没有改变木瓜蛋白酶的溶解性。宣红霞[38]发现,胰蛋白酶与激活剂铜离子作用后,可及表面积增大,这与本研究的结论基本一致。
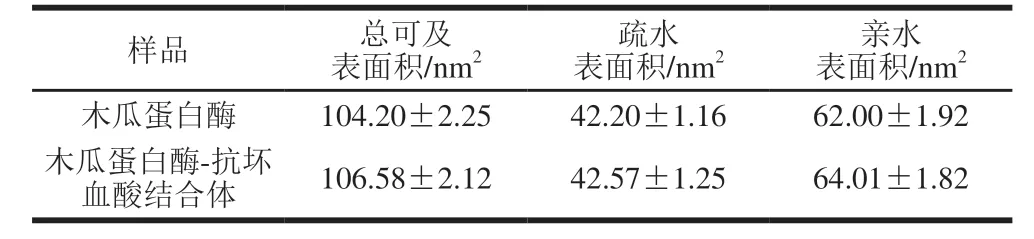
表 1 抗坏血酸对木瓜蛋白酶可及表面积的影响Table 1 Effect of ascorbic acid on the accessible surface area of the protease
2.2.7 抗坏血酸对木瓜蛋白酶活性中心氨基酸间距离的影响

表 2 抗坏血酸与木瓜蛋白酶活性中心3 个氨基酸残基的距离Table 2 Distance between ascorbic acid and three amino acid residues at the enzyme’s active center nm
由表2可知,0~100 ns内,抗坏血酸与3 个氨基酸的距离均随时间延长而变小,抗坏血酸与His159和Cys25残基的距离在100~150 ns内略微变大,但整体来看,0~150 ns内依旧呈随时间延长而缩小的趋势。抗坏血酸与活性中心的结合逐渐紧密,可能结合后能更有效地发挥活性中心的催化作用,酶活力也相应增强。
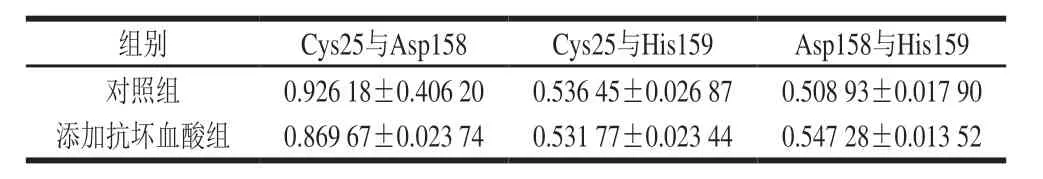
表 3 木瓜蛋白酶活性中心3 个氨基酸残基间距随时间 (100~150 ns)的变化Table 3 Change in spacing of three amino acid residues at papain’s active center with time (100–150 ns) nm
由表3可知,Asp158与His159距离在结合抗坏血酸后略微变大,而Cys25到Asp158和His159的距离均缩小,由此可推断,抗坏血酸对木瓜蛋白酶的激活作用可能与活性中心3 个氨基酸之间距离的变化有关,氨基酸间距缩小使蛋白内部结构更紧密,从而更好地发挥酶活性。宣红霞[38]通过分子动力学模拟结合主成分分析发现,胰蛋白酶与铜离子交联时,蛋白结合位点附近的氨基酸间距缩小,使蛋白构象变得更紧密,进而促进酶活力;而胰蛋白酶与抑制剂作用后,蛋白结构会变得更松散,这与本研究的计算结果基本一致。
3 结 论
考察3 种浓度(0.1、0.2、0.3 mmol/L)抗坏血酸处理木瓜蛋白酶对酶活性的影响,结果表明:抗坏血酸提高了木瓜蛋白酶水解酪蛋白的能力,且抗坏血酸浓度越高,激活作用越明显;通过分子动力学模拟发现,木瓜蛋白酶在与抗坏血酸结合后的回旋半径和RMSD变化不明显,氨基酸残基波动程度明显增大,说明抗坏血酸并没有对木瓜蛋白酶的结构造成大的影响,但可使活性中心的柔性增强,木瓜蛋白酶呈现为被激活的效果;木瓜蛋白酶内部的氢键数量平均减少3 个,这可能是由于木瓜蛋白酶与抗坏血酸之间形成了氢键所导致;随着抗坏血酸与木瓜蛋白酶的结合逐渐紧密,发挥主要催化作用的Cys25与另外2 个辅助氨基酸残基(Asp158、His159)的间距缩小,辅助作用增强,因此木瓜蛋白酶能更有效地发挥催化作用。本研究探讨了抗坏血酸与木瓜蛋白酶的结合机理,为促进木瓜蛋白酶在食品中的进一步使用和提高嫩肉粉的嫩化效果提供了一定的理论参考。

