纳米多孔花形乳糖装载姜黄素固体脂质纳米粒吸入微粉的制备及其体外抑凋亡作用研究 Δ
李楠,李旭,程鹏,孔令钰,杨萍 (天津市医药科学研究所,天津 300020)
姜黄素(curcumin,Cur)可通过调节多种信号通路,发挥抗黏液分泌、改善气道重塑和减轻气道高反应等作用,有望成为治疗肺部炎症性疾病的新型药物[1]。研究发现,Cur可显著抑制BEAS-2B细胞的增殖,提示Cur对支气管上皮细胞介导的进行性炎症反应具有预防作用[2]。
肺部吸入给药可能是提高Cur等难溶性药物生物利用度的有效途径[3]。将药物包裹于纳米载体内能减少药物对肺部的不良反应,降低药物对肺黏膜纤毛的损伤。本课题组前期曾采用微乳法制备了姜黄素固体脂质纳米粒(Cur-SLN),将其微粉化后与载体乳糖(200目)和第三组分乳糖充分混匀后,制得Cur-SLN干粉吸入剂(Cur-SLN-DPI),经测定其平均粒径约为3.35 μm、排空率为95.17%、体外有效部位沉积率为28.73%[4],但该制剂存在药物从载体上分离效率低的问题。本研究采用课题组自主研发的花形乳糖(flower-shaped lactose,FL)[5-6]对原有Cur-SLN-DPI中的载体乳糖和第三组分乳糖进行替换,构建纳米多孔FL装载Cur-SLN吸入微粉(Cur-SLN-FL),并通过修饰载体表面的粗糙度,提高该微粉的分散性,改善药物的体外肺部有效部位沉积效率;然后,以人支气管上皮细胞BEAS-2B为对象,探讨该吸入微粉作为肺部递药系统对气道上皮细胞的安全性和作用机制,以期为该吸入微粉的进一步研发提供理论依据。
1 材料
1.1 主要仪器
本研究所用主要仪器有SPD-M20A型紫外检测器、LC-20A型高效液相色谱仪(日本Shimadzu公司),FDU-2110型冷冻干燥机(日本EYELA公司),SZ-100型纳米粒度仪(日本Horiba公司),S-3400N型扫描电子显微镜(日本Hitachi公司),HELOS-OASIS型激光粒度仪(德国Sympatec公司),Sigma-3k30型高速冷冻离心机(德国Sigma-Aldrich公司),DNM-9602型酶标仪(北京普朗新技术有限公司),Aerolizer®吸入装置(澳大利亚Novartis Pharmaceutical公司),新一代多级撞击器(英国Copley公司)等。
1.2 主要药品与试剂
Cur原料药(批号TZSW200317-1,纯度99.0%)购自西安通泽生物科技有限公司;海藻糖购自艾伟拓(上海)医药科技有限公司;FL(批号20210312)为实验室自制。DMEM完全培养液、1640完全培养液和胰蛋白酶均购自北京鼎国昌盛生物技术有限责任公司;胎牛血清均购自美国Gibco公司;脂多糖(LPS)购自美国Sigma-Aldrich公司;乳酸脱氢酶(lactate dehydrogenase,LDH)细胞毒性检测试剂盒(批号042721220221)、Annexin Ⅴ/PI细胞凋亡检测试剂盒(批号092120201215)、JC-1线粒体膜电位测定试剂盒(批号093020201026)均购自上海碧云天生物技术有限公司;甲醇、乙腈为色谱纯,其余试剂均为分析纯或实验室常用规格,水为纯净水。
1.3 实验细胞
BEAS-2B细胞购自湖南丰晖生物科技有限公司。
2 方法与结果
2.1 Cur的含量测定方法
采用高效液相色谱法进行检测[5]。色谱柱为Agilent C18(150 mm×5 mm,4.6 μm);流动相为乙腈-5%冰醋酸溶液(55∶45,V/V);检测器为紫外检测器;检测波长为426 nm;流速为1.0 mL/min;柱温为35 ℃;进样量为20 μL。
2.2 Cur-SLN混悬液的制备
称取处方量的泊洛沙姆188和吐温-80,在75 ℃磁力搅拌下加入适量水作为水相;另称取处方量的Cur、单硬脂酸甘油酯和PEG-40硬脂酸酯,在相同温度和转速下加入适量无水乙醇,完全溶解后作为有机相。在80 ℃、1 020 r/min恒温磁力搅拌下,将有机相缓慢注入水相中,滴加完毕后,继续恒温搅拌3 h使其浓缩。趁热将热乳液以1∶1(V/V)加入0~2 ℃的冷水中,低温固化2 h,即得黄色的Cur-SLN混悬液,于4 ℃下保存。同法制备空白SLN混悬液,备用[7]。
2.3 Cur-SLN-FL的工艺优化及制备
2.3.1 单因素实验优化Cur-SLN的冻干保护剂 基于课题组的前期研究[7],本研究仅对Cur-SLN的冻干保护剂进行考察。冻干保护剂的种类和浓度与其对样品的保护作用直接相关。量取同体积的Cur-SLN混悬液,加入不同种类(乳糖、蔗糖、甘露醇、海藻糖)和不同用量(2%、3%、5%)的冻干保护剂,混匀、分装后,放入冷冻干燥机的程序冻干仓内进行程序冷冻干燥。设置真空冻干程序约48 h,完成干燥后即得Cur-SLN冻干粉。以冻干粉的外观形态、色泽、再分散性为主要评价指标[8],评分标准见表1,综合评分结果见表2。最终优选出3%海藻糖为Cur-SLN冻干保护剂。以此条件所得冻干粉外形致密、饱满、不回缩塌陷,为色泽均匀的淡黄色粉末,30 s可完全溶解。

表1 Cur-SLN冻干粉的指标评分标准
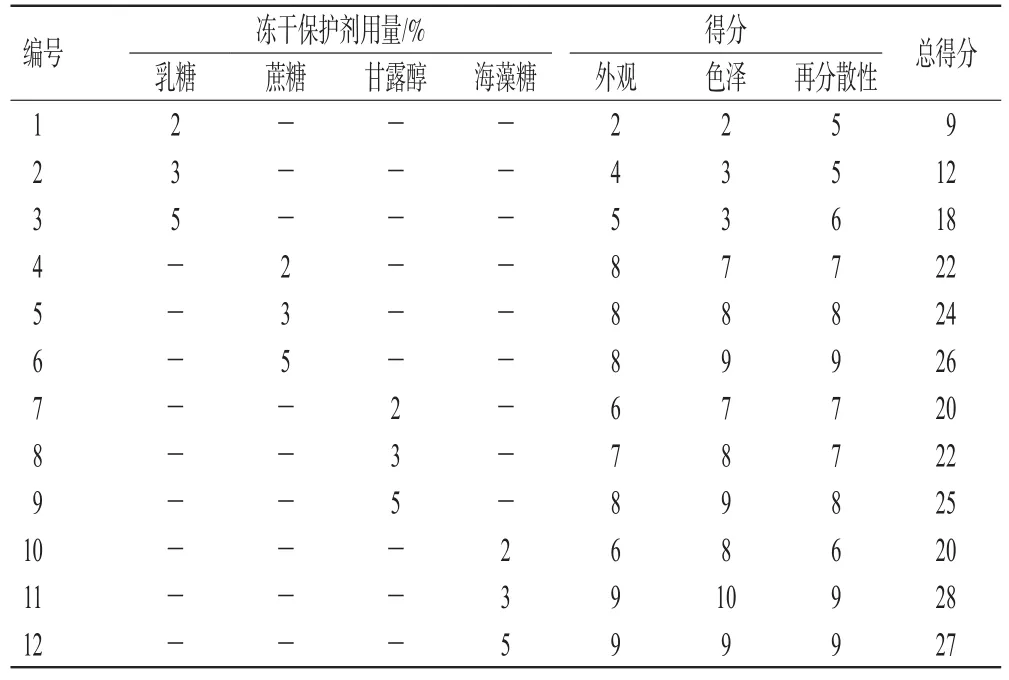
表2 不同冻干保护剂用量制备的Cur-SLN冻干粉质量评分结果
2.3.2 优选冻干工艺所制Cur-SLN冻干粉的理化性质评价 取Cur-SLN冻干粉,测定样品冻干前和冻干后再分散混悬液的粒径、多分散性指数和包封率(%)[7];采用透射电镜观察Cur-SLN冻干粉的形态。结果见表3和图1。

图1 Cur-SLN冻干粉再分散后透射电镜图
表3 样品冻干前和再分散后的粒径、多分散系数及包封率(±s,n=3)

表3 样品冻干前和再分散后的粒径、多分散系数及包封率(±s,n=3)
时间点冻干前再分散后平均粒径/nm 19.13±0.11 21.69±0.95多分散性指数0.14±0.26 0.17±0.87 Zeta电位/mV-21.61±0.10-22.31±0.23包封率/%89.62±0.71 88.51±1.26
结果显示,采用优选工艺制备的Cur-SLN冻干粉经再分散后,其粒径、多分散性指数及包封率与冻干前略有变化,但其形态仍呈类球形或椭圆形,粒度圆整,表明冻干工艺不破坏Cur-SLN的结构。
2.3.3 Cur-SLN-FL的制备 分别精密称量FL及Cur-SLN冻干粉适量,两者以质量比2∶1、1∶1、1∶2,过200目筛混合均匀后,按2020年版《中国药典》(四部)通则0951项下方法[9],采用装置1(双级撞击器)测定各部位的药物沉积率[4],实验重复3次,结果见表4。
表4 不同混合比例对Cur-SLN-FL各部位沉积率的影响(±s,n=3,%)

表4 不同混合比例对Cur-SLN-FL各部位沉积率的影响(±s,n=3,%)
FL和Cur-SLN冻干粉的质量比2∶1 1∶1 1∶2模拟喉部25.19±1.08 21.03±0.79 16.12±1.28一级分布33.62±1.45 38.23±0.49 35.16±0.61二级分布29.34±0.51 32.76±2.61 40.92±0.02
由表4可见,Cur-SLN-FL的二级分布沉积率为(40.92±0.02)%,相比课题组前期报道的以吸入乳糖作为载体的Cur-SLN-DPI(28.73%)[4],具有更高的药物二级分布,推测可能是由于FL几何粒径虽较大,但密度较小,使FL空气动力学粒径较小,可在细支气管中获得更高的沉积率。随着FL用量的减少,药物的二级分布率沉积率逐渐提高,而模拟喉部的药物沉积率逐渐降低。当FL与Cur-SLN冻干粉比例为1∶2时,药物具有较好的二级分布。采用上述优化工艺制备3批Cur-SLN-FL,并同法制备FL装载的空白固体脂质纳米粒吸入微粉(空白SLN-FL),用于后续理化性质的评价。
2.4 Cur-SLN-FL的理化性质表征
2.4.1 形态学分析 分别取Cur-SLN冻干粉、Cur-SLNFL和FL各适量,涂布在双面导电胶上,再将导电胶固定于金属板上,喷金后在扫描电镜下观察样品的形态[5],结果见图2。

图2 Cur-SLN冻干粉、Cur-SLN-FL和FL的形貌特征
结果显示,Cur-SLN-FL呈现花形外貌,FL作为干粉吸入剂的载体在与药物冻干粉混合的时候,将其吸附于其表面,起到了对Cur-SLN冻干粉表面形态的修饰作用,增加了粗糙度。
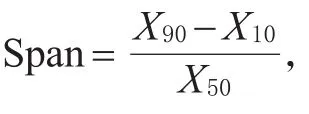
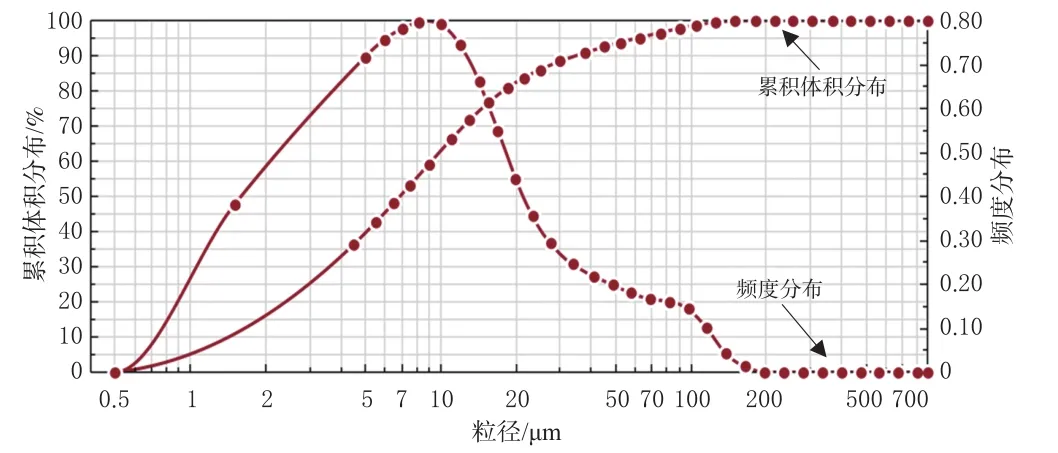
图3 Cur-SLN-FL的粒径分布图
结果,Cur-SLN-FL的平均粒径为(4.95±0.57)μm,De为(7.66±0.76)μm,Span为 2.39±0.41,MMAD 为(4.03±0.40)μm(MMAD在1~5 μm的范围内时,适合肺部吸入微粒的要求[10])。
2.4.3 临界相对湿度的考察 精密称取Cur-SLN-FL适量,将其均匀铺于预先精密称定质量的具塞玻璃称量瓶底部,置于不同相对湿度(relative humidity,RH)的恒温恒湿箱内,72 h后取出,精密称量,计算吸湿率。以吸湿率为纵坐标、RH为横坐标作图,得吸湿平衡曲线[9,11]。结果如图4所示。当RH大于52.89%时,Cur-SLN-FL的吸湿增重明显上升,故本品的临界相对湿度约为54%。这可能与FL的α/β复合结晶态有关,相较吸入乳糖,FL更易溶于水,因此在样品的储存中,尤其是高温潮湿的季节,样品应置于避光的干燥器内。

图4 不同RH下Cur-SLN-FL的吸湿百分率(25 ℃)
2.4.4 排空率的测定 取10粒装有Cur-SLN-FL的胶囊,精密称定其质量(m1);然后将胶囊置于Aerolizer®吸入装置内,以(60±5)L/min的气流抽吸4次、每次1.5 s,称定其质量(m2);用小刷拭净胶囊内的残留内容物,再称定囊壳质量(m3)。计算每粒胶囊的排空率:排空率(%)=(m1-m2)/(m1-m3)×100%[4]。试验重复3次,结果得Cur-SLN-FL的排空率为(90.34±1.21)%。

经计算,Cur-SLN-FL在收集盘2~7级中的FPF为(47.5±0.7)%,明显高于原有制剂 Cur-SLN-DPI的(25.8±0.6)%和Cur原料药的(9.8±0.4)%。普通的Cur原料药无法满足肺部吸入制剂的要求,而原有制剂Cur-SLN-DPI有效部位沉积率虽符合《中国药典》的要求[9],但其在收集盘3~5级的比例明显低于Cur-SLN-FL。结果见图5。
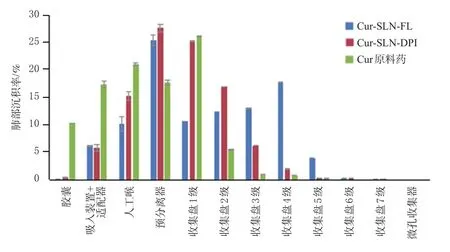
图5 空气动力学实验的各层级FPF的测定结果(±s,n=3,%%)
Cur-SLN-FL实测MMAD为(4.33±0.08)μm,通常认为MMAD在0.5~5 μm的微粒可被肺部有效吸收,而4~5 μm的颗粒可用来递送治疗呼吸系统疾病的药物[10],可见本研究制备的Cur-SLN-FL符合相关要求。
2.5 Cur-SLN-FL体外抑凋亡作用研究
2.5.1 统计学分析 采用GraphPad Prism 5.0软件和SPSS Statistics软件进行统计分析。计量资料以±s表示,各组与模型组行方差分析。检验水准α=0.05。
2.5.2 细胞培养 将BEAS-2B细胞培养于含10%胎牛血清的DMEM培养液中,置于37 ℃、5% CO2的培养箱内,贴壁生长,消化、传代[12]。
2.5.3 空白SLN-FL浸提液的制备 在无菌条件下,将空白SLN-FL加入细胞培养液,在37 ℃下浸提24 h,制成不同质量浓度的空白SLN-FL浸提液。
2.5.4 Cur-SLN-FL对BEAS-2B细胞的毒性检测 用含10%胎牛血清的DMEM培养液制备BEAS-2B细胞悬液。将BEAS-2B细胞以1.0×104个/孔接种于96孔板内,置于培养箱内培养(24±1)h,待细胞完全贴壁后,吸取培养液,用PBS洗涤1次。换新鲜无血清培养液,将各培养孔分为样品对照孔(未经处理的对照细胞孔)、样品最大酶活性对照孔(未经处理的阳性细胞孔)和处理样品孔(Cur-SLN-FL和空白SLN-FL处理的细胞孔)。处理样品孔每孔分别加入100 μL不同质量浓度(16、8、4、2、1 mg/mL)的空白SLN-FL浸提液和用培养液溶解的不同质量浓度(16、8、4、2、1 mg/mL)Cur-SLN-FL溶液进行处理,质量浓度设置参照课题组预试验结果。继续培养2 h后,将细胞培养板按400 r/min离心5 min,分别取各孔的上清液120 μL加入到新的96孔板相应孔内,每孔再加60 μL LDH检测工作液,混匀,室温避光孵育30 min后,于490 nm处测定吸光度,并计算细胞毒性。细胞毒性(%)=(处理样品孔吸光度-样品对照孔吸光度)/(样品最大酶活性对照孔吸光度-样品对照孔吸光度)×100%。
结果显示,经Cur-SLN-FL处理2 h后,BEAS-2B细胞的增殖受到抑制,细胞的LDH释放量随着Cur-SLNFL质量浓度的增加而增加,且具有量效关系。经计算,Cur-SLN-FL的半数致死量(LD50)为5.809 mg/mL。而空白SLN-FL浸提液按照《GB/T 16886.5-2017医疗器械生物学评价第5部分:体外细胞毒性试验》规定的细胞毒性检测方法进行检测,其LD50为3.908 mg/mL。
2.5.5 Cur-SLN-FL对BEAS-2B细胞早期凋亡的影响 采用Annexin Ⅴ/PI双染法进行检测。将BEAS-2B细胞悬液接种于6孔板,待细胞贴壁后将其分为Sham组、Model组、Cur-SLN-FL-H组(0.25 mg/mL)、Cur-SLNFL-L组(0.125 mg/mL)和Budesonide组(2.5 μg/mL),参考细胞毒性实验结果和文献[12]设置给药剂量。除Sham组外,各组均加入含LPS(50 μg/mL)的培养液培养24 h后,Sham组、Model组加入同体积的培养液,给药组分别加入对应剂量的药液,继续培养24 h后消化,加入含10%胎牛血清的DMEM培养基,中和胰酶,终止消化,反复吹打使细胞脱落;以2 000 r/min离心5 min后,弃上清液,用PBS洗涤2次;再次离心5 min,弃上清液,采用PBS悬浮细胞,加入Annexin Ⅴ染色液混匀后再加入PI染液混匀,室温避光染色15 min,用流式细胞仪检测[13]。结果显示,Sham组仅有少数细胞凋亡;与Sham组比较,Model组细胞凋亡率显著升高(P<0.05);与Model组比较,Cur-SLN-FL处理组的细胞凋亡率均显著降低(P<0.05),提示Cur-SLN-FL处理可减轻由LPS引起的细胞凋亡。结果见表5和图6。
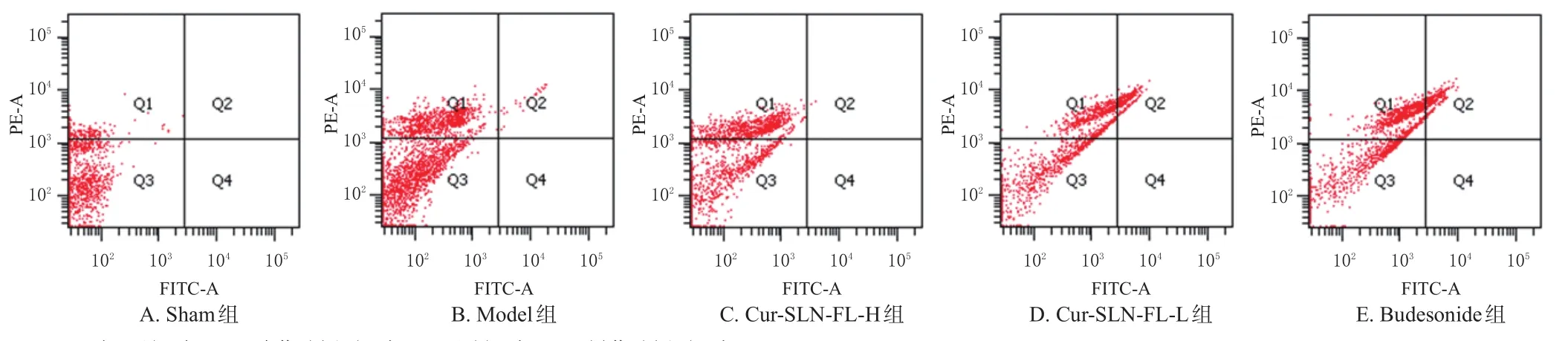
图6 Cur-SLN-FL对BEAS-2B细胞早期凋亡率影响的流式细胞图
表5 Cur-SLN-FL对BEAS-2B细胞早期凋亡率及线粒体膜电位的影响(±s,n=5)
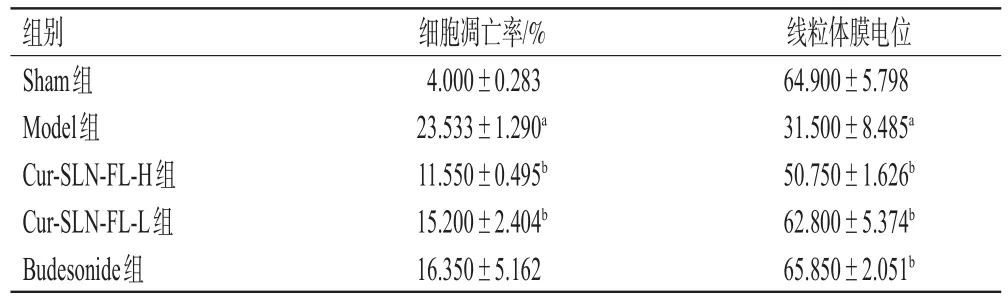
表5 Cur-SLN-FL对BEAS-2B细胞早期凋亡率及线粒体膜电位的影响(±s,n=5)
a:与Sham组比较,P<0.05;b:与Model组比较,P<0.05
组别Sham组Model组Cur-SLN-FL-H组Cur-SLN-FL-L组Budesonide组线粒体膜电位64.900±5.798 31.500±8.485a 50.750±1.626b 62.800±5.374b 65.850±2.051b细胞凋亡率/%4.000±0.283 23.533±1.290a 11.550±0.495b 15.200±2.404b 16.350±5.162
2.5.6 Cur-SLN-FL对BEAS-2B细胞线粒体膜电位的影响 采用JC-1试剂盒检测线粒体膜电位。将BEAS-2B细胞悬液接种于6孔板中,贴壁后按“2.5.5”项下分组处理24 h后,收集细胞,用PBS洗涤2次,以2 000 r/min离心5 min。按说明书配制JC-1荧光探针检测工作液,每孔细胞用500 μL工作液悬浮均匀,于37 ℃、5%CO2避光染色20 min。经2 000 r/min离心5 min后,弃去上清液,收集细胞,用PBS洗涤2次,每孔用500 μL稀释后的培养缓冲液重悬细胞后,用流式细胞仪检测[13]。结果,与Sham组比较,Model组的线粒体膜电位显著下降(P<0.05),而Cur-SLN-FL处理组和Budesonide组的线粒体膜电位较Model组显著升高(P<0.05),表明Cur-SLNFL可以通过调节线粒体膜电位减轻LPS引起的BEAS-2B细胞凋亡。结果见表5和图7。

图7 Cur-SLN-FL对BEAS-2B细胞线粒体膜电位影响的流式细胞图
3 讨论
载体型干粉吸入剂经口吸入后,首先在呼吸道气流的作用下,微粉由静止变为流动状态;然后继续在气流的作用下,解聚成自由粒子,最终根据其空气动力学粒径的不同,沉积在肺部的不同位置。本课题组前期制备的Cur-SLN-DPI是将Cur-SLN吸附在一水合乳糖颗粒上,通过分子吸附作用将药物分子固定。因载体乳糖和第三组分乳糖的稀释剂粒径均大于5 μm,限制了Cur-SLN-DPI进入细支气管的量,其FPF仅为(25.8±0.6)%[4]。而本研究采用FL对原有载体乳糖和第三组分乳糖进行替换后,FPF提高至(47.5±0.7)%。由于溶解过慢可能会使得吸入颗粒被纤毛清除,降低治疗效果[14],而本研究制备的FL相比普通的吸入乳糖具有速溶的特性[5-6],进入细支气管后可迅速溶解,释放出Cur-SLN,解决了干粉吸入剂脱吸附困难的问题。
气道上皮细胞是呼吸系统的重要组成部分,是人体防止有毒颗粒、气体和病原体侵入的第一道防御屏障[15]。气道上皮细胞的过度凋亡通常被认为是气道损伤的主要机制之一,线粒体是细胞凋亡的主要途径之一,线粒体膜电位是目前最常用的反映线粒体通透性的指标之一,其下降越多表明细胞凋亡程度越深[13]。本研究制备的Cur-SLN-FL针对肺部吸入给药的特点,以BEAS-2B细胞为靶细胞,进行了细胞凋亡率及线粒体膜电位研究。结果显示,Cur-SLN-FL可有效削弱由LPS引起的BEAS-2B细胞的过度凋亡,且该作用与调节线粒体损伤有关。
综上所述,本研究采用FL装载Cur-SLN制成Cur-SLN-FL,操作简便易行,有效改善了该制剂的体外肺部有效部分沉积率;同时,Cur-SLN-FL可通过调节线粒体膜电位明显改善LPS诱导的BEAS-2B细胞凋亡,为Cur等难溶性药物应用于慢性阻塞性肺疾病呼吸系统疾病研究提供了一种新的思路。但本研究仅考察了Cur-SLN-FL在体外对LPS诱导BEAS-2B细胞损伤的作用,后续可考虑对其吸入给药后改善慢性阻塞性肺疾病模型动物肺部炎症的体内药效及作用机制进行深入研究。

