基于粪便代谢组学的麻黄细辛附子汤毒性作用机制研究 Δ
王耀东 ,李灿 ,杨勇 ,孙启慧 ,容蓉 (.山东中医药大学药学院,济南 50355;.山东中医药大学实验中心,济南 50355)
麻黄细辛附子汤(Mahuang xixin fuzi decoction,MXF)始见于东汉张仲景的《伤寒论》,组方严谨、短小精练,是治疗少阴阳虚兼外感病证的经典方剂[1],在临床应用广泛。现代药理研究发现,MXF对感染普通流感的小鼠和肾阳虚外感证模型小鼠均具有良好的药效作用[2-3]。随着中药在全球的广泛应用,有关中药不良反应的报道越来越多。研究指出,MXF组方中麻黄、细辛、附子3味药均为有毒中药[4]。麻黄中含有多种苯丙胺类生物碱,其药理、毒理作用与冰毒类毒品较为相似,服用过量会导致中枢神经兴奋、血压升高、紫绀等毒副作用[5]。细辛中的挥发性成分易引起呼吸毒性,大剂量服用会引起肝肾毒性,甚至可导致严重的肾衰竭[6]。附子作为有毒中药,其毒/效成分均为双酯型生物碱[7]。目前对于MXF复方及单味药的毒性作用研究较多,但其主要作用机制有待进一步研究。
代谢组学能够通过多个学科技术的交叉互助,明确不同代谢模式下代谢物的变化,综合评价给药前后生物体液中小分子代谢物轮廓的改变,评价或预测药物疗效和毒性[8]。其中,粪便代谢物作为肠道菌和宿主共代谢的产物,检测粪便中的代谢产物,能够提供丰富的代谢组学信息,反映宿主机体以及肠道菌的状态[9]。本研究选择具有“效-毒二重性”的MXF为研究对象,以粪便代谢组学方法为研究手段,采用超高效液相-质谱联用(UHPLC-QE/MS)技术研究低、中、高剂量MXF灌胃正常小鼠后,小鼠粪便中内源性代谢物的变化,以期从微观角度阐释MXF对小鼠的毒性作用机制,为MXF的临床安全和规范化用药提供依据。
1 材料
1.1 主要仪器
本研究所用的主要仪器有Ultimate 3000-Q-Exactive型超高效液相-四极杆-傅里叶变换质谱仪(美国Thermo Fisher Scientific公司),DW-HL668型超低温冰箱(中科美菱低温科技股份有限公司),DXL-XS型小鼠代谢笼(苏州市冯氏实验动物设备有限公司),NJ 08818型涡旋仪(美国SI公司),ZIL-2型小鼠自主活动仪(上海欣曼科教设备有限公司),01193-YP601N型电子天平(上海精密科学仪器有限公司),LabMaster-CaloSys型动物代谢测量分析系统(德国TSE公司)。
1.2 主要药品与试剂
麻黄、细辛饮片(批号分别为401003136P、401002360P)均购自北京同仁堂(亳州)饮片责任有限公司,炒附片(批号191201)购自四川江油中坝附子科技发展有限公司,以上饮片经山东中医药大学药学院李峰教授鉴定均为真品。L-2-氯苯丙氨酸购自上海源叶生物科技有限公司;乙腈、甲酸为色谱纯,水为蒸馏水。
1.3 动物
48只SPF级雄性BABL/C小鼠,体质量为(20±2)g,由济南朋悦实验动物繁育有限公司提供,动物生产许可证号为SCXK(鲁)2021-1007,动物使用许可证号为SYXK(鲁)20170022。本实验方案经山东中医药大学伦理委员会批准,批准号为SDUTCM2021030320。
2 方法
2.1 MXF的制备
参照文献[10]的煎煮方法进行制备:取麻黄15 g(去节),加蒸馏水1 000 mL浸泡30 min,大火煮沸至一定量后除去泡沫,加入细辛15 g和炒附片7.5 g,小火使其稍微沸腾至300 mL。药液冷冻干燥后加入蒸馏水,用50 mL容量瓶定容,获得质量浓度为0.75 g/mL的浓缩药液(以生药量计,下同)。
2.2 动物分组及给药
48只小鼠适应性喂养3 d后,随机分为空白组和MXF低、中、高剂量组(给药剂量分别为11.262、33.786、45.050 g/kg,分别为10、30、40倍人体临床剂量),每组12只。小鼠按照20 mL/kg灌胃,空白组小鼠灌胃等体积生理盐水,其余各组分别灌胃相应药物,每日1次,连续灌胃7 d。收集小鼠末次灌胃后12 h的粪便样品,置于-80 ℃冰箱保存备用。
2.3 毒性作用指标测定
实验期间每天测量小鼠体质量、肛温,并观察小鼠生存情况。末次灌胃后,处死小鼠,取各组小鼠心、肝、脾、肺等脏器,计算脏器指数(脏器指数=脏器质量/体质量×100)。测定各组小鼠血清中的心肌功能指标:肌酸激酶(creatine kinase,CK)、肌酸激酶同工酶(creatine kinase isoenzyme,CK-MB)、CK-MB/CK比值、α-羟丁酸脱氢酶(α-hydroxybutyrate dehydrogenase,α-HBDH)、乳酸脱氢酶(lactate dehydrogenase,LDH);肝功能指标:丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)、AST/ALT比值和碱性磷酸酶(alkaline phosphatase,ALP);肾功能指标:尿素、肌酐、胱抑素C(cystatin C,CYS-C)等。
2.4 小鼠粪便代谢组学研究
2.4.1 溶液的制备 (1)内标溶液:精密称取L-2-氯苯丙氨酸3.20 mg,加甲醇定容至10 mL,得到320 μg/mL的母液。吸取母液100 μL,加甲醇定容至10 mL,得到质量浓度为3.20 μg/mL的内标溶液。(2)供试品溶液:称取200 mg粪便样本,加入600 μL甲醇和20 μL内标溶液,涡旋10 min混合,以12 000 r/min离心20 min,吸取300 μL上清液;重复上述操作1次,合并上清液,作为供试品溶液。(3)质量控制(QC)样本溶液:从空白组和MXF低、中、高剂量组每个粪便样本中称取相同质量的粪便样品,置于同一容器中,混合均匀,按照“2.4.1(2)”项下供试品溶液制备方法制备QC样本溶液。
2.4.2 色谱条件与质谱条件 (1)色谱条件:色谱柱为HALO-C18(2.1 mm×100 mm,2.7 μm),以0.05%甲酸溶液为流动相A、0.05%甲酸乙腈溶液为流动相B进行梯度洗脱(0~5 min,5%B→10%B;5~15 min,10%B→40%B;15~25 min,40%B→98%B;25~26 min,98%B→100%B;26~28 min,100%B;28~29 min,100%B→5%B;29~32 min,5%B),柱温为30 °C,进样量为5 μL,流速为0.3 mL/min。(2)质谱条件:采用正、负离子扫描模式进行检测。离子源为电喷雾电离源(ESI),毛细管电压为3.5 kV,毛细管温度为350 ℃,鞘气为45 arb,辅助气为10 arb,源内温度为350 ℃,质谱采集范围为m/z 50~1 500,分辨率为70 000。
2.4.3 样本检测 为保障样本数据采集的重现性与质谱仪器的稳定性,在检测序列中每6个样本添加1个QC样本。将正、负离子模式下采集的所有样本数据连同QC样本数据进行主成分分析(principal component analysis,PCA),判断仪器的稳定性。
2.5 数据处理
2.5.1 统计学方法 毒性作用指标采用SPSS 20.0软件进行单因素方差分析,数据以±s表示。检验水准α=0.05。采用GraphPad Prism 9.0软件进行小鼠生存率分析。
2.5.2 粪便代谢组学数据处理方法 粪便代谢组学原始数据转换后首先采用R语言软件进行色谱峰识别、对齐等处理,参数设定使用默认数值,并采用修正80%规则去除缺失值,得到一个保留时间、m/z和峰强度的三维数据矩阵;将得到的数据导入SIMCA-P 17.0软件进行数据的降维和标准化处理,采用无监督的PCA和有监督的正交偏最小二乘法-判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)对数据进行分析,以投影变量重要性(variable importance for the projection,VIP)值>1、方差分析中P<0.05、倍数变化(fold change,FC)>1为条件,筛选得到潜在生物标志物。
2.5.3 生物标志物鉴定及代谢通路分析 将“2.5.2”项下获得的潜在生物标志物的保留时间、精确m/z以及同位素比例等信息输入在线数据库METLIN(https://metlin.scripps.edu)、HMDB(https://hmdb.ca)进行标志物的检索和鉴定,使用KEGG数据库(https://kegg.jp)进行代谢通路分析。
3 结果
3.1 小鼠体质量、肛温和生存率的测定结果
灌胃7 d内,空白组小鼠体质量持续增长,肛温维持在36~39 ℃范围内,相对稳定。与空白组相比,MXF低剂量组小鼠体质量增长缓慢,差异无统计学意义;MXF中剂量组小鼠第3~5天、MXF高剂量组小鼠第2~7天体质量显著低于空白组(P<0.05)。与空白组相比,各给药组小鼠的肛温差异均无统计学意义。给药第2天,MXF中、高剂量组有小鼠死亡,生存率分别为58.33%、50.00%,后续指标检测按代谢组学样本数量的最低要求进行,每组6只。结果见图1和图2。
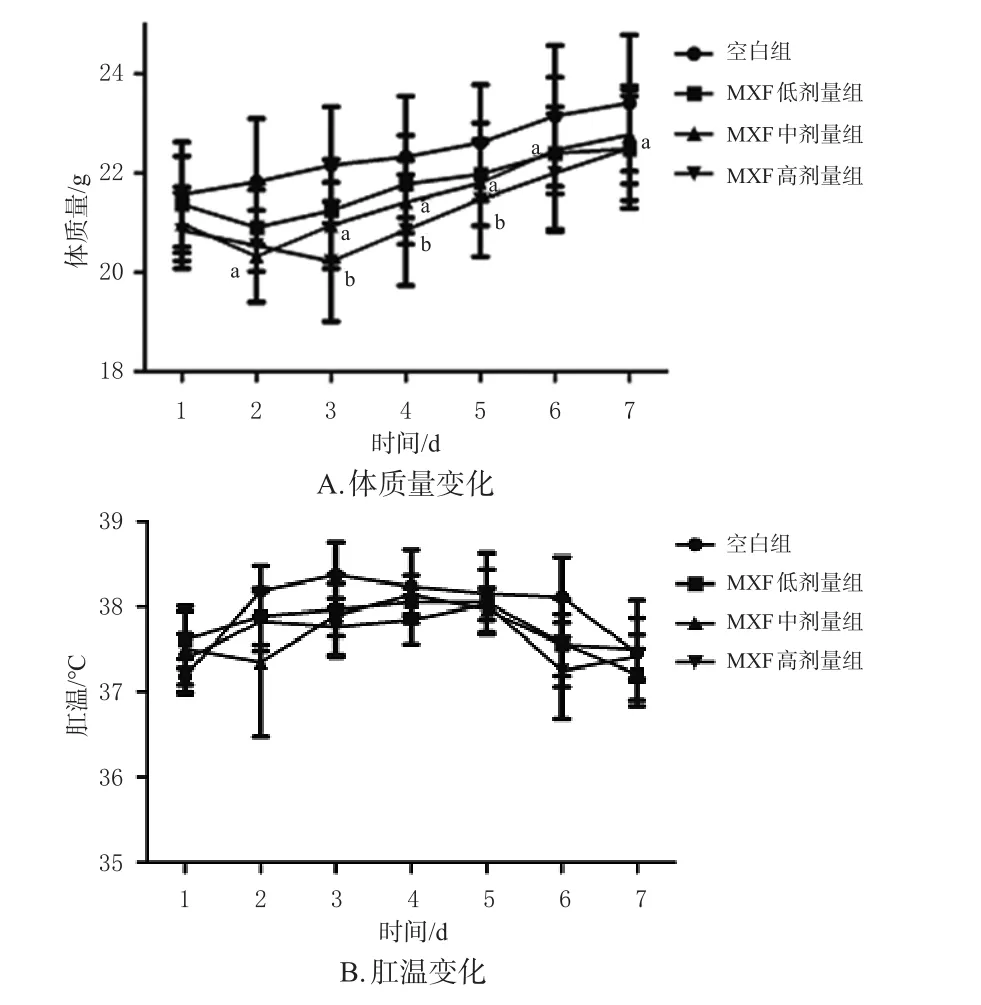
图1 各组小鼠体质量和肛温变化图

图2 各组小鼠生存率变化图
3.2 小鼠脏器指数的检测结果
与空白组相比,各给药组小鼠的心指数、肝指数、肾指数、精囊腺指数差异均无统计学意义;各给药组小鼠的脾指数、肺指数、肾上腺指数均显著升高,胸腺指数显著降低(P<0.05);MXF低、高剂量组小鼠的睾丸指数均显著升高(P<0.05)。结果见表1。
表1 各组小鼠脏器指数的检测结果(±s,n=6)
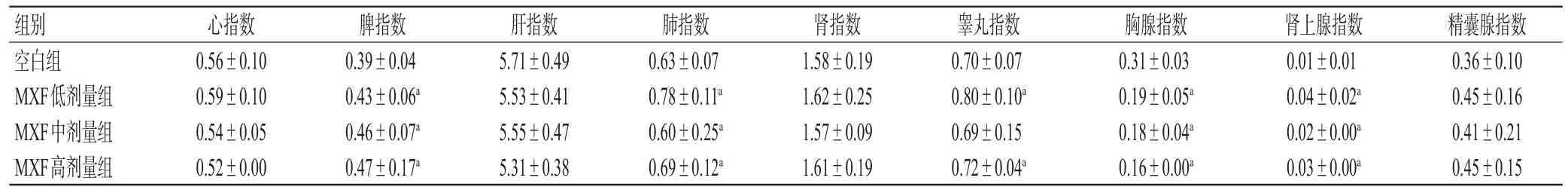
表1 各组小鼠脏器指数的检测结果(±s,n=6)
a:与空白组相比,P<0.05
组别空白组MXF低剂量组MXF中剂量组MXF高剂量组精囊腺指数0.36±0.10 0.45±0.16 0.41±0.21 0.45±0.15心指数0.56±0.10 0.59±0.10 0.54±0.05 0.52±0.00脾指数0.39±0.04 0.43±0.06a 0.46±0.07a 0.47±0.17a肝指数5.71±0.49 5.53±0.41 5.55±0.47 5.31±0.38肺指数0.63±0.07 0.78±0.11a 0.60±0.25a 0.69±0.12a肾指数1.58±0.19 1.62±0.25 1.57±0.09 1.61±0.19睾丸指数0.70±0.07 0.80±0.10a 0.69±0.15 0.72±0.04a胸腺指数0.31±0.03 0.19±0.05a 0.18±0.04a 0.16±0.00a肾上腺指数0.01±0.01 0.04±0.02a 0.02±0.00a 0.03±0.00a
3.3 血清生化指标检测结果
与空白组相比,各给药组小鼠的心肌功能指标CK水平显著升高(P<0.05),MXF低剂量组的CK-MB/CK比值显著降低(P<0.05);MXF中剂量组的心肌功能指标α-HBDH、LDH水平均显著升高(P<0.05),肝功能指标ALP水平显著降低(P<0.05);MXF中、高剂量组的肾功能指标尿素水平显著升高(P<0.05),CYS-C水平显著降低(P<0.05)。结果见表2~表4。
表2 各组小鼠心肌功能指标检测结果(±s,n=6)
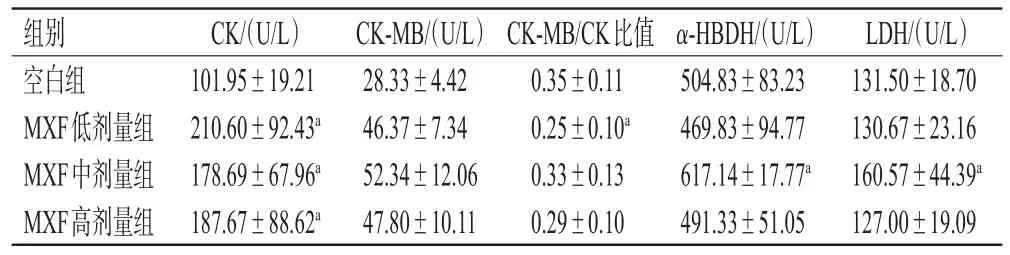
表2 各组小鼠心肌功能指标检测结果(±s,n=6)
a:与空白组相比,P<0.05
组别空白组MXF低剂量组MXF中剂量组MXF高剂量组α-HBDH/(U/L)504.83±83.23 469.83±94.77 617.14±17.77a 491.33±51.05 CK/(U/L)101.95±19.21 210.60±92.43a 178.69±67.96a 187.67±88.62a CK-MB/(U/L)28.33±4.42 46.37±7.34 52.34±12.06 47.80±10.11 CK-MB/CK比值0.35±0.11 0.25±0.10a 0.33±0.13 0.29±0.10 LDH/(U/L)131.50±18.70 130.67±23.16 160.57±44.39a 127.00±19.09
表4 各组小鼠肾功能指标检测结果(±s,n=6)

表4 各组小鼠肾功能指标检测结果(±s,n=6)
a:与空白组相比,P<0.05
组别空白组MXF低剂量组MXF中剂量组MXF高剂量组CYS-C/(µmol/L)0.25±0.04 0.21±0.04 0.19±0.04a 0.20±0.02a尿素/(mmol/L)7.04±0.81 7.16±1.16 8.85±1.53a 10.54±1.47a肌酐/(µmol/L)12.18±0.80 11.67±0.78 12.00±1.15 11.33±1.63
表3 各组小鼠肝功能指标检测结果(±s,n=6)

表3 各组小鼠肝功能指标检测结果(±s,n=6)
a:与空白组相比,P<0.05
组别空白组MXF低剂量组MXF中剂量组MXF高剂量组ALT/(U/L)23.33±6.17 30.67±4.62 28.86±5.27 30.33±6.50 AST/(U/L)86.83±9.81 96.17±18.56 97.14±17.31 91.67±25.47 AST/ALT比值3.06±0.62 3.20±0.78 3.40±0.57 3.03±0.57 ALP/(U/L)96.42±11.56 87.42±16.89 83.14±6.59a 84.67±19.22
3.4 粪便代谢组学结果
3.4.1 样本质量控制 将正、负离子模式下采集的所有样本数据连同QC样本数据进行PCA,其中QC样本聚集良好,说明仪器性能良好、数据质量可信,结果见图3。
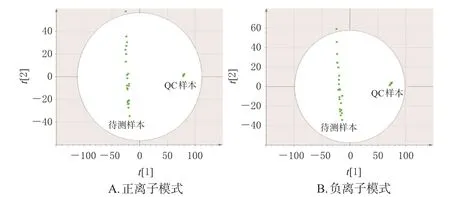
图3 正、负离子模式各组小鼠粪便QC样本PCA图
3.4.2 粪便样品分析 不同组小鼠粪便样品代谢组学的正、负离子模式下各组样品的总离子流(TIC)叠加图见图4。结果显示,各组样本分离度良好。
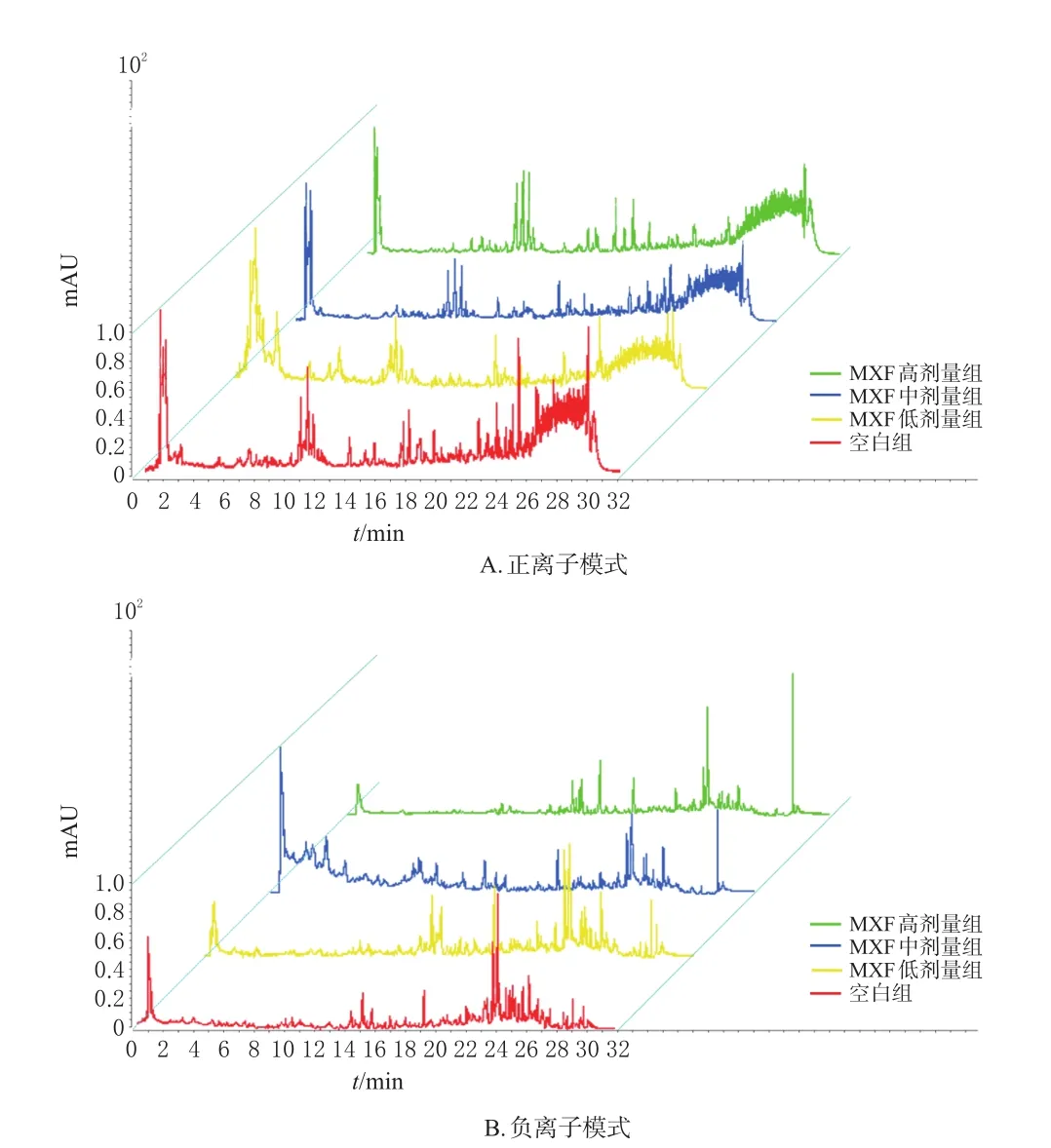
图4 正、负离子模式各组小鼠粪便样品TIC叠加图
3.4.3 数据模式识别分析 数据预处理后,分别进行PCA和OPLS-DA,空白组和MXF低、中、高剂量组可在空间上完全分开,结果见图5。其中模型X轴累积解释率(R2X)、模型累积预测率(Q2)均大于0.5,说明模型预测效果良好。为了防止模型过度拟合,本研究又进行了排列检验各100次,结果正离子模式下模型Y轴累积解释率(R2Y)分别为0.834、0.629、0.789,Q2分别为-0.138、-0.131、-0.025;负离子模式下R2Y分别为0.777、0.653、0.578,Q2分别为-0.262、-0.079 8、-0.102。Q2均为负值表明模型预测能力良好,没有过度拟合的现象[11]。
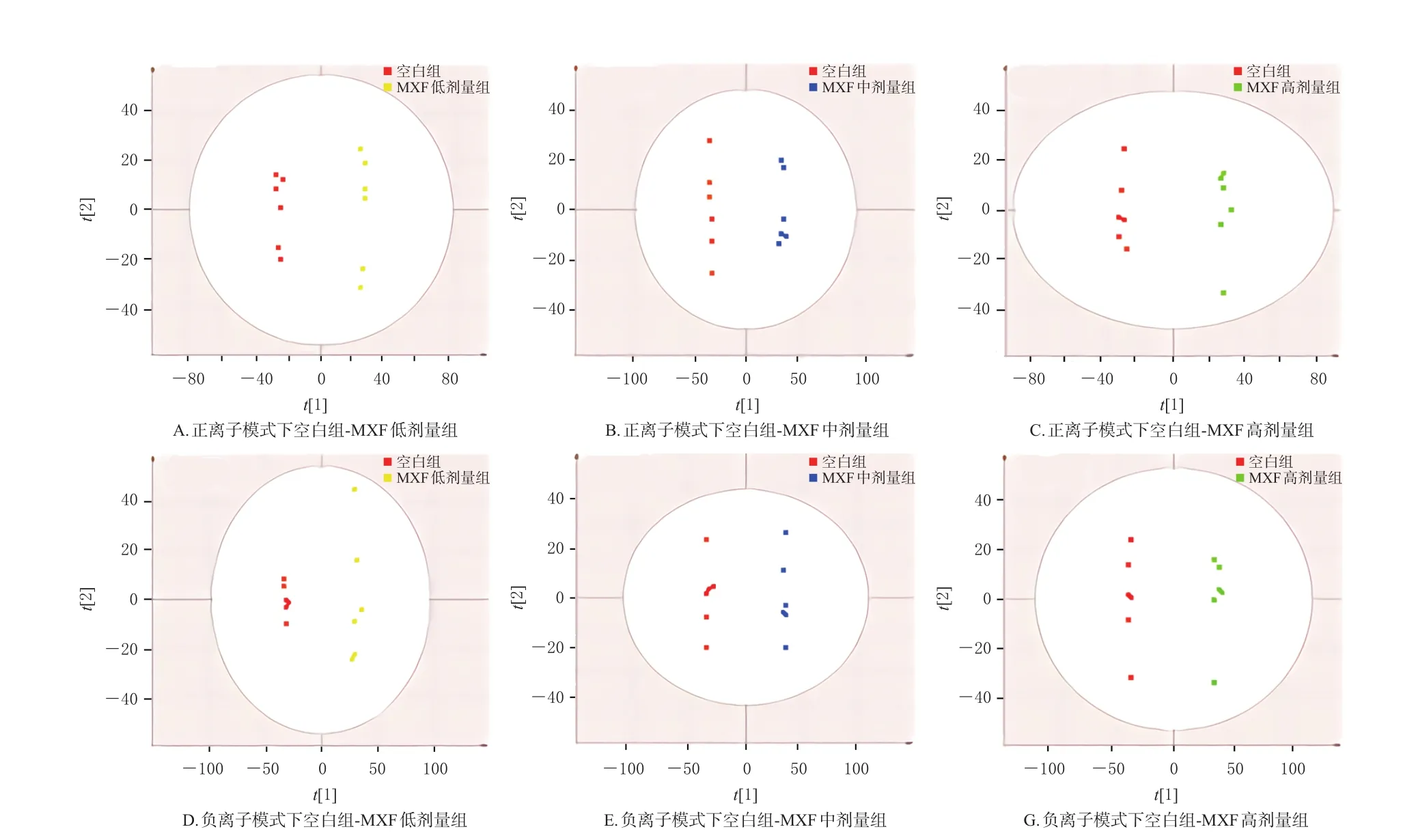
图5 正、负离子模式各组小鼠粪便样品OPLS-DA散点图
3.4.4 潜在生物标志物的筛选和鉴定 通过PCA、OPLS-DA、方差分析和FC分析,最终认为FC>1、P<0.05、VIP值>1的变量为潜在生物标志物。通过标志物的保留时间、精确m/z以及同位素比例等信息,在METLIN、HMDB和KEGG等数据库中进行搜索,结果正、负离子模式下分别鉴定出12、7个潜在生物标志物。结果见表5。
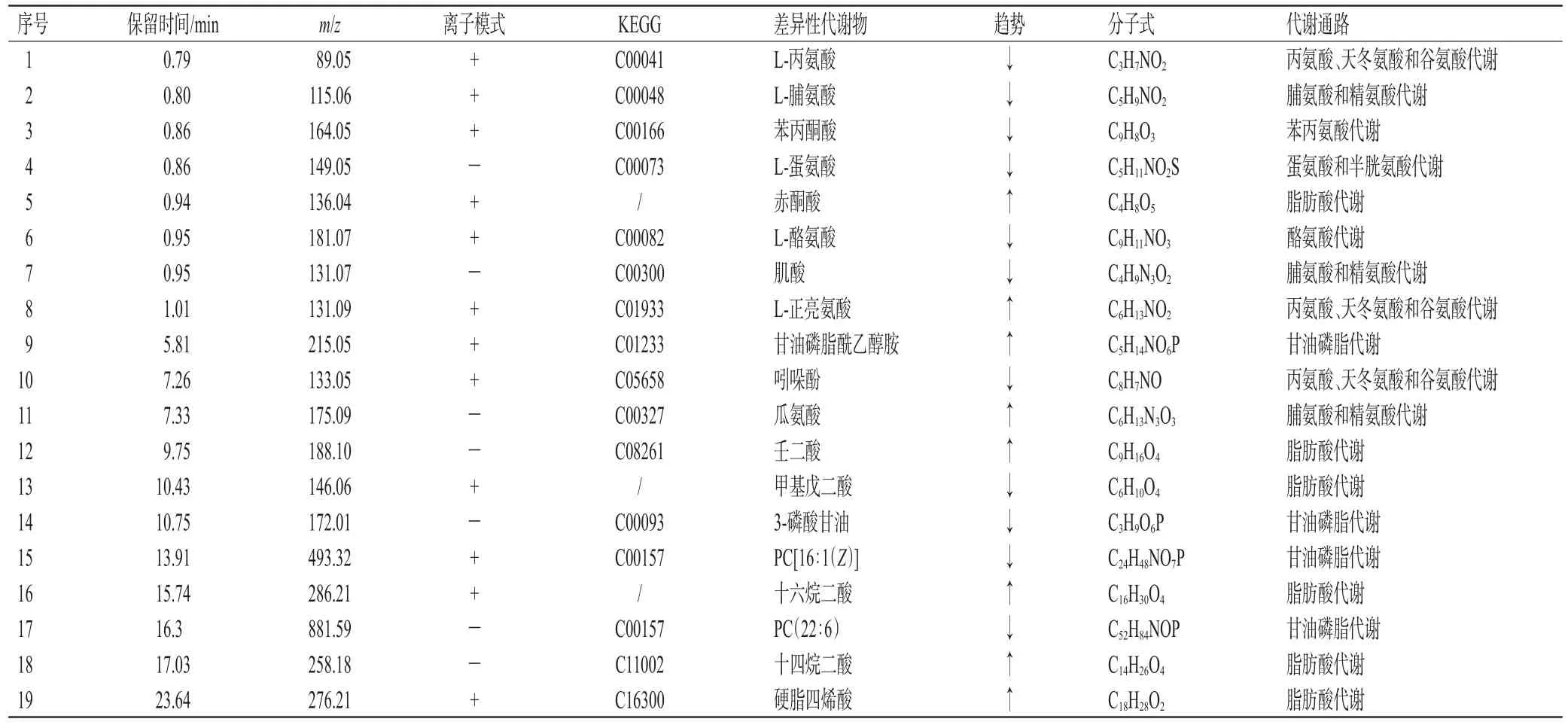
表5 MXF对正常小鼠毒性相关的潜在生物标志物鉴定结果
3.4.5 代谢通路关联分析 利用MetaboAnalyst对19个潜在生物标志物进行通路富集分析和通路拓扑分析,结果见图6。图中圆圈代表了所有匹配的代谢通路,每个圆圈的颜色和大小分别依据代谢通路的P值和重要值界定——当某一条代谢通路的重要值大于0.05时,认为其为潜在靶标代谢通路。结果,共鉴定出6个代谢通路。

图6 MXF对正常小鼠毒性相关潜在生物标志物的代谢通路图
4 讨论
4.1 MXF对小鼠毒性作用指标的影响
毒性作用指标显示,低、中、高剂量MXF对正常小鼠的体质量均产生一定影响,给药剂量越大影响越大,随着给药时间的延长,中剂量组和高剂量组小鼠均出现个体死亡情况。MXF低、高剂量组小鼠的睾丸指数均显著升高,MXF低、中、高剂量组的脾指数、肺指数和肾上腺指数均显著升高,胸腺指数均显著降低(P<0.05);MXF低、中、高剂量组的心肌功能指标CK水平显著上升,MXF低剂量组的CK-MB/CK比值显著下降(P<0.05);MXF中剂量组的心肌功能指标α-HBDH、LDH水平均显著升高,肝功能指标ALP水平显著降低(P<0.05);MXF中、高剂量组的肾功能指标尿素水平显著上升,CYS-C水平则显著下降(P<0.05)。以上结果表明,MXF给药达到一定剂量后会对小鼠心脏、肝脏、肾脏等产生一定的毒副作用,严重的会导致小鼠死亡。
4.2 MXF对小鼠的毒性作用机制
粪便代谢组学研究发现,MXF低、中、高剂量组氨基酸代谢通路中L-丙氨酸、L-脯氨酸、苯丙酮酸、L-蛋氨酸、L-酪氨酸、肌酸、吲哚酚含量均显著下降。这些氨基酸类物质与机体共生菌关系密切,是机体-肠菌的共同代谢产物[12],在机体的炎症反应、免疫反应以及三羧酸循环过程中发挥着重要作用[13-14]。在MXF诱导的毒性模型中,小鼠粪便样本中PC含量显著下降(表5)。PC是磷脂家族成员,其在肠黏膜上分布最为广泛。有报道称,在炎症介导的肠黏膜中PC水平显著下降,增加PC可提高黏膜PC浓度,从而改善肠道炎症状态[15]。脂肪酸类物质能够为肠道细菌的生长和繁殖提供所需的环境和营养物质,尤其是丁酸[16]。本研究发现,MXF低、中、高剂量组中3-磷酸甘油和甲基戊二酸含量均显著下降(表5),推测MXF可能抑制了小鼠肠道菌群活性,使其发挥糖酵解的功能下降。可见,MXF对正常小鼠的毒性作用机制可能与降低了正常小鼠粪便中多种氨基酸、PC、3-磷酸甘油和甲基戊二酸等内源性代谢物相关,进而造成小鼠肠道菌群紊乱,肠道炎症反应发生和机体免疫反应失调。
综上所述,本研究分别从宏观毒性作用指标和微观代谢生物标志物层面探究了MXF对小鼠的毒性作用和可能机制。结果表明,MXF达到一定剂量会对小鼠的体质量、多脏器和血清生化指标产生不良影响,从而表现出一定的毒性作用,其作用机制可能与扰乱机体的肠道菌群代谢、引起炎症反应和造成免疫失调有关。

