草类植物抗病机制研究进展
张彩霞,方香玲
(兰州大学草地农业生态系统国家重点实验室,兰州大学农业农村部草牧业创新重点实验室,兰州大学草地农业科技学院,甘肃 兰州 730020)
草类植物主要包括以紫花苜蓿(Medicago sativa,简称苜蓿)、沙打旺(Astragalus adsurgens)、三叶草(Trifolium)和柱花草(Stylosanthes guianensis)等为主的豆科牧草以及以燕麦(Avena sativa)、黑麦草(Loliumperenne)和草地早熟禾(Poa pratensis)等为主的禾本科牧草。病害一直是草类植物生产和畜牧业发展的主要限制性因素[1-2]。草类植物病害主要包括白粉病、锈病、炭疽病、霜霉病、枯萎病和根腐病等,病害不仅造成产量的损失和品质下降,而且还会导致草地衰退。如白粉病造成燕麦年产量损失5%~10%[3];由根腐病造成的苜蓿产量损失约20%,严重时高达60%[4]。化学防治是病害防治的有效途径,但是对环境污染较为严重且对人畜健康造成巨大威胁,使其应用受到限制。抗病品种的开发利用是防治病害最经济有效和环境友好的方法[5],但是目前缺乏高抗品种资源和抗病基因,无法给抗病育种提供抗性资源。因此研究草类植物的抗病机理,寻找广谱和特异性抗病因子是草类植物可持续生产的重要手段。
植物中存在多种抗性机制,如组织结构抗性和生理生化抗性等。植物细胞表面或内部结构主要通过形成物理障碍阻止病原菌的侵染和进一步扩散;同时植物还产生一些化学物质如皂角苷、酚类化合物等抑制病原菌的定殖[6]。病原菌侵染植物时会产生活性氧(reactive oxygen species,ROS)迸发、过敏反应、植物的解毒作用以及信号传递,植物通过不断产生一系列化合物来抑制病原菌的侵入和定殖,形成抑菌活性物质杀死病原菌以及形成酶类物质消除致病因子[7-8]。此外,在小麦(Triticum aestivum)中发现的第一个基因以及后期提出的“基因对基因”假说为植物的抗病性遗传研究奠定了基础[9]。利用抗病基因(R)介导的抗病性进行抗病育种是控制病害和减少产量损失的绿色防控策略。抗病基因中单基因抗性包括显性、部分显性和隐性等类型,这些基因多数仅仅对一种病原菌和一个小种发挥作用,但是目前由于新病原小种的出现使得抗性不稳定,最终导致抗病基因的作用消失。因此需要不断地筛选抗病种质资源,不断地将新的抗病基因应用到抗病育种中。因此研究草类植物的抗病分子机制是目前进行抗病育种的重要条件。但是目前关于分子抗病机制的研究主要集中在粮食作物小麦和水稻(Oryza sativa)以及模式植物拟南芥(Arabidopsis thaliana)等植物中。对于草类植物的抗病机制研究相对较少,已开展的研究主要集中在少量的豆科和禾本科草类植物对白粉病、锈病、炭疽病、霜霉病、枯萎病和根腐病抗性等方面。本研究主要从植物组织结构、诱导植物抗性等生理生化、抗性基因以及抗性数量性状位点(quantitative trait locus,QTLs)定位等分子方面综述草类植物抗病机制的研究进展。
1 植物组织结构
植物组织结构可以抵抗病原菌的侵入和扩展,其中蜡质层和气孔是植物抵御病原菌侵入的最外层防线。蜡质层主要通过防止植物体内的营养物质外渗,可以有效地抑制病原菌孢子的萌发从而阻止许多潜在病原菌的附着和侵入[10]。如白粉病菌侵染蒺藜苜蓿(Medicago truncatula)时,叶片表面分泌物影响叶片润湿性和通气性等从而影响孢子的萌发和入侵[10]。其次,蜡质层还通过影响植物表面的疏水性,不利于孢子的停滞从而有效地减少病原菌的侵染[11]。气孔是许多叶部病害病原菌入侵植物的主要途径,如锈菌通过气孔并形成附着胞侵入蒺藜苜蓿[12]。组成气孔的保卫细胞是主动识别病原菌的具有高度保守性的结构分子,在真菌侵染植物过程中,植物保卫细胞能够识别几丁质寡糖从而引起气孔关闭,阻止病原真菌的入侵[13]。另一方面,病原真菌在入侵过程中导致几丁质寡糖脱乙酰化变为壳寡糖,表明几丁质脱乙酰化可能是病原真菌抑制气孔关闭的生存策略之一[13]。其次气孔数量和密度等也是主要的抗侵入因素,如沙打旺对黄矮根腐病(Embellisia astragali)、草地早熟禾和黑麦草等对禾草离蠕孢(Bipolaris sorokiniana)引起的叶枯病抗性与气孔密度呈负相关,气孔数量越少的品种抗性越强[14-15]。也有研究表明气孔密度和长度与抗性无关,如关于苜蓿白粉病在田间自然发病条件下以及室内苗期接种的研究,表明不同品种间气孔密度和长度差异不显著[16]。
2 生理生化机制
2.1 活性氧迸发
植物被病原菌侵染的早期防御反应之一是ROS的迅速增加。一方面ROS在植物与病原菌互作中具有直接杀死病原菌抵抗微生物活性的作用[17];也可参与植物细胞壁木质化及富含羟脯氨酸糖蛋白的交联,使细胞壁强化,抵御病原菌的入侵;还可以诱导寄主细胞过敏性坏死,参与植物细胞程序性死亡过程。另一方面ROS可以作为信号分子直接或间接地激活抗性基因和防卫基因表达[18],主要表现为超氧阴离子自由基(O2-)和过氧化氢(H2O2)等含量的突增。病原菌侵染触发过氧化物酶(peroxidase,POD)的产生。超氧化物歧化酶(superoxide dismutase,SOD)是抵御活性氧的第一道防线,能够清除自由基O2-,快速将O2-转化为H2O2和O2,保护细胞免受氧化损害[19]。使用SOD、过氧化氢酶(catalase,CAT)等活性氧清除剂处理则可有效地抑制植物中植保素的合成与积累[20]。H2O2在植物抵抗病原菌侵染过程中发挥重要作用,参与植物的抗病反应过程。如施加外源H2O2可以提高沙打旺对黄矮根腐病病原埃里砖格孢(E.astragali)的抗性,表明H2O2与沙打旺抗病性紧密相关,并通过调节病程相关酶活性来增强沙打旺对黄矮根腐病的抗性,减少侵染率[21]。研究发现H2O2对卵菌根腐丝囊霉(Aphanomyces euteiches)侵染蒺藜苜蓿的体外生长没有不利影响,且对卵菌根腐丝囊霉没有直接的抗菌作用,但是参与根周围细胞壁的强化,防止病原菌侵入维管组织。如通过接种卵菌根腐丝囊霉测定蒺藜苜蓿抗性品系“A17”和易感品系“F83005.5”根部的H2O2、SOD、POD、可溶性酚类和木质素含量,H2O2水平与抗病品种的POD和木质素的产生呈负相关[22]。ROS可以创造不适宜病原菌生存和繁殖的环境,H2O2还刺激细胞壁木质化和糖蛋白交联,从而增强细胞壁抵抗入侵的病原菌。此外,H2O2和一氧化氮(NO)可诱导抗病相关基因的表达,如苯丙氨酸解氨酶(phenylalanine ammonia-lyase,PAL)、病程相关蛋白(pathogenesis-related proteins,PR)和谷胱甘肽S-转移酶(glutathione S-transferase,GST)基因的表达[23]。
2.2 过敏反应(hypersensitive response,HR)和系统获得性抗性(systemic acquired resistance,SAR)
植物在病害胁迫下进化出多种防御机制,过敏反应是一种早期防御反应。当植物受到病原菌侵染时,被侵染部位以局部组织迅速坏死的方式来阻止病害扩散。HR是一种特定类型的程序性细胞死亡。通过产生ROS、细胞壁修饰或抗菌蛋白和化合物来阻止病原菌进一步定殖。如苜蓿对炭疽病的抗性表现为病原菌侵染后强烈的HR,抗病和易感品种在接种炭疽病菌(Colletotrichum trifolii)72 h内,孢子萌发并在表皮细胞壁的连接处形成黑色的附生体。植物通过形成乳突和增厚与附着体接触的细胞壁对接触角质层的穿透钉作出反应。细胞质中酚类化合物的产生以及细胞壁中木质素和木栓质的沉积可能会阻止真菌酶在穿透细胞中扩散,从而保护相邻细胞[24]。在抗炭疽病的蒺藜苜蓿品种“Jemalong 6”中,伴随着ROS和酚类化合物的产生而发生HR,与植物防御、植物抗毒素产生有关的基因上调表达[25]。Kemen等[26]对113份蒺藜苜蓿种质抗性进行鉴定,结果表明在锈菌(Uromyces striatus)侵入后,抗性品种表现出不同程度的细胞死亡反应,一些种质通过发展坏死病变表现出HR。此外,对锈病表现广谱抗性的蒺藜苜蓿品种的调查发现,由于抗性品种在早期可以终止锈菌菌落的生长从而限制吸器的形成,且在一些品种中可以检测到与侵染菌丝相关的宿主细胞坏死而表现出抗性[27]。另一方面,植物表现出可诱导的防御机制来抵御病原菌的侵染。研究表明,当病原菌侵染植物后,SAR的激活依赖于较高水平的内源性水杨酸(salicylic acid,SA)和一系列PR蛋白的激活[28],并伴随着一系列抗病和防卫相关基因的表达,如病程相关蛋白PR1和NPR1。其中PR1蛋白是SA介导的SAR信号转导通路中的关键调节因子,NPR1基因是植物抗病基因表达和系统获得性抗性中的一个关键基因,其表达量的变化会直接影响植物对病原菌的抵抗能力[29]。
2.3 内源激素信号转导途径
水杨酸、茉莉酸(jasmonic acid,JA)和乙烯(ethylene,ET)是植物抗病信号转导途径中重要的信号分子[30]。当植物受到病原菌侵染时,细胞内发生一系列与抗病相关的反应,激活植物的防御能力并且诱导植物产生抗性,JA和ET等信号转导途径在植物抗病中发挥重要作用。SA在活体营养型和半活体营养型病原菌的抗性反应中起着核心作用,其受体主要有NPR1,NPR3和NPR4[31],SA通过诱导植物相关PR蛋白基因PR1、PR2和PR5的产生,PR2具有β-1,3-葡聚糖酶活性,能催化β-1,3-葡聚糖多聚体水解,可对真菌的菌丝壁直接进行攻击,从而使植物产生SAR[32-33]。如喷施SA后接种立枯丝核菌(Rhizoctonia solani)可以使草地早熟禾抗性基因PR1和NPR1的相对表达量显著升高,从而使植物获得抗性[33]。此外,SA可作为胞外信号分子抑制CAT活性而引起H2O2水平上升。一方面,H2O2含量增加导致一系列基因的表达,从而激发植物的抗病性。另一方面,诱导植物抗病性酶活性和促进植物木质素含量增加从而激发植物的抗病性[34]。如外施SA诱导苜蓿体内POD和PAL活性从而提高对霜霉病的抗性,还可以提高匍匐翦股颖(Agrostis stolonifera)对镰刀菌枯萎病和高羊茅(Festuca arundinacea)对弯孢霉叶斑病(Curvularia lunate)的抗性[35-36]。
JA和ET参与植物对腐生病原菌的抗性反应,与SA存在拮抗作用[37]。外源JA作为广谱的生理效应因子和抗病信号转导过程中重要的信号分子,参与植物对病原菌的应答,激发植物的防御系统从而诱导植物的抗病反应达到提高植物抵御病原菌侵入的能力。如外源JA处理苜蓿叶片后,再接种病原菌匍柄霉(Stemphylium botryosum)和茎点霉(Phoma medicaginis),可以诱导苜蓿产生抗病性[38]。茉莉酸甲酯(methyl jasmonate,MeJA)是茉莉酸的衍生物,外施MeJA能诱导植物产生系统抗性,促进PR的积累和植保素的合成,改变抗病相关的防御酶活性。如MeJA可以增强PAL、POD和SOD活性,降低由尖孢镰刀菌(Fusarium oxysporum)引起的苜蓿根腐病的发病率和病情指数[39],增加草地早熟禾叶片SOD、POD、CAT、多酚氧化酶(polyphenol oxidase,PPO)和PAL酶活性,提高活性氧清除的能力,使草地早熟禾的抗病性增强[40]。植物在受到病原菌侵染后乙烯的释放量增加,并且能够调节一些抗病基因或蛋白的表达。Anderson等[41]通过研究乙烯信号通路在防御立枯丝核菌和其他根部病害中的作用发现,立枯丝核菌侵染蒺藜苜蓿后,野生型A17的乙烯和茉莉酮酸酯响应的GCC盒(AGCCGCC)启动子被激活,但在突变型skl中未被激活,同时在野生型A17中乙烯反转录因子(ethyleneresponse factors,ERFs)的B-3亚组表现上调。因此,蒺藜苜蓿对立枯丝核菌的抗性增强主要表现为B-3 ERF,MtERF1-1基因的过表达。
3 植物的解毒作用
植物的解毒作用是病原菌侵染后诱导的主动保卫反应,能够代谢病原菌产生的植物毒素,将毒素转化为无毒物质,降低病原菌的毒性,抑制病原菌在植物组织中的定殖,增强抗病性。此外,植物在解毒过程中产生的羟基化合物可以诱导植物植保素合成,表明植物抗病机制是解毒作用和激发植保素的合成[42]。目前在作物小麦抗赤霉病菌禾谷镰刀菌(Fusarium graminearum)中研究较多[43],在草类植物燕麦和苜蓿中有少量报道。如维多菌素(victorin)是燕麦叶枯病菌(Helminthosporium victoriae)产生的寄主特异性毒素,利用燕麦叶枯病菌产生的维多菌素处理燕麦抗病和感病品种,12 h后感病品种胚芽鞘细胞破裂,停止钝化毒素,但是抗病品种继续保持钝化能力;24 h后抗病品种胚芽鞘中毒素含量仅为感病品种的1/30[44]。此外,苜蓿素(medicarpin)在抗疫霉根腐病中发挥重要作用,可以抑制疫霉菌(Phytophthora medicaginis)的生长[45]。植物抗毒素的产生可能会杀死菌丝产生抗性。有研究发现炭疽病菌侵染苜蓿时,苯丙烷途径中基因的上调与抗性植物中苜蓿素和大蒜素(allicin)的增加有关[46]。
植物产生的初级代谢产物和次级代谢产物在植物防御过程中发挥不同的作用,初级代谢产物作为信号可以诱导植物产生抗性,而次级代谢产物不仅可以作为诱导抗性的信号,还可以作为诱导下游抗菌物质生成的信号,直接参与对病原菌的抑制[47]。植物初级代谢产物有蔗糖、果糖、脯氨酸、谷氨酸和苯丙氨酸等。植物体内的糖可以提供病原菌生长所需的能量,也可通过与病原菌竞争养分使病原菌获得较少的养分,最终导致病原菌适应低营养的状态来提高植物抗病性[48]。脯氨酸、谷氨酸和苯丙氨酸分别通过强化细胞壁、参与多种代谢物合成以及黄酮类物质、细胞壁木质素等一些抗病相关的代谢物前体来提高植物的抗病性[49]。次级代谢产物SA和JA等作为重要的信号物质,激活植物获得系统抗性,增强苯丙酸的代谢物,使木质素在细胞壁上沉积,阻止病原菌的侵入[50]。此外,次级代谢产物异黄酮和紫檀碱生物结合物的抗毒素前体可以提高鹰嘴豆(Cicer arietinum)对尖孢镰刀菌的抗性[51]。
4 抗病基因和数量抗性位点
植物的抗病性主要包括由单个或多个抗病(R)基因控制的质量抗性和数量抗性,其中数量抗性具有广谱性和持久性[52-53]。目前已从大麦(Hordeum vulgare)、水稻和番茄(Lycopersicon esculentum)等重要作物中分离出针对各种病原菌的R基因[54],但是大多数R基因在模式植物拟南芥中研究较为深入。定性显性基因主要对活体营养型和半活体营养型病原菌产生抗性,目前还没有发现完全抗性或质量抗性的基因。随着分子标记技术的发展,利用数量性状位点(QTLs)可以定位多种病害,QTLs定位是借助遗传连锁图谱,利用表型性状与连锁图谱上的分子标记连锁关系,将控制表型的位点定位在该连锁图谱的某个区段内,并对QTLs进行遗传效应的评估[55]。主要集中在水稻、大麦、小麦和玉米(Zea mays)等作物上[56-58]。此外,模式植物蒺藜苜蓿越来越多地用于对卵菌根腐丝囊霉,炭疽病菌和茎点霉等病原菌抗性的研究[22,59-60]。抗病基因是培育抗性品种的基础和关键,但草类植物病害抗性基因研究比较薄弱,仅在抗性基因克隆、定位以及相关分子标记方面有报道。主要集中在苜蓿、蒺藜苜蓿、红三叶(Trifolium pratense)等少数豆科牧草以及燕麦、多年生黑麦草和草地早熟禾等禾本科牧草(表1和表2)。
4.1 抗病基因
4.1.1 豆科牧草抗病基因 豆科牧草抗病基因的研究主要集中在炭疽病、枯萎病、霜霉病和根腐病等病害(表1)。炭疽病病原主要有三叶草炭疽菌、毁灭炭疽菌(Colletotrichum destructivum)和长孢炭疽菌(Colletotrichumgloeosporioides)等[61-62]。苜蓿抗病品种“Arc-1”和“Saranac AR”接种炭疽菌小种1号和小种2号的抗性遗传表明,“Arc-1”对小种1号的抗性受显性基因An1的控制,而“Saranac AR”对小种1号和小种2号的抗性受显性基因An2的控制[63]。以蒺藜苜蓿品种“Jemalong A17”作为抗性亲本进行F2代作图群体,鉴定出对三叶草炭疽菌小种1号具有抗性的单个显性基因RCT1,RCT1是TIR-NBS-LRR家族基因,位于蒺藜苜蓿4号染色体上,对RCT1进行克隆,连锁标记鉴定了5个NLR基因,RCT1是蒺藜苜蓿中对三叶草炭疽菌多个小种都具有抗性的基因,转移到易感紫花苜蓿植物中时赋予广谱炭疽病抗性[64]。因此,RCT1为开发抗炭疽病的苜蓿品种提供了新资源。尽管从抗病蒺藜苜蓿品种“Jemalong A17”中克隆了RCT1的同源物,但它与An1的关系以及在抗病中的作用尚不清楚。利用扩增片段长度多态性(amplified fragment length polymorphism,AFLP)和cDNA末端扩增(rapid amplification of cDNA ends,RACE)分子标记技术从柱花草克隆出抗炭疽病有关的PAL基因,且在抗病品种中的表达量高于感病品种。此外,通过转录组学挖掘出柱花草抗炭疽病苯丙氨酸解氨酶基因SgPAL1,可以通过提高下游次生代谢产物含量增强柱花草对炭疽病的抗性[65]。
通过cDNA扩增片段长度多态性(cDNA-AFLP)、微阵列和随机扩增多态性DNA(random amplified polymorphic DNA,RAPD)方法研究鹰嘴豆与尖孢镰刀菌鹰嘴豆专化型1号小种(F.oxysporumf.sp.Cicerirace 1,Foc1)引起的枯萎病的相互作用。cDNA-AFLP方法确定编码蔗糖合酶、转化酶和β-淀粉酶的基因在抗性相互作用中被诱导,14-3-3基因在易感品种中过度表达,表明存在潜在的营养饥饿,而抗性相互作用可能通过过度诱导糖代谢基因来应对这种糖饥饿,表明糖还充当响应病原菌感知的信号分子。使用cDNA随机扩增多态性(cDNA-RAPD)方法进行鹰嘴豆与Foc 1、2和7号的相互作用研究确定了植物葡糖基转移酶基因在抗性反应中的作用[66]。蒺藜苜蓿接种卵菌根腐丝囊霉后的RIL群体(分别命名为LR3和LR5)受不同基因的控制,如接种同一致病型的两种不同卵菌根腐丝囊霉菌株,LR3群体中的表型抗性受显性单基因AER1控制并且是控制蒺藜苜蓿根腐丝霉抗性的主要基因[67],而LR5群体的表型抗性受隐性基因prAe1控制[24]。从苜蓿品种“Vernal”和“Lahontan”中确定了抗病基因对疫霉根腐病病原侵染具有过敏反应[68]。这些植物材料中的易感性受具有不完全显性的单一基因Pm制约,已在植物中鉴定出多种病害易感基因,所有促进侵染和支持病原菌定殖的植物基因都可以被认为是易感基因,易感基因的突变或缺失会限制病原菌的致病力,从而导致植物具有广谱抗病性[69]。也有研究发现抗性是由隐性基因Pm控制[70]。在二倍体和四倍体紫花苜蓿植物中,抗性受两个显性互补基因Pm1和Pm2的限制[71-72];在四倍体植物中鉴定了另外两个不同的显性抗性基因Pm5和Pm6[73]。研究表明苜蓿对霜霉病(Peronospora trifoliorum)的抗性遗传受一个不完全显性的四倍体遗传基因Dm和5个抗霜霉病苜蓿基因PtR1~5的影响[74-75]。
4.1.2 禾本科牧草抗病基因 目前禾本科牧草抗病基因主要集中在白粉病和锈病等病害(表1)。Pm4和Pm7基因是燕麦对白粉病的高抗基因,而Pm1、Pm3和Pm6基因控制的抗性无效[76]。显性抗病基因Eg-3存在于燕麦栽培品种“Rollo”与六倍体燕麦品种“Mostyn”中[77],此外还鉴定出其他显性抗病基因Eg-1和Eg-5[78]。通过SCAR-BG8标记筛选出燕麦抗白粉病显性基因OMR1、OMR2和OMR3[79]。对于抗锈病研究的禾草植物主要有燕麦抗冠锈病和早熟禾抗禾柄锈菌[80-82]。采用分子标记的方法鉴定出100多个燕麦冠锈病抗病基因,其中96个为Pc基因,大多数Pc基因是显性的,有少数是部分显性和隐性,抗性可以由两个或多个次要基因累加起作用[83]。目前挖掘出的单个Pc基因由于生理小种的出现使得品种在短时间内可以丧失抗性而表现出短效性,如培育出含有Pc38、Pc39、Pc48、Pc53、Pc54、Pc58、Pc68、Pc71、Pc91和Pc94等抗病基因的品种,其中Pc54基因对大部分冠锈病菌(Puccinia coronata)具有抗性,与其他Pc基因结合能够有效地提高抗性[84-85]。随后发现了燕麦抗秆锈病基因Pg1~4、Pg6、Pg8~13、Pg15~16和Pg19,其中Pg9和Pg13基因对生理小种NA3和NA7具有普遍抗性,但随着生理小种6AF、C10和NA27的出现,抗性逐渐下降[86-87]。此外也有研究发现温度对燕麦秆锈病抗病基因的表达有显著影响,Pg1和Pg2随温度升高抗病性下降,Pg10对温度的变化较为稳定,而其他基因均表现低温抗病性[88]。甘露等[82]对草地早熟禾及其矮化突变材料接种秆锈病菌(Puccinia graminis)的抗病机理研究表明,抗病基因PR1和NPR1诱导12 h后的表达量显著提高,说明矮化突变植株对禾柄锈菌的敏感性更强。多项研究表明,PR1和NPR1基因是调控植物抗病性的关键基因,其表达量的变化会直接影响植物对病原菌的抵抗能力,其中NPR1基因是植物防御免疫的关键调控因子,该基因的过量表达均使植物增强了对病原菌的抗性[29]。如禾柄锈菌侵染草地早熟禾后可以使得PR1L、NPR1L基因的转录水平提高以及PRs蛋白表达情况发生变化,发现PR1L、NPR1L基因在病菌诱导12 h时的表达量达到了峰值,且在矮化突变植株中的相对表达量均大于其在对照植株中的表达量[82]。通过转录组挖掘结缕草(Zoysia japonica)感染立枯丝核菌引起的褐斑病,NCED基因差异表达调控植物内源ABA的合成并进一步参与植物抗病机制[89]。
4.2 数量抗性位点QTLs
4.2.1 豆科牧草QTLs 蒺藜苜蓿QTLs的研究主要集中在白粉病、春季黑茎病和黄萎病等病害(表2)。蒺藜苜蓿接种豌豆白粉菌(Erysiphe pisi)后,白粉病的抗性涉及3个不同的位点,分别为4号染色体上的Epp1和5号染色体上的Epa1和Epa2[1]。关于其他豆科牧草相关研究表明,利用红三叶对白粉病高感和抗病品种杂交F1代为作图群体,采用AFLP技术构建7个连锁群,检测到5个抗白粉病相关的QTLs位点,其中qrp-5位于LG5,其余位点均位于LG4;5个QTLs位点均为正效应,其中qrp-1为主效QTL,因此qrp-1被确定为控制红三叶白粉病抗性的主要候选基因[94]。蒺藜苜蓿对春季黑茎病的一个抗病和两个不同易感品种之间进行杂交揭示了抗性的QTL,两个基因座分别为位于LG4和LG8的rnpm1和rnpm2[60],其中rnpm1与一组toll/interleukin1受体核苷酸结合位点富含亮氨酸重复序列基因和抗病蛋白基因紧密相连。蒺藜苜蓿利用基因分型测序产生的单核苷酸多态性标记(single nucleotide polymorphism,SNP)的单剂量等位基因,构建了抗病和感病亲本的高密度连锁图谱,鉴定了与黄萎病抗性相关的5个QTLs,它们位于4个LG(4D,6B,6D和8C)上。其中3个QTLs(qVW-6D-1,qVW-6D-2和qVW-8C)的赔率对数(LOD score)最高。在qVW-6D-2和qVW-8C的区间中,分别鉴定了2个核苷酸结合位点富含亮氨酸重复抗病基因的推定候选基因[95]。使用蒺藜苜蓿抗性品种“F83005.5”和易感品种“A17”的重组自交系(RIL)群体接种到马铃薯(Solanum tuberosum)分离株LPP0323中研究抗黄萎病的QTL,确定了4个QTLs[96]。对蒺藜苜蓿抗病和易感品种接种苜蓿轮枝菌(Verticillium alfalfae)早期的根进行转录组学研究表明,抗性品系在接种后具有更高的防御相关基因表达[97]。在3个RIL群体中进行了蒺藜苜蓿黄萎病抗性遗传作图的研究,确定了3个QTLs(MtVa1、MtVa2和MtVa3),这些QTLs在群体“A17”和“DZA45.5”中赋予对黑白轮枝菌(Verticillium albo-atrum)的抗性,主效QTL位于亲本“A17”的LG7上,附加QTL位于亲本“DZA45.5”的LG2和LG6上[98],表型和遗传分析表明,蒺藜苜蓿群体对黄萎病存在不同的抗性机制。
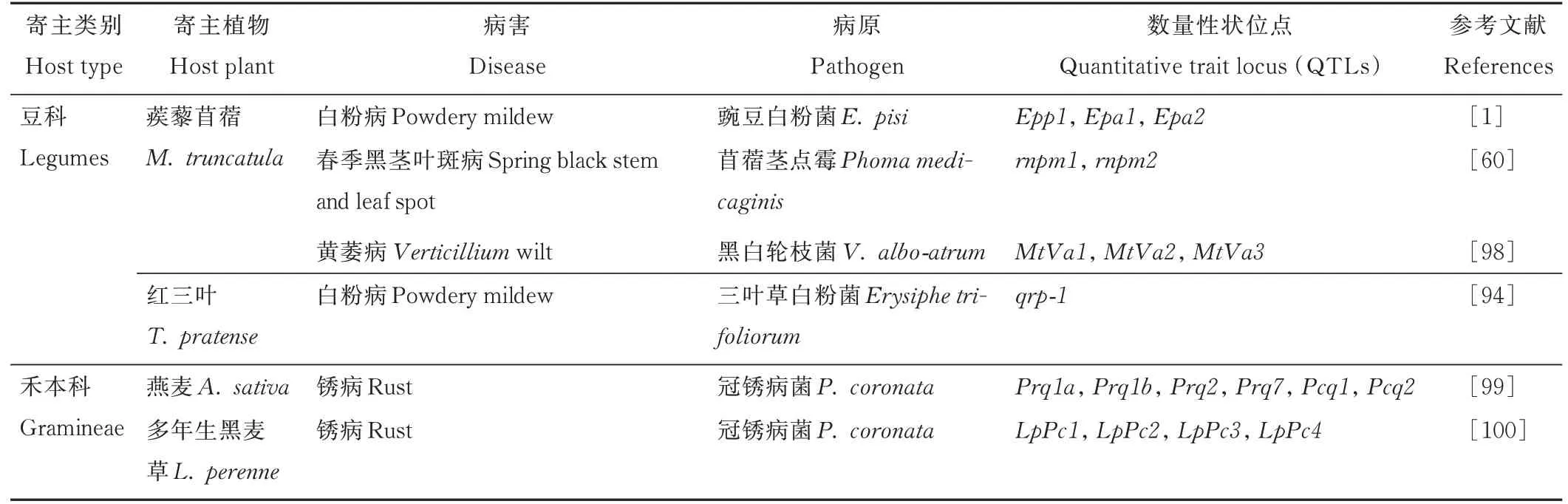
表2 草类植物数量性状位点Table 2 Quantitative trait locus of herbaceous plants
4.2.2 禾本科牧草QTLs定位 对于禾草抗病基因定位的研究相对较少,主要集中在燕麦、多年生黑麦草(表2)。研究通过燕麦作图群体中鉴定出2个抗冠锈病QTLs(Pcq1和Pcq2),其中Pcq1是控制田间成株期抗性的主要QTL,单独存在时在幼苗期不会产生抗性,但是当Pcq1与Pcq2结合时,会起到增强幼苗抗性的作用[99]。使用连锁作图和QTLs分析多年生黑麦草种群中的抗病性,揭示了4个参与抗冠锈病的基因组区域,其中2个QTLs位于LG1(LpPc4和LpPc2),2个位于LG2(LpPc3和LpPc1)[100]。在燕麦冠锈病部分抗性的数量性状基因座的研究中,通过感病品种“Noble-2”和抗性品种“MN841801-1”杂交的F6燕麦重组自交系群体中生成了遗传图谱。该图谱使用AFLP标记,检测到4个抗锈病的主要QTLs,Prq1a、Prq1b、Prq2和Prq7,以及3个次要QTLs,Prq3、Prq5和Prq6。
5 问题与展望
5.1 抗病种质资源和广谱抗病基因的缺乏
目前从已有的抗病品种中选择高抗品种是抗病育种的关键环节,对我国农业可持续发展具有重要作用。但是随着我国农业结构改变和草地生态环境的复杂性,导致病害种类较多且不同生态区同一病害的致病种群结构存在较大差异,造成筛选出的抗病种质资源在推广方面存在较大的区域性及不确定性。目前针对重要的草类植物克隆的抗病基因由于病原小种的出现抗性减弱,从而限制在实际生产中的应用,这导致在育种过程中常选择抗性效果最好的基因进行利用,从而出现大面积长期使用单一基因对病原菌产生持续的选择压力,使得菌群结构发生变化,进化产生新的病原菌和小种,最终导致品种丧失抗性。实现寄主广谱抗性的常见策略是修改R基因介导的抗性狭窄病原菌的特异性。此外,由于病原菌出现的变种或小种,使得单个抗病基因对抗病存在一定的限制,为抗病品种的选育带来很大困难。因此在后续试验中应该明确抗病蛋白识别病原菌信号激发免疫的分子机制,同时应该监测病原菌群落结构与地理环境之间的关系以及动态变化规律,合理轮换使用不同生理小种的抗病基因,最终实现对草类植物的持久抗性。
5.2 建立抗病基因鉴定技术和加快基因克隆
目前草类植物可利用的抗病基因很少,因此急需开发新技术加快抗病基因的分离。随着高通量基因组测序技术的发展和目的基因遗传的深度分析,草类植物如苜蓿、蒺藜苜蓿、百脉根(Lotus corniculatus)以及鹰嘴豆的全基因组信息被解析,研究豆科牧草抗病基因结构进化关系,可以为豆科植物抗病基因研究奠定比较基因组学基础。基因编辑技术在植物抗病性研究中已经得到高度重视,为植物的病害抗性研究提供越来越多的靶点,通过实现对目的基因的精准修饰加速抗病品种的选育。因此可以利用全基因组关联分子技术与克隆技术相结合,加快抗病基因的分离效率。利用转基因技术以及转录因子克隆可以提高草类植物的抗病性。如通过农杆菌介导法将含抗真菌病害的几丁质酶基因Chi和β-1,3-葡聚糖酶基因Glu导入高羊茅愈伤组织细胞内,可以提高高羊茅对禾谷镰刀菌引起的病害抗性[101]。

