SARS-CoV-2 突变株Omicron家族的演化传播和流行现状
郑嘉豪,王 琼,练仲豪,黄 勋*
(1.中南大学湘雅医院感染控制中心,长沙 410083;2.长沙医学院基础医学院,长沙 410200;3.医学病毒学湖南省重点实验室,湖南大学生物学院,长沙 410082)
2019 年12 月,中国湖北省武汉市监测到不明原因肺炎患者,其临床症状与之前感染严重急性呼吸综合征冠状病毒(severe acute respiratory syndrome coronavirus,SARS-CoV)和中东呼吸系统综合征冠状病毒(Middle East respiratory syndrome coronavirus,MERS-CoV)的患者相似,主要表现为病毒性肺炎的相关症状,较轻者表现为发热、干咳、胸部不适、乏力等症状,严重者会出现急性呼吸窘迫综合征、脓毒血症、凝血功能障碍、代谢性酸中毒,甚至多器官衰竭,部分患者还伴有鼻塞、咽炎、腹泻、结膜炎等症状[1]。对患者样品中的病毒进行测序,发现该病毒是一种冠状病毒科的新型β 冠状病毒,科学家们将其命名为严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARSCoV-2),引起的疾病称为新型冠状病毒感染(corona virus disease 2019,COVID-19)[2]。SARS-CoV-2 主要通过呼吸道途径感染传播,呈现出强传染性,以致于其在全球范围形成大流行[3-4]。
SARS-CoV-2 作为RNA 病毒,其基因序列变异速率较高,自其出现以来一直处于持续变异的状态。目前,世界卫生组织(World Health Organization,WHO)基于SARS-CoV-2 的刺突蛋白(S 蛋白)的氨基酸变化,将重要的变异株分为感兴趣变异株(variants of interest,VOI)和关注变异株(variants of concern,VOC)。VOI 是指那些传染性、致病性、免疫逃逸能力发生了改变,并对全球公共卫生构成了明显的流行病学风险的变异株;VOC 是指不仅符合VOI 的定义,而且在流行病学、毒性或现有诊断方法、疫苗和治疗手段有效性方面具有不利变化的变异株。由SARS-CoV-2 引发的世界范围内的疫情高峰出现过5 次,分别是由Alpha、Beta、Gamma、Delta 以及最近的Omicron 家族毒株引起的。Omicron 家族毒株表现出传染性增强、致病性减弱的特征。2022 年12 月26 日,我国国家卫生健康委员会正式发布了《关于对新型冠状病毒感染实施“乙类乙管”的总体方案》。自2023 年1 月8 日起,正式对SARS-CoV-2 感染实施“乙类乙管”的管理方案。Omicron 最近演化出了XBB.1.16 变异株及XBB.1.9.2 谱系的EG.5 变异株,其中XBB.1.16 已迅速扩散至全球34 个国家或地区[5]。研究表明,XBB.1.16 的传播能力进一步增强,约为XBB.1 和XBB.1.5 的1.27 倍。不同国家或地区的人群免疫背景有差异,导致SARS-CoV-2 的变异方向会受到既往感染的影响,在未来可能出现传播速度更快、免疫逃逸能力更强、致病性更高的SARS-CoV-2 变异株[6]。EG.5 变异株自出现以来,流行率一直不断增加,由于其呈现的免疫逃逸能力,相较于其他变异株,EG.5 有着更显著的流行趋势。目前已有45 个国家相继报道了EG.5 感染病例,WHO 已将EG.5 列为“需要留意”的变异株[7]。因此,及时监测、尽早发现SARS-CoV-2新变体对疾病防控至关重要。
1 SARS-CoV-2 Omicron 家族重要变异株及其特征
迄今导致全球范围大流行的SARS-CoV-2 包括Alpha、Beta、Gamma、Delta和Omicron变异株(图1)。以上变异株在传染性、致病性、免疫逃逸能力、应答中和抗体能力方面均存在差别。Alpha 变异毒株相较于原始株,其传染性和致病性增强,病死率更高。Beta 变异毒株的传染性和免疫逃逸力增强,感染后更容易长期潜伏于患者体内并导致慢性感染[8]。Gamma 变异毒株的主要特征为中和抗性增强,患者感染该毒株后难以产生有效的保护性抗体[9]。Delta变异毒株的传染性、致病性和病死率则在之前的变异株的基础上进一步增强[10]。目前主要的流行毒株,即Omicron 家族毒株,是当前最受关注的变异株,该毒株于2021 年11 月在非洲博茨瓦纳被初次报道(B.1.1.529),由于其广泛、持续的流行,现已衍生出了多种子代变异毒株,如 BA.1、BA.2、BA.4、BA.5、BF.7(BA.5.2.1.7)、XBB.1、XBB.1.5、XBB.1.9.2、XBB.1.16、BQ.1.1、BQ.1.2、BQ.1.8 和CH.1.1 等(图2)[11-12]。与先前的变异株相比,Omicron 变异株普遍表现出传染性增强、致病性降低的特点,患者发生感染后的症状更接近于普通冠状病毒感染的症状[13]。

图2 SARS-CoV-2 各变异株系统发育树Fig.2 The phylogenetic tree of SARS-CoV-2 variant
1.1 BA变异株
Omicron 毒株自2021 年11 月被发现,迅速取代了Delta毒株,成为最主要的流行株。目前,Omicron家族毒株大致包括3个分支,即BA、BQ、XBB谱系。这些谱系继而被划分为100 多个亚谱系。BA 谱系的BA.2 变异株于2021 年底在丹麦、南非、印度等国家首次被发现,BA.2 比BA.1 变异株的传染性增强了约30%[14-15]。2022 年4 月出现的BA.4 和BA.5 变异株的传染性进一步加强,迅速取代了先前的BA.2变异株,引发了新一波的SARS-CoV-2 流行[16]。与BA.1 和BA.2 相比,BA.4 和BA.5 变异株的S 蛋白上具有特异性突变L452R,该突变在此前的B.1.427/B.1.429 变异株中也曾被发现,它在免疫逃逸中发挥了重要作用,并极大地增强了BA.4 变异株的传染性[17]。已有研究表明,携带L452R的假病毒对293T细胞和肺器官等的感染性增强,并且L452R 突变可通过稳定S 蛋白与hACE2 受体之间的相互作用来增强病毒的感染性[18]。2022 年5 月13 日,比利时首次发现了BF.7(BA.5.2.1.7)变异株,BF.7感染病例占比利时全国感染病例的76.2%,并在包括我国在内的多个国家迅速流行,引起了全球高度重视[19]。BF.7 是BA.5 的一个亚变体。研究表明,BF.7 的S 蛋白发生了大量突变,包括K444T、F486S、D1199N 和R346T突变,BF.7在Omicron家族毒株中展现出的传染性最强,并且潜伏期更短[20-21]。
在免疫逃逸方面,BA.1 和BA.2 能够感染COVID-19恢复期的患者。由于L452R突变,BA.2.12.1、BA.4和BA.5相较于BA.1和BA.2具有更强大的体液免疫逃逸能力,能够逃逸BA.1 和BA.2 感染诱导的抗体中和反应[22]。除此之外,BA变异株也呈现出较强的疫苗免疫逃逸性,导致许多疫苗对BA变异株的中和效果欠佳,比如BF.7 由于携带R346T 突变,导致免疫逃逸能力增强[23]。有研究发现,感染了BA.1和BA.5的患者血清中仍然检测到了BF.7。然而,最近有研究发现,增加疫苗的剂量和接种次数可以有效增强疫苗对BA 变异株的中和能力,尤其是Bebtelovimab 疫苗,对多种BA 变异株均表现出了良好的中和活性,提示开发针对当前流行和未来新出现的Omicron毒株的下一代疫苗仍然有一定的需求[24-28]。
1.2 BQ变异株
2022 年7 月中旬,尼日利亚首次报道了BQ.1和BQ.1.1 变异株[29]。BQ.1 与BQ.1.1 变异株自出现以来,感染人数持续增加,而BA.5 感染人数不断减少。截止到2023 年2 月6 日,BQ.1.1 和BQ.1 在美国的流行率已分别达到了19.9%和7.3%,而BA.5 的流行率则下降至0.5%。与其他Omicron 毒株一样,BQ.1 与BQ.1.1 的S 蛋白也发生了大量的突变。研究推测,BQ.1 和BQ.1.1 是由BA.5 进化而来的,BQ.1与BQ.1.1 除了具有BA.5 S 蛋白突变外,还有一些独特的突变,如K444T、L452R、N460K 和F486V,BQ.1.1 的S 蛋白上还有R346T 突变,不过针对BA.4和BA.5的疫苗同样可有效预防BQ.1 和BQ.1.1[11]。
在免疫逃逸方面,辉瑞的mRNA 疫苗免疫者血清对BQ.1.1 的中和活性比BA.5 下降了2/3(约66.7%),通过评估接受单价mRNA 增强剂和二价mRNA 增强剂的患者对不同变异株的免疫中和能力发现,接受单价和二价mRNA 增强剂的患者对BQ.1.1 的抗体中和效率均比BA.5 低6/7(约85.7%)[30]。另一项研究评估了mRNA 疫苗BNT162b2 和雾化疫苗Ad5-nCoV 对不同变异株的中和抗体滴度。两种疫苗针对BQ.1 和BQ.1.1 的抗体中和效率均低于BA.4 和BA.5,各变异株逃逸抗性中和能力顺序依次为BA.2=BA.4=BA.5<BF.7<BQ.1<BQ.1.1。这表明,相较于之前的BA 变异株,BQ.1 和BQ.1.1 的逃逸抗性中和能力显著增强[31]。最近一项研究发现,受体结合结构域(receptor binding domain,RBD)异源三聚体可诱导广谱保护性免疫反应,基于此的DBA2BA5 疫苗在小鼠中验证了其可以广泛中和包括BF.7、BQ.1.1、XBB 在内的SARS-CoV-2 变异株,并通过诱导IFN-γ、IL-2 和IL-4等细胞因子的分泌增强抗病毒免疫反应[32]。
1.3 XBB变异株
XBB 变异株于2022 年8 月13 日在印度首次被发现[33]。随后,XBB 变异株在南亚地区成为主要的流行株,并迅速传播至全球各地。2022 年12 月,BQ 变异株在欧美地区已经广泛流行。截止到2023 年2 月6 日,XBB.1.5 在美国的流行率达到66.4%,超过了BQ 变异株的流行率。XBB 变异株被认为是由BA.2 亚变体BJ.1 和BA.2.75 重组进化而来,与之前很多的流行株一样,XBB 变异株的S蛋白也携带有R346T、L452R、K444T、N460K 等突变,然而XBB.1.5 的S 蛋白RBD 上还发生了罕见的F486P、G252V 突变[34]。研究表明,F486P 突变能够增强SARS-CoV-2 与其受体hACE2 的亲和力,这可能是XBB.1.5 具有比其他Omicron 变异株更强的传染性和免疫逃逸能力的原因[35]。小鼠试验发现,XBB.1 的致病性与BA.2.75 相当,且较Delta 变异株更低,然而,XBB.1 在VeroE6/TMPRSS2 细胞中的复制效率高于BA.2.75,且XBB.1 感染气道上皮-内皮屏障的病毒载量较BA.2.75 更高,表明XBB.1 的致病性与BA 变异株的差异较小,但是XBB.1 具有更强的传染性[36]。另一项研究比较了XBB 与BA.5.2变异株感染导致的临床症状的差异,发现XBB 感染后患者更容易出现消化道症状,并且XBB 患者既往恶性肿瘤病史的概率大于BA.5.2 患者,但是BA.5.2患者死亡率是XBB 患者的3 倍,说明BA.5.2 变异株的致病性比XBB变异株更高[37]。
在免疫逃逸方面,在所有的Omicron 变异株中,XBB.1 和XBB.1.5 均表现出了最强的免疫逃逸能力,Evusheld 和Bebtelovimab 疫苗诱导的抗体均不能有效中和XBB.1 和XBB.1.5[38]。辉瑞的mRNA 疫苗免疫者血清对XBB.1 的中和活性比BA.5 下降了87.5%。有研究对比了各Omicron 变异株对疫苗的免疫逃逸能力,结果表明,各变异株的逃逸疫苗中和的效率顺序依次为BA.2/BA.5 <BF.7 <BQ.1 <BQ.1.1 <BA.2.75.2<XBB/XBB.1.5[31]。
2023 年2 月下旬,一种新的变异株XBB.1.16 被报道。至2023 年3 月底,XBB.1.16 逐渐取代之前的变异株成为印度等地的主要流行株。与先前的XBB.1.5 一样,XBB.1.16 也携带有F486P 突变,与XBB.1.5 不同的是,XBB.1.16 还有两个新的突变,它们分别是S 蛋白N 端结构域上的E180V 和RBD上的T487R[39]。XBB.1.16 与hACE2 的亲和力低于XBB.1.5,然而,假病毒试验表明,XBB.1.16 的细胞感染能力与XBB.1.5 相似;中和试验显示,XBB.1.16对几种血清的中和抗性也与XBB.1/XBB.1.5 相似[6]。2023 年2 月17 日,WHO 首次报导了EG.5变异株,并将其列为VOI。EG.5 及其子代EG.5.1、EG.5.1.1、EG.5.2 是由XBB.1.9.2 进化而来的,与先前的XBB 变异株相比,EG.5 的S 蛋白上携带了一个F456L 突变,EG.5.1 携带了另一个Q52H 突变[40]。目前,EG.5 已成为全球最主要的流行株,在美国,约20.6%的COVID-19 病例是由EG.5 感染引起的。与其他XBB 变异株相比,EG.5 携带F456L 突变,因而具有更快的传播速度[40]。然而,现有的研究表明,EG.5 的公共卫生风险较低,免疫逃逸能力仅比之前的XBB.1.5 高1.7 倍,且Moderna 研发的加强疫苗诱导的抗体可以有效中和EG.5。但由于现有相关数据有限,对于EG.5 的检测、预防和治疗仍需进一步的研究[41-42]。
2 SARS-CoV-2 Omicron 变异株S 蛋白的重要突变
由于SARS-CoV-2 是一种RNA 病毒,其聚合酶保真性较低,所以更容易导致突变[43]。在SARSCoV-2 的诸多变异中,最主要的突变是SARS-CoV-2的S 蛋白上的突变,许多流行的SARS-CoV-2 变异株都是由于S蛋白突变而产生的[44-45]。SARS-CoV-2 S 蛋白是一种三聚体,包含了大概1 300 个氨基酸,其中300 个左右的氨基酸构成了RBD(图3)。SARS-CoV-2 S 蛋白的结合受体hACE2 是一种广泛存在于人体的心、肺、肾脏和肠道的具有调节血压功能的蛋白质[46-47]。S 蛋白在结构上可以分为S1和S2,S1 的主要功能是促进SARS-CoV-2 与受体结合,S2 则主要介导SARS-CoV-2 的包膜与宿主细胞膜融合[48]。因此,S 蛋白在SARS-CoV-2 黏附、融合和侵入宿主细胞的过程中发挥了重要的作用。研究表明,相较于最初的SARS-CoV-2,Omicron 变异株在S 蛋白、N 蛋白等结构或非结构蛋白上均发生了突变,其中以S 蛋白的变异最为显著,如S 蛋白RBD 上的G339D、S373P、S375F、K417N、N440K、S477N、T478K、E484A、Q498R、N501Y 和Y505H突变,以及非RBD 区域的D614G、G142D、H655Y、N679K、P681H、N764K、D796Y、Q954H、N969K 突变等(表1)[49]。
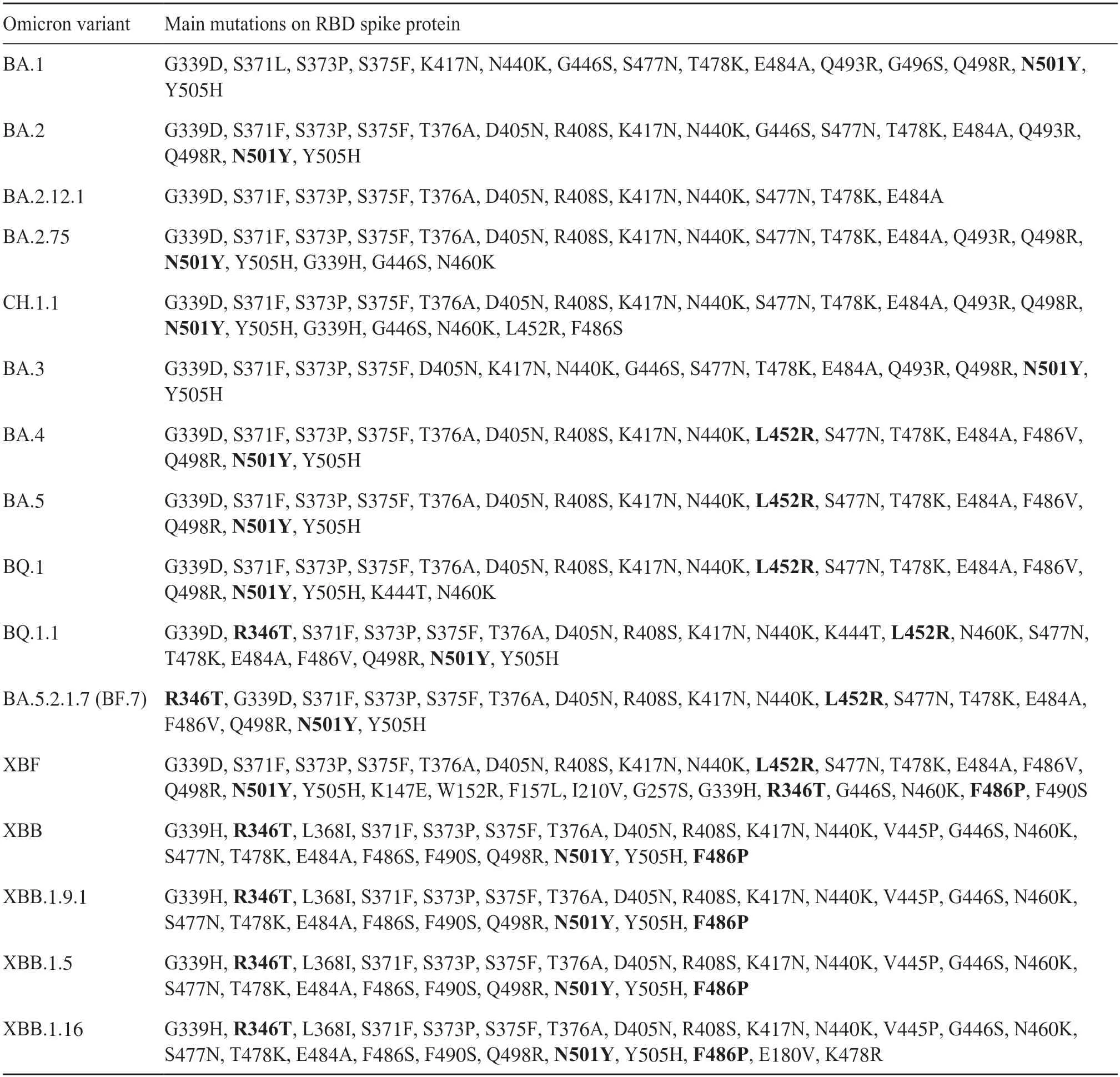
表1 Omicron各变异株在S蛋白RBD 上的重要突变Tab.1 Omicron subvariants with mutations on RBD spike protein
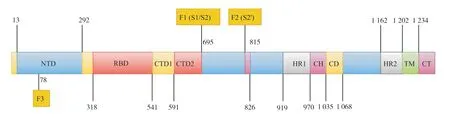
图3 SARS-CoV-2 S 蛋白结构及功能域Fig.3 Structure of SARS-CoV-2 S protein
2.1 D614G突变
2020 年1 月,D614G 突变首次在SARS-CoV-2的S 蛋白上被发现[50]。D614G 突变是指SARSCoV-2 S 蛋白上第614 位氨基酸由天冬氨酸突变为甘氨酸,目前BA.1、BA.2、BA.3、BA.4、BA.5 变异株上均发现了D614G 突变。研究发现,D614G 可通过改变RBD 的构象从而增强S 蛋白与hACE2 的亲和力;动物试验证明,携带D614G 突变的变异株传染性极大地增强了,且D614G 突变减弱了中和抗体(nAbs)的效力[51]。另一项研究发现,DBA2BA5 疫苗对D614G 突变株表现出了较好的中和效力,却几乎不能中和XBB、BQ.1.1、BF.7 变异株;假病毒试验显示,原型RBD 同源三聚体(prototype RBD homotrimer,PPP)和原型-Delta -BA.1(prototype-Delta-BA.1,POD)蛋白疫苗对D614G 变异株的中和能力是BA.1、BA.2的10倍[32]。
2.2 N501Y突变
2020 年12 月,英国最早在SARS-CoV-2 新变异株B.1.1.7 S 蛋白上检测到了N501Y 突变[52]。截止到目前,在所有的Omicron 变异株的S 蛋白RBD 上均发现了N501Y 突变。研究表明,N501Y 与D614G相似,也可通过增强S 蛋白与hACE2 受体的亲和力,从而增强病毒的传染性[53]。研究通过小鼠试验和细胞试验观察到,与Delta 毒株相比,小鼠对携带N501Y 突变的Omicron 变异株更加敏感,且N501Y 变异株在人呼吸道细胞中的复制速度显著增强[54-55]。假病毒试验发现,携带N501Y 突变的SARS-CoV-2 与小鼠的ACE2 亲和力显著增强,提示N501Y 突变可能扩大了SARS-CoV-2 的宿主谱[56]。同时,N501Y 突变还显著降低了部分抗体对病毒的中和效力,让病毒可以逃逸恢复期免疫反应及疫苗的中和反应[57]。
2.3 L452R突变
2020 年3 月,丹麦最早在SARS-CoV-2 的S 蛋白RBD 上发现了L452R 突变[17]。L452R 突变是SARS-CoV-2 的S 蛋白第452 位点上的亮氨酸突变为精氨酸。目前在Omicron 家族毒株中,BA 变异株BA.4、BA.5、CH.1.1、BF.7、BQ 变异株BQ.1 和BQ.1.1 以及XBB 变异株XBF 中均发现了L452R 突变。与N501Y 不同的是,L452R 并没有直接作用于hACE2,其位于S 蛋白的疏水区,通过增强S 蛋白与hACE2结合的稳定性来增强病毒的传染性[58-59]。试验表明,携带L452R 突变的假病毒对293T 细胞和肺器官的感染性较D614G 更强,但是低于N501Y,并且相较于D614G,L452R 突变还增强了病毒的致病性[60]。BA.4/BA.5 携带有L452 突变而BA.1/BA.2没有,这可能是BA.4/BA.5 的传染性高于BA.1/BA.2的原因之一,且Delta 变异株也携带了L452R 突变,因而具有更强的致病性。在免疫逃逸方面,有研究表明,L425R 能通过降低CD8+T 细胞表位NF9 与HLA-A24 的亲和力,从而逃逸细胞免疫[61]。另一项研究发现,LYCoV555 抗体对L452R 变异株完全无效,且L452R 突变使bamlanivimab 抗体的中和能力下降了99.9%以上[62]。
2.4 R346T突变
R346T 突变是指SARS-CoV-2 的S 蛋白RBD上第346 位点的精氨酸突变为了苏氨酸。目前在Omicron 家族毒株中,BA 变异株BA.2.75.2、BA.4.6、BF.7、BQ 变异株BQ.1.1 以及XBB 变异株XBF、XBB、XBB.1.9.1、XBB.1.5、XBB.1.16 中均发现了R346T 突变[21]。研究表明,与L452R 不同,R346T突变除了能增强S 蛋白与hACE2 的亲和力以外,还能增强病毒的免疫逃逸能力[63-64]。先前的BF.7、BQ.1.1、XBB 变异株由于都携带R346T 突变,其传染性和免疫逃逸能力进一步增强。试验表明,R346T 突变显著增强了假病毒对细胞的感染,并且R346T 突变并不直接参与hACE2 与S 蛋白的结合[65]。在免疫逃逸方面,BF.7 变异株携带R346T突变,因而其中和抗性是D614G 变异株的4.4 倍。此外,R346T 突变显著降低了bebtelovimab、sotrovimab、romlusevimab、cilgavimab、tixagevimab 等单克隆抗体的中和能力[66]。
2.5 F486P突变
F486P 突变是指SARS-CoV-2 的S 蛋白RBD上第486 位点的苯丙氨酸突变为了脯氨酸。目前在XBB 变异株XBF、XBB、XBB.1.9.1、XBB.1.5、XBB.1.16 中均发现了F486P 突变[67]。与前面的许多突变类似,F486P 通过增强S 蛋白与hACE2 的亲和力来增强病毒的传染性,同时还能增强病毒的免疫逃逸能力[68-69]。XBB.1.5 变异株由于携带F486P突变,一度成为最主要的流行株,并且对多种疫苗表现出强大的免疫逃逸能力。然而,有研究表明,F486S 突变与F486V 突变显著降低了S 蛋白与hACE2 的亲和力,表现出了与F486P 突变截然相反的作用,但是F486S 和F486V 突变与F486P 突变一样,都能增强病毒的免疫逃逸能力,例如,F486V 能抑制REGN10933 和LY-CoV555 等大部分Ⅱ类RBD单克隆抗体与S蛋白的结合[70-71]。
3 总结与展望
SARS-CoV-2 作为继SARS-CoV 和MERS-CoV后的第三种具有高度传染性和致病性的冠状病毒,虽然其致病性不如SARS-CoV 和MERS-CoV,但是波及范围大,持续流行时间长,对全球健康造成了巨大的威胁。目前SARS-CoV-2 的Omicron 家族毒株是主要的流行毒株,且正处于不断地变异中,其已衍生出多个分支。自去年我国疫情防控进入常态化防控阶段以来,去年年底发生了全国大面积人群感染,康复后的人群普遍产生了针对感染毒株的抗体。然而,考虑到抗体的半衰期大约仅有6个月,未来可能会出现部分地区人群反复感染的情况。因此,持续监测SARS-CoV-2 最新的变异株和流行状况,关注其传播途径和感染形式的最新变化,有助于及时准确作出预警并采取必要的防控措施。

