甲状腺滤泡上皮癌病理诊断的实用策略
沈 勤,王 康,张红莺,周晓军
甲状腺癌主要来自于甲状腺滤泡上皮,占比达95%以上。近30年来随着体检的普及和超声技术的广泛应用,甲状腺结节的检出率急剧上升,新发甲状腺癌患者以每年20%的速度持续增长,而病死率基本无变化,提示以往诊断的甲状腺癌多数是缓慢生长的惰性病变[1]。随着甲状腺癌分子遗传学研究的不断深入,甲状腺癌的诊断标准也随之被修订,而甲状腺滤泡上皮癌也被分为低风险肿瘤、分化型癌和高级别癌3种类型。本文基于近年来对甲状腺癌新的认识,着重讨论如何根据病理基本形态(包括免疫表型),并有效结合基因检测结果,对这些肿瘤作出更精准的病理诊断,为临床制定合理的治疗方案提供重要依据。
1 甲状腺细胞学检查
目前临床普遍采用术前风险分级来确定甲状腺结节恶性相关性,超声是首选的影像学检查方法,主要依据甲状腺影像报告和数据系统(thyroid imaging-reporting and data system, TI-RADS)超声分类及美国甲状腺协会(American thyroid association, ATA)超声模型等指南,其中4~5类(中度怀疑恶性以上)结节需采用细针穿刺活检(fine needle aspiration biopsy, FNAB)证实,这是术前鉴别甲状腺结节良恶性的最可靠方法,细胞学病理检查是风险分级的金标准[2]。
现在国内外普遍采用的2017年第2版甲状腺细胞病理Bethesda报告系统[3](the Bethesda system for reporting thyroid cytopathology, TBSRTC)对于多数FNAB病例可明确诊断分类,包括Bethesda Ⅰ级、Ⅱ级、Ⅴ级和Ⅵ级,并建议临床分别实施相应处理。20%~30%的结节FNAB并不能定性,尤其Bethesda Ⅲ级和Ⅳ级细胞病理诊断重复率低、术语使用泛滥,是诊治分流管理中最大的挑战。Bethesda Ⅲ级病例采用重复穿刺后多数归类为Ⅱ级或Ⅳ级。FNAB联合分子检测显著提高了阳性患者的筛选效能,如BRAF V600E单一基因位点在中国人群甲状腺乳头状癌(papillary thyroid carcinoma, PTC)中的突变率高达91.23%,良性结节和正常组织中均未发现该突变,检测出BRAF V600E突变则支持PTC,解决了部分Bethesda Ⅲ级和Ⅳ级病例的困惑[2]。
Bethesda Ⅳ级包括结节性甲状腺肿或结节状增生、滤泡腺瘤、甲状腺滤泡癌(follicular thyroid cancer, FTC)等一组以滤泡结构生长的良恶性病变。这组病变多是RAS样分子亚型,基因检测区别肿瘤良恶性价值有限[4]。鉴别诊断主要依据肿块完整切除后观察包膜血管有无侵犯,而穿刺标本则无法鉴别。这类病变60%~80%采用诊断性腺叶切除,但组织病理证实恶性仅占15%~30%。日本Satoh等[5]对Bethesda Ⅲ~Ⅳ级滤泡性病变再依细胞形态分为A1倾向良性、A2交界性、A3倾向恶性;美国普遍运用基因表达或测序分类系统筛选出良性病变[6-7],均是为了最大程度地减少良性结节的不必要手术。
2022年第5版WHO甲状腺肿瘤分类的更新对术前细胞学诊断带来巨大冲击,2023年第3版TBSRTC系统[8-9](表1)着重对滤泡结构生长模式病变和高级别甲状腺癌的术语及标准进行了修订和更新,与第5版WHO甲状腺肿瘤分类组织学病理术语保持一致,以确保术前细胞学诊断与影像相关性和临床实用性。

表1 2023年第3版甲状腺细胞病理Bethesda报告系统
虽然FNAB因具有安全、便捷等优势而得到普遍应用,但受穿刺涂片技术的影响,部分病例抽吸细胞过少、涂片血液过多、病灶钙化、实性区过小等原因均可导致无法诊断或获取不满意标本。此外,有些交界性病变具有PTC核特征,FNAB可能过诊为乳头状癌,滤泡结构生长模式的结节难以精准分流管理,仅依靠超声检查和FNAB甚至联合分子检测仍有一定诊断难度。
2 高分化甲状腺癌的病理诊断
高分化甲状腺癌是一组具有接近正常滤泡结构生长模式的滤泡上皮癌,包括低风险滤泡性肿瘤和浸润性高分化型甲状腺癌(PTC、FTC和嗜酸细胞癌)。
第5版WHO甲状腺肿瘤分类提出了一组低风险滤泡性肿瘤(ICD-O编码为1),包括具有PTC核特征的非浸润性甲状腺滤泡性肿瘤(non-invasive follicular thyroid neoplasm with papillary-like nuclear features, NIFTP)、恶性潜能未定的滤泡性肿瘤(follicular tumor of uncertain malignant potential, FT-UMP)、恶性潜能未定的高分化肿瘤(well-differentiated tumor of uncertain malignant potential, WDT-UMP)、玻璃样变梁状肿瘤(hyalinizing trabecular tumor, HTT)。这组肿瘤浸润生长不明显,呈惰性生物学行为,长期随访预后良好,属于交界性肿瘤,要求肿块完整切除、且整个肿瘤包膜及外周进行全面取材(或至少10张包膜切片)后在显微镜下未发现明确的包膜/血管侵犯。如果瘤细胞具有典型PTC核特征,且缺乏乳头(或<1%真性乳头结构)和砂粒体、<30%小梁状/岛状/实性结构、无肿瘤坏死、核分裂<3个/2 mm2、无高细胞/靴钉细胞/柱状细胞、无高危基因突变等特征应诊断为NIFTP[10];包膜/血管侵犯有争议或不肯定时归为恶性潜能未定(uncertain malignant potential, UMP)。实际工作中应避免将UMP当作“垃圾桶”,须经细致工作(如充分取材、间断切片、细致观察和会诊讨论等)后确诊,严格控制UMP的诊断率(参考国际上报道0.5%~3.0%)[11];同时,应向临床备注说明此类肿瘤的生物学特征。2017年第4版WHO甲状腺肿瘤分类[12]中阐述了包裹性滤泡结构生长模式的滤泡上皮性肿瘤的鉴别诊断(表2)。HTT具有PTC核特征,但通常具有包膜或界限清楚,特征性形态(器官样结构、玻璃样基质)、Ki-67(克隆号MIB1,室温下孵育)胞膜表达、PAX8::GLIS1/GLIS3重排均具有诊断意义。

表2 滤泡结构生长模式的滤泡上皮性肿瘤诊断策略
PTC组织学亚型包括经典型、包裹型、浸润滤泡型、弥漫硬化型、实性/梁状型、高细胞型、柱状细胞型、鞋钉型、透明细胞型、梭形细胞型、Warthin样型、嗜酸细胞型、伴有纤维瘤病样间质型等,其中经典型和多数亚型预后较好,10%~15%患者表现为显著侵袭性行为,主要是高细胞型、柱状细胞型、鞋钉型PTC,与患者年老、血管侵犯、分期较晚和核分裂活跃密切有关。各类PTC的主要组织学特点和基因改变[11]见表3。在日常工作中这些亚型主要根据其组织学特点、免疫表型进行确诊,基因改变在不同亚型中有重叠,因此诊断价值有待进一步探讨。
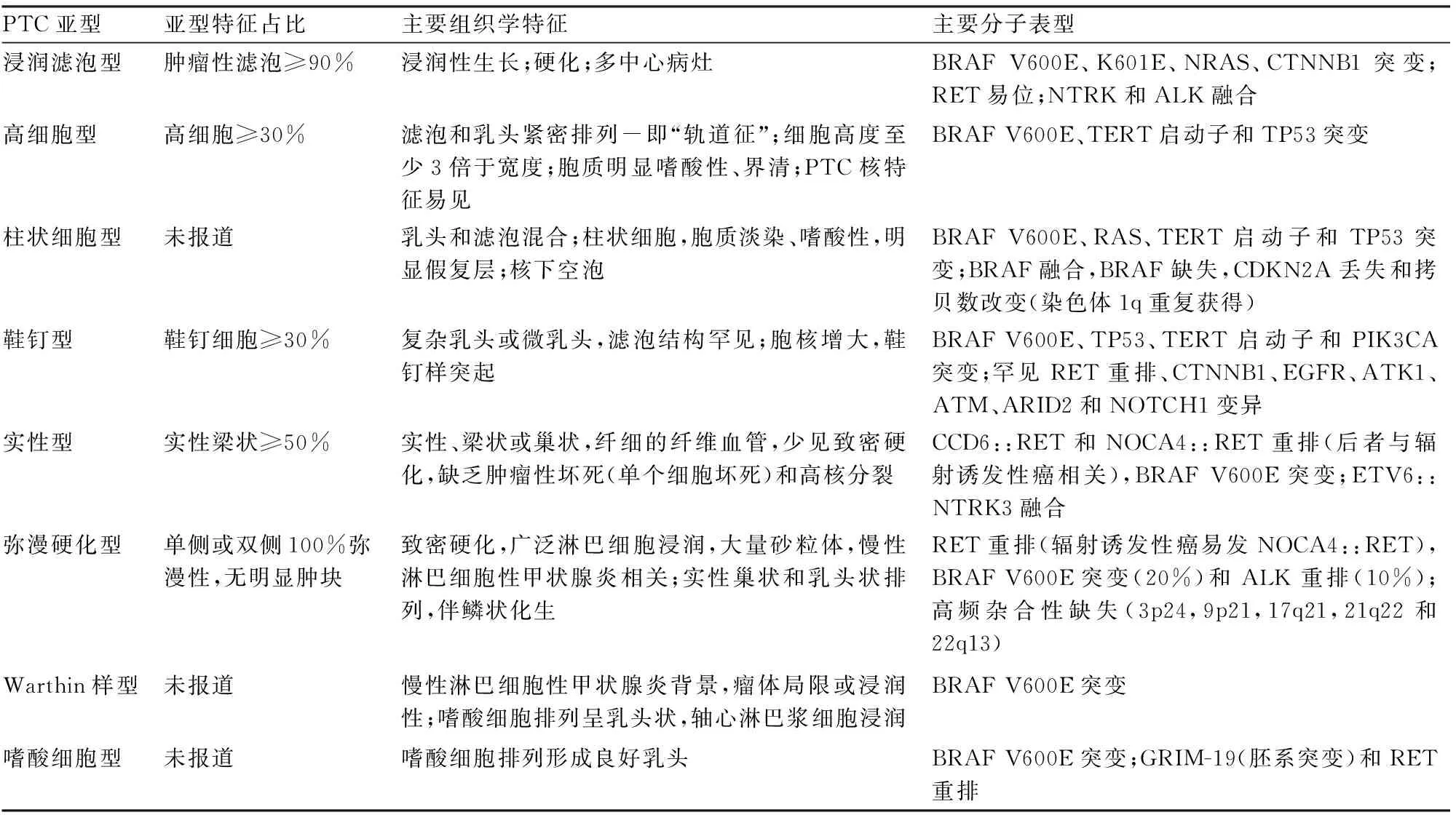
表3 甲状腺乳头状癌各亚型的主要组织学标准和分子表型
既往WHO分类将PTC肿瘤最大径≤1 cm定义为微小亚型,绝大多数是偶然发现并预后良好。有研究显示少数微小PTC病例表现出侵袭性的病理特征和临床行为(包括复发、局部和远处转移),甚至危及生命。因此,第5版WHO甲状腺肿瘤分类并未将“微小乳头状癌”列为独立亚型,建议按照组织学形态分型,不能仅凭肿瘤大小评估患者预后风险[13]。
FTC的诊断标准依然根据肿瘤侵犯包膜或血管,目前缺乏特异的免疫组化标志物和基因检测指标。RAS突变、PAX8::PPARG融合是FTC最常见的分子变异,但这些改变也可在滤泡腺瘤、增生和NIFTP中检测到,因此无法借助基因检测鉴别良、恶性。滤泡癌包膜侵犯要求瘤细胞群穿透纤维包膜、并延伸至轮廓之外才视为肯定的包膜侵犯;需警惕FNAB针道破坏包膜引起的假浸润(通常伴有反应性炎性纤维增生、出血梗死和穿刺史)[10]。血管浸润的必要条件是肿瘤侵入纤维囊壁或纤维囊外的血管内,同时瘤细胞群被覆内皮细胞或黏附血管腔壁或混杂纤维蛋白血栓。目前血管侵犯的最低组织学标准仍存在争论,有学者建议至少一半瘤细胞群突入血管腔内才可判为血管侵犯。与滤泡亚型PTC的鉴别关键在于核形态特征,理论上FTC完全缺乏PTC核特征,但实际上可具有透明变、核扭曲等轻微异型。
嗜酸细胞性肿瘤良恶性诊断标准同滤泡肿瘤一样。嗜酸细胞癌更多见于年老女性,较滤泡肿瘤更具侵袭性,可经淋巴道和(或)血道转移,放射性碘治疗抵抗。分子改变不同于FTC,早期即可发生特征性线粒体基因组(mtDNA)、GRIM19(NDUFA13)及染色体广泛变异[11]。第5版WHO甲状腺肿瘤分类中指出诊断嗜酸细胞癌要求缺乏PTC核特征和高级别形态(坏死和核分裂≥5个/2 mm2),同时嗜酸细胞成分占比≥75%;若充分取材后嗜酸细胞成分占比不足75%,建议写入病理诊断报告中提醒临床医师重视。需要注意嗜酸细胞性肿瘤富含线粒体易发生退变,穿刺后常发生出血梗死或单个细胞/局灶坏死,导致结构形态复杂而极易过诊[14-15]。
浸润性高分化甲状腺癌的浸润程度与预后密切相关,需进一步分型[10]:(1)微浸润型,仅显微镜下肿瘤侵犯包膜。属低度危险性,预后良好,一般腺叶切除即可。(2)血管浸润型,大体肿瘤界清或包裹性生长,无论是否存在镜下包膜浸润,显微镜下分为局灶性(≤3个)或广泛性(≥4个)血管受侵。血管浸润数量与远处转移相关,广泛性(≥4个)血管侵犯具有高度复发风险,需行放射性碘治疗以防止局部复发和(或)远处转移。(3)弥漫浸润型,大体上见肿瘤明显侵犯周围实质或血管瘤栓,需行根治性手术切除并行全身系统性综合治疗。
3 高级别甲状腺癌的病理诊断
高级别甲状腺癌包括高级别分化型癌(diferentiated high-grade thyroid carcinoma, DHGTC)、低分化癌(poorly diferentiated thyroid carcinoma, PDTC)和间变性癌(anaplastic thyroid carcinoma, ATC)[16](表4)。这组肿瘤在高分化型癌早期驱动基因基础上继发侵袭性基因改变(TERT启动子、TP53、PLEKHS1、PIK3CA、PTEN突变,CDKN2A/B缺失等),形态发生了去分化转化。DHGTC和PDTC两者临床病理特征接近,组织学上可有重叠,当具有分化且伴有高级别形态时(肿瘤坏死或高核分裂象)即诊断为DHGTC而非PDTC[17-19]。PDTC和DHGTC均可同时携带RAS/BRAF、TERT启动子、TP53突变。两者生物学行为类似,预后稍差于高分化甲状腺癌、明显优于ATC[16]。

表4 高级别滤泡源性肿瘤与间变性癌的临床病理比较
ATC是最具侵袭性的甲状腺肿瘤,携带侵袭基因改变[尤其TERT启动子和(或)TP53突变]频率明显高于其他甲状腺癌。ATC就诊时即存在广泛性血管和甲状腺外侵犯,常因发生远处转移短期内致命(中位生存期<6个月)。除了肿瘤细胞多形性和未分化特征,常见大量核分裂、肿瘤性坏死和炎细胞反应。当ATC成分占比极少或仅有淋巴结转移灶时易漏诊,肿块边缘区是重点取检部位。ATC因免疫表型失表达而常导致误诊为软组织肉瘤或其他类型的恶性肿瘤。头颈部低分化肿瘤表达PAX8时,强烈提示甲状腺来源的ATC。75%患者具有分化型癌病史或同时存在,为诊断提供了有力证据[19-21]。
高分化甲状腺癌可首选BRAF V600E为主的单基因检测,携带BRAF V600E突变患者对BRAF抑制剂和MEK抑制剂联合治疗有效。所有低分化或侵袭性临床特征明显的病例应及时进行多基因检测,采用系统性综合治疗。低频发生的激酶相关驱动基因重排(如RET、NTRK1-3、BRAF和ALK)对特定靶向药物敏感[22]。亦有文献报道PD-L1、MSI-H等检测对预测免疫药物治疗的临床价值,术后检测可指导靶向治疗[23]。

