樱桃萝卜对抗生素的富集及其潜在风险
李杨洋,梅沁源,刘紫茵,尹丽纯,王星烁,陈则友
樱桃萝卜对抗生素的富集及其潜在风险
李杨洋,梅沁源,刘紫茵,尹丽纯,王星烁,陈则友*
(南开大学环境科学与工程学院,天津 300071)
为探究土壤抗生素污染的潜在生态和健康风险,于2021年6~9月进行温室土培樱桃萝卜试验,每隔6d向土壤中施用土霉素(OTC)或链霉素(STR)污水,并对其中生长的樱桃萝卜的生物量、萝卜组织抗生素含量和菌群耐药性进行分析.同时,通过风险商法、摄入量计算和小鼠饲喂试验对萝卜植株残留的抗生素和抗性细菌的潜在人体健康风险进行评估.结果表明,与未施用抗生素对照组相比,OTC的连续施用在第74d显著促进了萝卜植株生长,使其总生物量提高了23.1%,而STR的连续施用对萝卜植株的生长并无显著影响;萝卜植株对土壤中施入的两种抗生素均有一定的富集能力,STR在组织中的残留量高于的OTC 1~2个数量级,抗生素在植物生长初期主要富集在叶中,生长后期在肉质根根颈部中的富集量显著增加(<0.05);抗生素的施用使萝卜植株组织中可培养OTC和STR抗性细菌占总可培养细菌的比率分别增加了2.48×10-6%~5.05×10-4%和0.19%~3.32%;食用经抗生素暴露后的萝卜肉质根根颈部可增加机体对抗生素和抗生素抗性细菌的摄入量,但其健康风险较低(评估的风险商指数HQ<0.1、食用萝卜植株的小鼠粪便中抗生素的含量低于检出限).
土霉素(OTC);链霉素(STR);樱桃萝卜;富集特征;抗生素抗性细菌;健康风险
作为大量应用的抗生素,土霉素(OTC)和链霉素(STR)在畜禽粪便、再生水和农业土壤中广泛存在[1-2].据报道,土壤中OTC和STR的浓度普遍在ng/kg至mg/kg范围内,在部分地区土壤中的浓度甚至可达上百mg/kg[3-4].土壤中的OTC和STR除少部分来自土著微生物的天然合成外,其主要来自污水灌溉过程、污泥还田和畜禽粪便施用等人为过程[5].
残留在土壤中的抗生素可能会对土壤生态环境、植物和人体健康均造成一定的负面影响.已有研究发现土壤中残留的抗生素能被黄瓜、土豆、生菜等植物吸收并对其生长产生影响[6-7].抗生素能富集在植物的叶、根和茎等组织中[8].有研究发现低浓度的抗生素对植物生长有促进作用,但中高浓度的抗生素则可能会抑制植物生长[9].进入土壤的抗生素还会对植物和土壤的微生物群落施加一定程度的选择压力,使抗性细菌大量繁殖,抗性基因丰度不断增加[10].有研究表明四环素的暴露会改变土壤和植物的菌群结构,改变可培养细菌和抗性细菌的数量,提升耐药细菌的比例[11-12].但现有的研究大多关注抗生素在单次或几次暴露过程中的影响,而对于长期抗生素的连续暴露过程关注较少.然而,实际农业生产过程中的污水灌溉、畜禽粪便施用等过程往往需要多次反复地进行.因此,研究抗生素在连续暴露过程中在植物中的富集及其对植物生长和植物菌群的影响具有重要的现实意义.此外,对于生长在抗生素污染土壤中的植物的人体健康风险仍需进一步的研究.
萝卜作为一类可生食的大众蔬菜,其生长周期短、生长过程需要充足的水分,使得萝卜的品质极易受到土壤抗生素污染的影响.为此,本文以樱桃萝卜为研究对象,分析了OTC和STR在连续灌溉过程中在植物组织中的富集特征,并探究了其对樱桃萝卜生长及樱桃萝卜不同组织抗性细菌的影响.与此同时,初步评估了萝卜组织中富集的抗生素和抗性细菌的健康风险.本研究对于理解土壤抗生素污染可能存在的生态和健康风险具有重要意义.
1 材料与方法
1.1 供试材料
供试作物为十字花科的樱桃萝卜(),种子购买于山东禾之元种业公司.栽培樱桃萝卜的土壤由采自南开大学津南校区校园的土壤和采购于山东禾之元种业公司的果蔬种植基质(主要成分为草炭、蛭石和珍珠岩)按1:2(M:M)比例均匀混合而得,为植物生长提供充足的养分.供试土壤pH 7.21,土壤含水量(重量%) 38.7%,阳离子交换量45.68cmol/kg,机械组成0.02%黏粒(<2μm)、19.88%粉粒(2~50μm)、80.10%砂粒(50~2000μm),有机质含量为309.16g/kg,全氮11.89g/ kg,全磷3.61g/kg,速效钾1.03g/kg.OTC和STR标准品购自北京索莱宝科技有限公司,HPLC级.
1.2 试验设计与方法
试验于2021年6月~9月在南开大学环境科学与工程学院温室大棚内进行.试验开始前,在每个花盆中分别放入450g供试混合土壤,随后将3~4粒用去离子水浸泡8h的樱桃萝卜种子播种到土壤中央2~3cm深处并给予充足水分.紧接着根据后续试验是否施用抗生素将花盆标记为3组:空白对照组(Control)、土霉素处理组(OTC)和链霉素处理组(STR),每组12~13盆.待植物长出后,每隔2~3d给植物浇水100mL.植物生长的环境条件为:温度20~ 26℃、湿度40%~60%、16h光照:8h黑暗,植物生长期间不施用任何肥料.在植物生长至第21d开始进行抗生素施用试验:通过直接浇灌的方式向抗生素处理组土壤中加入100mL浓度为4mg/L的OTC或STR溶液,并每隔6d施用一次,空白对照组则每次浇灌相同体积的去离子水.研究中单次施加的抗生素浓度换算至土壤干重质量浓度为1.45mg/kg,该浓度可模拟长期施用畜禽粪便、污泥或污水的农田土壤的抗生素污染水平[13].抗生素连续施用4次后,在第44d每组随机选择5盆植株进行取样.剩余的7~8盆植株继续施用抗生素,第5次抗生素施用浓度仍然保持在4mg/L之后将抗生素浓度进一步提高至40mg/L,并持续使用4次,在第74d每组再取5盆植株进行取样.40mg/L的抗生素浓度换算至土壤干重质量浓度为14.5mg/kg,该浓度用以模拟土壤中抗生素高度污染的情景.最后,对每组剩余的2盆植株继续施用1次40mg/L抗生素后于第98d取样.取样过程均为将整株樱桃萝卜从土壤中剥离,并按照叶、肉质根的根颈部和侧根将植株分成3部分.与此同时,采集植物的根际土并对所有样品称重记录.
将上述第44d和第74d取得的植物组织样品和土壤样品进一步分成单独的几小份,其中一份称重、研碎后冷冻干燥并储存在-80℃下,用于提取抗生素.此外,选取第74d获得的部分样品,经称重、研碎后与无菌PBS溶液以1:1(V:V)的比例混合,储存于4℃条件下用于分菌.第98d获得的叶和肉质根根颈部样本则全部悬浮于200mL PBS溶液并榨成汁后饲喂小鼠.实验中将70只6~8周龄体重(20±3) g的雄性C57BL/6J小鼠进行不处理饲养一周以平衡肠道菌群后,随机分成7组,每组10只,一组每天只喂饲料,其他6组每天喂饲料的同时灌喂0.6mL来自不同抗生素处理组的叶子汁或肉质根根颈部汁,2周后,收集小鼠的粪便,用于提取抗生素.
1.3 样品分析方法
1.3.1 抗生素含量测定 使用QuEChERS方法[14]提取上述采集的植物组织、土壤以及小鼠粪便中的抗生素.QuEChERS方法常用于提取检测植物中的抗生素类化学物质,其回收率高达71%~93%[15].过程如下:取冻干的叶和土壤样品各250mg、肉质根根颈部100mg,分别加入2mL 150mg/L的Na2EDTA,混合1min后加入适量玻璃珠,并加入1.75mL甲醇,均质1.5min;随后加入2g Na2SO4和0.5g NaCl,再次均质1.5min,并以5050g离心10min后收集上清液;离心剩余物加入3.25mL乙腈,并5050g离心10min,收集上清液;混合前两步的上清液,取1.2mL混合液加入d-SPE(d-SPE配制:12.5mg C18;12.5mg PSA;225mg Na2SO4),均质1min,9240g离心10min;取上清液0.9mL,加入提前准备好的装有0.1mL甲醇的离心管,并经0.22μm滤膜过滤后装入进样瓶.
使用高效液相色谱-串联质谱法(LC-MRM), OA_SPE Waters Xevo TQ_S串联四级杆质谱(美国Waters公司)进行抗生素含量测定.使用WATERS ACQUITY UPLC BEH C18色谱柱(2.1´50mm, 1.7μm)测定OTC含量,具体为柱温:40℃;进样体积: 10μL,流速:0.45mL/min.二元梯度泵,流动相A为乙腈,流动相B为0.1%甲酸溶液.梯度洗脱顺序: 0min,90% A;1.5min,84% A;2.0min,82% A;3.0min, 78% A;4.0min,65% A;4.5min,40% A;6.5min,5% A; 7.1min,90% A;10min,90% A.离子源:电喷雾电离(ESI+);毛细管电压:3.5kV;离子源温度:150℃;脱溶剂气温度:350℃;碰撞气流速:0.15mL/min;检测方式:MRM.吸取待测溶液500μL到新的进样瓶里并加入500μL流动相B.使用Waters Acquity UPLC BEH HILIC色谱柱(2.1×100mm, 1.7μm)测STR[16],二元梯度泵,流动相A为乙腈,流动相B为200mmol/L甲酸铵水溶液(pH 4.0).其他质谱条件参见表1.
1.3.2 可培养细菌和抗生素抗性细菌的分离与分析 取上述用于分菌的菌悬液样品,以合适的倍数稀释后分别涂布于不含抗生素和含有100mg/L OTC或STR的牛肉膏蛋白胨琼脂培养基上,放在30℃恒温培养箱中培养12h后进行计数.细菌耐药率(即可培养抗生素抗性细菌占总可培养细菌的比例)通过每g植物或土壤中分离的抗性细菌数除以每g植物或土壤的总可培养细菌数而得.随后在两种抗性板中选出形态、颜色等表观特征不一样的单菌落,将其挑出并用平板划线法在LB培养基上划线,37℃恒温静态培养24h,得到纯化后的细菌,将单菌落挑出放入LB液体培养基中,并在37℃摇床中培养8h后将500μL菌液与甘油以1:1(:)的比例混合后保存在-20℃冰箱,剩余菌液进行16S rDNA菌种鉴定.
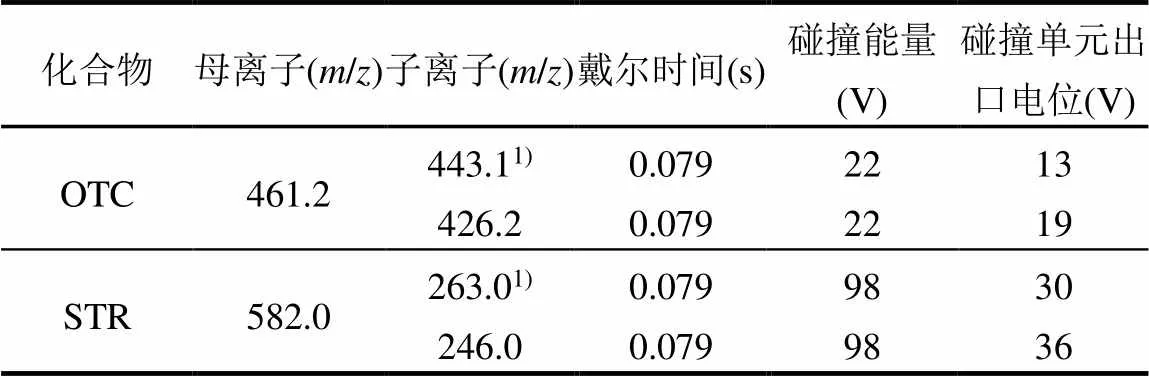
表1 土霉素(OTC)和链霉素(STR)的质谱参数
注:1)定量离子.
1.4 数据分析
用Excel 2003记录数据,用Origin 2022作图,所得数据运用IBM SPSS Statistics V21.0软件进行方差分析(One-way ANOVA)和显著性分析,α = 0.05为显著水平.植物对抗生素的富集可以用生物富集系数(BEF)值表示,采用公式(1)计算;抗生素在土壤中的残留可以用土壤残留率(SRR)体现,采用公式(2)计算;人体通过饮食摄入抗生素的每日预测摄入量(EDI),采用公式(3)计算;抗生素对人体健康的威胁用风险商(HQ)表示,采用公式(4)计算;人体通过饮食摄入抗生素抗性细菌的每日预测摄入量(RBI),采用公式(5)计算.


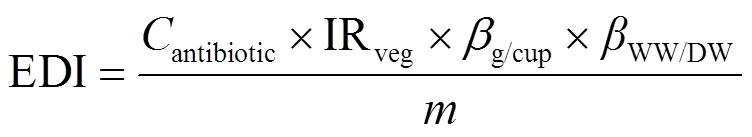
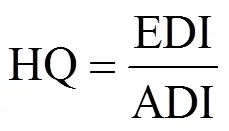
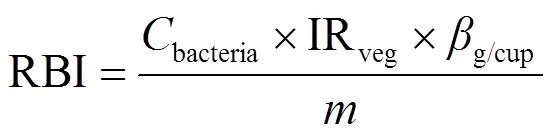
式中:antibiotic为食品中抗生素含量,ng/g,以干重计; IRveg为每天食用的蔬菜/水果量(杯),其中,成人每天食用蔬菜/水果为3.45杯,儿童每天食用蔬菜/水果为2.86杯[17];g/cup为一杯新鲜植物组织的质量,g/杯,以湿重计,一杯樱桃萝卜的质量为135.5g/杯[18];WW/DW为植物组织平均湿重干重转化因子,表示1g植物组织(以湿重计)的干重,一般取0.085[19];为人体平均体重,kg,根据中国2014年国民体质监测公报,本文设定25kg为儿童的平均体重,60kg为成年人平均体重[20];ADI为在不产生不良影响的前提下每人每天最多摄入的抗生素的量,STR选取10mg/(kg·d),OTC选取5.7mg/(kg·d)[18];bacteria为食品中抗生素抗性细菌的数量,个/g,以湿重计.
2 结果与分析
2.1 抗生素对萝卜植株生物量的影响
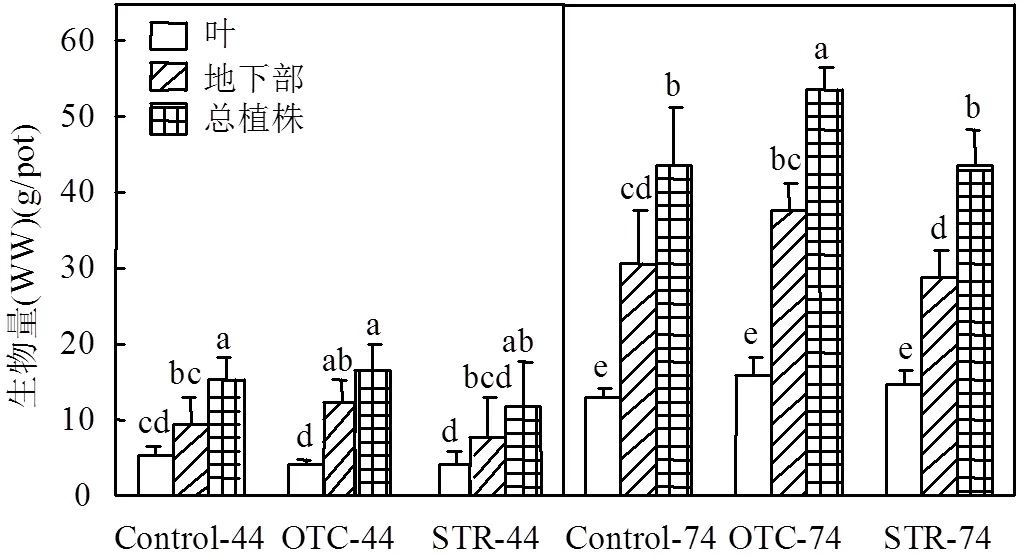
图1 OTC和STR对萝卜植株生物量的影响
WW表示湿重,下同;“-44”表示植物生长第44d取样,“-74”表示植物生长第74d取样,下同;不同小写字母代表各竖分隔线内所有处理间存在显著性差异(<0.05),下同
为了模拟实际应用中连续的再生水灌溉、污泥还田和畜禽粪便施用过程,本试验中抗生素的暴露采取了多次施用的方式进行.与此同时,考虑到不同介质中抗生素浓度存在差异,本试验也将抗生素的施用浓度设置为2个阶段,第一阶段(21~44d)的抗生素施用浓度设置为4mg/L,换算到土壤中的浓度约为1.45mg/kg(以干重计),而第二阶段(44~74d)的抗生素浓度由4mg/L提高到40mg/L,对应土壤浓度约为14.5mg/kg(以干重计).本文中抗生素浓度的选择主要依据土壤中抗生素的污染水平,且用以模拟土壤发生较高污染程度的情景.由图1可知,23d的OTC和STR连续施用对萝卜植株叶、地下部和总植株生物量均没有显著影响.53d的STR连续施用对萝卜植株各部分生物量仍无显著影响,但53d的OTC连续施用显著地增加了萝卜植株的总生物量(较对照组提高了23.1%),且植株的叶和地下部分(尤其是地下部分)均有一定程度的增加.
2.2 抗生素在土壤和植物组织中的富集特征
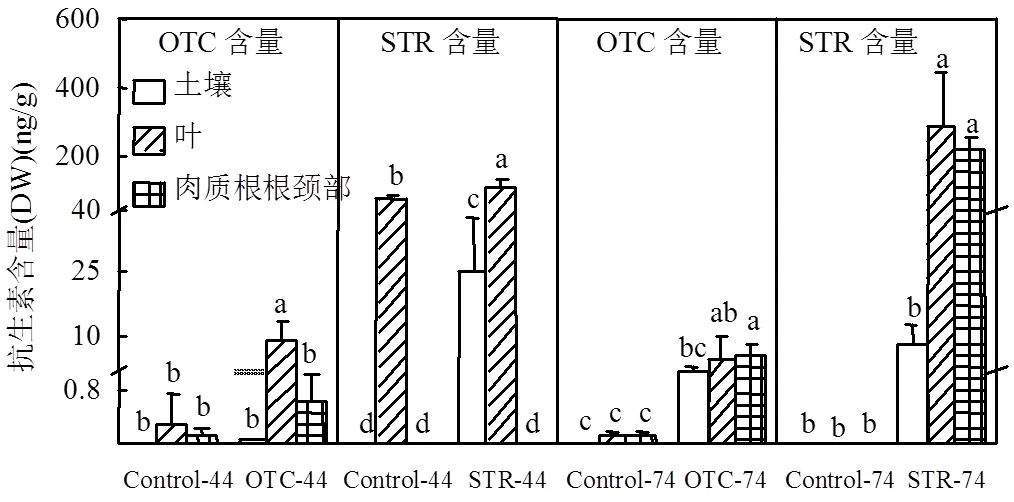
图2 土壤和萝卜植株不同组织中的OTC和STR含量
DW表示干重
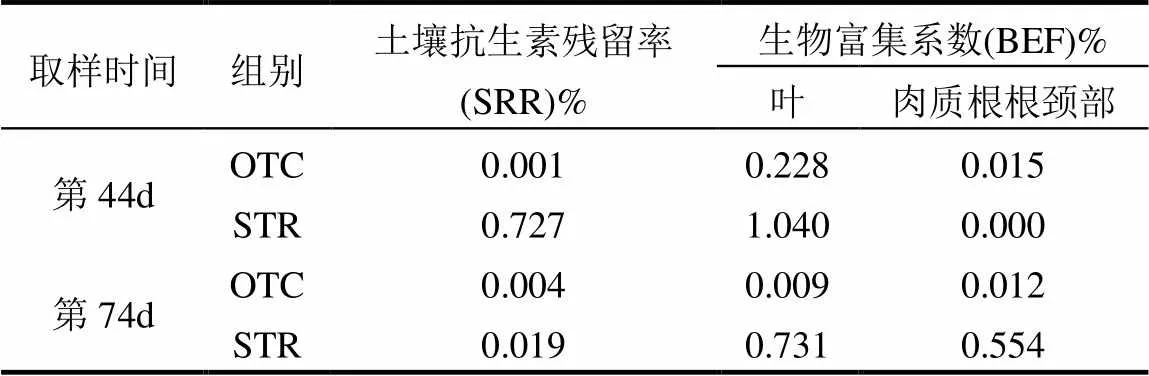
表2 土壤的抗生素残留率(SRR)和萝卜植株的生物富集系数(BEF)
抗生素在土壤和植物组织中的富集特征如图2所示,在第44d对照组植物的叶中存在一定含量的STR,第74d其STR含量大大减少.植物生长第44d和74d时抗生素处理组的土壤和植物中抗生素的含量均高于对照组,说明施用的抗生素在土壤中有所富集且部分抗生素被植物所吸收.与此同时,叶中富集的两种抗生素含量高于肉质根根颈部.对比两种抗生素可发现STR在植物组织中的检出浓度高于OTC.抗生素在土壤和植物组织的残留状况和富集系数显示(表2),抗生素在土壤中的残留率极低,最高残留率不足1%.在第44d,OTC处理组和STR处理组的两组植物中叶中OTC和STR含量均最高,富集系数分别为0.23%和1.04%.在第74d,STR处理组的土壤中STR含量减少,叶和肉质根根颈部中STR的含量均增加,植物中叶中STR含量依旧最高,肉质根根颈部中STR的含量也有提高,其在叶和肉质根根颈部中的富集系数分别为0.73%和0.55%;对于OTC组来说,此阶段叶中OTC含量减小,其富集系数减小了0.22%,肉质根根颈部中OTC含量增加,其富集系数变化不大.
2.3 抗生素对萝卜植株不同组织内可培养细菌及抗生素抗性细菌的影响
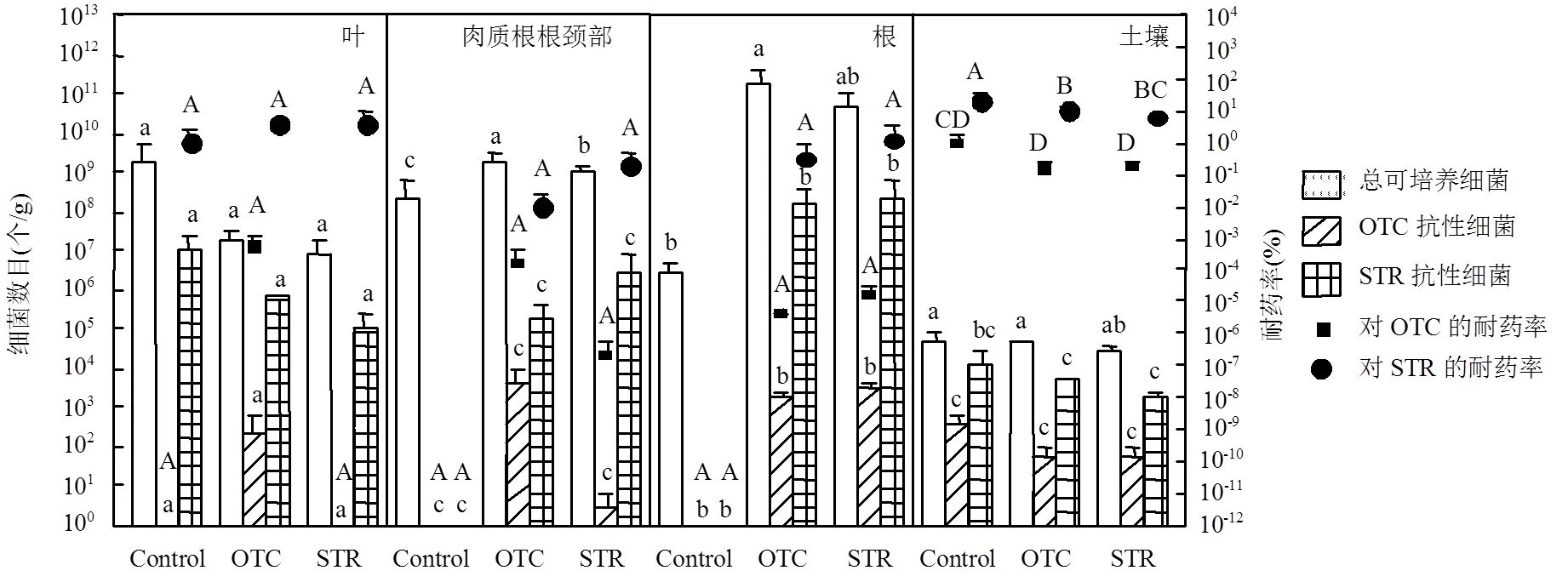
图3 不同处理组植物组织和土壤中总可培养细菌、抗生素抗性细菌数量以及耐药率
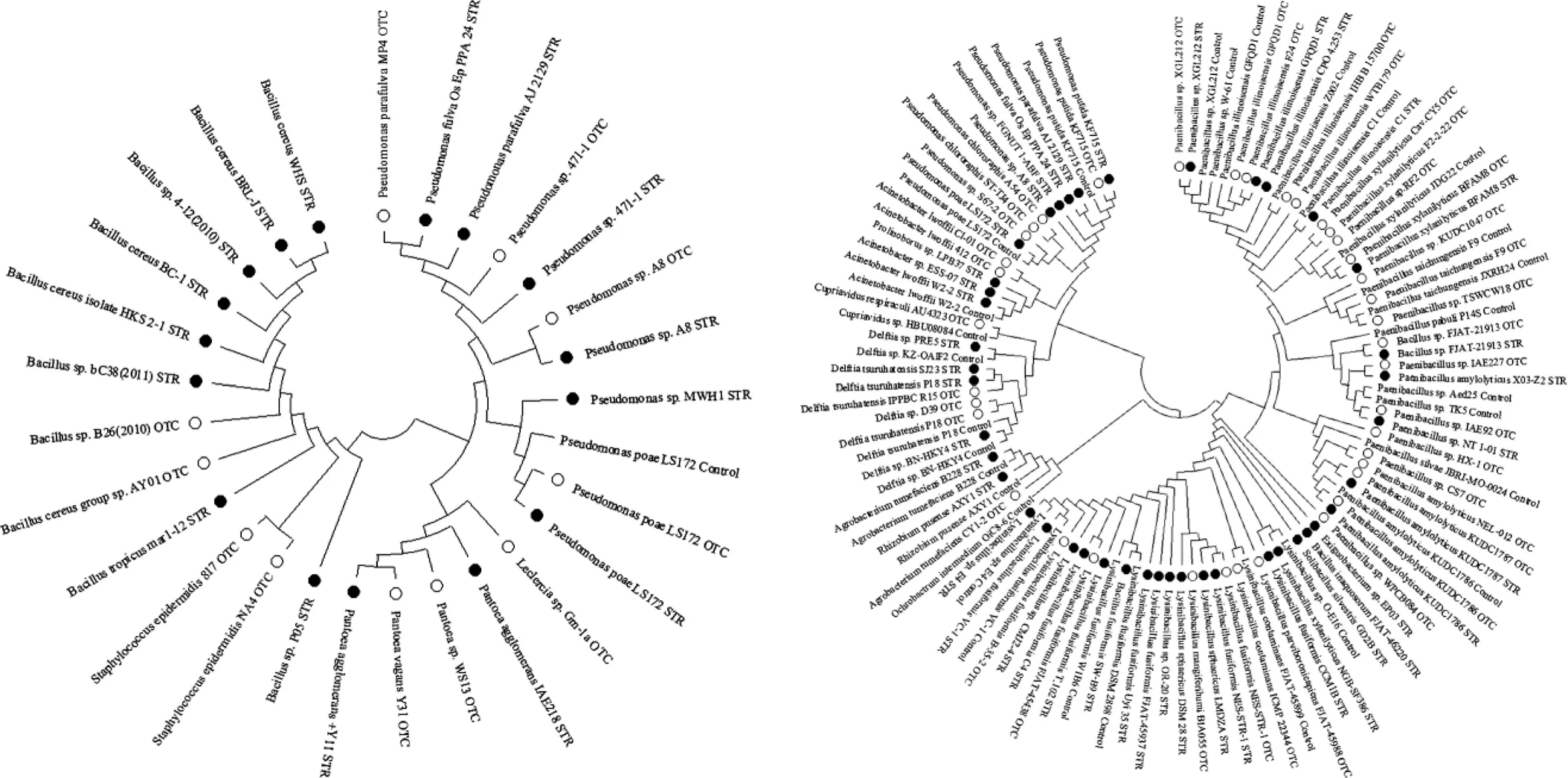
图4 不同处理组植物和土壤中的OTC(a)及STR(b)抗性细菌
如图3所示,未施用抗生素的萝卜植株各组织中可培养细菌数量呈叶>肉质根根颈部>根顺序递减,施用抗生素后叶中可培养细菌数量减小了2~3个数量级,而肉质根根颈部和根中可培养细菌数量增加了1~5个数量级.萝卜植株不同组织中OTC或STR抗性细菌占总可培养细菌的比例(即菌群耐药率)可以反映抗生素胁迫下植物菌群中抗生素抗性的变化.结果显示,对照组植物组织中无OTC抗性细菌,但OTC处理组萝卜植株的各组织中均出现了OTC抗性细菌,其中叶、肉质根根颈部和根中菌群对OTC的耐药率分别为5.05×10-4%、1.60×10-4%和2.48×10-6%.菌种鉴定结果显示(图4(a)),叶中的OTC抗性细菌主要来自葡萄球菌属、泛菌属和勒氏菌属,肉质根根颈部中的OTC抗性细菌主要为假单胞菌属,根中的OTC抗性细菌主要来自假单胞菌属和芽孢杆菌属.有趣的是,与OTC处理不同,虽然对照组肉质根根颈部和根中仍无STR抗性细菌,但对照组植物叶中存在部分STR抗性细菌.施用STR后,植物叶中STR抗性细菌的数量减小了2个数量级,但STR抗性细菌种类有所增加.对照组的STR抗性细菌主要来自戴尔福特属、芽孢杆菌属、不动杆菌属和假单胞菌属,而STR处理组的STR抗性细菌主要来自微小杆菌属、噬脯氨酸菌属、戴尔福特属、芽孢杆菌属、不动杆菌属和假单胞菌属.经STR暴露后,处理组的肉质根根颈部和根中均出现了抗性细菌,肉质根根颈部和根中菌群对STR的耐药率分别为0.19%和1.35%,肉质根根颈部和根中的STR抗性细菌主要来自假单胞菌属.对于同一组植物的相同组织,在两种抗生素胁迫下萝卜植株菌群对两种抗生素的耐药率均为STR>OTC.在同一种抗生素的胁迫下,萝卜植株叶中菌群的耐药率均高于肉质根根颈部中菌群的耐药率.
2.4 抗生素对土壤中可培养细菌及抗生素抗性细菌的影响
由图3可知,施用抗生素后,土壤中可培养细菌数量、菌群耐药率和抗生素抗性细菌的种类变化均不明显,对照组中OTC抗性细菌主要来自于假单胞菌属,OTC处理组中的OTC抗性细菌主要来自于假单胞菌属和葡萄球菌属;对照组中STR抗性细菌主要来自于芽孢杆菌属、根瘤菌属、贪铜菌属、苍白杆菌属和假单胞菌属,STR处理组的STR抗性细菌主要来自于芽孢杆菌属、根瘤菌属和假单胞菌属.在两种抗生素胁迫下土壤菌群的耐药率为STR>OTC.
2.5 萝卜植株中的抗生素和抗生素抗性细菌的健康风险评估
萝卜植株中的抗生素和抗生素抗性细菌可通过饮食进入人体,对人类健康造成潜在威胁.由表3可知,植物生长第44d时两种抗生素的每日预测摄入量(EDI)和风险商(HQ)均为叶>肉质根根颈部;第74d时STR的EDI和HQ同样为叶>肉质根根颈部,而OTC的EDI和HQ则为肉质根根颈部>叶.由于儿童每日食用的蔬菜相对于自身体重的比值更高,因此食用被抗生素污染的樱桃萝卜对儿童健康的威胁大于成人.在所有处理组中HQ均小于0.1.小鼠试验结果显示,食用了不同处理组叶和肉质根根颈部的小鼠粪便中抗生素的含量均低于最低检出限.本研究也对抗生素抗性细菌的人体摄入量进行了计算评估.由表4可知,通过食用含有抗性细菌萝卜植株,人体OTC抗性细菌的预测摄入量为 (1.72± 3.36)×103~(6.47±9.06)×104个/(kg·d),STR抗性细菌的每日预测摄入量为(0.74±1.20)×106~(1.54±2.39)× 108个/(kg·d).与对照组相比,两种抗生素的施用均增加了肉质根根颈部中的抗性细菌每日摄入量.考虑到肉质根根颈部具有可食用性,该结果证实土壤抗生素污染可能导致人体摄入更多的抗性细菌.
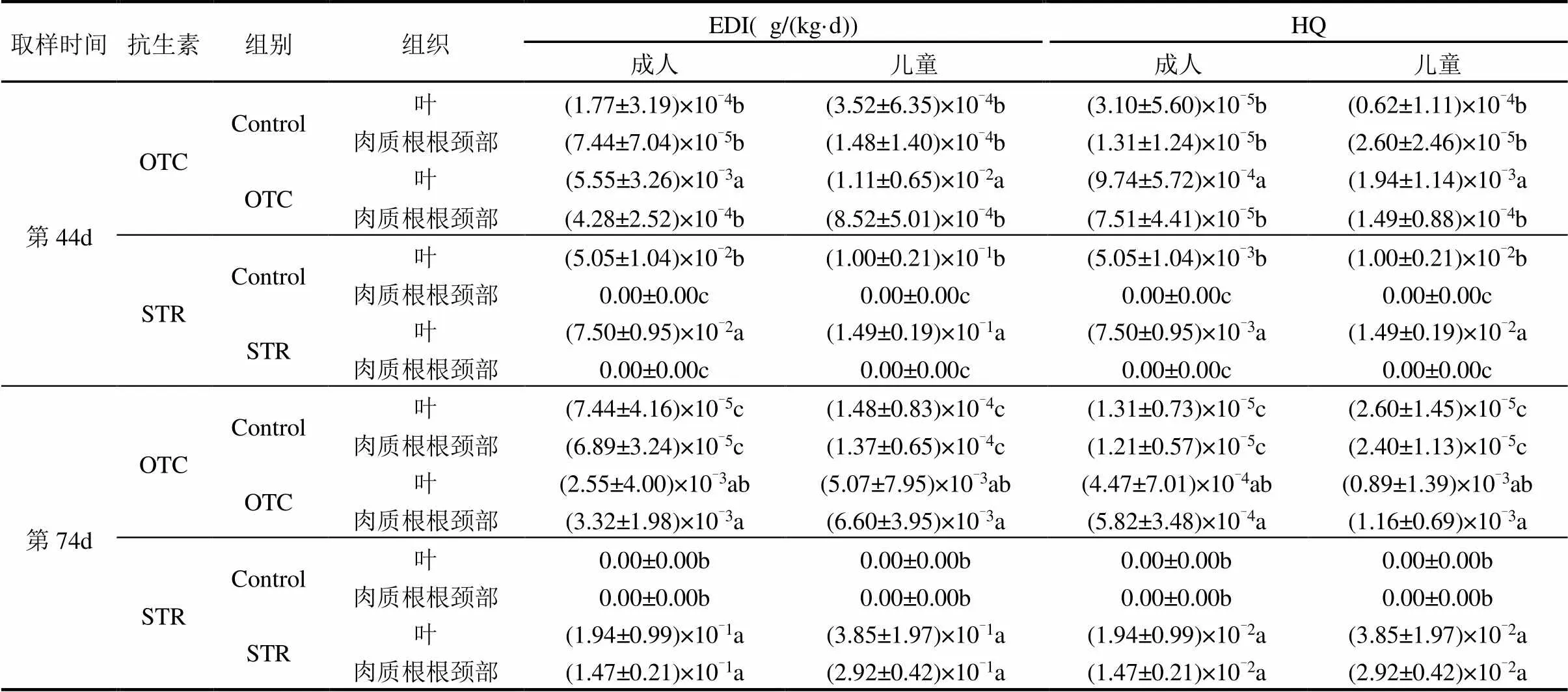
表3 通过食用萝卜植株而导致的抗生素摄入量估算
注:数值(平均值±标准差,n = 4)后的不同小写字母表示分隔线内同一列存在显著性差异(<0.05),下同.
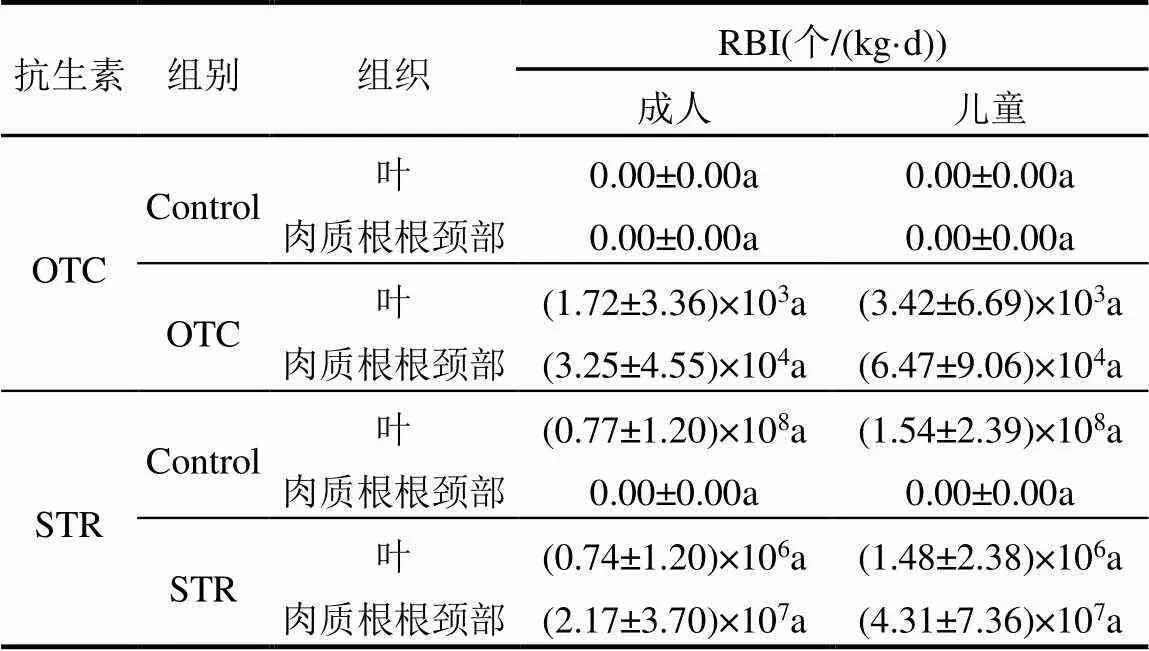
表4 通过食用萝卜植株而导致的抗生素抗性细菌摄入量估算
3 讨论
3.1 OTC和STR对萝卜植株生物量的影响
在本文中,53d的OTC连续施用对萝卜植株生长具有显著的促进作用.之前也有部分研究发现抗生素能促进植物生长[6].迟荪琳等[21]发现50mg/kg四环素对土培小白菜地下部分的生长具有显著促进作用.鲍陈燕等[22]发现水培条件下低浓度(50~ 100μg/L)的抗生素污染可增加水芹根系生长,使根系活力增加.抗生素促进植物生长的机理可能存在以下几种可能:一是抗生素的胁迫使植物代谢增强,以促进植物生长.研究表明,低浓度的抗生素能促进细胞内核酸和蛋白质的合成以及线粒体数目的增加[22-23];二是低浓度的抗生素使植物体内抗氧化酶活性增加,从而清除活性氧自由基保护植物生长[24];三是抗生素能改变植物菌群的结构,从而有利于植物的生长.
本研究结果也显示,相较叶子,OTC对地下部生长的促进作用更为明显,这可能是由于生长在土壤中的地下部与抗生素接触更为直接.此外,本研究也发现STR施用对萝卜植株的生长没有显著影响,表明抗生素污染对植物的影响也取决于抗生素的种类.
3.2 土壤和植物组织中OTC和STR的富集特征
本试验结果显示土壤中抗生素的残留率极低.其原因一方面是抗生素进入到土壤后会经历多种生物和非生物降解过程[25],导致其残留量降低;另一方面,一部分进入土壤中的抗生素也会被植物吸收从而减少土壤中的抗生素含量[26].此外,抗生素会通过物理吸附、化学结合或生物固定作用而残留在土壤固相基质中,而相对较为温和的提取条件可能导致QuEChERS方法不能完全提取土壤中的抗生素[10,27].
抗生素可通过主动运输或被动运输被植物根部吸收,随后通过根部的凯氏带运输,并通过木质部的蒸腾流在植物体内运输,此过程中不断将抗生素分配至临近的植物组织部位[28].植物对抗生素吸收运输的途径与植物类型、抗生素种类等有关[29].本研究发现抗生素处理组植物的叶和肉质根根颈部中抗生素的含量均高于对照组,证实了土壤中的抗生素会被植物吸收并随蒸腾作用在植物的不同组织间运输并富集.与此同时,本研究也发现叶中富集的两种抗生素浓度均高于肉质根根颈部,且植物生长后期肉质根根颈部中抗生素的富集量显著增加(<0.05).这可能与樱桃萝卜植株的生长过程有关,樱桃萝卜植株以先长叶子再长肉质根为基本特征,更长的抗生素富集时间可能是叶子中富集更多抗生素的主要原因,而生长阶段的变化可能是后期肉质根根颈部中抗生素富集量增加的原因.在本研究中,萝卜植株对STR的富集能力高于OTC,这说明植物对抗生素的吸收富集与抗生素本身的理化性质有关[21].研究发现抗生素的分子量、化学结构以及辛醇水分配系数等特性均可影响其在植物中的富集情况.由于OTC分子结构中含有酚二酮官能团,其极易与土壤介质中的金属离子结合形成螯合物而强烈吸附于土壤颗粒上[30],因此OTC较难被植物吸收富集.经检测,供试土壤和萝卜植株种子中分别存在0.54和1.34ng/g的STR残留,这可能是第44d对照组植株的叶中存在一定含量的STR的原因.而抗生素在植物中的生物和非生物降解过程可能是第74d其STR含量大大减少的主要原因.
3.3 OTC和STR对土壤和萝卜植株菌群的影响
在本试验中,抗生素的连续施用使植物叶中可培养细菌数量减小,其原因可能是抗生素会抑制不具有抗生素抗性细菌的生长与繁殖.研究表明,OTC和STR都能特异性地与细菌核糖体30S亚基的A位置结合,抑制肽链的延长进而影响细菌蛋白质的合成[31].抗生素对细菌的毒性大小主要取决于细菌种属、抗生素类型以及抗生素的浓度和作用时间等.与叶部相反,抗生素的连续施用增加了植物肉质根根颈部中可培养细菌数量,其机理可推测为抗生素能促进肉质根根颈部的生长,抗生素处理组植物为其中细菌的生长提供更多的营养和栖息地.植物细菌可通过产生具有促生、抗菌等作用的代谢产物和固定营养元素,来促进宿主植物的生长发育与繁殖[32],抗生素处理组植物肉质根根颈部的生物量显著大于对照组也可能与其细菌数量增加有关.
本研究发现,抗生素的连续施用可使植物各组织的耐药率增加,这与大多数已报道的研究结果一致.Zhang等[33]发现在培养液中分别加入8和16mg/L的四环素后,小白菜中可培养抗生素抗性细菌的数量增加了2~3倍,耐药率也从0.23%提升到0.79%~1.23%.Yashiro等[34]报道喷洒STR后苹果树叶片中菌群的耐药率提升了30%.施用抗生素后,抗生素会进入并富集在植物内部,使抗生素抗性细菌获得竞争优势,从而增加植物组织中抗性细菌的比例.同时,抗生素抗性基因还可通过水平转移在同种细菌或异种细菌间传播[35],进一步提升抗性细菌的比例和种类.在本试验中,植物组织中的抗性细菌主要为葡萄球菌属、泛菌属、假单胞菌属、不动杆菌属和芽孢杆菌属等.在一定条件下,这些细菌对植物、动物和人类具有致病性,例如,假单胞菌可以感染苹果树使其产生疾病[36],鲁氏不动杆菌是人类的条件致病菌[37].这些细菌产生抗生素抗性不仅会导致植物疾病难以治愈,还可能通过食物链进入人体,危害人类健康.与此同时,本研究也发现萝卜植株中STR耐药细菌的比例和种类都远大于OTC耐药细菌,其可能的原因可能为STR更容易被植物吸收富集,因此其更易对植物菌群耐药率和结构产生影响.在本试验中,对照组植物叶子中存在高浓度的STR残留以及1.09%的STR耐药细菌.之前已有研究报道了STR耐药性的广泛性,例如,Yashiro[34]发现没有喷洒STR的苹果树叶片中菌群耐药率已高达50%.此外,本研究中抗生素的施用对土壤细菌的数量、土著菌群耐药率和抗生素抗性细菌的种类影响均较小,其原因可能是本试验所用的土壤中有机质含量较高,从而导致OTC和STR的生物可利用性较小[38].
3.4 OTC和STR施用的健康风险评估
施用过抗生素的萝卜植株被人体食用后可能会对人体健康造成威胁.一方面,抗生素大量富集在樱桃萝卜的可食用部位(叶和肉质根根颈部),可通过食用进入人体肠道中.抗生素及其代谢产物可能通过影响肠道微生物的数量、多样性和抗生素抗性而对人类健康造成影响.另一方面,由抗生素暴露引起的萝卜植株中的抗生素抗性细菌和抗性基因也会通过食物链被人体摄入,导致人体中抗性基因的增加以及具有抗生素抗性的致病菌的出现,从而危害人体健康[39].在本试验数据结果显示,人体在食用抗生素处理组的叶或肉质根根颈部的过程中会摄入3~4个数量级的OTC抗性细菌或5~7个数量级STR抗性细菌.
现阶段,常使用风险商法来评估长期食用含抗生素的食物(如水果、蔬菜、肉类等)对人类健康造成的威胁[17,40].风险商等于每日预计摄入量(EDI)除以每日最多摄入量(ADI),ADI是指在不产生不良影响的前提下,每人每天最多摄入的抗生素的量.通常认为HQ>0.1表示对人类健康存在威胁[18-19].在本文中,所有处理组供试植株的HQ都小于0.1,后续的小鼠试验中小鼠粪便中的抗生素含量也均低于最低检出限,说明食用本研究中经抗生素暴露的蔬菜对人体的健康风险较小.大部分研究也表明食用OTC和STR处理的食物不会对人类健康产生威胁[18].Ahmed等[41]发现使用含四环素的溶液灌溉后的黄瓜、生菜和西红柿的可食用部位中四环素浓度均在0.002~0.204mg/kg,均无健康风险;王卫中等[42]揭示只有当OTC在土壤中的含量大于450mg/kg时,其对儿童的HQ略大于0.1,其他情况的HQ都小于0.1.值得注意的是,研究表明植物中抗生素浓度会随着环境中抗生素浓度的增加而增加[33,42],而且不同植物对抗生素的富集能力存在较大的差异[21].因此,长期施用含高浓度抗生素的再生污水、污泥或畜禽粪便可能导致抗生素富集能力较强的植物吸收大量抗生素且富集耐药细菌,其可能会存在一定的健康风险.因此,需要特别关注土壤中抗生素的浓度、粪污施用频率以及抗生素污染土壤上种植的植物类型.
4 结论
4.1 53d OTC的连续施用可以增加萝卜植株的总生物量(<0.05),而STR的连续施用并无显著影响.
4.2 萝卜植株对STR的富集能力强于OTC;抗生素在植物生长初期主要富集在叶中,而生长后期在肉质根根颈部中的富集量显著增加(<0.05).
4.3 抗生素的施用可提高萝卜植株组织中菌群对供试抗生素的耐药性,改变抗生素抗性细菌的种类,但其对土壤菌群的影响较小.
4.4 本试验中抗生素处理组萝卜植株的食用对人体健康产生的风险很小(HQ<0.1).人体在食用抗生素处理组植物的过程中会摄入3~4个数量级的OTC抗性细菌或5~7个数量级的STR抗性细菌.
[1] 刘鹏霄,王 旭,冯 玲.自然水环境中抗生素的污染现状、来源及危害研究进展 [J]. 环境工程, 2020,38(5):36-42.
Liu P X, Wang X, Feng L. Occurrences, resources and risk of antibiotics in aquatic environment: A review [J]. Environmental Engineering, 2020,38(5):36-42.
[2] Qian M R, Wu H Z, Wang J M, et al. Occurrence of trace elements and antibiotics in manure- based fertilizers from the Zhejiang Province of China [J]. Science of the Total Environment, 2016,559:174-181.
[3] 张慧敏,章明奎,顾国平.浙北地区畜禽粪便和农田土壤中四环素类抗生素残留 [J]. 生态与农村环境学报, 2008,24(3):69-73.
Zhang H M, Zhang M K, Gu G P. Residues of tetracyclines in livestock and poultry manures and agricultural soils from North Zhejiang Province [J]. Journal of Ecology and Rural Environment, 2008,24(3):69-73.
[4] 萨仁其其格,赵文岩,马静静.HPLC法检测内蒙古牧区土壤中链霉素残留 [J]. 分析化学, 2009,37(A2):217.
Sarenqiqige, Zhao W Y, Ma J J. Determination of streptomycin residues in soil of pastoral area of Inner Mongolia by HPLC [J]. Chinese Journal of Analytical Chemistry, 2009,37(A2):217.
[5] 王 冲,罗 义,毛大庆.土壤环境中抗生素的来源、转归、生态风险以及消减对策 [J]. 环境化学, 2014,33(1):19-29.
Wang C, Luo Y, Mao D Q. Sources, fate, ecological risks and mitigation strategies of antibiotics in the soil environment [J]. Environmental Chemistry, 2014,33(1):19-29.
[6] Pan M, Chu L M. Phytotoxicity of veterinary antibiotics to seed germination and root elongation of crops [J]. Ecotoxicology and Environmental Safety, 2016,126:228-237.
[7] 秦俊梅,熊华烨,李兆君.施用含四环素类抗生素鸡粪对玉米生长的影响及其残留特征 [J]. 灌溉排水学报, 2018,37(9):22-28.
Qin J M, Xiong H Y, Li Z J. Decay of tetracycline antibiotics and the growth of maize in soil amended with chicken manure [J]. Journal of Irrigation and Drainage, 2018,37(9):22-28.
[8] 黄 佳,杨 甜,李泽林,等.不同浓度四环素和土霉素对生菜生长的影响及生态毒性 [J]. 应用与环境生物学报, 2022,28(4):995-1001.
Huang J, Yang T, Li Z L, et al. Effect of different concentrations of tetracycline and oxytetracycline on the growth and ecotoxicity in lettuce [J]. Chinese Journal of Applied and Environmental, 2022,28(4): 995-1001.
[9] 张继旭,申国明,孔凡玉,等.四环素对烤烟生长发育及光合作用的影响研究 [J]. 农业环境科学学报, 2017,36(1):48-56.
Zhang J X, Shen G M, Kong F Y, et al. Effect of tetracycline on the growth and photosynthesis of flue-cured tobacco [J]. Journal of Agro-Environment Science, 2017,36(1):48-56.
[10] 黄 丹,叶 茂,朱国繁,等.抗生素/抗性细菌/抗性基因在土壤-植物系统中迁移转化及阻控消减的研究进展 [J]. 土壤, 2020,52(5): 891-900.
Huang D, Ye M, Zhu G F, et al. Migration and risk control of antibiotic and antibiotic resistance bacteria/genes in soil-plant system: a review [J]. Soils, 2020,52(5):891-900.
[11] 王盼亮,张 昊,王瑞飞,等.抗生素暴露对小白菜幼苗生长及内生细菌的影响 [J]. 农业环境科学学报, 2017,36(9):1734-1740.
Wang P L, Zhang H, Wang R F, et al. Effects of antibiotic exposure on the growth and endophytic bacterial community of Chinese cabbage seedlings [J]. Journal of Agro-Environment Science, 2017,36(9): 1734-1740.
[12] 于晓雯,索全义,史李萍.外源四环素类抗生素对土壤微生物多样性的影响 [J]. 北方园艺, 2021,(2):91-96.
Yu X W, Suo Q Y, Shi L P. Effects of exogenous tetracycline antibiotics on soil microbial diversity [J]. Northern Horticulture, 2021,(2):91-96.
[13] 肖 磊,王海芳.四环素类抗生素在土壤环境中的残留及环境行为研究进展 [J]. 应用化工, 2020,49(12):3178-3184.
Xiao L, Wang H F. Tetracycline residues and environmental behavior of tetracycline antibiotics in soil: A review [J]. Applied Chemical Industry, 2020,49(12):3178-3184.
[14] Chuang Y H, Zhang Y J, Zhang W, et al. Comparison of accelerated solvent extraction and quick, easy, cheap, effective, rugged and safe method for extraction and determination of pharmaceuticals in vegetables [J]. Journal of Chromatography A, 2015,1404:1-9.
[15] 叶 倩,黄健祥,孙玲,等.QuEChERS-超高效液相色谱-串联质谱法测定叶类蔬菜中5种植物生长调节剂的残留 [J]. 农药学学报, 2017,19(5):589-596.
Ye Q, Huang J X, Sun L, et al. Determination of five plant growth regulator residues in leafy vegetables by QuEChERS-ultra performance liquid chromatography-tandem mass spectrometry [J]. Chinese Journal of Pesticide Science, 2017,19(5):589-596.
[16] Spoerri A S, Jan P, Cognard E, et al. Comprehensive screening of veterinary drugs in honey by ultra-high-performance liquid chromatography coupled to mass spectrometry [J]. Food Additives and Contaminants Part A-Chemistry Analysis Control Exposure & Risk Assessment, 2014,31(5):806-816.
[17] Hanna N, Sun P, Sun Q, et al. Presence of antibiotic residues in various environmental compartments of Shandong province in eastern China: Its potential for resistance development and ecological and human risk [J]. Environment International, 2018,114:131-142.
[18] Prosser R S, Sibley P K. Human health risk assessment of pharmaceuticals and personal care products in plant tissue due to biosolids and manure amendments, and wastewater irrigation [J]. Environment International, 2015,75:223-233.
[19] Liu X J, Liang C Z, Liu X H, et al. Occurrence and human health risk assessment of pharmaceuticals and personal care products in real agricultural systems with long-term reclaimed wastewater irrigation in Beijing, China [J]. Ecotoxicology and Environmental Safety, 2020, 190:110022.
[20] 国家体育总局.2014年国民体质监测公报 [EB/OL]. http://www. sport.gov.cn/n16/n1077/n1227/7328132.html,2015-11-25/2022-06-06.
General Administration of Sport of China. Bulletin of National Physical Fitness Monitoring in 2014[EB/OL]. http://www.sport. gov.cn/n16/n1077/n1227/7328132.html,2015-11-25/2022-06-06.
[21] 迟荪琳,王卫中,徐卫红,等.四环素类抗生素对不同蔬菜生长的影响及其富集转运特征 [J]. 环境科学, 2018,39(2):935-943.
Chi S L, Wang W Z, Xu W H, et al. Effects of tetracycline antibiotics on growth and characteristics of enrichment and transformation in two vegetables [J]. Environmental Science, 2018,39(2):935-943.
[22] 鲍陈燕,顾国平,章明奎.兽用抗生素胁迫对水芹生长及其抗生素积累的影响 [J]. 土壤通报, 2016,47(1):164-172.
Bao C Y, Gu G P, Zhang M K. Effects of veterinary antibiotic stress on growth and antibiotic accumulation of oenanthe javanica DC [J]. Chinese Journal of Soil Science, 2016,47(1):164-172.
[23] Khan K Y, Ali B, Zhang S, et al. Phytotoxic effects on chloroplast and UHPLC-HRMS based untargeted metabolomic responses in Allium tuberosum Rottler ex Sprengel (Chinese leek) exposed to antibiotics [J]. Ecotoxicology and environmental safety, 2022,234:113418-113418.
[24] 王晓洁,赵 蔚,张志超,等.兽用抗生素在土壤中的环境行为、生态毒性及危害调控 [J]. 中国科学:技术科学, 2021,51(6):615-636.
Wang X J, Zhao W, Zhang Z C, et al. Veterinary antibiotics in soil: environmental processes, ecotoxicity and risk mitigation [J]. Scientia Sinica(Technologica), 2021,51(6):615-636.
[25] 李伟明,鲍艳宇,周启星.四环素类抗生素降解途径及其主要降解产物研究进展 [J]. 应用生态学报, 2012,23(8):2300-2308.
Li W M, Bao Y Y, Zhou Q X. Degradation pathways and main degradation products of tetracycline antibiotics: Research progress [J]. Chinese Journal of Applied Ecology, 2012,23(8):2300-2308.
[26] Aks A, Mtm B, Ab C. A global perspective on the use, sales, exposure pathways, occurrence, fate and effects of veterinary antibiotics (VAs) in the environment - ScienceDirect [J]. Chemosphere, 2006,65(5): 725-759.
[27] 饶怡璇,汪 斌,何玉洁,等.抗生素在土壤中的归趋及不可提取态残留 [J]. 环境化学, 2022,41(2):549-560.
Rao Y X, Wang B, He Y J, et al. Fate and non-extractable residues of antibiotics in soil [J]. Environmental Chemistry, 2022,41(2):549-560.
[28] 章 程.典型抗生素在土壤-植物中的迁移及其机制 [D]. 北京:中国农业科学院, 2018.
Zhang C. The fate of veterinary antibiotics in system of soil and plants and their mechanism [D]. Beijing: Chinese Academy of Agricultural Sciences, 2018.
[29] 贺德春,吴根义,许振成,等.小白菜和白萝卜对四环素类抗生素的吸收累积特征 [J]. 农业环境科学学报, 2014,33(6):1095-1099.
He D C, Wu G Y, Xu Z C, et al. Uptake of selected tetracycline antibiotics by pakchoi and radish from manure-amended soils [J]. Journal of Agro-Environment Science, 2014,33(6):1095-1099.
[30] 李蓝青.肥料中四环素类抗生素的检测方法及其在土壤中的降解与作物吸收效应 [D]. 上海:上海交通大学, 2016.
Li L Q. Determination of tetracyclines in fertilizer and their degradation in soil and accumulation by crop [D]. Shanghai: Shanghai Jiao Tong University, 2016.
[31] 朱 昶.四环素和土霉素的光降解产物与土壤酶相互作用的研究 [D]. 青岛:山东大学, 2020.
Zhu X. Study on the interaction of photolysis products of tetracycline and oxytetracycline with soil enzymes [D]. Qingdao: Shandong University, 2020.
[32] 陈 龙,梁子宁,朱 华.植物内生菌研究进展 [J]. 生物技术通报, 2015,31(8):30-34.
Chen L, Liang Z N, Zhu H. Research advances in the atudies of plant entophytic [J]. Biotechnology Bulletin, 2015,31(8):30-34.
[33] Zhang H, Li X N, Yang Q X, et al. Plant growth, antibiotic uptake, and prevalence of antibiotic resistance in an endophytic system of pakchoi under antibiotic exposure [J]. International Journal of Environmental Research and Public Health, 2017,14(11):1136.
[34] Yashiro E, Mcmanus P S. Effect of Streptomycin Treatment on Bacterial Community Structure in the Apple Phyllosphere [J]. Plos One, 2012,7(5):e37131.
[35] Wang Y, Lu J, Mao L K, et al. Antiepileptic drug carbamazepine promotes horizontal transfer of plasmid-borne multi-antibiotic resistance genes within and across bacterial genera [J]. Isme Journal, 2019,13(2):509-522.
[36] Stockwell V O, Duffy B. Use of antibiotics in plant agriculture [J]. Revue Scientifique Et Technique-Office International Des Epizooties, 2012,31(1):199-210.
[37] 明德松,潘艳萍,朱 炎.鲁氏不动杆菌的临床分布及耐药性分析 [J]. 中华医院感染学杂志, 2014,24(10):2351-2352,2355.
Ming D X, Pan Y P, Zhu Y. Clinical distribution and drug resistance of Acinetobacter lwoffii [J]. Chinese Journal of Nosocomiology, 2014, 24(10):2351-2352,2355.
[38] Chen Z Y, Zhang Y J, Gao Y Z, et al. Influence of dissolved organic matter on tetracycline bioavailability to an antibiotic-resistant bacterium [J]. Environmental Science & Technology, 2015,49(18): 10903-10910.
[39] Zhang Y J, Hu H W, Chen Q L, et al. Transfer of antibiotic resistance from manure-amended soils to vegetable microbiomes [J]. Environment International, 2019,130:104912.
[40] Mahmoud M a M, Abdel-Mohsein H S. Hysterical tetracycline in intensive poultry farms accountable for substantial gene resistance, health and ecological risk in Egypt-manure and fish [J]. Environmental Pollution, 2019,255:113039.
[41] Ahmed M B M, Rajapaksha A U, Lim J E, et al. Distribution and accumulative pattern of tetracyclines and sulfonamides in edible vegetables of cucumber, tomato, and lettuce [J]. Journal of Agricultural and Food Chemistry, 2015,63(2):398-405.
[42] 王卫中,迟荪琳,徐卫红.四环素类抗生素对土壤-生菜系统的生物效应及其迁移降解特性 [J]. 环境科学, 2021,42(3):1545-1558.
Wang W Z, Chi S L, Xu W H. Biological effect of tetracycline antibiotics on a soil-lettuce system and its migration degradation characteristics [J]. Environmental Science, 2021,42(3):1545-1558.
Enrichment of antibiotics in cherry radish and its potential risk.
LI Yang-yang, MEI Qin-yuan, LIU Zi-yin, YIN Li-chun, WANG Xing-shuo, CHEN Ze-you*
(Department of Environmental Science and Engineering, Nankai University, Tianjin 300071, China)., 2023,43(1):351~360
To explore the potential ecological and health risks of soil antibiotic pollution, a greenhouse pot experiment on cherry radishes was conducted from June to September 2021. Oxytetracycline (OTC) or streptomycin (STR) contaminated water was applied to soil every 6days, and the biomass, plant uptake of antibiotics, and the antibiotic resistance characteristics of the microbiome of cherry radish were analyzed. In addition, the potential human health risks of residual antibiotic and antibiotic-resistant bacteria (ARB) in radish plants were evaluated by risk quotient, calculation of intake index, and the mouse feeding tests. The results showed that continuous application of OTC significantly promoted the growth of radish plants and increased the total biomass of radish plants by 23.1% on 74 days compared with the non-antibiotic applied control group, while continuous application of STR had no significant effect on the growth of radish plants. Radish plants accumulated a certain amount of the applied two antibiotics, and the residual amount of STR in tissues was higher than OTC by 1~2 orders of magnitude. Antibiotics were mainly enriched in leaves at the early growth stage, and antibiotic residue in the neck of fleshy roots at the later growth stage was significantly increased (< 0.05). The proportion of culturable OTC- and STR-resistant bacteria in total culturable bacteria increased by 2.48×10-6%~5.05 ×10-4% and 0.19%~3.32%, respectively. Consumption of the neck of fleshy roots exposed to antibiotics could increase the body's intake of antibiotics and ARB, but the associated health risk was relatively low, as the assessed risk index HQ was less than 0.1 and the antibiotic residue in feces of mice eating radish plants was below the detection limit.
oxytetracycline (OTC);streptomycin (STR);cherry radish;plant enrichment;antibiotic resistance bacteria;health risk
X53
A
1000-6923(2023)01-0351-10
李杨洋(2001-),女,湖南湘潭人,本科生,主要从事环境微生物学的研究.
2022-06-06
国家自然科学基金资助项目(41977367);南开大学本科生创新科研项目(202110055797)
* 责任作者, 副教授, zeyou@nankai.edu.cn

