城市湿地水生植物对附生轮虫多样性的影响
梁迪文,刘 璐,黄春荣,叶 蓁,孙双双,许 睿,杨宇峰,董家华,梁明易,钟志强*
城市湿地水生植物对附生轮虫多样性的影响
梁迪文1,刘 璐2,黄春荣1,叶 蓁1,孙双双1,许 睿1,杨宇峰2,董家华1,梁明易1,钟志强1*
(1.生态环境部华南环境科学研究所,国家环境保护城市生态环境模拟与保护重点实验室,广东 广州 510530;2.暨南大学生态系,广东 广州 510632)
于2021年6~10月对海珠湿地连通水系水区及三类水生植物体表附生的轮虫群落结构开展研究,分析水生植物附生轮虫多样性及群落动态特征.研究期间共记录轮虫70种,其中水生植物水区最多,记录47种.水生植物均有大量轮虫附生,变化范围在108~5826ind./gdw之间,且附生轮虫丰度呈现沉水植物>浮叶植物>挺水植物的变化趋势.水生植物附生群落、无植物水区和水生植物栽培区3种生境轮虫群落物种组成差异明显.水生植物附生群落中游动能力较弱的腔轮虫、镜轮虫、鞍甲轮虫等敏感类群占据优势,而无水生植物区和水生植物水区群落中以游泳能力较强的多肢轮属、龟纹轮属和臂尾轮属等耐污类群占据优势.3类型水生植物附生轮虫群落Shannon-Weiner多样性指数与Pielou’s均匀性指数均显著高于无植物栽培水区(<0.05).3类水生植物均为轮虫提供了生境支持,有效提高城市湿地生态系统生物多样性.
生物多样性;群落结构;浮游动物;城市生态;生态修复
轮虫是水生态系统食物网的重要组成部分,作为鱼类幼苗的开口饵料,连接着初级生产者与次级消费者,是传统食物网和微型食物网链接的关键环节,在生态系统物质循环和能量流动过程中担当承上启下的重要角色[1-2].由于其分类群特征与多样性变化能对环境恶化做出快速响应,已被广泛作为水生态系统健康评价的指示性生物[3].
大型水生植物可增氧固碳,有效吸收水体中的氮、磷等营养盐及重金属,减轻水体富营养化程度,改善水质[4-6].植物栽培还可提高浅水湖泊中浮游轮虫多样性,水生植物区轮虫群落结构生物多样性要高于无水生植物区[7-8].一方面,水生植物的存在会为轮虫等小型浮游生物提供更多栖息地和育幼场所,在一定程度上增加了水区轮虫物种多样性[9].另一方面水生植物改变了水质状况从而影响水区轮虫群落结构[7].
目前关于湿地水生植物轮虫群落结构特征及其影响因素研究主要集中在温带,而亚热带湿地仍缺乏系统的研究[7-9,10-12].温带不同湿地研究中发现,挺水植物、浮叶植物、沉水植物覆盖水区其浮游轮虫物种组成有明显差异[8,10],浮叶植物水区对岸栖型镜轮属支持度较高,沉水植物区对浮游类三肢轮属、疣毛轮属支持度较高[8].金鱼藻属、轮藻属等沉水植物对温带湿地水区轮虫生物多样性支持度往往较香蒲属、芦苇等挺水植物高[10].
以往湿地大型水生植物对轮虫多样性及群落变化影响研究大多集中在水区浮游类群上,关于附生于水生植物上的轮虫群落特征研究较少.由于附生群落同样受到水环境影响,相同类型植物在不同湿地下其附生生物丰度存在明显差异[13].气候带、水文连通性等对轮虫等浮游动物群落结构异质性的影响往往较生境变化影响更强[14-15].因此,亚热带湿地连通水系中不同水生植物附生轮虫多样性及群落变化研究具有其必要性.
广州海珠湿地位于大湾区核心城市广州市中心,占地面积1100hm2,是全国特大城市中心区最具代表性的亚热带国家湿地公园.海珠湿地已记录水生植物约63种[16],其丰富的水生植物资源为水生植物附生轮虫群落特征研究提供了天然的受试场所.本研究拟识别湿地连通水系中不同类型水生植物附生轮虫多样性及群落动态特征,以期为生态修复中水生植物种植规划和亚热带城市湿地生物多样性保护提供科学支撑.
1 材料与方法
1.1 研究区域概况与采样点设置
本研究于2021年6-10月湿地大型水生植物生长期间,开展每月一次的采样调查.选取海珠湿地一期优势沉水植物苦草(sp.)、优势浮叶植物睡莲(sp.)和优势挺水植物再力花()进行水生植物附生轮虫群落研究.在海珠湿地一期连通水系中设置采样点共10个,其中无水生植物水区设置采样点2个(Non-M1、Non-M2),水生植物水区中设置2个(M1、M2),水生植物区苦草(Val1、Val2)、睡莲(Nym1、Nym2)、再力花(Tha1、Tha2)生境各设置2个采样点,分别采集无水生植物区水体轮虫和甲壳类样品、水生植物区水体轮虫和甲壳类样品和水生植物附生轮虫和甲壳类样品(图1).
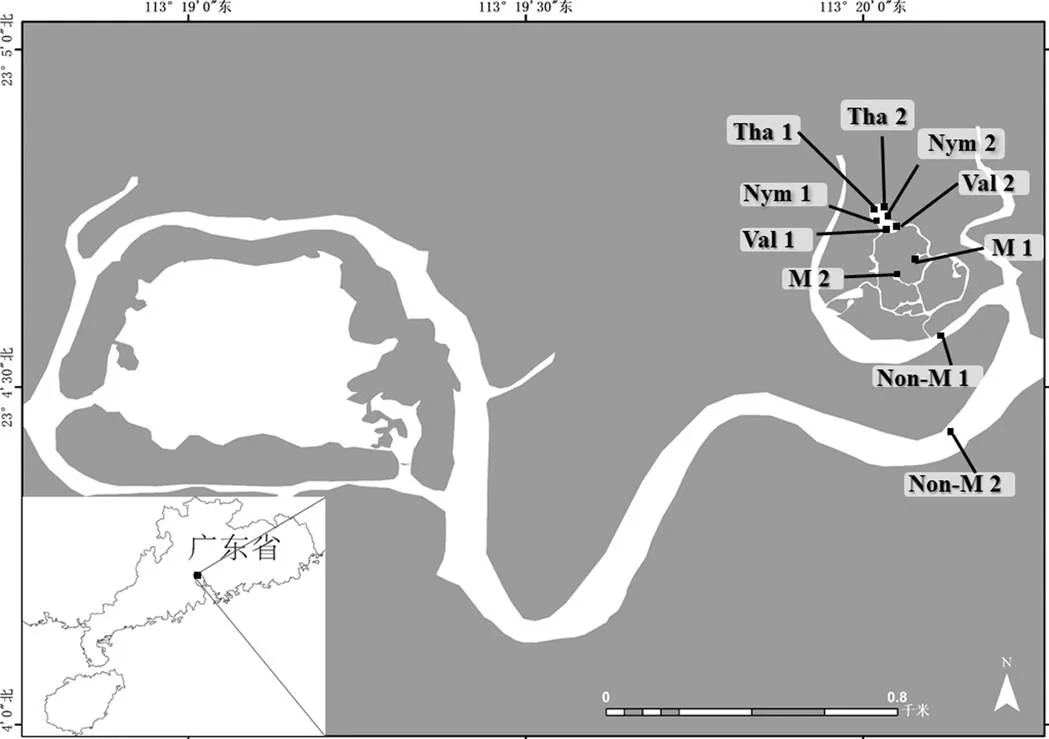
图1 海珠湿地连通水体采样点站位
Val: 苦草; Nym: 睡莲; Tha: 再力花; M: 水生植物水区; Non-M: 无水生植物水区
审图号:GS(2019)3266号
1.2 样品采集与分析
1.2.1 水生植物附生轮虫样品采集 使用高枝剪采集3类典型水生植物,置于装有1L蒸馏水的2L量杯中进行现场洗脱.使用小枝剪剪下挺水植物浸没于水下的植物部分洗脱,浮叶植物和沉水植物全部置于量杯中洗脱.定性样品:于装有1L蒸馏水的2L量杯中加入单种水生植物,将样品置于量杯中浸泡、搅拌洗脱后,该水样于30mm孔径筛网进行过滤,收集于50mL离心管中,回到实验室后显微镜下观察进行物种鉴定.定量样品:通过排水法确定植物体积,取体积约40mL的水生植物进行植物附生轮虫定量样品收集.植物在量杯中经浸泡、搅拌洗脱后,该水样于30mm孔径筛网进行过滤,收集于50mL离心管中,加入2%鲁哥试剂现场固定.每个采样点采集2份平行样.
1.2.2 水区轮虫样品采集与分析 使用采水器采集水区表中底层水样于桶内混合,采用30mm孔径筛网过滤浓缩10L混合水样后,于50mL离心管保存,加入2%鲁哥试剂现场固定.依据Koste(1978)分类系统以及中国动物志[17-19]进行物种鉴定.
定量样品摇匀后随机取1mL于计数框,在显微镜下进行全片计数.每个样品计数2片取平均值,每片计数误差不超过20%.水区轮虫丰度最后转换为ind./L,水生植物附生轮虫丰度最后转换为ind./ gdw[13].
1.2.3 环境因子参数测定 水区环境物理因子测定:使用YSI-plus水质分析仪(美国)现场测定并记录水温(Temp)、水深(Depth)、溶氧(DO)和pH值;使用萨氏盘测定水体透明度(SD).化学因子:在各采样点采集水样,实验室内按《国家地表水环境质量标准GB3838-2002》[20]测定总氮(TN)、氨氮(NH4-N)、总磷(TP)浓度、化学需氧量(CODMn),使用丙酮分光光度法测定叶绿素(Chl-)浓度.
植物生物量测定:使用排水法测量记录植物体积,现场浸泡洗脱附生轮虫后,植物样品使用密封袋封装.带回实验室后将封口袋内植物晾干至无水珠下滴,放入烧杯中称量其湿重.以铝箔纸封盖烧杯口,随后置于烘箱60℃中烘干24h以上,直至干重没有出现变化,测定植物干重,计算植物含水率.
1.2 数据处理与分析
为了减少离群值对模型拟合效果的影响,对物种丰富度数据集进行log(n+1)对数转换标准化.使用PRIMER 5进行轮虫群落结构分析.
a多样性:采用Margalef物种丰富度指数()、Simpson多样性指数()、Shannon-Weiner多样性指数()和Pielou’s均匀度指数()评估水体中轮虫群落多样性.
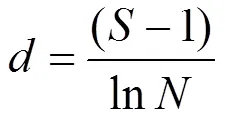
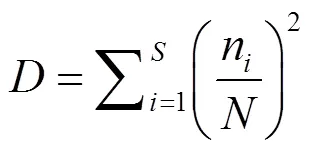
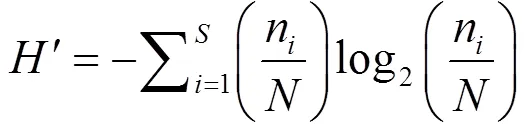
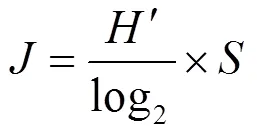
式中:为种类数;n为某物种个数;为样品中所有种类总个数.
物种优势度使用McNaughton优势度公式()进行计算:
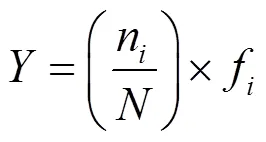
式中:n为第种的个数;f为第种的出现频率;为所有种类出现的总个数.
b多样性:基于Bray-Curtis距离进行β群落多样性分析,包括非度量多维尺度量分析(NMDS)和组间相似性分析(ANOSIM).NMDS属于非约束性排序,反映轮虫群落在生态系统中的聚集趋势,而ANOSIM用于检查组间差异的显著程度;>0.75意味着相差很大;>0.5表示中等差异,>0.25表示差异较小.
以Chl-为基准,TN、TP、SD和CODMn相关加权营养状态综合指数(TLIc)评价水体营养状态:
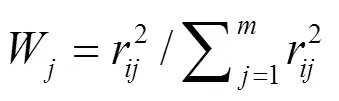
式中:W代表第种参数的营养状态指数的权重;r代表第个参数(Chl-, 1; TP, 0.84; TN, 0.82; SD, −0.83; CODMn, 0.83)与Chl-之间的相关系数;代表参与的指标数目.营养状态分级为:TLIc(Σ)<30时为贫营养;30£TLI(Σ)£50时为中营养;TLIc(Σ)>50时为富营养;50
使用Origin2016软件进行作图.使用SPSS软件进行显著性分析,对符合正态分布的数据采用t检验或单因素方差分析(ANOVA);对不符合正态分布的数据进行非参数检验Mann-Whitney或Kruskal- Wallis分析.
2 结果与分析
2.1 环境因子特征
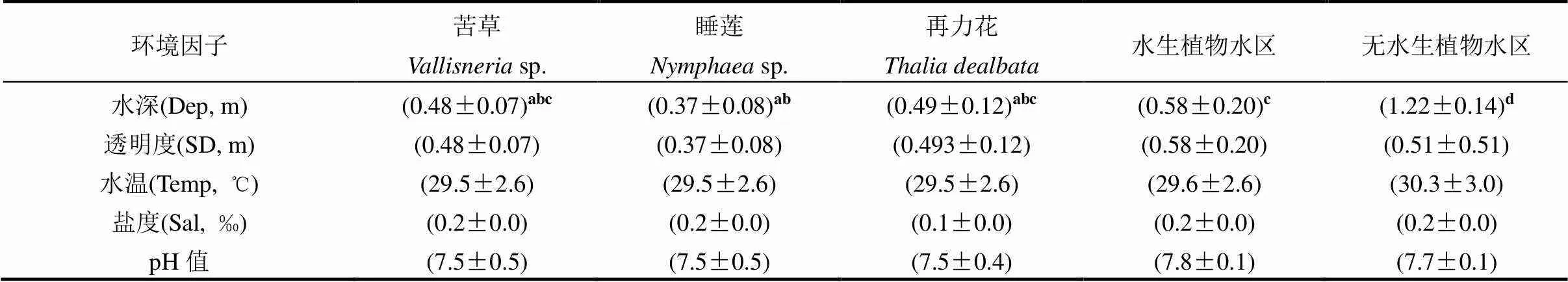
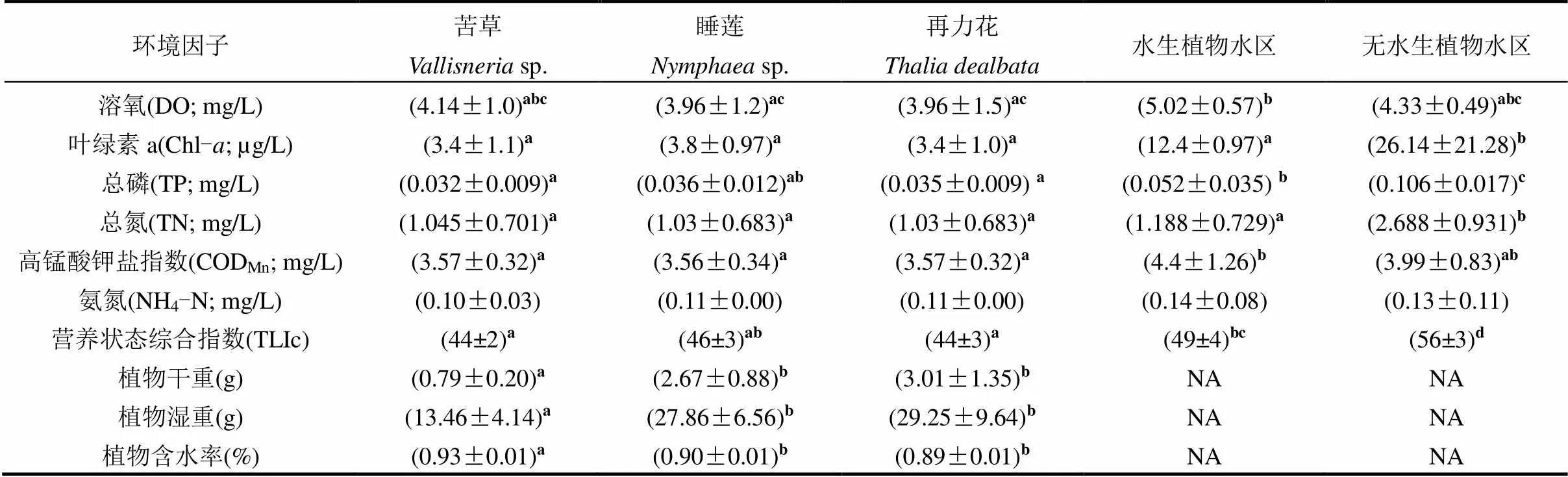
表1 五种不同生境理化环境因子平均值(平均值±标准差)
续表1
注:同行不同字母表示不同水体理化指标之间差异显著(<0.05;Kruskal-Wallis检验); NA表示无数.
调查期间平均水温变化范围在24~33℃.各生境环境因子随月份变化波动较小,而不同生境差异较明显(表1).三类大型水生植物旁和水生植物种植水区富营养化相关参数Chl-、TP、TN和TLIc均显著低于无水生植物水区(<0.05).根据营养状态综合指数标准,水生植物水区处于中营养水平而无水生植物种植水区处于轻度富营养水平.
2.2 不同生境轮虫种类组成
调查期间在海珠湿地一期连通水系中共检出轮虫70种(属),其中苦草附生43种,睡莲附生50种,再力花附生40种,水生植物水区47种,无水生植物水区43种(表2).五类生境中共有种类18种,苦草附生生境和无水生植物水区生境独有种类最多(4种),其次为睡莲附生生境(3种)、再力花附生生境(2种)和水生植物水区(2种)(图2).无水生植物水区独有种为耐污类群:可变臂尾轮虫()、尾突臂尾轮虫()和敏感类群:史氏腔轮虫()、尖头异尾轮虫();而植物附生独有种类皆为瓷甲异尾轮虫()、冠饰异尾轮虫()、尖棘腔轮虫()、唇形叶轮虫()、盘镜轮虫()等敏感类群.
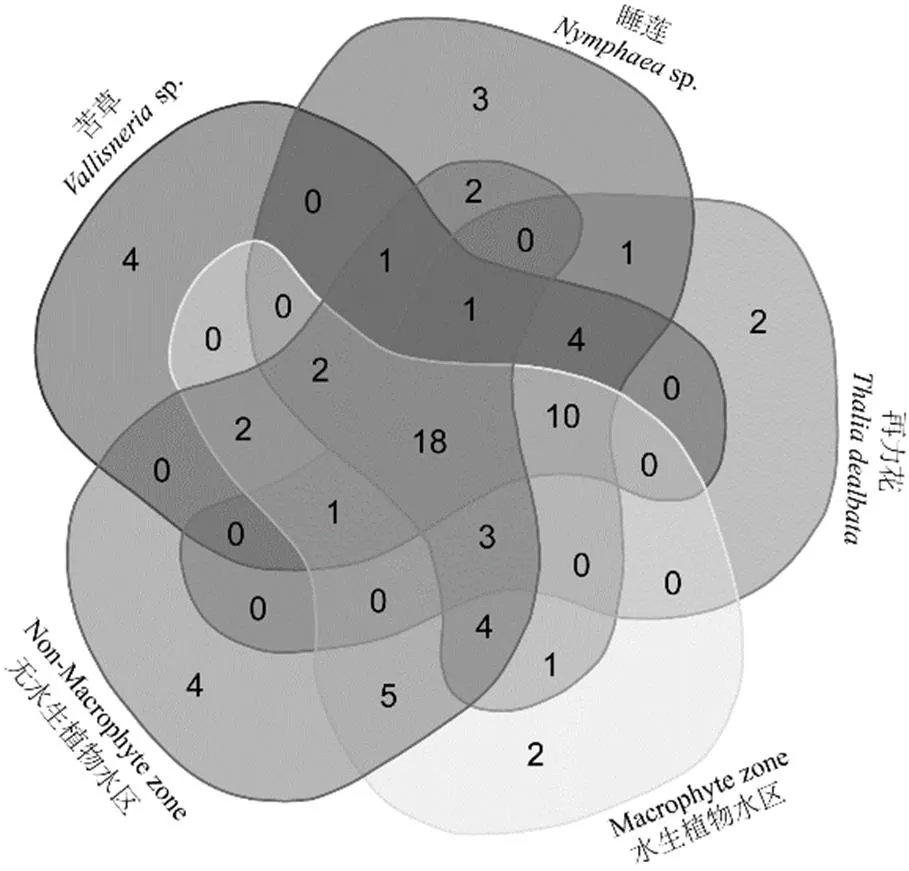
图2 五类不同生境独有和共有物种组成Venn图
苦草=10;睡莲=10;再力花=10;水生植物水区=10;无水生植物水区=10

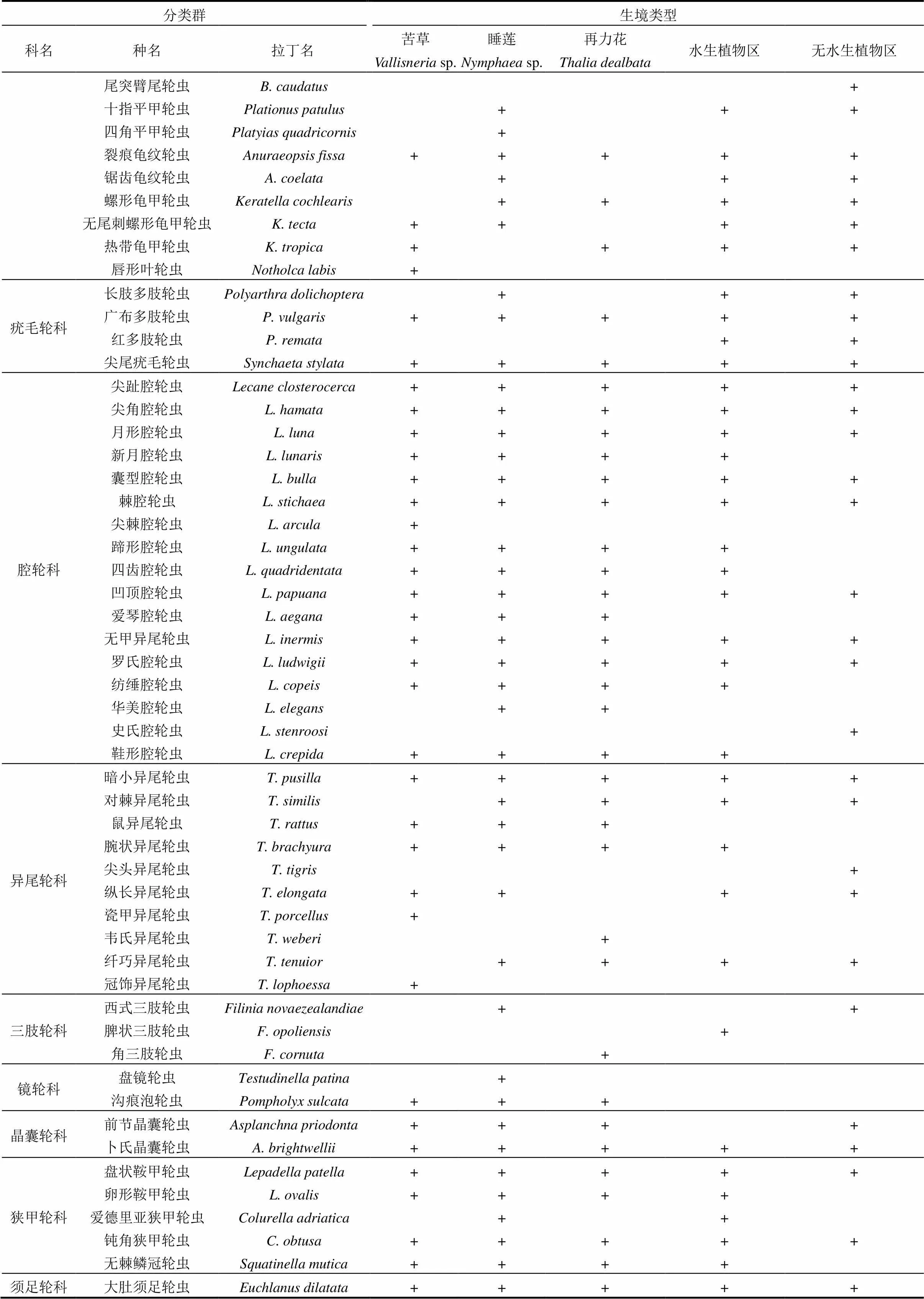
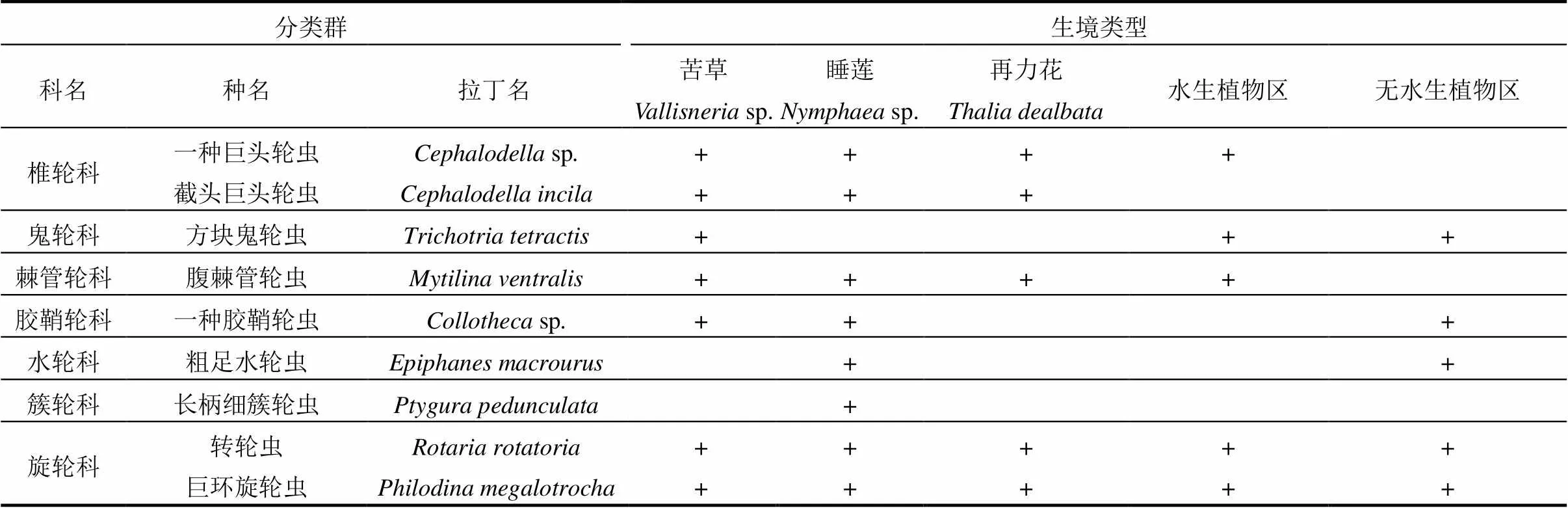
表2 五类不同生境轮虫种类名录
续表2
续表2
注:+表示在该站位有出现.
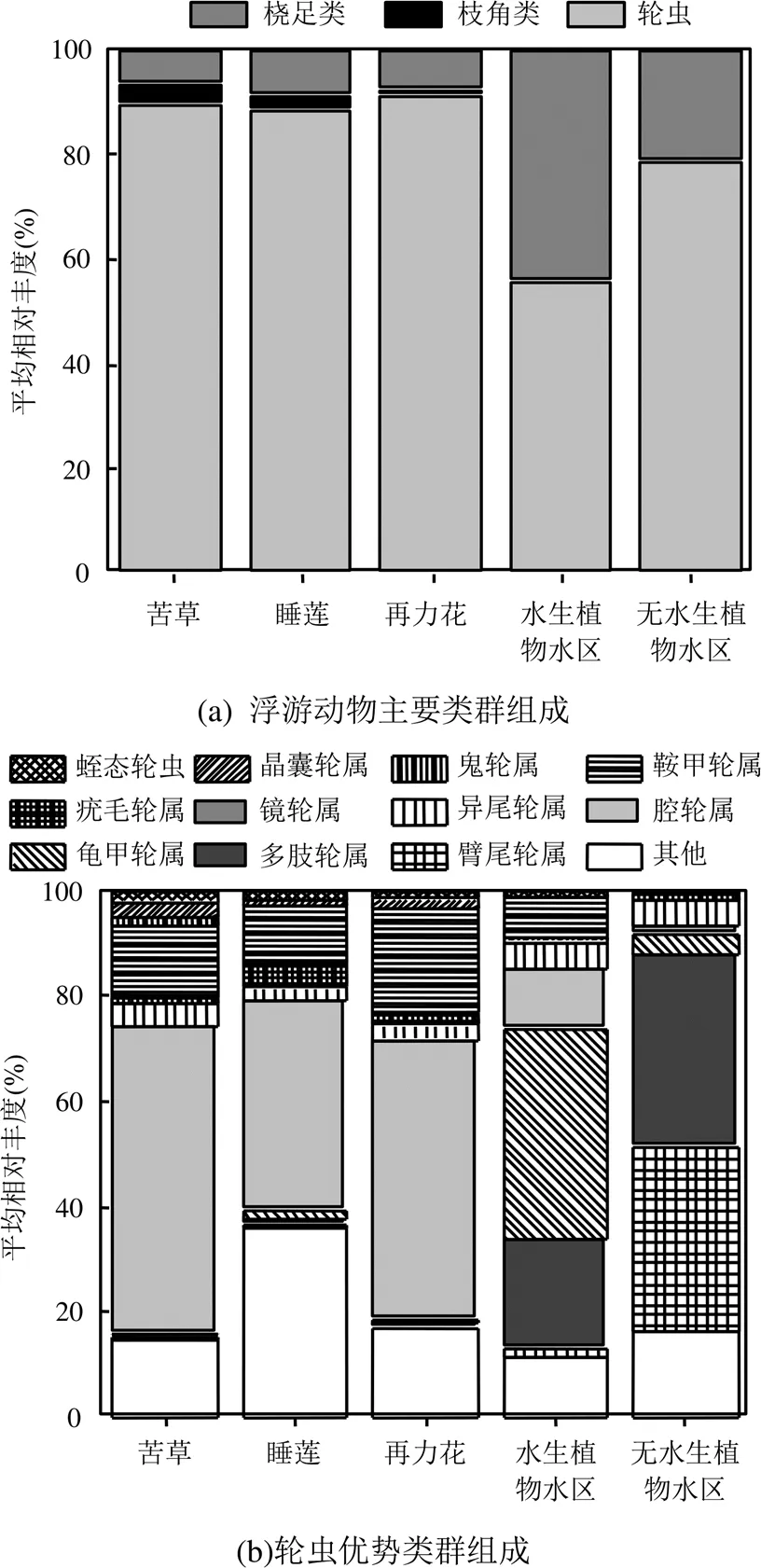
图3 五类不同生境浮游动物各类群平均相对丰度
苦草=10;睡莲=10;再力花=10;水生植物水区=10;无水生植物水区=10
不同生境下浮游动物优势类群组成差异明显.枝角类和桡足类中大型浮游动物在水生植物水区和无水生植物水区中占比较高,平均相对丰度分别为45%和21%;而在苦草、睡莲、再力花附生类群中占比较低,平均相对丰度仅分别为10%、12%和9%.小型浮游动物轮虫在植物附生类群中占比较高,达到88%或以上(图3a).三类大型水生植物附生轮虫优势类群为腔轮属(=0.489)、鞍甲轮属(=0.131)和异尾轮属(=0.026);水生植物水区优势类群为龟甲轮属(=0.315)、多肢轮属(=0.208)、腔轮属(=0.125)、鞍甲轮属(=0.040)和异尾轮属(=0.039);无水生植物水区优势类群为臂尾轮属(=0.348)、多肢轮属(=0.294)、异尾轮属(=0.053)和龟甲轮属(=0.029)(图3b).
2.3 不同生境轮虫总丰度变化
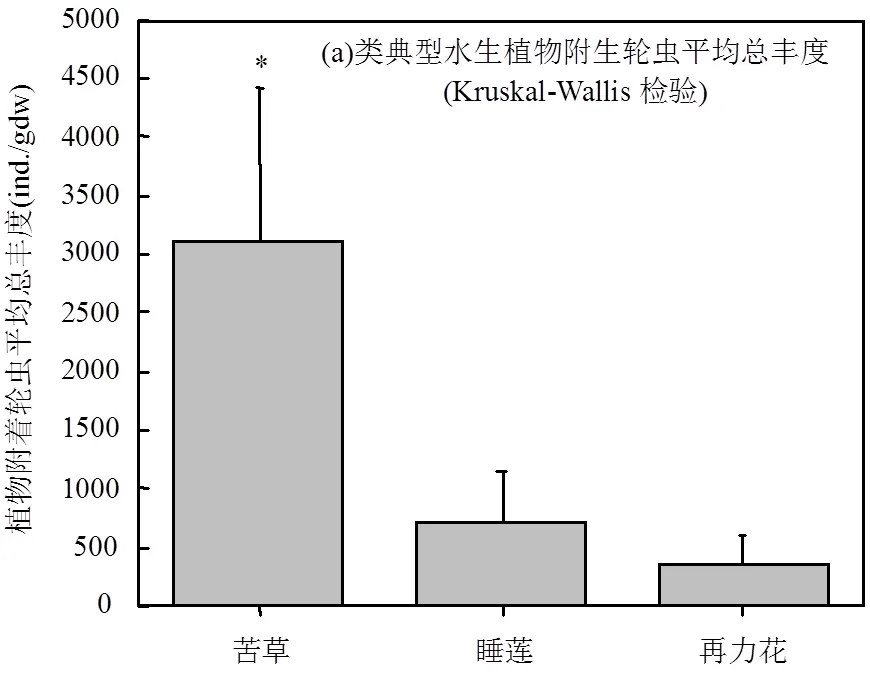
水生植物水区和无水生植物水区轮虫丰度变化范围分别在191~572ind./L和35~440ind./L之间;大型水生植物附生的轮虫丰度变化范围在108~5826ind./ gdw(个/每克植物干重)之间(图4).三类典型水生植物中,沉水植物苦草附生轮虫平均丰度达(3098±1317)ind./gdw,显著高于浮叶植物睡莲(713±428)ind./gdw和挺水植物再力花(364±219)ind./gdw附生的轮虫平均丰度(<0.05).水生植物种植水区轮虫平均总丰度为(205±134)ind./L,也显著高于无水生植物种植水区(121±134)ind./L;<0.05.
2.4 不同生境轮虫群落结构与多样性特征
NMDS分析显示,植物附生轮虫群落、水生植物区、无水生植物水区生境群落分化显著,而不同类型水生植物附生轮虫群落差异不明显,植物附生轮虫类群呈现季节变化明显(图5a).水生植物区和无水生植物区群落样本集中在第一和第四象限且呈现明显生境分化趋势,三类大型水生植物附生群落样本聚集在第二和第三象限且呈现生境混合趋势.
苦草=10;睡莲=10;再力花=10;水生植物水区=10;无水生植物水区=10
ANOSIM结果表明,五类不同生境轮虫群落结构差异显著,且组间差异大于组内差异(Global= 0.65,<0.01).其中,苦草附生群落与无水生植物区群落之间差异最大(=1,<0.01),睡莲、再力花附生轮虫群落与水区轮虫群落差异也较大(均大于0.75,<0.01).苦草、睡莲、再力花附生轮虫群落之间相似度较高(均小于0.2,>0.05).
以群落结构差异最大的苦草附生群落与无水生植物区群落为例,差异贡献率分析显示,两种生境之间群落结构差异主要是由优势物种组成差异造成.贡献率较高的耐污种类广布多肢轮虫、萼花臂尾轮虫、角突臂尾轮虫在无水生植物区平均丰度要高于苦草生境,而寡污染指示种(敏感种类)尖趾腔轮虫、尖角腔轮虫、盘状鞍甲轮虫等在苦草生境中要高于无水生植物区(图5b).
苦草、睡莲和再力花附生轮虫群落Pielou’s均匀度指数分别为(0.84±0.05)、(0.80±0.67)和(0.86±0.55),均显著高于水生植物水区(0.55±0.12)和无水生植物水区群落(0.70±0.08) (<0.05).三类典型水生植物附生轮虫群落Shannon-Weiner多样性指数分别为(2.44±0.15)、(2.27±0.37)和(2.36±0.22),均显著高于水生植物水区(1.63±0.40)和无水生植物水区群落(0.76±0.13)(<0.05).此外,苦草(0.88±0.03)和再力花(0.87±0.03)附生群落Simpson多样性指数也显著高于水生植物水区(0.65±0.15)和无水生植物水区群落(0.76±0.13) (<0.05)(图6).
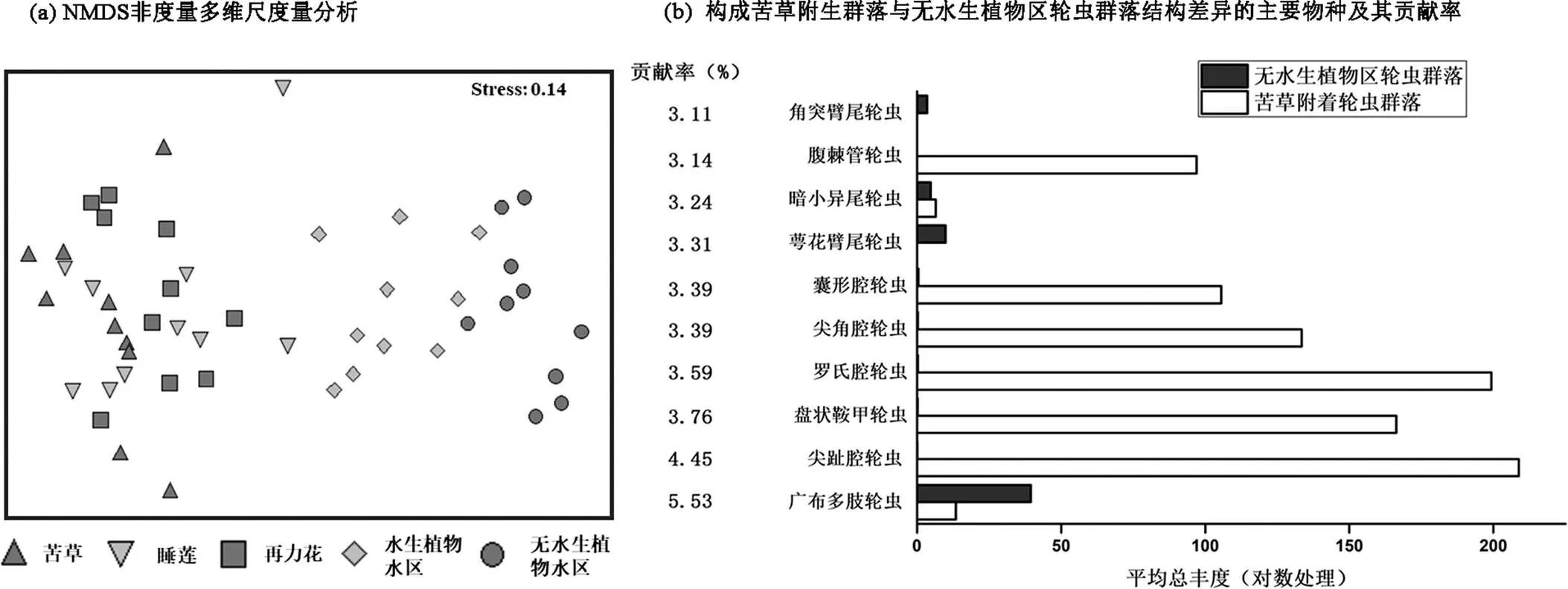
图5 五类不同生境轮虫群落结构差异特征
苦草N=10;睡莲N=10;再力花N=10;水生植物水区N=10;无水生植物水区N=10

图6 五类不同生境轮虫群落a多样性指数
苦草=10;睡莲=10;再力花=10;水生植物水区=10;无水生植物水区=10; Kruskal-Wallis检验
2.5 附生轮虫与生境环境因子关系
植物附生轮虫总丰度与周围环境Temp、pH值、CODMn和NH4-N非生物因素呈显著负相关,与水生植物含水率、植物附着桡足类、枝角类丰度呈显著正相关(表3).逐次回归分析得出:植物附生轮虫总丰度=0.644+0.635植物含水率**-0.331水温*(Adjust2=0.49,<0.01).表明植物属性和水温是影响植物附生轮虫丰度的主要因素.连通水系轮虫群落结构多样性与均匀性指数均呈现与Dep、Chl-、CODMn、TP、TLIc指数呈显著负相关关系(<0.05).
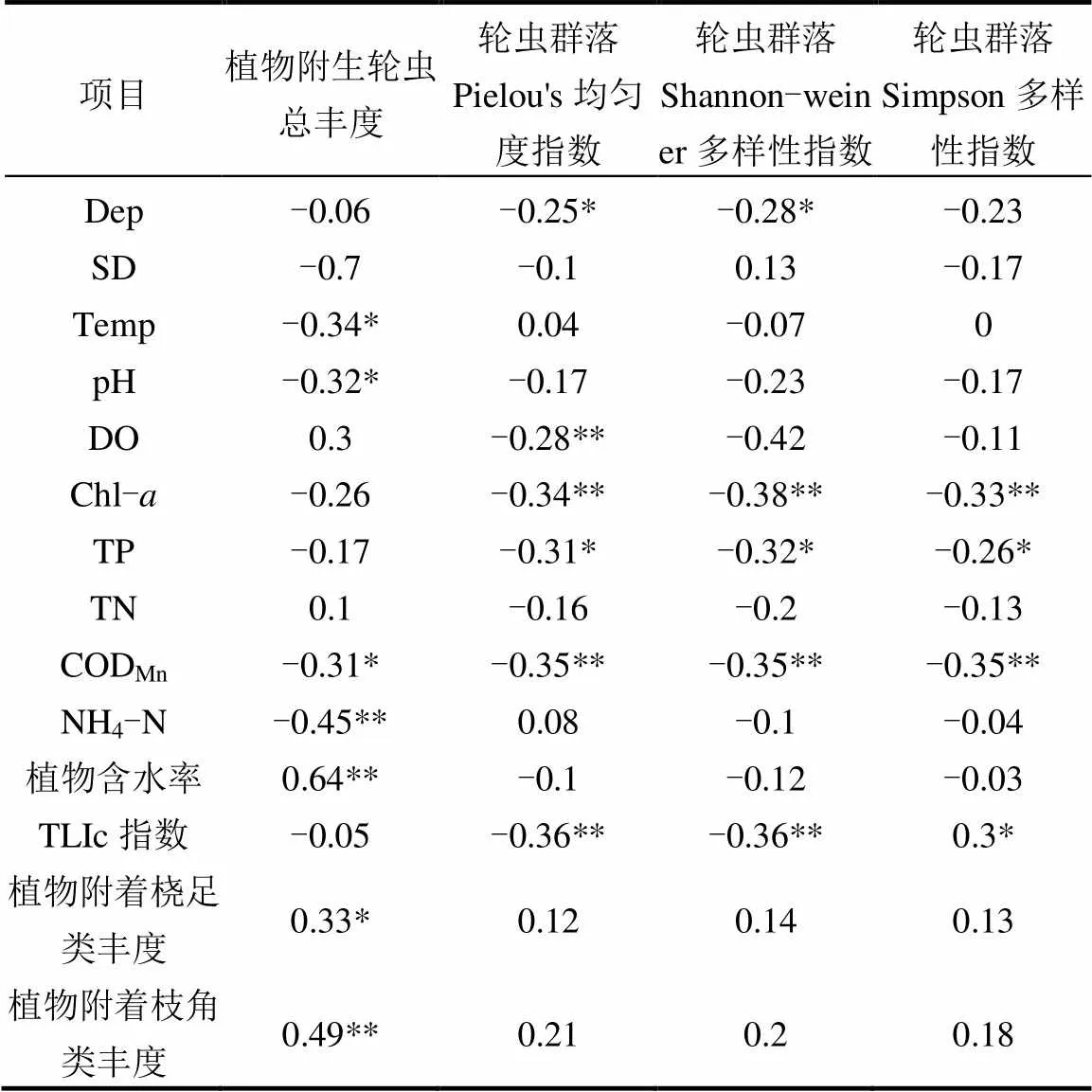
表3 轮虫群落特征与环境因子的Pearson相关性分析
注:*表示<0.05; **表示<0.01.
3 讨论
3.1 水生植物对附生轮虫群落的生境支持作用
“下行效应”是影响轮虫等浮游动物群落结构变化的重要因素之一[22],当水环境中桡足类和枝角类等中大型浮游动物较多时,小型浮游动物轮虫会受到中大型浮游动物竞争和捕食压力[23].本研究结果发现植物附生轮虫丰度与附着的大型浮游动物枝角类和桡足类丰度呈显著正相关关系,表明水生植物对大型和小型浮游动物作用一致.此外,大型水生植物附生浮游动物群落中轮虫相对丰度达到88%以上,远高于其在水生植物水区和无水生植物水区中的比例,表明水生植物对小型浮游动物支持作用更明显.水生植物叶片以及茎秆为小型浮游动物轮虫提供避难所,以躲避大型捕食者[24].
水生植物对轮虫不同类群生境支持作用存在差异,其主要为岸栖型轮虫提供附生平台[11].本研究发现三类大型水生植物附生轮虫主要类群为腔轮属、鞍甲轮属、晶囊轮属、疣毛轮属和镜轮属类群.腔轮属、鞍甲轮属、镜轮属和蛭态亚纲等岸栖型轮虫由于其移动能力较弱,在植物庇护下更容易躲避捕食者,而龟甲轮属、多肢轮属、臂尾轮属等由于移动能力强且进化出一系列反捕食策略更能适应开阔水域的生活[25].
腔轮属、鞍甲轮属等附生型物种需要诸如水下茎或叶表面基质进行附着,并且由于它们的体积小活动度低,这使得它们被捕食者发现几率降低,在植物生境中成为优势类群[26].此外,大型水生植物密度高时,复杂叶茎分布会干扰鱼类和大型浮游动物的游泳和捕食行为[27].因此,大型水生植物为游泳能力弱的腔轮属、鞍甲轮属、镜轮属轮虫甚至也为多肢轮属、臂尾轮属等逃逸能力强的浮游类群提供躲避捕食者的天然庇护场所[10].
本研究发现,连通水体中不同类型水生植物轮虫附着群落差异不显著.虽然三类水生植物均记录有个别独有物种,但物种组成尤其是优势种组成较为一致.在河湖连通水系中,水文连通程度在调节浮游动物群落组成方面比生境类型更为重要[15, 28-29].水体连通程度高时,水环境变化较为一致[28],当水体连通性较低时,水温、盐度和氮、磷营养盐含量等理化因子则是其群落结构的主要影响因素[15].
非连通湿地中,挺水植物、浮叶植物、沉水植物覆盖水区浮游轮虫物种组成有明显差异[8, 11].浮叶植物水区对岸栖型镜轮属支持度较高;沉水植物区对浮游类三肢轮属、疣毛轮属支持度较高,但部分岸栖型如狭甲轮属、棘管轮属、异尾轮属等则与植物的干重关系大于植物形态特征[10].因此,非连通水体中附生轮虫种类组成受植物类型影响较大,更大可能是与不同水体的植物所在水环境差异有关.
3.2 不同类型水生植物对附生轮虫丰度影响
不同类型水生植物附生轮虫丰度有显著差异.本研究结果显示沉水植物苦草附生轮虫平均丰度(3098±1317)ind./gdw显著高于浮叶植物睡莲(713±428)ind./gdw和挺水植物再力花(364±219)ind./ gdw,且附生丰度呈现苦草>睡莲>再力花的变化趋势.植物附生轮虫丰度会因所处湿地气候环境不同而有所差别,但总体以浮叶植物和沉水植物丰度最高.温带湿地研究中发现沉水植物金鱼藻上附生轮虫平均丰度最高,达(2784±784)ind./gdw;其次为浮叶植物槐叶萍,达(2547±917)ind./gdw挺水植物芦苇最低仅为101ind./gdw[13].植物附生轮虫丰度在温带和亚热带湿地的结果均呈现沉水植物>浮叶植物>挺水植物的变化趋势.沉水植物金鱼藻与苦草的附生轮虫丰度较为接近,附生轮虫倾向于附生在沉水植物和浮叶植物上,可能与它们单位质量下在水中的表面积大有关[30].相同质量的植物下,苦草、金鱼藻和睡莲等植物叶片更薄,可为轮虫提供更多的附着空间;而挺水植物茎秆往往为圆柱状,相同质量下其可供轮虫等浮游动物附着的表面积相对浮叶植物和沉水植物较少.等水生植物质量下,沉水植物可提供更多的附生轮虫生物丰度.
在温带湿地中,当水生植物数量增加时,记录的物种数量增加,附生轮虫b-多样性也会明显增加,当植物种类和数量增加到一定程度时,生境空间和异质性已充足,b多样性曲线趋于收敛[13].本研究也发现3种类型水生植物中均记录有独有物种,表明植物混搭在一定空间内提供更多的微生境,吸引更多物种常驻,增加了区域生物多样性.
不同生境下,轮虫群落结构的关键因子有差异.在湖泊中,氮和磷营养盐往往是轮虫群落结构差异与多样性指数变化的驱动因子[31-32],但水库河流连通水体研究中发现,物理因子和水文条件反而是影响轮虫群落变异和多样性的主要因素[33].本研究提出水生植物存在与否是影响湿地生境轮虫群落结构的关键因素.因为在无水生植物的湖泊河流中,轮虫丰度随氨氮和CODMn含量升高而增加[34],但本研究发现存在水生植物的连通水系中,植物附生轮虫丰度与CODMn、氨氮含量呈显著负相关关系.温带地区水生植物覆盖的沿岸生境也发现蛭态轮虫和岸栖型轮虫丰度与水体营养盐呈负相关关系[35],表明水生植物的存在可能改变了轮虫丰度的关键影响因素.
此外,环境因子和植物附生轮虫丰度关系分析表明其丰度主要受周围环境水温和水生植物属性(附生基质类型)影响.单位体积下,含水率较高的沉水植物苦草干重和湿重要低于睡莲和再力花茎秆,其较高的表面积可为轮虫提供更多的附生基质.沉水植物表面粗糙,比浮叶植物富集更多悬浮颗粒物,更易于轮虫附生[36].
3.3 水生植物栽培对维持湿地水生态健康作用
本研究发现大型水生植物附生轮虫群落多样性显著高于无水生植物水区和水生植物水区群落多样性,植物附生群落种类组成更为均匀,但是不同类型植物附生群落的a多样性无显著差异.不同的植物混搭造成水区微生境异质性增加从而使沿岸生境浮游生物多样性增加[10].在亚热带湖泊中,中营养状态下轮虫物种多样性较高,而在极端贫营养和极度富营养状态下,群落结构趋于简单,物种多样性降低[37].但在有水生植物种植的水区中,富营养化池塘轮虫a多样性显著高于其他营养状态水体[35].大型水生植物可减轻周围水区环境富营养化状态,另一方面为中营养和岸栖型轮虫提供附生基质,使富营养和贫营养状态下依然保持水区较高的生物多样性.沉水植物存在通过增加水体沿岸型(岸栖型)轮虫比例和中营养指示种数量,减少富营养指示种数量,增加群落b多样性,从而提升水生态健康水平[8].
在大型水生植物水区中,即使叶绿素含量下降2~3倍,但浮游动物生物量并没有下降,岸栖型枝角类数量反而有所增加[12].本研究同样发现,水生植物水区叶绿素含量显著低于无水生植物水区,但水生植物水区轮虫总丰度显著高于无水生植物水区.大型水生植物-周丛藻类复合体为浮游细菌和轮虫提供碳补贴,可增强浮游食物网的级联效应,从而维持水生植物水区占主导的清澈水体中食物网稳定性[36].浮游细菌和大型水生植物碎屑是轮虫的潜在食物来源,附生细菌群落和植物碎屑颗粒相结合,更容易被轮虫等滤食性浮游动物获取[12,35],以颗粒有机碳和可溶性有机碳形式为浮游食物网提供碳补贴途径[36].大型水生植物可能通过为轮虫提供食物资源补贴的方式维持中低营养水体轮虫生物多样性.
4 结论
4.1 本研究期间记录大型水生植物附着轮虫多达43种.水生植物对轮虫群落具有生境支持作用,尤其利于游泳能力弱的岸栖类群躲避捕食者.
4.2 3类典型水生植物均有大量轮虫附生,附生轮虫丰度变化在108~5826ind./gdw之间,且呈现沉水植物>浮叶植物>挺水植物的变化趋势.沉水植物在城市湿地连通水系中,对维持轮虫生物丰度作用更明显.
4.3 大型水生植物附生轮虫丰度与CODMn、氨氮含量呈显著负相关.在中低营养水体中,水生植物通过提供食物资源补贴的方式维持轮虫生物多样性和食物网健康.
[1] 汪文博,王 庆,李 莹,等.落叶生境蛭态轮虫物种多样性及四种中国新记录种 [J]. 水生生物学报, 2021,45(2):436-445.
Wang W, Wang Q, Li Y, et al. Species diversity of Bdelloid rotifers in leaf litter and four new records in China [J]. Acta Hydrobiologica Sinica, 2021,45(2):436-445.
[2] 梁迪文,王 庆,魏 南,等.广州市不同类型水体轮虫群落结构的时空变动及与理化因子间的关系 [J]. 湖泊科学, 2017,29(6):1433- 1443.
Liang D, Wang Q, Wei N, et al. Spatial and temporal variation in rotifer community structure and the response to environmental factors among different water bodies in Guangzhou City [J]. Journal of Lake Sciences, 2017,29(6):1433-1443.
[3] Jurczak T, Wojtal-Frankiewicz A, Frankiewicz P, et al. Comprehensive approach to restoring urban recreational reservoirs. Part 2 - Use of zooplankton as indicators for the ecological quality assessment [J]. Science of The Total Environment, 2018,653:1623-1640.
[4] Zhen Z, Yan C, Zhao Y. Epiphytic bacterial community enhances arsenic uptake and reduction by[J]. Environmental Science and Pollution Research, 2020,27(35):44205- 44217.
[5] 方美清.基于水生植物净化修复的水环境综合治理研究 [J]. 低碳环保与节能减排, 2018,37(11):67-70.
Fang M. Comprehensive treatment of water environment based on purification and restoration of aquatic plants [J]. Energy conservation, 2018,37(11):67-70.
[6] 高海龙,程寒飞,詹茂华,等.太湖水生植物研究进展 [J]. 湿地科学, 2019,v.17(1):11-17.
Gao H, Cheng H, Zhan M, et al. Research progress of aquatic macrophytes in Taihu Lake [J]. Wetland science, 2019,v.17(1):11-17.
[7] 张 依,魏 南,王 庆,等.小型湖泊水生植物栽培对轮虫群落结构的影响 [J]. 应用生态学报, 2018,29(12):4208-4216.
Zhang Y, Wei N, Wang Q, et al. Effects of macrophyte cultivation on community structure of rotifer in small lakes [J]. Chinese Journal of Applied Ecology, 2018,29(12):4208-4216.
[8] Kuczyńska-Kippen N, Špoljar M, Mleczek M, et al. Elodeids, but not helophytes, increase community diversity and reduce trophic state: Case study with rotifer indices in field ponds [J]. Ecological Indicators, 2021,128:107829.
[9] 曾海逸,钟 萍,赵雪枫,等.热带浅水湖泊后生浮游动物群落结构对生态修复的响应[J]. 湖泊科学, 2016,28(1):170-177.
Zeng H, Zhong P, Zhao X, et al. Response of metazoan zooplankton communities to ecological restoration in a tropical shallow lake [J]. Journal of Lake Sciences, 2016,28(1):170-177.
[10] Choi J, Jeong K, Kim S, et al. Role of macrophytes as microhabitats for zooplankton community in lentic freshwater ecosystems of South Korea [J]. Ecological Informatics, 2014,24:177-185.
[11] Choi J, Kim S, Jeng K, et al. Detecting response patterns of zooplankton to environmental parameters in shallow freshwater wetlands: Discovery of the role of macrophytes as microhabitat for epiphytic zooplankton [J]. Journal of Ecology and Environment, 2015,38(2):133-143.
[12] Kurbatova S, Lapteva N, Bykova S, et al. Aquatic plants as a factor that changes trophic relations and the structure of zooplankton and microperiphytone communities [J]. Biology Bulletin, 2019,46(3):284- 293.
[13] Choi J, Jeong K, La G, et al. Sustainment of epiphytic microinvertebrate assemblage in relation with different aquatic plant microhabitats in freshwater wetlands (South Korea) [J]. Journal fo Limnology, 2014,73(1):197-202.
[14] Ji G, Wang X, Wang L. Planktonic rotifers in a subtropical shallow lake: Succession, relationship to environmental factors, and use as bioindicators [J]. Scientific World Journal, 2013,2013:702942.
[15] Ginders M, Collier K, Duggan I, et al. Influence of hydrological connectivity on plankton communities in natural and reconstructed side-arms of a large new zealand river [J]. River Research & Applications, 2016,32(8):1675-1686.
[16] 黄 燕,毛君竹,詹红星,等.广州海珠国家湿地公园植物资源研究[J]. 林业与环境科学, 2018,34(5):81-85.
Huang Y, Mao J, Zhan H, et al. Plant resources of Haizhu National Wetland Park, Guangzhou [J]. Forestry and Environmental Science, 2018,34(5):81-85.
[17] Koste W. Rotatoria: Die radertiere mitteleuropas [M]. Berlin: Gebrder Borntraeger, 1978.
[18] 蒋燮志,堵南山.中国动物志(淡水枝角类) [M]. 北京:科学出版社, 1979:1-297.
Jiang X, Du N. Zoology of China (Freshwater Cladoceran) [M]. Beijing: Science Press, 1979:1-297.
[19] 沈嘉瑞.中国动物志(淡水桡足类) [M]. 北京:科学出版社, 1979: 1-450.
Shen J. Zoology of China (freshwater copepod) [M]. Beijing: Science Press, 1979:1-450.
[20] GB 3838-2002 地表水环境质量标准 [S].
GB3838-2002 Environmental quality standards for surface water [S].
[21] 金相灿,屠清瑛.湖泊富营养化调查规范 [M]. 北京:中国环境科学出版社, 1990.
Jin X, Tu Q. Standard for Investigation of Lake Eutrophication [M]. Beijing: China Environmental Science Press, 1990.
[22] Guo R, Snell T, Yang J. Ecological strategy of rotifer () exposed to predator- and competitor-conditioned media [J]. Hydrobiologia, 2011,658:163–171.
[23] Yoshida T, Urabe J, Elser J. Assessment of ‘top-down’ and ‘bottom-up’ forces as determinants of rotifer distribution among lakes in Ontario, Canada [J]. Ecological Research, 2003,18(6):639-650.
[24] Iglesias C, Goyenola G, Mazzeo N, Meerhoff M, Rodó E. Jeppesen E. Horizontal dynamics of zooplankton in subtropical Lake Blanca (Uruguay) hosting multiple zooplankton predators and aquatic plant refuges [J]. Hydrobiologia, 2007,584:179-189.
[25] Yin X, Jin W, Zhou Y, et al. Hidden defensive morphology in rotifers: benefits, costs, and fitness consequences [J]. Scientific report, 2017, 7(1):4488.
[26] Phiri C, Chakona A, Day J. The effect of plant density on epiphytic macroinvertebrates associated with a submerged macrophyte, Lagarosiphon ilicifolius Obermeyer, in Lake Kariba, Zimbabwe [J]. Journal of the Limnological Society of Southern Africa, 2011,36(3): 289–297.
[27] Manatunge J, Asaeda T, Priyadarshana T. The influence of structural complexity on fish-zooplankton interactions: a study using artificial submerged macrophytes [J]. Environmental Biology of Fishes, 2000, 58:425–438.
[28] Goździejewska A, Glińska-Lewczuk K, Obolewski K, et al. Effects of lateral connectivity on zooplankton community structure in floodplain lakes [J]. Hydrobiologia, 2016,774(1):7-21.
[29] Portinho J, Perbiche-Neves G, Nogueira M. Zooplankton community and tributary effects in free-flowing section downstream a large tropical reservoir [J]. International Review of Hydrobiology, 2016, 101(1/2):48-56.
[30] Meerhoff M, Fosalba C, Bruzzone C, et al. An experimental study of habitat choice by Daphnia: plants signal danger more than refuge in subtropical lakes [J]. Freshwater Biology, 2006,51:1320-1330.
[31] Wen X, Xi Y, Qian F, et al. Comparative analysis of rotifer community structure in five subtropical shallow lakes in East China: role of physical and chemical conditions [J]. Hydrobiologia, 2011,661(1): 303-316.
[32] May L, Spears B, Dudley B, et al. The response of the rotifer community in Loch Leven, UK, to changes associated with a 60% reduction in phosphorus inputs from the catchment [J]. International Review of Hydrobiology, 2014,99(1/2):65-71.
[33] 温展明,顾杨亮,林秋奇,等.广东流溪河水库异尾轮属()的分布模式及其影响因素[J]. 湖泊科学, 2016,29(2):458-466.
Wen Z, Gu Y, Lin Q, et al. Distribution pattern ofand its ecological driving variables in Liuxihe Reservoir, Guangdong Province [J]. Journal of Lake Science, 2016,29(2):458-466.
[34] Liang D, Wang Q, Wei N, et al. Biological indicators of ecological quality in typical urban river-lake ecosystems: The planktonic rotifer community and its response to environmental factors [J]. Ecological Indicators, 2020,112:106127.
[35] Kuczynska-Kippen N. The use of bdelloids in reference to rotifer biocoenotic indices as an indicator of the ecological state of small field water bodies: The effect of macrophytes, shading and trophic state of water [J]. Ecological Indicators, 2018,89:576-583.
[36] De Kluijver A, Ning J, Liu Z, et al. Macrophytes and periphyton carbon subsidies to bacterioplankton and zooplankton in a shallow eutrophic lake in tropical China: Shallow lake macrophytes- periphyton carbon subsidy [J]. Limnology and Oceanography, 2015, 60:375-385.
[37] 钱方平,席贻龙,温新利,等.湖泊富营养化对轮虫群落结构及物种多样性的影响[J]. 生物多样性, 2007,15(4):344-355.
Qian F, Xi Y, Wen X, et al. Eutrophication impact on community structure and species diversity of rotifers in five lakes of Anhui [J]. Biodiversity Science, 2007,15(4):344-355.
致谢:本实验依托粤港澳大湾区城市群生态观测研究站网平台开展,在此表示感谢.
Effects of macrophytes on epiphytic rotifer species diversity in urban wetlands.
LIANG Di-wen1, LIU Lu2, HUANG Chun-rong1, YE Zhen1, SUN Shuang-shuang1, XU Rui1, YANG Yu-feng2, DONG Jia-hua1, LIANG Ming-yi1, ZHONG Zhi-qiang1*
(1.State Environmental Protection Key Laboratory of Urban Ecological Environment Simulation and Protection, South China Institute of Environmental Sciences, Ministry of Ecology and Environment of the People’s Republic of China, Guangzhou 510530, China;2.Department of Ecology, Jinan University, Guangzhou 510632, China)., 2023,43(1):255~265
This study investigated the community structure of rotifers living epiphytically on three types of macrophytes and in the pelagic zone within the connected water system of Haizhu National Wetland Park from June to October, 2021. The rotifer species diversity and the community dynamics of epiphytic rotifers on macrophytes were analysed. A total of 70 rotifer species were recorded during the study period.The highest number of taxa occurred in macrophyte zone (47). Abundant rotifers were attached to the surface of macrophytes, ranging from 108 to 5826 ind./gdw. The abundance of epiphytic rotifers decreased in the trend: submerged plants > floating leaf plants > emergent plants. The rotifer communities were significantly different among the non-macrophyte zone, the macrophyte zone and the three types of macrophytes. The surface of macrophytes were dominated by sensitive genera with weak swimming ability, such as,and. While macrophyte zone and non-macrophyte zone communities were dominated by genera with strong swimming ability such asas well as pollution-tolerant genera such asand. In addition, the Shannon-Weiner diversity index and the Pielou’s evenness index of the three macrophyte epiphytic rotifer communities were significantly higher than those in the non-macrophyte zone (<0.05). All three types of the macrophytes provide habitat support for rotifers and effectively improve the biodiversity in urban wetland ecosystem.
biodiversity;community structure;zooplankton;urban ecosystem;ecological restoration
X173
A
1000-6923(2023)01-0255-11
梁迪文(1990-),男,广东肇庆人,助理研究员,博士,主要从事城市水生态学研究.发表论文10余篇.
2022-06-10
中央级公益性科研院所基本科研业务专项(PM-zx703- 202207-267和PM-zx421-202204-161);广州市科技计划项目(202201010592)
* 责任作者, 高级工程师, zhongzhiqiang@scies.org

