家禽附睾功能及其对睾丸后精子成熟调控机制研究进展
韩昕彤,马腾壑,2*,李云雷,樊世杰,陈继兰,孙研研*
(1.河北工程大学生命科学与食品工程学院,邯郸 056000;2.河北工程大学医学院,邯郸 056000;3.中国农业科学院北京畜牧兽医研究所 农业农村部动物遗传育种与繁殖(家禽)重点实验室,北京 100193;4.北京市华都峪口禽业有限责任公司,北京 101206)
精子运动和受精能力受垂体性腺轴调控作用、睾丸内精子发生以及附睾和输精管的成熟作用等众多因素影响[1-2]。研究表明,刚从睾丸排出的精子功能尚不成熟。当精子通过附睾时,在附睾管腔微环境的液体、离子、蛋白质和抗氧化剂等作用下进一步成熟,获得受精能力。传统观念认为附睾对家禽繁殖的作用不大,但是近年来越来越多研究表明家禽附睾对精子功能有一定调控作用。对附睾的研究可能是提升家禽繁殖效率的重要突破点。本文对家禽附睾功能及其对精子睾丸后成熟的作用机制研究进展进行综述,以期进一步启发家禽繁殖性能调控机制研究。
1 家禽附睾的结构
附睾和输精管是雄性动物除睾丸以外的管状生殖结构。附睾又称睾丸旁导管系统,是由一部分睾丸网管、睾丸输出管和附睾管所组成的一个高度特异的管状器官,连接着睾丸和输精管。虽然家禽和哺乳动物的睾丸结构非常相似,但附睾组织形态差异较大。哺乳动物附睾紧贴睾丸的上端和后缘,可以分为典型的头部(caput)、体部(corpus)和尾部(cauda),在小鼠和大鼠的头部近端还有起始段(initial segment)[3]。而家禽附睾发生退化,细小,呈纺锤形,紧附于睾丸背侧,因有睾丸系膜遮蔽,所以不很明显(图1A)。家禽附睾可分为睾丸网管(rete testis)、输出小管(efferent ductules)、附睾管(epididymal duct)、短连接管(connecting ductules)、附睾附件(appendix epididymidis)、旁睾(paradidymis)和远端传出管以及管间结缔组织[4-5](图1B),不同区域又有着不同的生理功能[6]。附睾管黏膜上皮细胞主要由主细胞(principal cells)、基底细胞(basal cells)、晕细胞(halo cells)和亮细胞(clear cells)组成。附睾上皮基膜外侧还包绕有平滑肌层。附睾管很短,由附睾后端延续为输精管,处于性活动旺盛时期的公禽附睾管内充满精子。
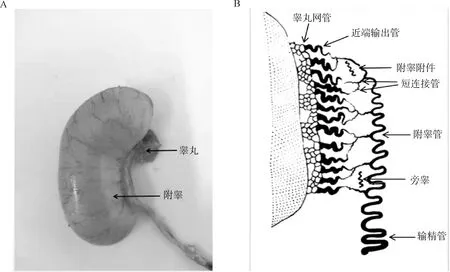
图1 成年公鸡附睾外观(A)和组织结构示意图(B)(修改自参考文献[4-5])Fig.1 Appearance (A) and histological structure diagram (B) of epididymis in adult cocks (modified from references [4-5])
2 家禽附睾的基本功能
2.1 精子转运和暂存功能
转运精子是附睾最基本的功能。附睾近端输出管上皮由单层立方细胞和柱状纤毛细胞排列组成,精子由睾丸输出管进入附睾的过程与纤毛细胞的长纤毛和微绒毛结构的摆动有关[7]。附睾上皮基膜外侧包绕的平滑肌层的节律性收缩也配合纤毛运动一起运送精子至输精管中暂存。家禽精子通过附睾和输精管的时间是1~2 d,远低于哺乳动物[8]。研究表明,鹌鹑精子在附睾输出管中停留约8 min,在附睾其他部位和输精管中大约停留24 h。输精管中储存了90%以上的精子,精子的转运速度约0.37 mm·min-1,与哺乳动物的转运速度相当[9]。当公鸡附睾传出管出现囊肿或发展为结石时,精子转运受阻,精液量和精子数量显著降低[10]。上述研究表明,附睾是精子运输的通道,精子的转运受到纤毛摆动和平滑肌收缩的协同作用,同时附睾也有短暂贮存精子的功能。
2.2 激素合成和激素转化功能
附睾与公鸭性欲的相关性已被Ouyang等[11]证实,高性欲组公鸭的附睾重量显著高于低性欲组,推测附睾的激素合成和激素转化功能影响了性欲。在公鸡的附睾近端传出管和附睾附件盲端,发现了明显的类固醇激素合成的超微结构,这表明公鸡附睾上皮部与哺乳动物相同,也可以分泌类固醇类性激素[12]。Akmal等[13]向公鸡血液中分别注射附睾、睾丸组织以及二者混合提取物,发现血清睾酮浓度均显著提高,这提示附睾具有睾酮合成功能。日本科学家将鸡附睾组织匀浆后,分别与雄烯二酮和睾酮在含有NADPH的蔗糖溶液中混合培养60 min,发现附睾能够将睾酮和雄烯二酮代谢为5α-二氢睾酮和5β-二氢睾酮,且睾酮底物组生成的二氢睾酮量明显低于雄烯二酮底物组[14];而Nakamura和Tanabe[15]用鸡睾丸组织进行相同试验时发现,睾丸组织不同于附睾,不具备激素转化功能。此外,附睾不同部位的激素转化能力又有所差别,例如,3β-羟基类醇脱氢酶和17β-羟基类醇脱氢酶是与类固醇类激素的代谢和转化有关的关键酶。Tingari[16]以孕烯醇酮、17α-羟基孕烯醇酮、DEHA和睾酮为底物,检测到在家禽附睾管有羟基类醇脱氢酶的活性表达,在附睾网管却表达缺失。Akmal等[17]将山羊的睾丸和附睾提取物注射到公鸡体内,发现公鸡体内睾酮含量明显上升,对公鸡的精子发生有促进作用。以上研究表明,家禽附睾具有生殖激素合成和转化功能,附睾管可能是相关激素转化的主要部位,对于维持公禽的生殖生理功能具有重要作用。
2.3 离子转运和重吸收功能
附睾通过分泌和重吸收水、蛋白和离子等内源性物质,维持附睾内微环境稳定[18]。附睾上皮不同组织区域的分泌和重吸收能力有一定差别。与哺乳动物类似,家禽附睾管参与了约86%的睾丸液的重吸收[19],钠-钾ATP酶(Na+、K+-ATPase)、碳酸酐酶(carbonic anhydrase 2,CAII)和3型钠氢交换通道(Na+/H+hydrogen exchanger 3,NHE3)在公鸡附睾输出管(efferent ductules,EFD)的非纤毛细胞中表达,这些离子转运体在公鸡的机制与哺乳动物类似,促进了附睾中的离子和水的重吸收[20]。附睾上皮细胞存在着对Na+的主动重吸收和对Cl-的被动重吸收,因此形成的渗透压有利于对水的吸收利用[21]。附睾对管腔内K+和Ca2+也有着活跃的重吸收机制,这些物质可以影响精子的运动、获能以及顶体反应的发生[22]。附睾内稳定的低Ca2+环境是精子在附睾中成熟的前提[23]。在小鼠中,Ca2+内流还会激活cAMP-PKA通路并导致酪氨酸蛋白磷酸化,影响精子获能[24]。在大鼠中,当附睾中TRVP6蛋白通路缺失后,附睾尾部Ca2+浓度升高近十倍,精子活力明显下降[23]。Oliveira等[25]研究发现,在患附睾结石的公鸡中,公鸡的附睾输出管腔内形成钙结石,TRVP6表达升高,由此猜测,附睾中Ca2+稳态的失衡可能是导致公鸡患附睾结石的主要原因。因此,家禽附睾的重吸收功能被认为在精液浓度调节、精子成熟和受精过程中具有重要作用。
2.4 免疫功能
附睾的免疫功能主要依靠血-附睾屏障和免疫屏障,分别发挥免疫抑制和免疫应激功能。由于雄性动物的生殖管道中存在单倍体的生殖细胞,在睾丸、附睾和输精管中的免疫应激与免疫抑制的平衡对于维持正常的生理功能十分重要[26]。
2.4.1 血-附睾屏障 血-附睾屏障(blood-epididymis barrier,BEB)是存在于附睾管内与管壁外结缔组织中毛细血管间的结构,包括附睾上皮主细胞及其细胞连接(特别是紧密连接)、基膜、平滑肌、毛细血管内皮及其基膜。紧密连接的构成又依赖于一系列钙依赖的黏结分子、钙黏着蛋白和连环蛋白的作用[27]。血-附睾屏障可以隔绝抗精子抗体、限制免疫球蛋白和免疫细胞进入管腔,阻止由于管内精子自身抗原和免疫系统之间的相互作用而发生自体免疫反应,也可通过调控上皮细胞中离子、溶质和大分子的选择性运输来调节附睾管腔组成,保护精子免受免疫系统和细菌的攻击。当血-附睾屏障出现渗漏时,精子头部抗原决定簇可以引起抗精子抗体,诱导宿主不育。血-附睾屏障对维持附睾腔的酸性环境发挥作用,这对于精子成熟、附睾小体的转移,以及在附睾转运过程中维持精子休眠是必不可少的[28]。有研究认为附睾中特异性免疫主要成员B淋巴细胞的数量相对较少,合成抗体的能力弱,可能是为了避免产生抗精子抗体[29]。血-附睾屏障还参与调节物质进出,维持附睾微环境稳定[30-31]。
2.4.2 免疫屏障 非特异性免疫和特异性免疫是生物体内的两种免疫机制,非特异性免疫是指不针对特定细菌或病毒产生免疫能力的反应,而特异性免疫是指针对特定的细菌、病毒产生免疫的反应。免疫屏障即附睾上皮中由大量单核巨噬细胞和T淋巴细胞等组成晕细胞,晕细胞在上皮基部呈环状分布,对附睾上皮细胞和血-附睾屏障具有保护作用,被称为血-附睾屏障的“卫士”[32]。且免疫屏障使睾丸获得了特异性免疫[30-31]。家禽雄性生殖器官可被各种致病微生物感染,造成生育能力下降。在家禽上由病毒和细菌感染引起的睾丸炎和输精管炎症非常常见,目前已被证明的有禽传染性支气管炎病毒(avian infectious bronchitis virus,AIBV)、白痢沙门菌、大肠杆菌、多杀性巴氏杆菌等,肠炎沙门菌和鼠伤寒沙门菌引起的睾丸炎在鸭子上也有证明,睾丸炎和输精管炎对精液品质和受精率都有影响[33-35]。睾丸和附睾的非特异性免疫系统在预防这种感染中起着至关重要的作用。Toll样受体(toll-like receptors,TLR)是参与非特异性免疫的一类重要蛋白质分子,也是连接非特异性免疫和特异性免疫的桥梁。不同TLR可识别的抗原对象也有所区别。有研究表明,公鸡睾丸和附睾中大量表达不同的TLR,证明睾丸和附睾通过识别不同外源病原,启动非特异性免疫来达到防御局部感染的目的。促炎细胞因子表达上调是刺激TLR后常见的反应,在Anastasiadou和Michailidis[36]的研究中,用沙门菌感染成年洛岛红公鸡,解剖后发现睾丸和附睾中某些TLRs家族成员表达上调,其中TLR-4可能识别外源抗原细菌脂多糖,并进一步上调促炎细胞因子和趋化因子的表达来抵御感染,其中在睾丸和附睾中有检测到9种细胞因子编码基因的表达,即IL-1、IL-6、IL-8、IL-10、IL-12、IL-15、IL-16、IL-17和IL-18。陈毅等[37]通过免疫组化分析发现IL-1β和IL-6在公鸡附睾,尤其是附睾输出管大量表达,提示附睾输出管可能是清除未射出或不成熟精子等异常精子以及来自前段生殖道脱落细胞的主要部位。
3 附睾对精子成熟的影响
哺乳动物睾丸中形成的不具备受精能力的精子,需要在附睾中的移行中发生一系列化学和物理变化并获得运动和受精能力,这一过程称为精子成熟[38-39]。在家禽上,Ahammad等[40-41]检测来自白来航、日本斗鸡和乌骨鸡睾丸、附睾和输精管各部分精子的运动和受精能力,发现睾丸、附睾和输精管近端、中端和远端的精子迁移率、精子存活时间以及子宫部人工授精后的受精率逐渐增强。说明家禽的附睾和输精管具有与哺乳动物类似的精子成熟功能。精子在附睾中的成熟过程主要包括形态变化、精子膜成分及流动性的变化、运动能力和受精能力的获得等。
3.1 精子形态的改变
从形态学上看,精子在进入附睾移行过程中最明显的形态变化是原生质滴从精子头部向尾部的迁移[42-43],以及精子尾部卷曲程度的变化。
精子细胞在睾丸内的变形过程中,细胞核变为精子头部,高尔基体发育成顶体,中心体演变成精子尾部,线粒体演变成线粒体鞘,细胞内的其他物质浓缩为球状,称为原生质滴。哺乳动物精子刚进入附睾头时,颈部常有原生质滴,在通过附睾的过程中,其向尾部末端移动,至精子成熟时也随之消失[43]。有研究表明,水牛附睾头部、体部和尾部中携带原生质滴的精子比例逐渐降低[44]。除了家鸭,在其他家禽的射精精液中也很少检测到原生质滴[45-46],因此可以推测家禽精子在附睾中移行时,也伴随着原生质滴的脱落。
除了原生质滴的移行,精子的尾部形态在通过附睾的过程中也发生变化。在灵长类动物附睾起始段和头段,大多数精子的尾部卷曲,随着精子在附睾内的转运,尾部卷曲精子的数目逐渐下降。到了附睾尾,精子尾变直,即使有少量卷曲精子其卷曲程度也有所减轻[47]。但是关于具体的调控机制尚未明确。
3.2 精子膜变化
目前精子成熟过程中精子膜表面的变化是研究的热点和难点。精子在附睾成熟过程中精子膜表面成分、形态及精子膜的理化性质发生重要的变化,主要包括膜的通透性、膜蛋白、膜上糖基成分和受体性质的改变。
3.2.1 精子膜通透性变化 精子在附睾内成熟的过程中其质膜结构发生一系列变化,膜流动性的下降使精子膜的通透性改变。张君慧等[48]用大鼠精子进行精子低渗肿胀试验,结果显示从附睾头部到尾部,精子膜对渗透压的反应能力逐步减弱,其中附睾体部到尾部的减弱程度最为明显。精子随着在附睾中的移行逐步获得了排Na+的能力,因此精子膜外Na+高。同时,精子膜对于K+的通透性明显增加,造成K+的内流,使精子内K+浓度明显高于精子外附睾液的K+浓度[49]。精子膜通透性的这种成熟变化,影响了精子内酶的活性以及精子的代谢,对于精子在附睾成熟过程中精子运动的启动和成熟有着重要意义。
3.2.2 精子膜表面成分变化 精子膜表面成分的变化包括膜蛋白和脂质的变化。精子表面膜蛋白主要有附着蛋白、结构蛋白、抗原和酶等,参与精子获能、顶体反应和精卵融合等过程[49]。精子在附睾中移行并逐渐成熟的过程中,精子表面膜蛋白有增加和缺失现象的出现,Kaul等[50]发现羊的精子成熟前后的蛋白数量有明显减少,这种现象的发生一是因为精子膜表面、内部及附睾液中蛋白水解酶造成了蛋白质的裂解,二是因为外源性复合物对原有蛋白的掩盖。附睾液中富含氨基酸和多种蛋白质合成、转移、糖基化所需要的酶和转移长萜醇,可以猜测精子膜表面蛋白的形成与附睾液对精子的作用有关[51]。
精子的黏附能力也随精子移行而发生变化,例如,未成熟豚鼠精子经简单冲洗后即可导致表面蛋白质的脱落,而附睾上皮细胞分泌的附睾特异性蛋白在附睾液低离子浓度环境的促进下与精子结合能力上升。另外,精子表面蛋白在糖基转移酶的作用下,糖类和蛋白质特定的氨基酸残基形成糖苷键,即蛋白质的糖基化,蛋白质糖基化具有多类,大致可分为N-糖基化、O-糖基化和GPI糖基磷脂酰肌醇;蛋白质糖基化对精子表面电荷具有影响,继而影响精子的运动能力[52]。
3.3 精子运动能力的获得
早在20世纪70~80年代,学者们就已发现了睾丸精子与附睾精子,特别是附睾较远侧部位精子的运动能力有明显差别。Nixon等[53]指出,日本鹌鹑精子进入附睾后运动能力大大加强,Howarth等[54-55]在鸡上的研究中也证实了这一观点,可以认为家禽精子在附睾成熟移行的过程中获得了运动能力。活性氧(reactive oxygen species,ROS)是细胞氧化还原代谢的副产物,可通过对cAMP水平的调节而影响哺乳动物精子成熟和获能过程[56]。精子活力低可能与附睾成熟过程中线粒体蛋白的异常修饰有关,Park等[57-58]发现,牛精子线粒体蛋白的不规则表达可能导致ROS损伤和早期激活进而导致精子糖酵解能量消耗增加,精子因缺乏能量而丧失运动能力。很多研究表明,PKC信号通路(protein kinase C pathway)可能参与了精子运动能力的调节,PKC通路对鹌鹑和鸡的精子鞭毛运动能力的作用相反,PKC通路对蛋白的磷酸化作用可以维持日本鹌鹑的鞭毛运动,但鸡的PKC通路激活却减弱了精子鞭毛运动,具体机制仍不清楚[55];PKC通路的激活与Ca2+浓度息息相关,而Ca2+浓度与附睾上皮细胞的重吸收作用息息相关,这也证明了附睾具有调节精子运动的能力。精子运动能力的获得还和附睾上特异性基因所编码的蛋白有关,小鼠附睾除基本结构分区外,还可根据蛋白分布的不同划分为10个部分,在分泌蛋白数量最多的附睾头具有最强的代谢活性,也是精子获得运动能力的主要部分[59]。附睾分泌的前向运动蛋白,在仓鼠附睾头部可防止精子的停滞聚集,在附睾尾部则可使精子获得前向运动能力[60]。Sowińska等[61]发现,在火鸡附睾中与精子活力和鞭毛运动相关的蛋白,如钙调蛋白激酶(calcium/Calmodulin-Dependent Protein Kinase 1, CAMKK1)、钙调蛋白依赖性蛋白激酶(calcium/Calmodulin Dependent Protein Kinase ID, CAMK1D)、磷脂酰肌醇激酶(phosphatidylinositol-4-Phosphate 5-Kinase Type 1 beta, PIP5K1B)和磷脂酶A2(phospholipase A2 Group XIIB, PLA2G12b)等在精子活力差异的个体中也有显著差异表达。半胱氨酸丰富毒蛋白X2亚型(cysteine-rich Venom Protein-like Isoform X2,CRVPX2)在火鸡的附睾和输精管的上皮细胞中大量分泌,与哺乳动物中表达的CRISP1蛋白相似,CRVPX2参与睾丸后精子成熟,对精子活力具有调节作用[62]。重要的鞭毛蛋白SPAG6在睾丸、附睾和输精管部均有表达,但在附睾的丰度更多,且随精子成熟其丰度也随之升高;SPAG6与鞭毛功能密切相关,但它对精子运动能力的影响似乎和它对鞭毛的功能并不相关,因此不能将SPAG6的丰度作为精子运动能力强弱的依据[63]。TRIM36和TCP11被鉴定为影响精子运动能力的重要基因[64-65],赵延辉等[66]在家禽附睾中也鉴定到TRIM36和TCP11的表达。精浆是前列腺、精囊腺和尿道球腺分泌产生,由前列腺液、精囊液、附睾液和尿道球腺分泌的少量液体一起组成的物质。精浆是输送精子的必须介质,为精子提供能量和营养物质,也可调节精子的运动能力,在对体外精子的研究中,用不同剂量的精浆对精子进行清洗后发现精子的运动能力有所不同,可以猜测精浆中存在影响精子活力的物质[67]。上述研究表明,精子的运动能力随着在附睾内的移行而增强,这一变化与附睾上皮细胞分泌的蛋白息息相关,这些蛋白作用于精子鞭毛从而影响精子运动能力,蛋白的异常表达也对运动能力有影响。蛋白作为经久不息的研究热点,有关家禽附睾蛋白的研究仍需要深入,在蛋白层面与哺乳动物的异同也许是重要的突破点。
3.4 精子受精能力的获得
Bedford[68]在兔子上进行结扎试验,使精子不能在附睾内顺利移行而只能停留在附睾近中段,检测发现,该处精子虽能存活但却没有受精能力。随着对多种动物附睾精子的系统研究,科学家们猜测附睾对精子受精能力的获得有影响。精子受精能力的获得和发育与精子对卵丘细胞层的穿越作用有关。在哺乳动物中,精子通过附睾时,附睾腔液中的精子表面特异性透明质酸酶(PH-20)即可结合于精子表面网[69],如果PH-20被透明质酸酶抑制剂和抗氨基端活性部位的抗体封闭,精子就无法穿过卵丘细胞层。Primakoff和Myles[70]以及Seol等[71]的研究结果表明,PH-20可使卵丘细胞很快散开,促进精子穿入卵丘,此外还能促进经过顶体反应后的精子与透明带结合,PH-20虽然是在睾丸精子发生过程中形成且分布于精子头部[72],但在附睾中PH-20产生了异位,主要定位于精子后部质膜和顶体内膜,这种重新分布和浓度变化可能对受精起到重要作用。目前,通过现代组学技术对家禽附睾精子获能的机制解析提供了一定的科学证据。例如在Xing等[73]的研究中,分别对高精子活力和低精子活力公鸡的附睾转录组进行分析,鉴定到与精子活力相关的调控基因,包括MMP9、SLN、WT1、PLIN1和LRRIQ1,其中WT1、PLIN1和LRRIQ1在高精子活力鸡的表达量是低精子活力鸡的表达量的4倍;并鉴定到重要调控miRNA,包括mir-146a、mir-135b和mir-205。附睾上皮分泌的蛋白也对精子受精能力有影响。小鼠附睾上皮分泌的CRISP1蛋白和精卵结合有关,当该蛋白被敲除时精卵结合能力出现明显下降[74-75]。GPx5由附睾上皮细胞分泌,在山羊、牛、小尾寒羊和骆驼等动物的附睾中均有特异性表达,其在管腔中与精子质膜结合,调节管腔微环境的ROS水平,对维持精子活力和DNA完整性有作用,也防止精子在附睾尾部过早发生顶体反应。由附睾分泌的β-防御素126(defensin beta 126,DEFB126),又称附睾特异蛋白13.2(ESP13.2),可覆盖在精子表面,可保护精子经过雌性生殖道时不被免疫识别杀伤[76-77],在人上的研究也证实了DEFB126的缺失会阻碍精子穿过宫颈黏液[78]。火鸡附睾中连接蛋白的细微变化将影响附睾内环境的稳定,影响精子的发育和成熟从而使精液颜色从正常的白色变为病理性的黄色,即火鸡黄精液综合征(yellow semen syndrome,YYS)[79]。与哺乳动物相比,除了分泌功能型蛋白,家禽不具有副性腺,但是输精管上皮细胞可以分泌体液加入精液。
附睾小体也是目前的研究热点。附睾上皮细胞分泌的附睾小体内含蛋白质、RNA和脂质,当其与精子结合后,精子的蛋白质组图谱发生明显变化,Barrachina等[80]的研究证明了来源于附睾上皮细胞的几种蛋白通过附睾小体转运至精子,Nixon等[81]的试验也验证了附睾小体的蛋白转运功能。这也证明了精子的功能成熟主要与附睾分泌蛋白和附睾小体作用有关。
4 总结与展望
附睾的免疫、分泌、重吸收等功能使附睾形成了稳定的内环境,对睾丸后精子功能的进一步完善具有重要作用。了解附睾对精子功能的具体作用机制,对改善精液品质、提高雄性生殖力有指导意义,有利于畜禽良种繁育。附睾的具体作用机制仍是国内外科学家研究的热点。目前,对家禽附睾功能的研究远不及哺乳动物,在基因和蛋白表达、遗传修饰、附睾小体功能等层面还需要进一步深入探索。

