改性活性氧化铝的二氧化碳吸附性能研究
王志强,陈彬剑,焦 健
(山东建筑大学,山东 济南 250101)
1 概述
沼气是清洁可再生能源,主要组分为甲烷和二氧化碳,沼气经过提纯应满足相关技术标准,其中CO2体积分数应小于3.0%。氨溶液化学吸收法脱碳以其高脱碳效率和高选择性成为目前主要的脱碳方式之一,但是氨溶液存在腐蚀管道、解吸能耗大、易降解、有毒等问题[1]。吸附法因成本低、无腐蚀、设备简单等优点有望成为捕获CO2的替代技术[2]。活性氧化铝是最常见的工业吸附剂之一,具有高比表面积和活性,机械强度高,成本低,但吸附量较小。目前主要通过改性提升其吸附量,文献[3]介绍的DBU改性活性氧化铝,室温下CO2吸附量为9.05 mL/g,可见目前的改性方法对于吸附量的提升并不明显,且对活性氧化铝的改性研究较少。文献[4]以二乙烯三胺浸渍硅胶,25 ℃时,负载质量分数为10%的二乙烯三胺可以获得20 mL/g的CO2吸附量。Ma等人[5]以尿素作为氮源引入沸石咪唑酯骨架制备了多孔碳材料,证明含氮碱基可以增强吸附剂与CO2的亲和力,短链胺比长链胺更易发生降解,长链胺可更稳定地负载于吸附材料内。可见文献[4-5]均使用带有大量氨基的有机胺改性吸附剂,使CO2吸附量显著提升。为进一步提升活性氧化铝的CO2吸附量,提高沼气脱碳效率,本文使用含更多氨基的长链胺——五乙烯六胺(PEHA)来改性活性氧化铝,进行相关实验。
本文吸附量均为标准状态(0 ℃,0.101 325 MPa)下的值。
2 实验材料和方法
2.1 实验材料和条件
活性氧化铝(球状,直径6~8 mm)、PEHA、无水乙醇,纯度均为分析纯;去离子水,实验室自制。大气压力为0.101 325 MPa。
2.2 改性活性氧化铝的制备
将一定量PEHA溶解于50 mL无水乙醇中,于恒温搅拌水浴锅中70 ℃密封搅拌20 min。称取活性氧化铝5 g,置于上述搅拌均匀的溶液中,70 ℃恒温密封搅拌4 h。将浸渍后的活性氧化铝过滤洗涤后,先置于鼓风干燥箱内150 ℃干燥2 h,再置于真空干燥箱内在-0.097 MPa、150 ℃条件下干燥2 h,得到PEHA改性活性氧化铝,密封保存。PEHA改性活性氧化铝(以下简称改性活性氧化铝)记为Al2O3-PEHA-X,其中X为无水乙醇中溶解的PEHA体积的数值,对应单位为mL。
2.3 CO2静态吸附实验
采用静态吸附法对改性活性氧化铝的CO2吸附量进行测试,吸附装置见图1[6],吸附剂已放置于吸附槽内。实验过程如下。
① 测试系统密封性
所有阀门都处于关闭状态,将改性活性氧化铝放入吸附槽C2,通过恒温水浴锅设置吸附温度(25、40、55、70 ℃)。打开阀门V3、V4、V6,通过真空泵排空系统内的气体,压力低于-0.096 MPa时关闭阀门V6,5 min内压力表示值无明显升高证明密封性良好,记录此时压力表示值p1,关闭阀门V3、V4、V6。
② 测试系统内的死体积
死体积是指填装吸附剂后,装置内不发生吸附反应的无效体积。由于He为惰性气体,与改性活性氧化铝不发生吸附反应,且排空后He不会在改性活性氧化铝孔道内残留,因此选取He测试装置内的死体积。打开阀门V1、V3,通入He至参比槽C1,当压力表示值达到吸附压力(0.5 MPa)时关闭阀门V1并记录此时压力表示值p2;打开阀门V4并记录此时压力表示值p3。通过p1、p2、p3和实际气体状态方程计算死体积[7]。此过程重复两次,确保死体积计算正确。
③ 测试CO2吸附量
a.打开阀门V5,放空装置内的He至压力表示值为0.02 MPa,确保空气无法进入吸附装置,关闭阀门V5,打开阀门V6使用真空泵排空系统内的气体,压力低于-0.096 MPa时关闭阀门V6,记录此时压力表示值p4并关闭所有阀门。b.打开阀门V2、V3,CO2气体进入参比槽C1,当压力表示值达到吸附压力时关闭阀门V2并记录此时压力表示值p5。c.打开阀门V4开始CO2吸附,当压力表示值不再变化时,认为吸附达到平衡。吸附时间取25 min,记录吸附后的压力表示值p6。CO2吸附量通过p4、p5、p6、死体积和实际气体状态方程计算[7]。
④ 死体积和CO2吸附量计算
在吸附量计算中,进行如下假设:忽略管路体积;实验过程中参比槽、吸附槽、管路温度分布均匀且为恒温水浴锅的设定温度。
在吸附槽内死体积的计算过程中,将测试系统密封性结束时p1下吸附槽、参比槽内的空气视为He。吸附槽内死体积的计算见下式:
(1)
式中Vd——吸附槽内死体积,mL
Vc——参比槽体积,mL
p2、p3、p1——测试过程中的压力表示值,MPa
在CO2吸附量计算过程中,将测试CO2吸附量a步骤结束时p4下吸附槽、参比槽内的He视为CO2。吸附剂的CO2吸附量计算见下式:
(2)
式中Vg——吸附剂的CO2吸附量,mL/g
p5、p6、p4——测试过程中的压力表示值,MPa
T0——标准状态温度,K,为273.15 K
p0——标准状态压力,MPa,为0.101 325 MPa
T——CO2吸附实验测试温度,K
m——吸附槽内吸附剂质量,g
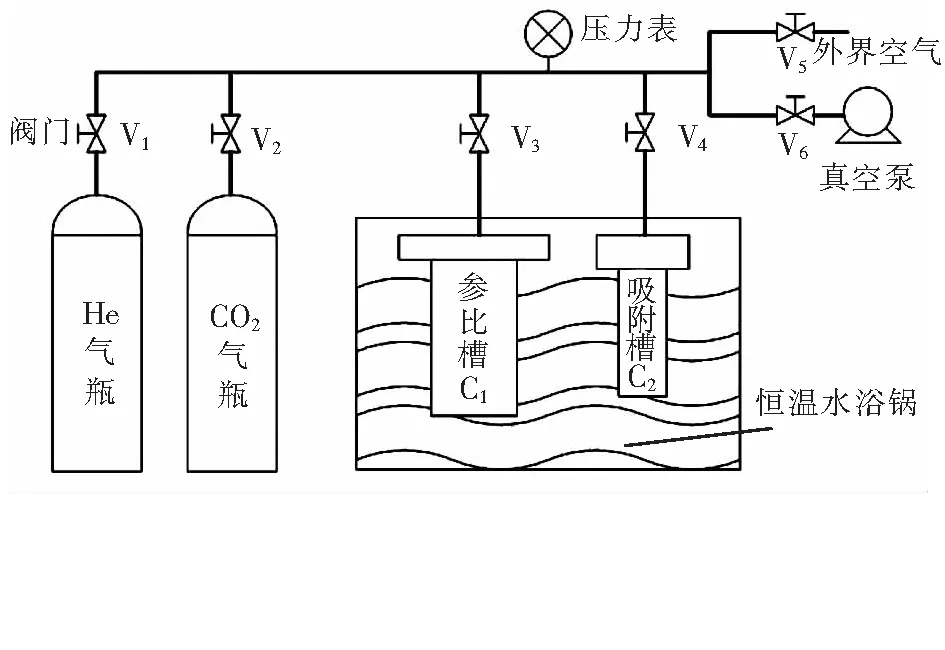
图1 CO2静态吸附装置
2.4 重复性实验
重复使用性是吸附剂能否在工业中推广的重要指标,为探究改性活性氧化铝的重复使用性,待改性活性氧化铝吸附平衡后,打开阀门V5放空系统内的CO2,关闭阀门V5,打开阀门V6对改性活性氧化铝在吸附温度下抽真空至-0.096 MPa进行解吸,直至压力表示值不再变化。随后在相同吸附温度、吸附压力下重复CO2吸附过程,吸附时间仍为25 min。
2.5 表征实验
对改性活性氧化铝分别进行X射线粉末衍射实验(XRD)、傅里叶变换红外光谱实验(FTIR)和氮气吸附脱附实验(BET)。X射线粉末衍射实验使用日本理学株式会社的SmartLab·SE型、smartlab·studio系统的X射线衍射仪对改性活性氧化铝物相变化进行分析,测试温度为25 ℃,X射线扫描范围为5°~90°,测试电压40 kV,测试电流40 mA。傅里叶变换红外光谱实验使用布鲁克仪器公司的TENSOR·27型、OPUS系统的傅里叶变换红外光谱仪,对改性活性氧化铝负载官能团的变化进行分析,测试温度为25 ℃,红外线波数范围为500~4 000 cm-1。氮气吸附脱附实验使用日本麦奇克拜尔有限公司的BELSORP-max型全自动孔隙结构分析仪对改性活性氧化铝孔径分布和比表面积变化进行分析,测试前将改性活性氧化铝在150 ℃环境下真空脱气24 h,测试温度为-196 ℃,测试相对压力(测试压力与测试温度下氮气的饱和蒸气压之比)为0~0.995。
3 结果与讨论
3.1 吸附剂表征
① X射线粉末衍射实验
图2为X射线粉末衍射实验测得的改性活性氧化铝XRD图。从图2可以看出,随着PEHA含量增加,改性活性氧化铝的衍射峰强度先升高后降低,说明改性活性氧化铝结晶性较差,晶粒尺寸先增大后减小[8]。在衍射角为14°、28°、38°、49°、64°、67°、72°时的衍射峰均对应了晶相为γ-Al2O3(对应的标准卡卡号为PDF#74-1895)的活性氧化铝的特征峰,说明改性活性氧化铝的晶体结构没有改变。

图2 改性活性氧化铝XRD图
② 傅里叶变换红外光谱实验
图3为傅里叶变换红外光谱实验测得的改性活性氧化铝的FTIR图。图中波数3 294 cm-1对应的吸收峰为O-H键的伸缩振动峰,1 649 cm-1附近强度较弱的宽峰为Al-OH键的伸缩振动峰,1 069 cm-1对应的吸收峰为改性活性氧化铝表面羟基的吸收峰。定义某波数对应的吸收峰强度与后续首个吸收峰强度峰值之差为峰高。随着PEHA含量增加,波数3 294 cm-1、1 649 cm-1、1 069 cm-1对应的峰高均降低,说明PEHA不仅负载于活性氧化铝的孔道,PEHA的氨基还与活性氧化铝表面的羟基发生了反应[9]。
波数885 cm-1对应的吸收峰为Al-O键的振动峰,743 cm-1和590 cm-1对应的吸收峰分别为AlO4和AlO6晶体结构的吸收峰,归因于Al-O-Al金属键的弯曲振动和对称伸缩振动[10]。改性活性氧化铝波数885 cm-1、743 cm-1、590 cm-1对应的吸收峰强度与改性前变化不大,证明PEHA没有破坏活性氧化铝的原有结构。
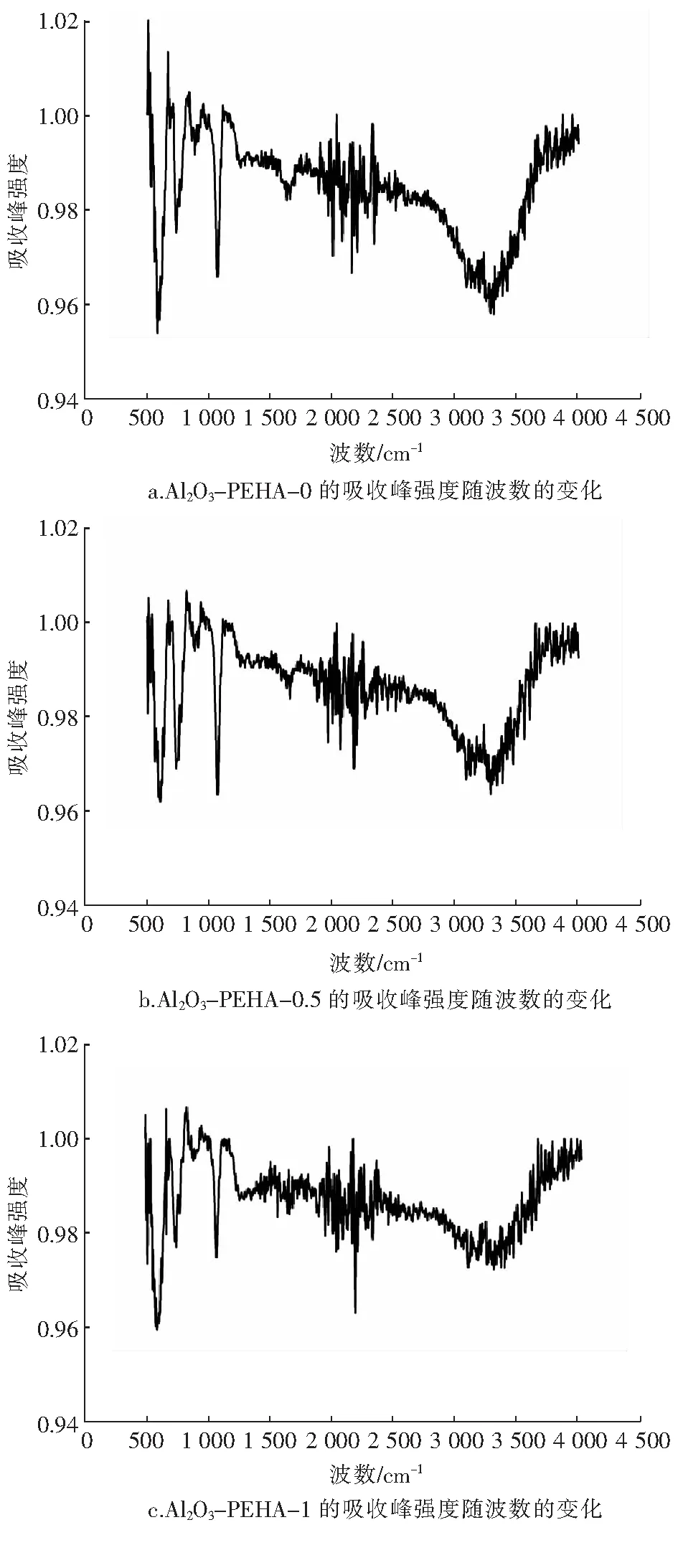
图3 改性活性氧化铝的FTIR图
③ 氮气吸附脱附实验
图4为改性活性氧化铝的氮气吸附、脱附等温线BET图。氮气吸附、脱附等温线指在测试温度下,氮气吸附量或脱附量随氮气相对压力(氮气测试压力与氮气在测试温度下的饱和蒸气压之比)的变化曲线。测得的改性活性氧化铝孔结构参数见表1。

图4 改性活性氧化铝的氮气吸附、脱附等温线BET图

表1 改性活性氧化铝的孔结构参数
由图4可知,根据IPUAC分类,Al2O3-PEHA-0、Al2O3-PEHA-0.5的氮气吸附、脱附等温线为典型的Ⅳ型等温线,两种材料在0.5≤氮气相对压力≤0.9范围内出现H3型滞后环,这是氮气在孔道中的毛细凝聚引起的,说明改性活性氧化铝为典型的缝型孔结构,在较高相对压力下对吸附没有限制。实验得知孔径主要分布于2.5 nm处,表明活性氧化铝为典型的介孔材料。由表1可知,与Al2O3-PEHA-0相比,Al2O3-PEHA-0.5的比表面积和孔容小,平均孔径大。Al2O3-PEHA-0.5的比表面积和孔容小,归因于PEHA分子占据和填充了活性氧化铝孔道[11],平均孔径增大归因于少量PEHA分子被微孔捕获[12]。
3.2 CO2吸附性能
为探究PEHA含量和吸附温度对改性活性氧化铝CO2吸附性能的影响,将Al2O3-PEHA-X分别在吸附温度为25、40、55、70 ℃条件下进行CO2静态吸附实验,吸附压力为0.5 MPa,吸附时间为25 min,得到不同PEHA含量和不同吸附温度下改性活性氧化铝CO2静态吸附曲线,见图5。

图5 不同PEHA含量和不同吸附温度下改性活性氧化铝CO2静态吸附曲线
已知活性氧化铝的CO2吸附量为16.92 mL/g。由图5可知,在吸附温度为25 ℃时, Al2O3-PEHA-0的CO2吸附量较活性氧化铝有所提升,这是由于乙醇增加了活性氧化铝表面的羟基,羟基通过与CO2分子间形成氢键来捕获CO2,且羟基中的氧原子含有一定电荷[5,13],较高的静电势强化了活性氧化铝对CO2的静电吸附。Al2O3-PEHA-0.5的CO2吸附量为19.55 mL/g,比活性氧化铝提升15.5%。吸附量增加的原因,一是羟基与CO2之间的氢键作用,二是PEHA分子含有大量氨基,增强了活性氧化铝对CO2的亲和力[14],氨基与CO2反应生成氨基甲酸盐[9]。
当PEHA含量一定时,在吸附温度为25 ~70 ℃范围内,随吸附温度升高,CO2吸附量下降。这是由于吸附温度升高使改性活性氧化铝热力学能增加,CO2与改性活性氧化铝之间弱的相互作用不足以使两者保持键合,强化了CO2的物理脱附过程[15]。在吸附温度一定时,随PEHA含量增加,CO2吸附量整体呈先增加后降低的趋势,在PEHA含量大于2 mL时,CO2吸附量下降尤为明显。吸附量下降是由于PEHA为长链胺,空间位阻效应更强,PEHA含量较高时,不仅影响了PEHA氨基与CO2之间的反应,而且阻碍了CO2与改性活性氧化铝活性位点的接触[16],这与文献[17]报道的高PEHA负载量下可堵塞高岭土孔道从而影响CO2与氨基接触的结果一致。
3.3 吸附剂的重复使用性
Al2O3-PEHA-0.5在吸附温度为25 ℃、吸附压力为0.5 MPa条件下进行CO2吸附量的重复性实验,重复使用5次,实验结果见表2。Al2O3-PEHA-0.5在第2次吸附时吸附量下降3.44 mL/g,即吸附量下降17.6%,随后基本保持稳定。

表2 Al2O3-PEHA-0.5重复使用5次的CO2吸附量
3.4 CO2吸附动力学
为探究CO2的吸附动力学,采用准一级动力学模型、准二级动力学模型、Elovich动力学模型[18]对Al2O3-PEHA-0.5在吸附温度为25 ℃、吸附压力为0.5 MPa时不同吸附时间的CO2吸附量进行拟合,拟合曲线见图6。由图6可知,准二级动力学模型能更好地描述Al2O3-PEHA-0.5的吸附动力学过程,拟合参数R2超过0.99,表明吸附过程主要由化学吸附控制。

图6 Al2O3-PEHA-0.5的吸附动力学拟合曲线
3.5 CO2吸附热力学
为探究CO2吸附过程的自发性和可行性,根据Al2O3-PEHA-0.5在吸附温度为25、40、55、70 ℃、吸附压力为0.5 MPa条件下的CO2吸附量实验数据,由式(3)、(4)计算得到对应条件下吸附前后改性活性氧化铝的摩尔吉布斯自由能变化,见表3。对lnK和T-1进行线性拟合,通过该拟合曲线和式(5)计算得到标准摩尔焓变ΔHm、标准摩尔熵变ΔSm,见表3。
ΔGm=-RTlnK
(3)
式中 ΔGm——吸附前后改性活性氧化铝的摩尔吉布斯自由能变化,kJ/mol
R——摩尔气体常数,J/(mol·K),为8.314 J/(mol·K)
K——平衡常数
(4)
式中patm——大气压力,MPa
(5)
式中 ΔSm——标准摩尔熵变,kJ/(mol·K)
ΔHm——标准摩尔焓变,kJ/mol

表3 Al2O3-PEHA-0.5的热力学参数
由表3可知,ΔGm、ΔHm、ΔSm均为负值,说明吸附过程放热,反应自发进行。ΔGm为-54.35~-46.09 kJ/mol,表明吸附过程以化学吸附为主[19]。随着吸附温度升高,ΔGm绝对值降低,表明吸附温度的升高加剧了脱附过程,阻碍了吸附反应的进行[18]。
4 结论
① 通过对改性活性氧化铝进行X射线粉末衍射实验(XRD)、傅里叶变换红外光谱实验(FTIR)和氮气吸附脱附实验(BET)可知,PEHA成功负载于活性氧化铝且没有破坏活性氧化铝原有结构,但导致其比表面积和孔容有所降低。
② 当PEHA含量一定时,在吸附温度为25~70 ℃范围内,随吸附温度升高,改性活性氧化铝的CO2吸附量下降。在吸附温度一定时,随PEHA含量增加,改性活性氧化铝的CO2吸附量呈先增加后减小的趋势,当PEHA含量大于2 mL时,CO2吸附量下降尤为明显。
③ Al2O3-PEHA-0.5经过5次重复使用,保持了约81%的吸附能力。在第2次吸附时CO2吸附量下降17.6%,随后基本保持稳定。
④ 改性活性氧化铝的CO2吸附过程符合准二级动力学模型,表明吸附过程主要由化学吸附控制。吸附过程放热,反应自发进行,吸附温度升高不利于吸附反应进行。

