夏季长江口不同粒级浮游植物碱性磷酸酶活性
王奕恒,郝 锵,陈建芳,4,朱元励, 金海燕,4,周 锋,张 伟,5
(1.浙江大学 海洋学院,浙江 舟山 316021; 2.自然资源部海洋生态系统动力学重点实验室,浙江 杭州 310012; 3.自然资源部第二海洋研究所,浙江 杭州 310012; 4.卫星海洋环境动力学国家重点实验室,浙江 杭州 310012; 5.浙江省近岸工程环境与生态安全重点实验室,浙江 杭州 310012)
0 引言
当藻类细胞接近饱和增长时,其周围水体中的碳、氮、磷原子比例为106 ∶16 ∶1,该比例被称为Redfield ratio[1]。在近岸生态系统中,由于人类排放过量的氮,海水中的氮磷比通常远高于Redfield ratio,这使得磷成为限制初级生产力的主要因子[2]。浮游植物对磷的利用能力与磷酸盐形态密切相关,并受自身碱性磷酸酶(alkaline phosphatase, AP)水平的调节。在海水中,磷以溶解无机磷酸盐(dissolved inorganic phosphate, DIP)或溶解有机磷(dissolved organic phosphate, DOP)的形态存在,其中DIP是生物唯一能直接利用的形式[3]。在DIP缺乏的情况下,AP能通过水解DOP生成DIP来帮助浮游植物和细菌应对磷限制[4]。AP水解DOP生成DIP的速率一般用碱性磷酸酶活性(alkaline phosphatase activity, APA)来表示[5]。一般来说,APA与DOP直接相关,与DIP间接相关[6]。在海洋中,细菌会和浮游植物竞争DIP[7],因此浮游植物APA和DIP相关性的稳固程度也会受到细菌丰度影响。历史观测表明,自然水体中APA与DIP之间通常呈幂函数关系[8]或反双曲线关系[9]。这些相关性研究印证了DIP是诱导浮游植物中APA升高的主要因素,因此,APA可以用作指示浮游植物磷限制的指标[10-12]。当前APA已经被广泛应用于不同海域浮游植物的磷限制研究中[12-14],但是有关长江口浮游植物APA的研究仍较少。
长江口及其邻近海域是中国近海初级生产力最高的区域之一,孕育了我国四大渔场之一的舟山渔场。长江口环流系统受长江径流、沿岸流、黑潮及台湾暖流的影响,从而导致复杂多变的营养盐分布和光照条件[15-17]。长江径流入海后会与海水混合,形成舌状的冲淡水。在近口门处,长江冲淡水表现出低盐、高浑浊度和高营养盐的特征,随着离岸距离的增加,其浑浊度会迅速降低,水柱内光的可利用性增加[16]。受长江径流极度不平衡的氮磷输入和近岸富营养化影响,长江口长期处于相对磷限制状态且极易发生藻华[18]。夏季藻华爆发后,由于跃层的存在,富含DIP的底层海水无法补充至表层,易出现表层DIP耗尽[15]。中层和底层海水受到黑潮和台湾暖流入侵的影响[17],DIP较为充足,不会产生磷限制。
理解长江口表层海水磷限制的动态变化和生态效应,需要对表层APA的分布进行剖析。MO et al[19]发现,夏季,在长江冲淡水中部,浮游植物生长受到严重的磷限制影响,导致其表层APA(平均值为106±133.3 nmol·L-1·h-1)远高于其余季节。而在TSENG et al[11]的研究中,夏季长江冲淡水区表层APA最高仅为11.5 nmol·L-1·h-1,远低于MO et al[19]的结果。TSENG et al[11]发现,随着离口门距离的增加,表层APA会呈现先降低后升高的变化趋势,表层APA低值区出现在生产力锋面附近。上述研究主要关注的都是颗粒物(≥0.2 μm)和溶解态(<0.2 μm)这两个粒级。颗粒物这一粒级包括了浮游植物和浮游细菌,而浮游细菌会和浮游植物竞争DIP[7],因此,这样的粒级划分可能不太合理。此外,目前有关各粒级浮游植物APA的研究也较为缺乏。
本研究给出了夏季长江口不同粒级浮游植物群落和表层浮游细菌APA的分布特征,同时结合DIP浓度和光照等环境参数,分析了各粒级浮游植物APA与DIP浓度之间的响应关系,并进一步总结了浮游植物在长江口附近受光、磷交替限制的规律。本研究有助于进一步理解长江口初级生产力的环境限制机制,并为长江口磷的生物地球化学研究提供基础资料。
1 材料与方法
1.1 站位布设和样品采集
2020年7月14日至7月22日在长江口及其邻近海域进行表层(2 m)海水采集,站位布设如图1所示,共8条断面,36个站位。为了便于比较,按照宁修仁 等[15]的方法,以不同盐度(小于15,15~30,大于30)将调查区域划分为河水-冲淡水界面、冲淡水中部和冲淡水-海水界面。
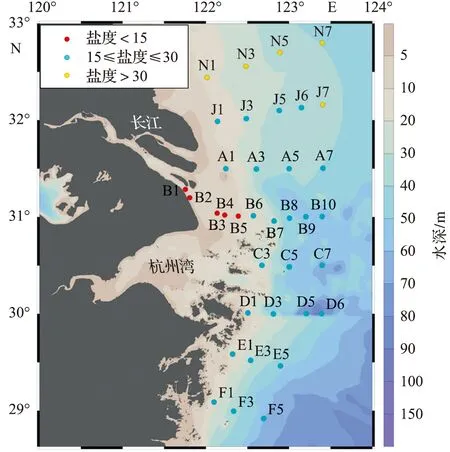
图1 调查区域和采样站位Fig.1 Study area and sampling stations
表层温度、盐度和浊度数据由温盐深传感器(Seabird 911 CTD)测得,海表光强从美国国家航空航天局网站(https:// oceancolor.gsfc.nasa.gov)获取。取60 mL水样经0.45 μm醋酸纤维膜过滤后,于-20 ℃冷冻保存,用于DIP浓度测定。水样经200 μm筛绢预过滤后,各取100 mL用于Chla质量浓度和APA测定。
1.2 DIP浓度测定
待样品解冻后,参考GRASSHOFF et al[20]提出的分光光度法,使用全自动间断化学分析仪(AMS-ALLIANGCE, SmartChem600)测定DIP浓度。
1.3 各粒级APA测定
采用对硝基苯磷酸二钠(PNP-P)法[21]测定各粒级APA。水样在现场依次经20 μm、2 μm、0.8 μm和0.2 μm 孔径滤膜过滤,得到Net(≥20 μm)、Nano(2~20 μm)和Pico级(0.8~2 μm)浮游植物,浮游细菌(0.2~0.8 μm)和经0.2 μm孔径滤膜过滤的滤液,于-20 ℃避光保存。待样品解冻后,使用5 mL采自同一站位的滤液浸泡滤膜(另单独取5 mL滤液用于测定溶解态APA),加入675 μL pH为8.2 的Tris-HCl缓冲液和325 μL 10 mmol/L的PNP-P溶液,于30 ℃恒温水浴振荡摇床中反应24 h(振荡速度为100 r/min),之后使用752N紫外可见分光光度计迅速测定其在405 nm处的吸光值。浮游植物总APA(Phyto-APA)由Net-APA、Nano-APA和Pico-APA求和得到,总APA由Phyto-APA、浮游细菌APA(Bacterio-APA)和溶解态APA求和得到。
1.4 各粒级Chl a质量浓度测定
采用荧光萃取法测定各粒级Chla质量浓度。水样在现场依次经20 μm孔径、2 μm 孔径和Whatman GF/F玻璃纤维滤膜过滤,得到Net、Nano和Pico级浮游植物。避光条件下,将滤膜放入体积分数为90%的丙酮溶液中,于-20 ℃条件下萃取24 h,在室温下使用Turner荧光仪对萃取液进行测定。总Chla质量浓度由Net-Chla、Nano-Chla和Pico-Chla质量浓度求和得到。
1.5 混合层内平均光照
对于海洋表层浮游植物,其细胞受到的光照以混合层内平均光照(the averaged light exposure in the mixed layer,Im)为主[22]。Im可由下式计算[23]:
(1)
式中:I0为海表光强,单位:Einstein/(m2·d);d为温度变化超过0.2 ℃/m的最小深度(即混合层深度),单位:m;K为漫衰减系数,单位:m-1,由浊度(Tn)计算得到[24]:
K=0.1Tn+0.44
(2)
1.6 数据处理与分析
采用Ocean Date View软件绘制站位图、环境参数、各粒级Chla和APA的平面分布图;采用R语言“corrplot”数据包分析生物参数与环境因子之间的Pearson相关性;采用分析软件Origin对DIP浓度和各粒级APA进行非线性拟合。考虑到只有在DIP下降时,AP才会水解DOP,而DIP和DOP通常呈反比[6]。因此本研究用米氏方程的倒数形式来描述APA和DIP的关系,公式如下:
(3)
式中:V0为碱性磷酸酶活性;[S]为DIP浓度;当[S]非常大时,V0接近于一个恒定值,该恒定值为最小碱性磷酸酶活性,即Vmin;Km为V0升高至2倍Vmin时的DIP浓度。为了避免光限制的影响,本研究只选取不受光限制的站位来研究APA和DIP的关系。
2 结果
2.1 环境要素分布
由表1可知,随着长江冲淡水向外扩张,盐度、DIP浓度、Im和混合层深度的变化较为显著,温度则无明显变化。调查期间长江口温度的变化范围为22.71~26.17 ℃,平均值为(24.51±0.93)℃;表层盐度的变化范围为0.12~31.64,平均值为22.42±8.26,在平面分布上呈现显著的梯度变化特征,随着离口门距离的增加而升高(图2a)。本次调查期间,河水-冲淡水界面和冲淡水中部的混合层深度一般小于10 m,而冲淡水-海水界面的混合层深度均大于10 m。
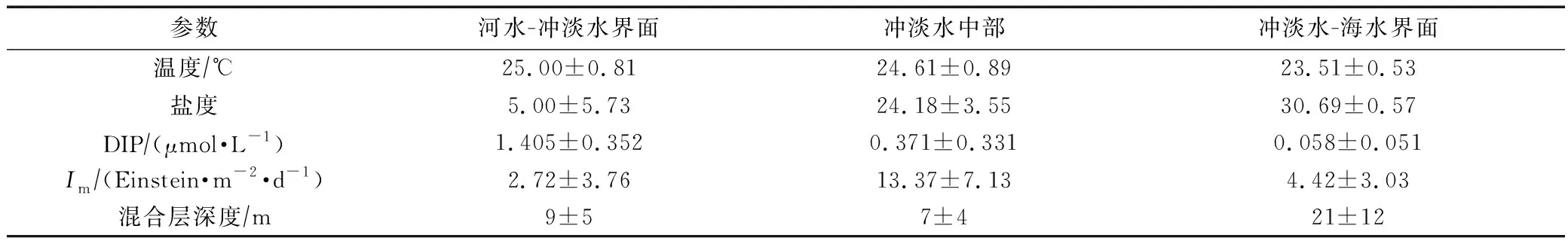
表1 长江口不同区域温度、盐度、DIP、Im和混合层深度的平均值(Mean±SD)Tab.1 Mean±SD of temperature, salinity, DIP, Im and mixed layer depth in the different zones in the Changjiang Estuary
DIP浓度的变化范围为0.017~1.956 μmol/L,平均值为(0.471±0.499) μmol/L。DIP浓度在河水-冲淡水界面最高,为(1.405±0.352) μmol/L,随着离口门距离的增加,DIP浓度逐渐降至0.1 μmol/L以下(图2b)。
Im的变化范围为0.25~30.76 Einstein/(m2·d),平均值为(10.65±7.68) Einstein/(m2·d)。河水-冲淡水界面悬浮物含量较高,导致该区域内Im较低,仅为(2.72±3.76) Einstein/(m2·d)。冲淡水中部的悬浮物含量减少,水体透明度升高,Im显著升高,达到了(13.37±7.13) Einstein/(m2·d)。在冲淡水-海水界面,受较深的混合层深度影响,Im降至(4.42±3.03) Einstein/(m2·d)。在平面分布上,Im大致呈从西向东先升高后降低的趋势(图2b)。
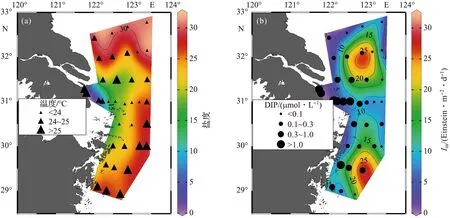
图2 盐度、温度 (a) 和 Im、DIP浓度 (b) 的空间分布Fig.2 Spatial distributions of salinity, temperature (a) and Im, DIP concentration (b)
2.2 Chl a的平面分布
Chla的平面分布如图3所示,各粒级Chla质量浓度见表2。总Chla质量浓度的变化范围为0.82~49.78 mg/m3,平均质量浓度为(6.36±9.50)mg/m3;冲淡水中部的总Chla质量浓度为(7.39±10.45) mg/m3,高于冲淡水-海水界面[(3.47±1.64)mg/m3]和河水-冲淡水界面[(1.39±0.29) mg/m3]。从平面分布来看,总Chla的高值区位于J6、D1和F3站位附近,低值区位于口门附近(图3a)。
在由河水-冲淡水界面向冲淡水-海水界面变化时,各粒级Chla质量浓度的变化趋势与总Chla相同,均表现出先升高后降低的变化趋势。Net-Chla的高值区位于D1和F3站位附近,低值区位于口门附近,与总Chla大致相同(图3b)。Nano-Chla和Pico-Chla的高值区位于J6站位附近,低值区位于口门附近,在大部分海域内,Nano-Chla和Pico-Chla质量浓度均小于1 mg/m3(图3c和3d)。
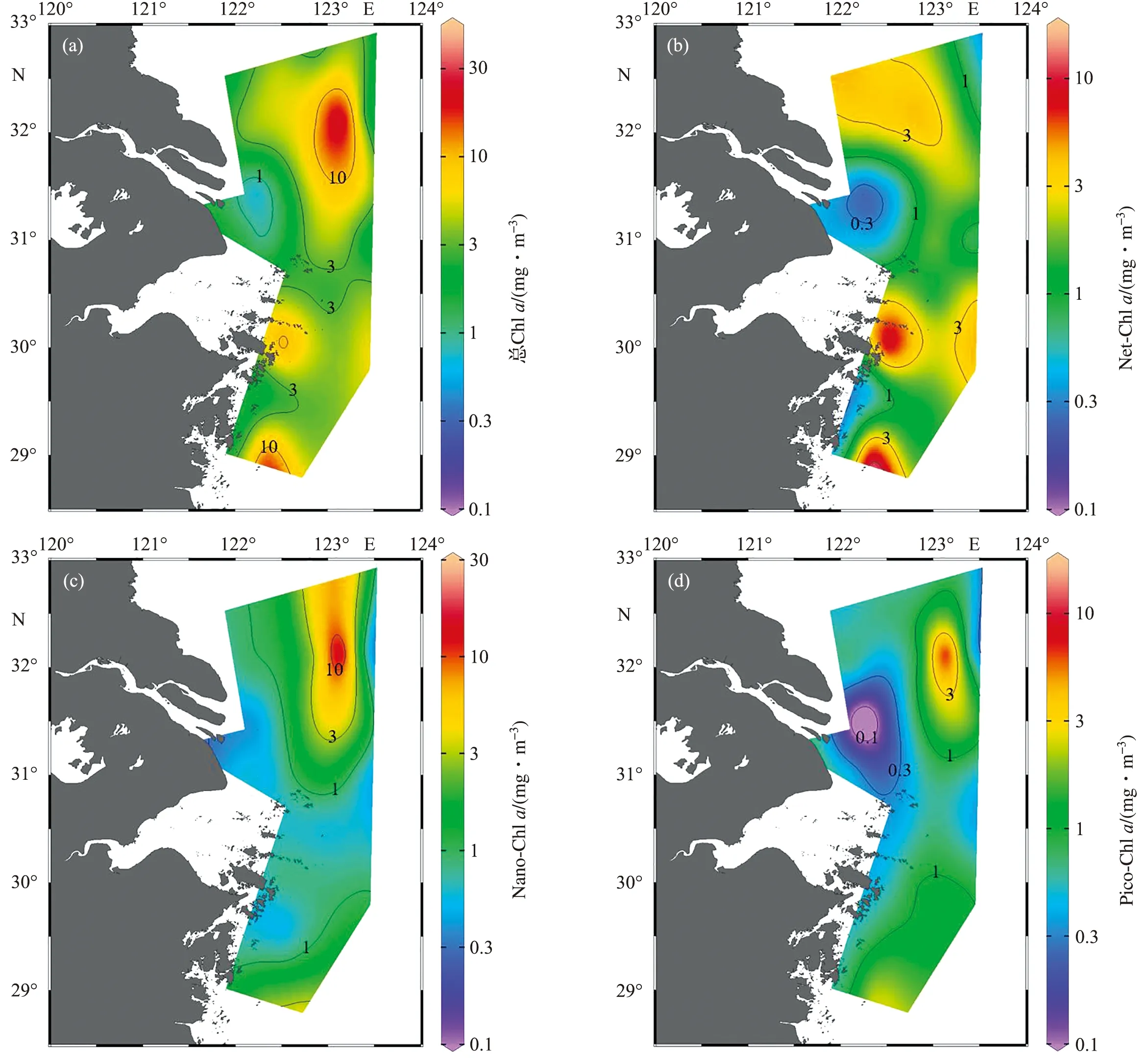
图3 总Chl a (a)、Net-Chl a (b)、Nano-Chl a (c) 和Pico-Chl a (d) 的平面分布Fig.3 Spatial distributions of Total-Chl a (a), Net-Chl a (b), Nano-Chl a (c) and Pico-Chl a (d)
随着离口门距离的增加,各粒级Chla对总Chla的贡献存在明显差别(表2)。在总Chla质量浓度较低的河水-冲淡水界面,各粒级Chla对总Chla的贡献几乎相同。在冲淡水中部和冲淡水-海水界面,Nano-Chla对总Chla的贡献未出现明显变化,而Net-Chla和Pico-Chla对总Chla的贡献分别出现了升高和降低的变化趋势。

表2 长江口不同区域各粒级Chl a(Mean±SD)及其对总Chl a的贡献Tab.2 Mean±SD and its contribution to Total-Chl a of size-fractionated Chl a in the different zones in the Changjiang Estuary
2.3 APA的平面分布
APA的平面分布如图4所示,各粒级APA随距口门距离的变化见表3。总APA的变化范围为29.75~963.99 nmol/(L·h),平均值为(262.76±213.12)nmol/(L·h),其中Phyto-APA、Bacterio-APA和溶解态APA的平均值分别为(123.52±79.27) nmol/(L·h)、(50.29±52.25) nmol/(L·h)和(91.37±106.57) nmol/(L·h)。总APA在冲淡水中部较高[(325.71±221.5) nmol/(L·h)],在冲淡水-海水界面 和河水-冲淡水界面较低,分别为(139.61±37.97) nmol/(L·h)和(71.11±25.27) nmol/(L·h)。在平面分布上,总APA的高值区主要位于离口门较远的东部海域,低值区主要位于口门处和调查区域的南北两侧(图4a)。
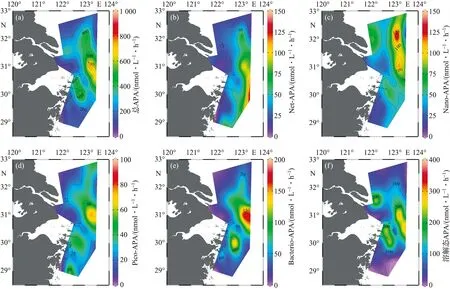
图4 总APA (a)、Net-APA (b)、Nano-APA (c)、Pico-APA (d)、浮游细菌APA (e) 和溶解态APA (f) 的平面分布Fig.4 Spatial distribution of Total-APA (a), Net-APA (b), Nano-APA (c), Pico-APA (d), Bacterio-APA (e) and Dissolved-APA (f)
由低盐度向高盐度变化时,各粒级APA的变化趋势多与总APA相同,表现出明显的先升高后降低的变化趋势,而Nano-APA在冲淡水-海水界面仍较高[(50.97±23.41) nmol/(L·h)]。在平面分布上,Bacterio-APA和溶解态APA的分布特征基本与总APA一致;Net-APA和Pico-APA大致呈自口门向东升高的趋势,Nano-APA呈自西向东先升高后降低的变化趋势。
各粒级APA对总APA的贡献存在较大差异(表3),各区域内Pico-APA和Bacterio-APA对总APA的贡献均较低(<20%),Nano-APA和溶解态APA对总APA的贡献较高(一般大于20%)。
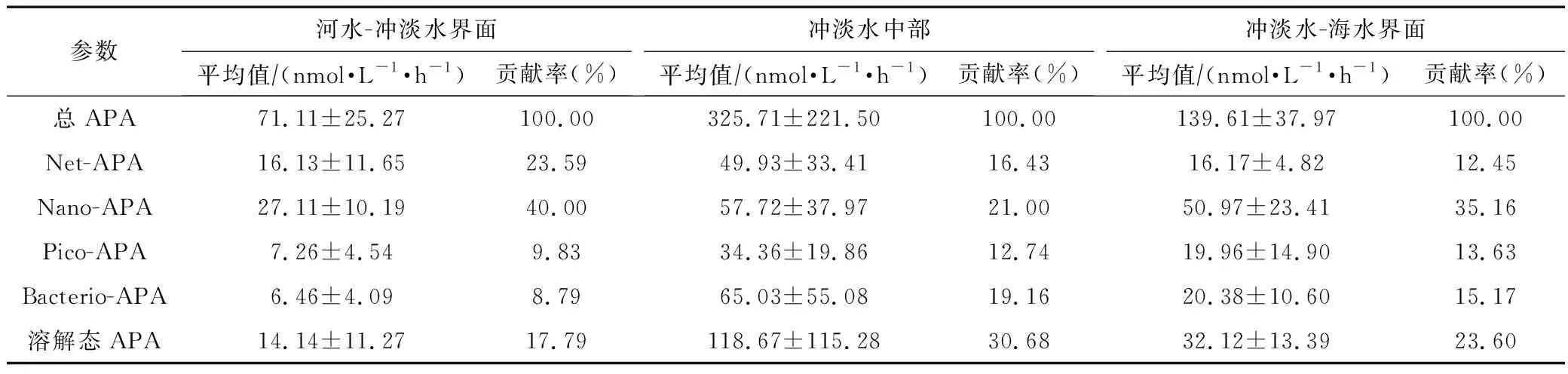
表3 长江口不同区域各粒级APA(Mean±SD)及其对总APA的贡献Tab.3 Mean±SD and its contribution to Total-APA of size-fractionated APA in the different zones in the Changjiang Estuary
2.4 生物参数和环境参数的相关性
各参数之间的Pearson相关性如图5所示。DIP浓度与盐度呈极显著负相关(p<0.001),表明DIP的输入以富营养化的陆源输入为主。除Nano-APA与盐度呈显著正相关(p<0.05)外,各粒级Chla和APA与温度和盐度均无显著相关性(p>0.05),表明温度和盐度不是影响夏季长江口Chla和APA分布的直接因素。Nano-Chla和Pico-Chla与Im呈显著正相关,表明光照是影响夏季长江口Nano-Chla和Pico-Chla分布的因子。溶解态APA与DIP浓度无显著相关性(p>0.05),其他各粒级浮游植物APA和浮游细菌APA均与DIP呈显著负相关(p<0.01或p<0.05),表明在DIP浓度较低时,浮游植物APA和浮游细菌APA会升高,而溶解态APA不受DIP浓度的影响。Nano-APA与Nano-Chla呈极显著正相关(p<0.001),而Net-APA和Pico-APA均与同粒级的Chla无显著相关性(p>0.05),表明浮游植物生物量的变化可能不是影响其APA分布的因素。各粒级浮游植物APA均与浮游细菌APA呈极显著正相关(p<0.001),表明浮游细菌和浮游植物之间可能存在对磷的竞争,其中,浮游细菌和Pico级浮游植物的竞争最为显著。
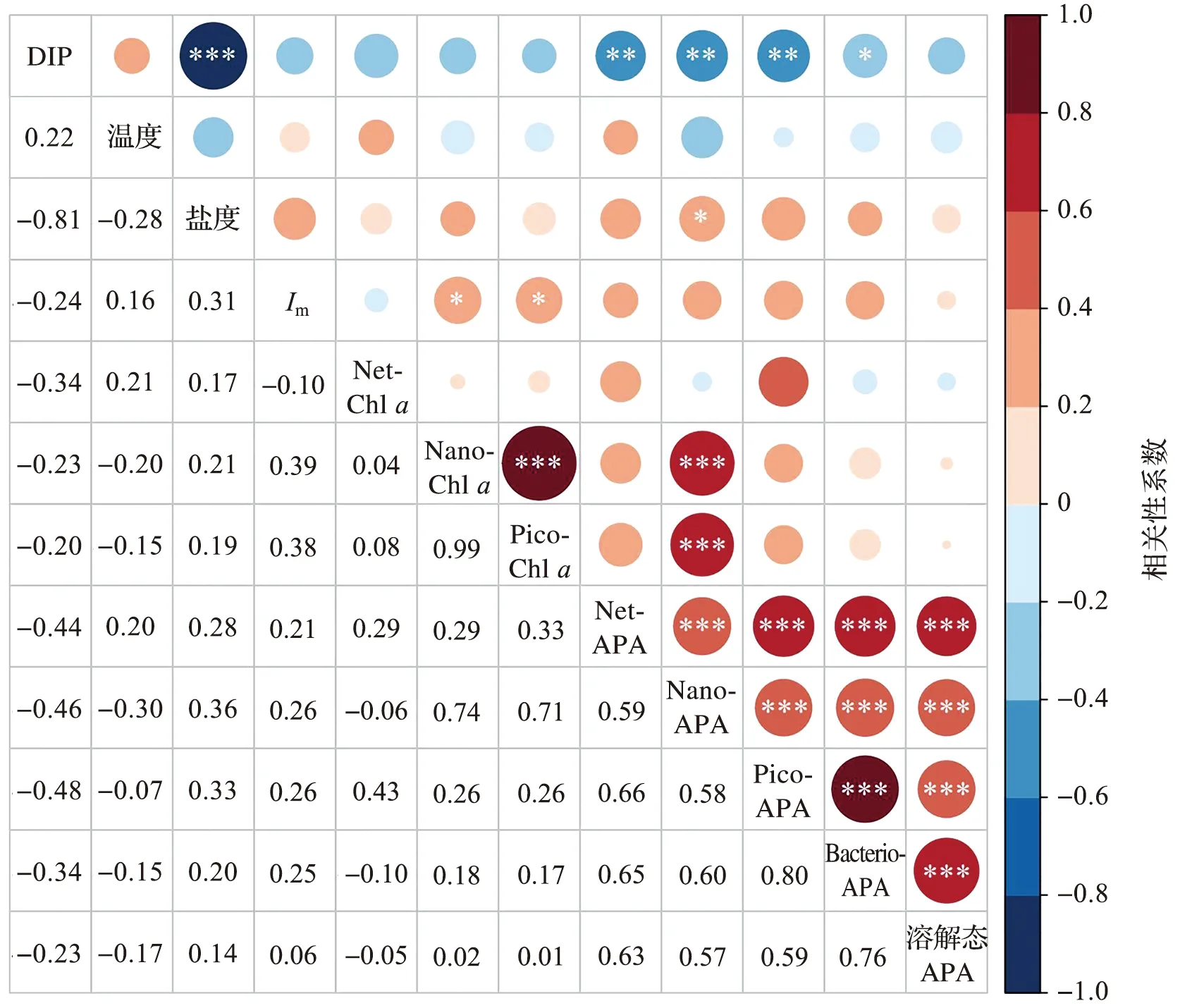
*: p<0.05; ** : p<0.01; *** : p<0.001图5 环境参数和生物参数之间的Pearson相关性矩阵Fig.5 Pearson correlation matrix among environmental and biological parameters
浮游植物各粒级APA与DIP的关系如图6所示。 Phyto-APA、Net-APA和Nano-APA均表现出了与DIP浓度良好的相关性,而Pico-APA与DIP浓度的相关性较差,这可能是由浮游细菌和Pico级浮游植物对磷的竞争导致的。Km随着浮游植物粒级的减小而降低,表现为:Net级(0.218 μmol/L)>Nano级(0.171 μmol/L)> Pico级(0.087 μmol/L)。
3 讨论
3.1 DIP对APA的诱导
在不同海域中,APA存在较大差异,开阔大洋中的APA一般低于10 nmol/(L·h)[25-26],而在近岸海域中,APA往往可以达到100 nmol/(L·h)[27-28]。MO et al[19]的研究结果表明,夏季长江口冲淡水区的总APA平均值为106±133.3 nmol/(L·h);林俊琪[29]的研究结果表明,夏季长江口冲淡水区的总APA平均值为379.8 nmol/(L·h)。本研究中总APA的平均值为(262.76±213.12) nmol/(L·h),与历史研究结果相近。
海水中DIP与APA通常表现为负相关[8,28]。当DIP低至某一浓度时,APA会显著升高;但在不同水体中,诱导浮游植物APA快速升高的DIP浓度存在一定差异[6,8,12]。如KANG et al[8]在对广东近海的研究中发现,诱导浮游植物APA快速升高的DIP浓度为0.2 μmol/L。LABRY et al[12]在对法国近海的研究中发现,低APA向高APA的转变通常在DIP浓度为0.05~0.1 μmol/L时发生。
本研究中诱导浮游植物APA快速升高的DIP浓度约为0.159 μmol/L(图6a),与众多研究结果(约为0.2 μmol/L)[8-9,27]相近,而诱导各粒级APA升高的DIP浓度与粒级大小有关。诱导Net-APA、Nano-APA和Pico-APA升高的DIP浓度分别为0.218 μmol/L、0.171 μmol/L和0.087 μmol/L(图6b~6d),与粒级大小变化相同,这表明浮游植物应对磷限制的能力与其细胞体积有关。浮游植物吸收营养盐后会在细胞表面形成营养盐耗尽区,由于大粒级浮游植物比表面积较小,当细胞表面和外界环境中的营养盐浓度梯度较高时,营养盐才能扩散至细胞表面[30-31]。此外,Net和Nano级APA[平均值分别为 (40.28±32.35) nmol/(L·h)和(52.38±34.78) nmol/(L·h)],显著高于Pico级APA[平均值为(28.43±20.23) nmol/(L·h)],这表明大粒级浮游植物可能更易受DIP下降的影响。因此,大粒级浮游植物应对磷限制的能力较差。
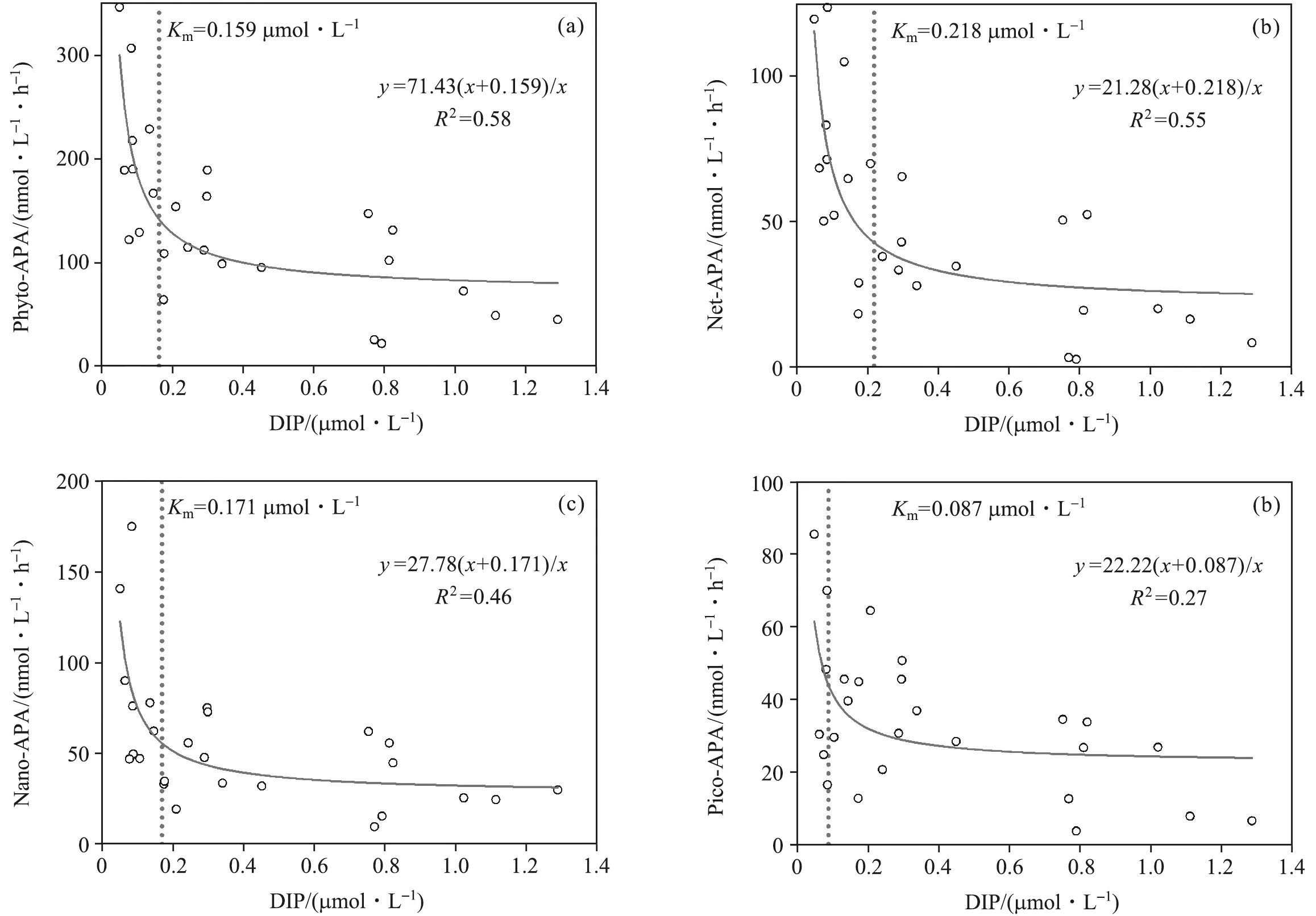
图6 Phyto-APA (a)、Net-APA (b)、Nano-APA (c) 和Pico-APA (d) 与DIP浓度的关系Fig.6 Relationship between Phyto-APA (a), Net-APA (b), Nano-APA (c), Pico-APA (d) and DIP concentration(图中虚线为Km的浓度。)(The dotted lines represent the Km concentration.)
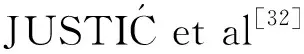
3.2 长江口浮游植物磷限制区域划分
一般而言,浮游植物的生长在河水-冲淡水界面和冲淡水-海水界面分别受到光限制和磷限制的影响,在冲淡水中部不受限制[15,33]。硅藻为夏季长江口浮游植物群落的主要优势种类[34-35],因此,当长江口的Im小于硅藻的饱和光强时[约为4 Einstein/(m2·d)[36]],可以认为该区域内浮游植物的生长受到了光限制的影响。然而,Im不仅受水体透明度影响,还与混合层深度有关。当混合层深度较深时,即使在高透明度、高盐度的外海(例如J7站位),浮游植物的生长也会受到光限制的影响,因此用不同盐度来区分光限制区可能是不可靠的。本研究根据Im和DIP浓度,将长江口划分为3种区域,即光限制区[Im<4 Einstein/(m2·d)]、无限制区(既不受光限制又不受磷限制)和磷限制区(DIP<0.159 μmol/L)(图7a)。光限制区主要位于口门附近和调查区域的西北侧,无限制区主要位于122.5°E—123.0°E之间,磷限制区主要位于123.0°E以东海域。其中,无限制区和磷限制区的盐度范围分别为13.19~28.52和23.45~30.64(表4),与冲淡水中部和冲淡水-海水界面的盐度变化基本吻合。
由光限制向磷限制转变时,盐度逐渐升高,而DIP浓度的变化与其相反(表4),表明磷限制会随着长江冲淡水影响的减弱而增强。在光限制区内,长江径流的输入带来了丰富的营养物质,但是强烈的光限制会抑制浮游植物生长,使得DIP过剩[37]。在无限制区,由于长江冲淡水密度较小,由长江冲淡水持续输入的DIP主要分布在表层海水,在光限制解除后,浮游植物的生长过度消耗了DIP,导致表层DIP浓度快速降低(图7b)。同时,由于夏季跃层的存在,富含DIP的底层海水无法补充至表层,最终导致表层DIP耗尽并形成磷限制区[11,15]。由光限制向磷限制转变时,各粒级APA均表现出显著升高的趋势(表4),表明磷限制对浮游植物生长的影响在不断加剧,但是总Chla质量浓度的变化趋势却与此不符。

图7 长江口浮游植物限制区域划分(a)和各参数随离口门距离的变化(b)Fig.7 Classification of phytoplankton limitation zones (a) and the variations of each parameter changingwith distance from the mouth (b) in the Changjiang Estuary
表4 光限制区、无限制区和磷限制区内各参数平均值(Mean±SD)及变化范围Tab.4 The Mean±SD and variation range of each parameter in light limitation, non-limitation and phosphorus limitation zone
历史研究表明,夏季长江口无限制区的总Chla质量浓度一般高于光限制区和磷限制区[11,33]。然而,在本研究中,磷限制区的总Chla平均质量浓度达到了11.06 mg/m3,高于光限制区和无限制区(表4)。Chla质量浓度是浮游植物现存量的指标[37],与浮游植物生长(受光照和营养盐的影响)和损失(如呼吸、浮游动物摄食、沉降和病毒溶解)的平衡有关[38]。尽管磷限制区DIP浓度限制了浮游植物的生长速率,但当浮游植物的损失速率小于生长速率时,浮游植物仍能达到较高的现存量。同时,磷限制区较高的 APA可能在一定程度上缓解了磷限制对浮游植物生长的影响[39]。
如图7b所示,在长江冲淡水向外海扩张时,影响浮游植物生长的限制因子由Im向DIP转变,且Chla质量浓度和APA均表现出明显的变化趋势。Chla质量浓度在光限制区呈现先升高后降低的变化,这可能与悬浮泥沙的影响有关[37]。当悬浮泥沙的质量浓度较高时,浮游动物的摄食可能会受到抑制[40- 41],使得浮游植物现存量升高。Chla质量浓度在光限制解除后立刻呈现升高的趋势,而后在123°E附近达到峰值。TSENG et al[11]对长江口的研究表明,APA在 Chla质量浓度达到峰值时极低。而在本研究中,APA与Chla几乎同时在磷限制区达到峰值,表明在DIP浓度较低时,AP对DOP的水解可能使浮游植物维持较高的生物量,ZHANG et al[9]在对胶州湾的研究中也得出了相似的结论。Chla峰值区的溶解态APA和颗粒态APA均较高(图7b),表明该海域浮游植物在调查时已处于较长时间的磷限制状态。浮游植物和细菌释放到海水中的AP被称为溶解态AP[42]。溶解态AP能长时间在海水中保持活性,因此它可以作为判断海域的磷历史状态的标准[21]。当溶解态APA和颗粒态APA都较高时,表明海域内的浮游植物在数天甚至数星期内持续遭受磷限制的影响[21]。此外,部分研究表明,浮游植物和浮游细菌会通过竞争DIP和DOP来满足自身对磷的需求[7,43- 44]。在本研究中,随着离口门距离的增加,Phyto-APA和Bacterio-APA的变化趋势几乎一致,此外,各粒级浮游植物APA均与Bacterio-APA呈显著正相关(图6),这些结果都表明,在长江口,浮游植物和浮游细菌会彼此竞争DOP。
3.3 磷限制对浮游植物群落粒级结构的影响
如图8所示,在本研究中,由无限制区向磷限制区转变时,Net-Chla对总Chla的贡献出现了下降的趋势,而Nano-Chla和Pico-Chla对总Chla的贡献出现了升高的趋势,表明随着磷限制的加剧,长江口浮游植物的群落粒级结构可能开始向小型化转变。在营养盐浓度极低的开阔大洋中,由于小粒级浮游植物吸收营养盐的速率高于大粒级浮游植物,浮游植物群落一般以粒级较小的浮游植物为主[30]。值得注意的是,本研究中,磷限制区内浮游植物群落仍以Net级占优势,这可能与大粒级细胞对磷的储存能力有关。大粒级的硅藻为夏季长江口浮游植物主要优势种类[34-35],其体内拥有液泡,可以将从环境中吸收的DIP浓缩和储存在体内,在外界环境中的DIP耗尽后用于维持自身的生长繁殖[45]。
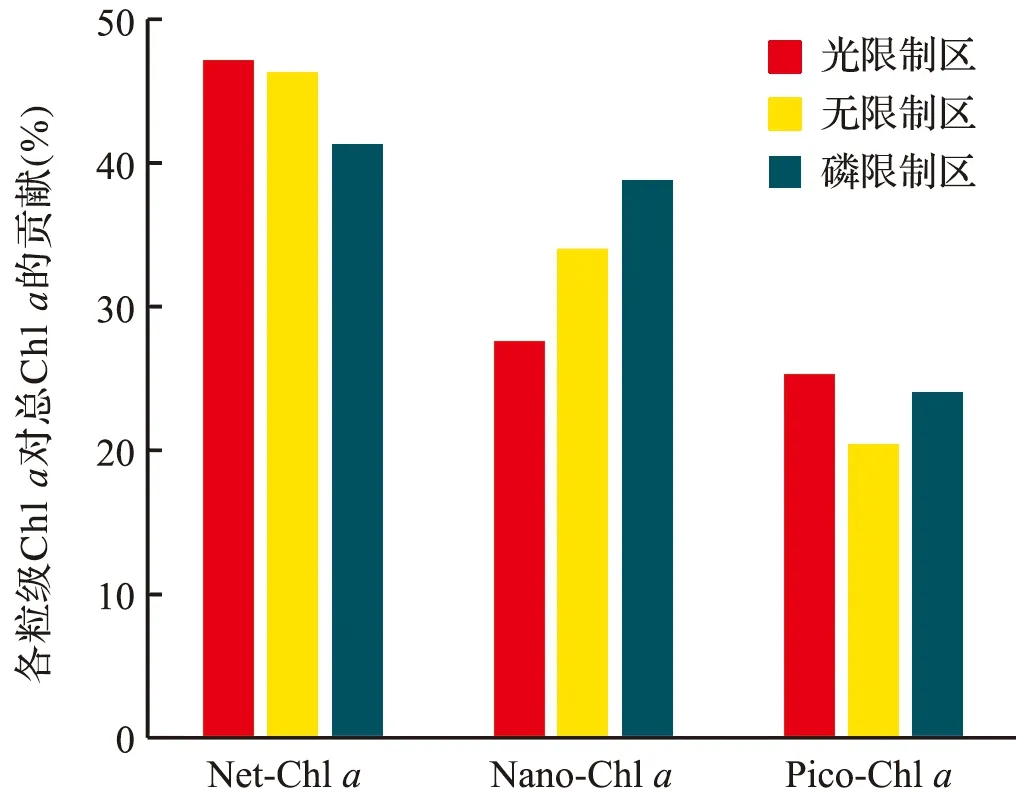
图8 各粒级Chl a对总Chl a的贡献在不同区域的变化Fig.8 Variations of the contribution of size-fractionated Chl a to Total-Chl a in different zones
4 结论
本文根据2020年夏季航次获取的长江口表层海水各粒级浮游植物群落APA和DIP数据,分析了浮游植物APA的空间分布及其影响因素,主要结论如下:
(1)各粒级浮游植物APA具有明显的空间差异,其分布特点主要表现为外海高、口门低。在部分DIP浓度较低的站位,较高的APA在一定程度上缓解了磷限制对浮游植物生长的影响,使得Chla质量浓度仍能维持在较高水平。DIP浓度是影响各粒级APA分布的主要因素,随着DIP浓度不断降低,各粒级APA呈不断升高的趋势。
(2)浮游植物的生长在Im<4 Einstein/(m2·d)时受到光限制影响,在DIP<0.159 μmol/L时受到磷限制影响。当混合层深度较深时,即使在透明度较高的海域,浮游植物的生长也可能受到光限制的影响。
(3)诱导Net级APA升高的DIP浓度(0.218 μmol/L)高于Nano级和Pico级(分别为0.171 μmol/L和0.087 μmol/L),这表明大粒级浮游植物应对磷限制的能力较差,最终可能导致浮游植物群落粒级组成随着DIP浓度的降低向小型化发展。
致谢感谢“科学三号”科考船全体人员在航次期间提供的帮助。

