HIF-1α、hs-CRP对COPD疾病进展的临床意义
陈丽君,张慧芳,陈娟霞,马丽婷,夏春燕,马晓勇
慢性阻塞性肺疾病(COPD)由于双肺及支气管的慢性炎症导致气道重塑、气流受限,随着疾病进展,肺实质及肺血管进一步破坏导致通气/血流比例失调使患者出现低氧。低氧刺激下缺氧诱导因子(HIF-1α)过度表达调控某些炎症因子参与COPD的炎症失调[1-3],使炎症持续或放大,同时炎症因子又可以激活HIF-1α的表达[4]造成了“炎症-缺氧-炎症”的恶性循环从而促进COPD疾病进展。本文通过检测不同严重程度COPD患者血清HIF-1α、超敏C反应蛋白(hs-CRP)浓度及肺功能,分析不同严重程度COPD患者间HIF-1α、hs-CRP的差异及HIF-1α与hs-CRP、FEV1%的相关性,探讨HIF-1α、hs-CRP对COPD疾病进展的可能作用。
1 资料与方法
1.1 一般资料:收集2016—2020年在银川市第一人民医院呼吸与危重症医学科就诊的COPD患者160例,依照肺功能检查分为轻度、中度、重度、极重度4组,每组各40例。所有患者签署知情同意书。
1.2 入选及排除标准:入选患者需符合2020版GOLD指南COPD的诊断标准;排除支气管哮喘、活动性肺结核、肺癌、原发性支气管扩张、尘肺及其他肺限制性通气功能障碍的患者。
1.3 肺功能分组标准:轻度(Ⅰ级),FEV1/FVC<70%,FEV1占预计值百分比≥80%;中度(Ⅱ级),FEV1/FVC<70%,50%≤FEV1占预计值百分比<80%;重度(Ⅲ级),FEV1/FVC<70%,30%≤FEV1占预计值百分比<50%;极重度(Ⅳ级),FEV1/FVC<70%,FEV1占预计值百分比<30%,或伴有慢性呼吸衰竭。
1.4 标本采集:所有患者于入组当天抽取外周静脉血5 mL,EDTA抗凝,离心后提取上层血清,置于-80 ℃冰箱保存备用。
1.5 HIF-1α检测:应用人HIF-1α酶联免疫分析检测试剂盒进行血清HIF-1α检测。
1.6 hs-CRP检测:使用比浊法测定血清hs-CRP浓度。
1.7 肺功能检查:应用惠普MasterScope肺功能仪由专职技术人员对患者进行肺功能检查。
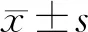
2 结果
2.1 4组患者一般资料及HIF-1α、hs-CRP浓度比较:4组患者间年龄、身高、性别比较差异无统计学意义(P>0.05),具有可比性。4组患者随疾病严重程度的增加,HIF-1α、hs-CRP浓度逐渐升高,且差异具有统计学意义(P<0.05),见表1。

表1 COPD患者HIF-1α、hs-CRP浓度比较
2.2 4组患者HIF-1α与hs-CRP、FEV1%的相关性分析:分别对4组患者HIF-1α与hs-CRP、FEV1%进行线性相关分析,结果发现轻度、中度、重度、极重度4组患者HIF-1α均与hs-CRP呈正相关性、与FEV1%呈负相关,且相关性随疾病加重而增加,见表2。

表2 COPD患者HIF-1α与hs-CRP、FEV1%相关性分析
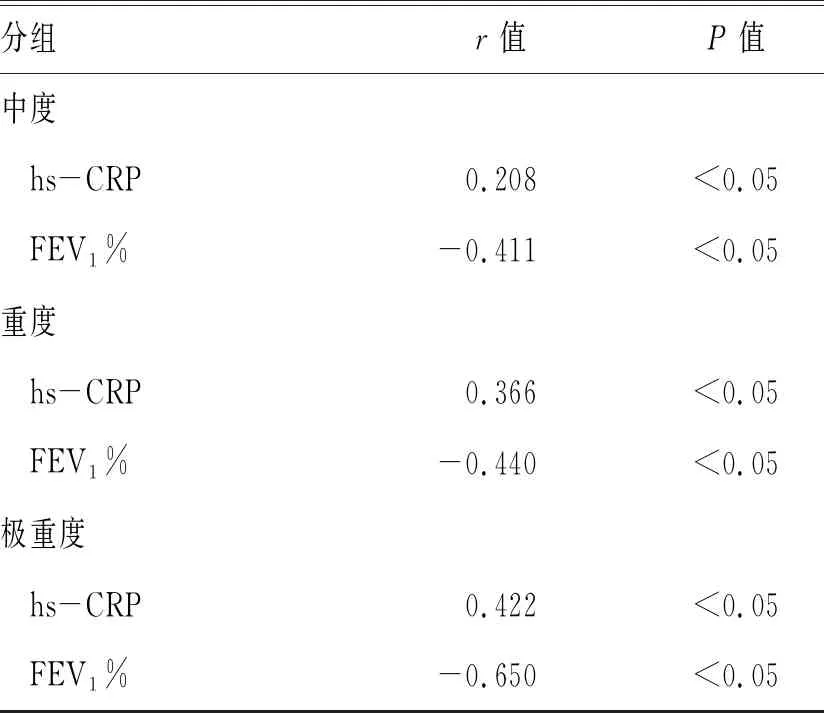
分组r值 P值中度 hs-CRP0.208<0.05 FEV1%-0.411<0.05重度 hs-CRP0.366<0.05 FEV1%-0.440<0.05极重度 hs-CRP0.422<0.05 FEV1%-0.650<0.05
3 讨论
COPD是累及气道、肺实质和肺血管的慢性呼吸系统疾病,其核心是全身炎症反应,炎症在COPD的发生发展中起关键作用[5-6]。机体在慢性炎症刺激下气管壁损伤-修复过程反复发生,进而引起气道重塑、肺实质胶原含量增加以及瘢痕形成,以上病理改变最终造成气道不可逆的气流受限、肺内通气/血流比例失调,引起组织缺氧,因此缺氧是COPD的病理结局。机体在炎症及缺氧刺激下导致血管内皮损伤、促红细胞生成素过度表达、血液黏滞、血栓形成,从而逐渐出现肺心病、骨质疏松、胃食管反流、肌少症等多系统并发症,加速了COPD疾病进展。
HIF-1α是反应机体缺氧的敏感指标,缺氧下迅速表达,常氧下又迅速降解。低氧下HIF-1α通过调控一系列缺氧基因的表达来调控机体适应低氧环境,从而避免机体因缺氧而引起组织、细胞的损伤[7-9]。COPD机体为适应长期缺氧逐渐出现了缺氧性肺动脉高压、肺源性心脏病等并发症使病情恶化[10]。本研究发现4组COPD患者疾病严重程度不同,HIF-1α表达不同,且随病情严重程度的增加HIF-1α表达逐渐增加,差异具有统计学意义,提示疾病严重程度的增加而伴随着机体缺氧程度的增加。因此,临床上通过监测HIF-1α浓度可以更加精准地评估机体缺氧状况,间接反映疾病进展程度,还可以为临床氧疗提供客观依据[2]。
hs-CRP是一种对炎症具有较高灵敏性和较好预测价值的生物标记物,且临床上操作简便,易于推广,即使是基层医疗卫生机构也便于开展,用于指导临床诊疗。hs-CRP可通过激活NF-B信号通路诱导产生一系列的炎性细胞因子[11-12],从而加重COPD炎症效应,促进疾病进展。众多研究证实,hs-CRP在评估COPD患者疾病严重程度、急性加重风险及预后等多方面具有重要作用[13-15]。本研究结果显示,hs-CRP浓度在COPD患者中极重度组>重度组>中度组>轻度组,说明随着疾病的进展,COPD炎症反应逐渐加重。
对4组COPD患者的HIF-1α与hs-CRP和FEV1%进行线性相关分析,结果显示,4组患者的HIF-1α均与hs-CRP呈正相关性、与FEV1.0%呈负相关性,且随着疾病严重程度的增加相关性增加。这一结果提示COPD缺氧与炎症密不可分,相关研究也证实缺氧下TNF-α、IL-6等炎症因子激活了HIF-1α,HIF-1α又通过调控VEGF、TGF-β等炎症因子加重了COPD的缺氧[2,16],导致炎症-缺氧-炎症的恶性循环。因此,COPD炎症和缺氧互相影响、互为因果促进了疾病进展。此外HIF-1α还通过对炎症因子的调控增大了COPD的炎症效应,长期存在的炎症刺激使COPD患者支气管、肺实质及肺血管受损、气道重塑、气流受限,最终导致FEV1%降低,引起肺功能减损[16]。本研究也证实了COPD患者HIF-1α与FEV1%呈负相关,且呈现出随疾病严重程度增加而相关性增加的趋势,说明HIF-1α与hs-CRP协同作用使患者出现气流受限、肺功能受损,共同促进了COPD的恶化及疾病进展。
因此,通过检测COPD患者血清HIF-1α和hs-CRP浓度可帮助临床医师初步预测疾病的严重程度,为临床判断疾病预后提供理论依据。后期将扩大样本量,进一步探讨血清HIF-1α和hs-CRP浓度预判疾病严重程度的界值,为临床疾病诊疗提供更好的帮助。

