BODIPY型光敏剂在光动力治疗癌症领域的研究现状与进展
汪清清,方 霄,熊惠娟,胡美纯,王小波*
(1.湖北科技学院医学部药学院,湖北 咸宁 437100;2.湖北科技学院医学部基础医学院)
PDT是指以特定波长的光源(通常为可见光,多为红光)激发光敏剂,随后迅速与周围的O2作用,产生可以攻击靶细胞或组织等生物大分子的活性氧(reactive oxygen species,ROS),如1O2、OH等[1-2]。这些活性氧物种具有很强的活性,能促使、诱导细胞坏死或凋亡,从而达到治疗目的,故常将光敏剂、光源和O2的协同作用作为PDT的关键[3]。
PDT在疾病的治疗尤其是癌症治疗领域有着独特的优势和广阔的应用前景。与经典的癌症治疗策略相比,PDT通过选择合适的光敏剂、光源,调节光照时间、强度,并特异性照射病灶位点,就能够实现对治疗效果的调控。其有如下优点:①可应用于不适合手术、化疗和放疗的病人群体;②可选择性用于手术不能接触的部位;③可安全有效地重复使用;④不产生免疫抑制;⑤能在手术、化疗、放疗的各个阶段配合辅助使用,达到协同增效并降低副作用的目的;⑥基本不产生耐药性[4]。
作为PDT的核心,光敏剂的研发一直是该领域的重点研究方向。最初,以卟啉作为光敏剂得到了广泛关注与重视。随着研究的不断深入,其他类型的光敏剂逐步出现,并被越来越多地应用于临床试验[5-8]。目前研究较为热门的光敏剂类型有:卟啉型、钛菁型以及氟硼二吡咯(dipyrromethene boron difluoride,BODIPY)型等[9-11]。其中BODIPY是一类优良的荧光物质,被广泛用于制备荧光探针和作为荧光成像染料。其优点为:①通常具有较大的摩尔吸光系数;②具有高的化学稳定性和光稳定性;③结构中有多个可修饰位点,方便引入其它功能基团[12-13]。在过去十多年中,它已发展成为一种极具潜力的新型光敏剂,其用于光动力抗癌的文献大量涌现[14-18]。本文将根据PDT用于癌症类型的不同,对BODIPY型小分子光敏剂进行综述。
1 BODIPY型光敏剂对肺癌和肝癌的PDT作用
Ramu团队将BODIPY连接吗啉环,并与Pt(Ⅱ)配位制备得到了一个能选择性定位于溶酶体的光敏型配合物1,结构见图1-1[19]。该配合物在600~720nm的近红外光照下具有良好的1O2产生能力,因而对人肺癌细胞A549等具有优异的PDT活性,IC50值低至0.7μmol/L,暗毒性则不明显。细胞凋亡检测表明光敏型铂配合物1主要通过致使癌细胞内的溶酶体功能紊乱而表现出高效的PDT活性。
Wang课题组利用水溶性良好的咔唑基连接BODIPY制备得到了一个正交给体-受体结构型光敏剂2,结构见图1-2[20],证明光敏剂2拥有强的1O2敏化能力,在甲醇中的单线态氧量子产率达到了0.68。同时,它的水溶性也很好,并具有较高的光稳定性。MTT实验表明光敏剂2对人肝癌细胞Bel-7402的抑制效率优异(4mW/cm2,460nm),IC50值达到了0.45μmol/L,而无光照时则没有任何效果。进一步以光敏剂2处理模式动物斑马鱼后,斑马鱼能有效吸收此光敏剂。给予光照后,释放大量ROS,氧化和破坏了斑马鱼组织的完整性。综上可知,化合物2是一个有望用于真实PDT的优良光敏剂。

图1 光敏型配合物1和正交给体-受体结构型光敏剂2的分子结构
2 BODIPY型光敏剂对乳腺癌和宫颈癌的PDT作用
Miao团队首先设计合成了有机氮杂的BODIPY,然后在此基础上加碘得到了一个具有突出的系统间交叉(ISC)特征的光敏剂3,结构见图2-3[21]。实验采用飞秒瞬态吸收光谱学(fs-TA)结合理论计算,揭示了光敏剂3高效的ISC效率(ФISC=91%)。这种ФISC赋予了光敏剂3超高单线态氧量子产率(ФΔ=88%),从而实现在超低近红外光功率密度(<10mW/cm2)下高效的PDT。应用流式细胞术对乳腺癌细胞进行检测,发现在光敏剂3和LED灯的协同照射下,晚期凋亡癌细胞从1.4%增加到90.1%。同时MTT实验表明光敏剂3即使在高浓度(100μg/mL)下也表现出可忽略的暗细胞毒性,而在660nm的LED灯照射下具有极高的光毒性。进一步用携带乳腺癌细胞的小鼠测试体内治疗效果,证实了光敏剂3的肿瘤积累。在LED灯照射后,注射了化合物3的小鼠肿瘤体积受到明显抑制。综上所述,本研究不仅提供了一种新型的超高ФΔ有机近红外光敏剂,而且丰富了对有机近红外材料ISC动力学的认识,为临床癌症治疗设计新型有机治疗材料提供了有价值的指导。
Qi等首先在BODIPY上引入噻吩,然后在此基础母核上引入一个对甲氧基苯基得到具有线粒体靶向的光敏剂4,结构见图2-4[22]。值得注意的是,光敏剂4具有显著的双重功能,表现为较高的单线态氧生成能力(ФΔ≈0.85)和中等的荧光强度(Фf=17.11)。此外,MTT实验表明光敏剂4即使在很低浓度(0.15μmol/L)下,生长抑制率也达到约88.0%,且对宫颈癌细胞的IC50值降低为95nmol/L,其可能归因于在光照射下产生的高单线态氧量子产率和高效的线粒体特异性ROS生成。激光共聚焦实验结果进一步表明,宫颈癌细胞死亡是由线粒体相关途径诱导的。综上可知,在噻吩融合的BODIPY平台的介观位置加入一个供电子基团可能是开发用于精确治疗癌症药物的有效方法。
3 BODIPY型光敏剂对皮肤癌的PDT作用
Qiao等将具有显著的单线态氧量子产率的金属Ru(Ⅱ)连接到BODIPY上,得到溶酶体靶向的偶联物5,结构见图2-5[23]。光敏剂5对恶性黑色素瘤细胞(PI=3448)和异种移植恶性黑色素瘤小鼠产生高效的PDT疗效。流式细胞术分析显示,恶性黑色素瘤细胞中2,7-二氯荧光素(DCF)发射呈光敏剂浓度依赖性增加,表明近红外光(NIR)照射下在细胞中产生了ROS。特别值得注意的是,在极低的NIR(0.5J/cm2)照射下,即使是超低的孵育浓度(0.0125mmol/L)的光敏剂5也能提高恶性黑色素瘤细胞中可观的ROS,且无暗毒性。进一步通过体内荧光成像发现,光敏剂5对异种移植恶性黑色素瘤小鼠有明显的肿瘤生长延迟和抑制作用,且未引起明显的体重减轻,这表明光敏剂5具有无毒性。综上所述,光敏剂5成功地整合了Ru(Ⅱ)和BODIPY的优点,在体外表现出显著的PDT效力,在体内能够抑制肿瘤生长,是新一代NIR驱动的PDT强大候选药物。

图2 光敏剂3、光敏剂4和偶联物5的分子结构
4 BODIPY型光敏剂对其它癌症的PDT作用
Yuan等首先将介-(4-吡啶基)连接到BODIPY上,然后与苯硼酸吡啶酯基进行烷基化反应,最后加碘并对其进行修饰,得到单线态氧生成效率低、水溶性好的光敏前药6,结构见图3-6[24]。其一旦被暴露于肿瘤环境的ROS中,光敏前药6可以被重新激活并转化为光敏剂6而产生高效率的单线态氧,从而在光照射下杀死癌细胞。与前药类似,光敏前药6可能在需要时表现出PDT效率,并在治疗前后保持惰性状态。因此,光敏前药6可能对正常细胞具有较低的光毒性,并可能在肿瘤环境中被ROS激活以恢复光毒性。采用结肠癌细胞和正常结肠黏膜上皮细胞进行PDT实验,光敏前药6无论有或没有光照的情况下,都对正常结肠黏膜上皮细胞表现出相对较低的细胞毒性,表明其具有良好的生物相容性和安全性。对于结肠癌细胞,则在黑暗中表现出较低的细胞毒性。有趣的是,即使仅在绿光下照射1min,结肠癌细胞的细胞活力也显著降低,光敏前药6对结肠癌细胞的IC50约为1μmol/L。进一步用流式细胞术检测结肠癌细胞和正常结肠黏膜上皮细胞内ROS的水平,发现肠癌细胞内ROS水平比正常结肠黏膜上皮细胞高10倍。光敏前药6一旦进入结肠癌细胞,就可以被高ROS水平重新激活生成光敏剂6,并表现出较高的单线态氧生成效率。因此,在绿光照射下,光敏前药6对结肠癌细胞的细胞毒性显著增强。不同的是,在正常结肠黏膜上皮细胞中,由于ROS浓度相对较低,光敏前药6保持失活状态。总之,基于细胞内ROS水平的差异,光敏前药6在肿瘤细胞中可被激活,具有良好的PDT效率,而在正常细胞中保持惰性状态和较低的光毒性。这样,在不牺牲治疗效果的情况下,进一步提高了PDT的安全性和选择性。
Reina等首先在BODIPY上连接苯基硼酸基团以及氯,然后在此基础上与氧化石墨烯(GO)通过二醇衍生化反应得到化合物7,其在谷胱甘肽转移酶(GST)存在下,两个氯原子被谷胱甘肽(GSH)取代而发挥作用,结构见图3-7[25]。在2D和3D前列腺癌细胞模型中对化合物7的疗效进行研究,发现在光照射下荧光增加9.5倍且产生高水平的ROS,导致显著的前列腺癌细胞死亡。此外,化合物7耗尽了细胞内的GSH,从而降低了GST清除ROS的能力,这有助于增加前列腺癌细胞死亡。综上可知,化合物7可以用于GSH的消耗,并作为一种体外光敏剂,具有优于氧化石墨烯的活性,也为如何应用BODIPY治疗前列腺癌提供了一个新的视角。
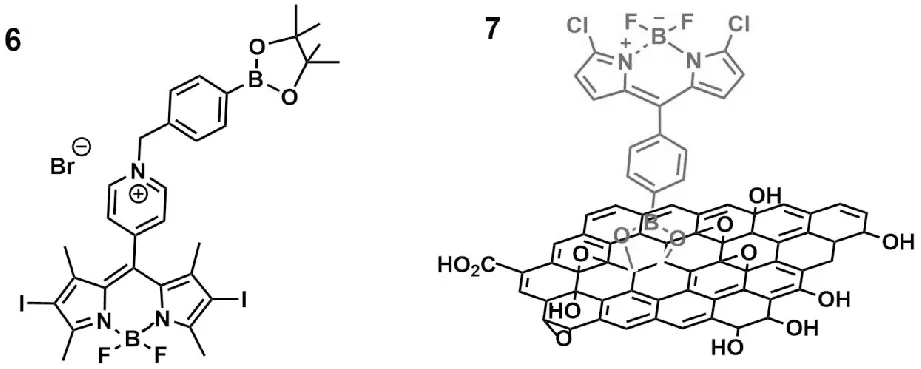
图3 光敏前药6和化合物7的分子结构
5 总结与展望
以疾病模型的不同分类,本文系统综述了BODIPYs作为光敏剂在光动力抗肿瘤中的研究进展。在对BODIPY的结构修饰方面,可以加入重原子如I、Br等,以增加ROS的产生,进而增强光动力活性。也可通过将meso位的C变成N而制备azo-BODIPYs,来增加其激发和发射波长,有助于实现对活体内深层组织的癌症病灶治疗。此外,还可将BODIPYs与具有化疗活性的金属配合物等联合,研发双功能或多功能药物等。
综上所述,设计和合成可用于真实生命体系中光动力抗癌的BODIPY型光敏剂对当前的化学家和药物学家来说仍是一个巨大的挑战。目前,已有一些研究者[26-28]尝试在BODIPYs基础上构建前药来实现诊疗一体化等。我们相信,BODIPYs作为一类极具前景的光敏剂核心单元,必将受到越来越多的关注而不断衍生出走向实际临床的光动力抗癌药物。

