原发性食管小细胞神经内分泌癌18F-FDG PET/CT显像1例
张实来,廖芝玲,莫少州,刘子雅,蒲维维,韦红娇,丘文明,肖国有
广西医科大学附属肿瘤医院核医学科,广西临床重点建设专科(核医学科),广西影像医学临床医学研究中心,广西医科大学附属肿瘤医院优势培育学科(医学影像学科),广西 南宁 530021
1 资 料
患者,男性,66岁,无明显诱因下出现声音嘶哑、吞咽异物感,偶有饮水呛咳伴有胸骨后疼痛,进食时疼痛明显,于2020年5月19日至外院行计算机体层成像(computed tomography,CT)检查发现食管中上段肿物,考虑为食管癌。2020年5月25日,患者转诊于广西医科大学附属肿瘤医院,入院后检查肿瘤标志物:细胞角质蛋白19片段抗原21-1(cyto-keratin 19 fragment antigen 21-1,CYFRA21-1)3.78 ng/mL(参考值≤3.3 ng/mL)。食管钡剂造影(图1):食管中下段(约平第7胸椎至第9胸椎水平)管壁黏膜破坏、中断,局部食管管壁蠕动较僵硬,其狭窄段以上管腔稍扩张,考虑胸中下段食管癌可能性大。增强CT检查(图2):胸中下段食管管壁增厚呈肿物影,病变与食管周围肿大淋巴结分界不清,增强呈不均匀强化,考虑为食管癌并淋巴结转移。患者为明确肿瘤的定性及分期,遂行18F-FDG正电子发射体层成像(positron emission tomography,PET)/CT检查(图3):胸中下段食管管壁增厚,管腔显示不清,病变与食管周围肿大淋巴结分界不清,较大截面约6.4 cm×3.2 cm,病变段长约8.3 cm,上缘达主动脉弓水平,下缘到左心房下缘,放射性浓聚,最大标准化摄取值(maximal standard uptake value,SUVmax)为11.8。双侧腮腺区、右锁骨上区、纵隔(2、4组)及食管旁见多发肿大淋巴结影伴放射性浓聚,可测较大者位于纵隔2组,中央可见液化坏死,大小约5.2 cm×4.0 cm,边缘放射性浓聚,SUVmax为10.6,病变挤压推移邻近气管、食管及甲状腺右叶,相应层面食管管腔狭窄。PET/CT诊断:胸中下段食管增厚代谢增高,两侧腮腺区、右锁骨上区、纵隔、食管旁多发代谢增高淋巴结,考虑食管癌并多发淋巴结转移可能,建议行穿刺病理学检查。因PET/CT提示患者多发转移,不适合手术治疗,遂行食管镜检查并穿刺活检。食管镜(图4):距门齿25~35 cm处食管见结节溃疡型肿物隆起,管腔狭窄,考虑为中段食管癌。穿刺病理学检查(图5):低分化癌,待免疫组织化学检查确定类型。免疫组织化学检查:CKpan(+),CK5/6(-),P40(-),CK7(+),VILLIN(+),CD56(+),Syn(+),CgA(+),P53(-),Ki-67增殖指数(+70%)。最终病理学诊断为(食管)小细胞神经内分泌癌(small cell neuroendocrine carcinoma,SCNEC)。

图1 患者食管钡剂造影检查
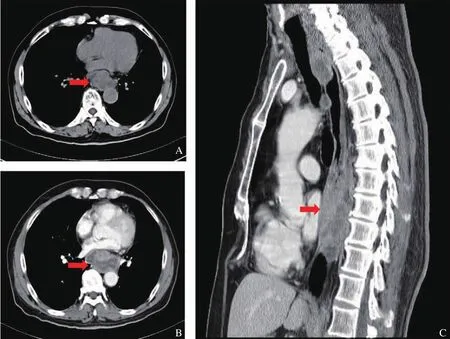
图2 患者CT图像

图3 患者18F-FDG PET/CT图像

图4 患者食管镜检查

图5 患者病理学图像
患者于2020年6月8日—2020年8月20日共行4个周期依托泊苷+顺铂方案化疗,化疗过程顺利。后于2020年9月20日—2020年11月5日完成放疗,放疗过程顺利。2020年12月下旬患者无明显诱因下出现阵发性头痛,2020年12月25日至外院复查颅脑磁共振成像(magnetic resonance imaging,MRI)提示脑转移瘤。于2021年1月4日来我院就诊,CT提示病情进展,右肺、颅脑、肝脏新见多发转移。结合辅助检查结果,患者诊断修订为胸中下段食管SCNEC放化疗后脑、肝、肺转移,治疗方案为脑部姑息放疗+免疫治疗,于2021年1月13日—2月5日行脑转移瘤放疗。2021年1月13日、2021年2月4日、2021年2月26日行3个周期特瑞普利单抗免疫治疗。2021年3月17日返院复查颅脑MRI及CT见脑转移瘤较前明显缩小,但肝转移瘤较前增多、增大,考虑患者肿瘤进展,治疗方案在特瑞普利单抗基础上加用安罗替尼靶向治疗,2021年3月22日开始服用安罗替尼治疗。于2021年3月22日、2021年4月13日、2021年5月7日、2021年5月26日予特瑞普利单抗免疫治疗。患者因肿瘤原因于2021年7月底病故,无进展生存期(progression free survival,PFS)6.5个月,总生存期(overall survival,OS)13.5个月。
2 讨 论
原发性食管SCNEC是一种罕见的疾病,仅占所有食管恶性肿瘤的0.8%~3.1%[1]。第1例患者由McKeown[2]于1952年报告,随着临床医师认识水平及诊断技术的提高,该病的检出率逐年升高。原发性食管SCNEC患者常有严重的吸烟史,多为50~70岁的中老年人,且男性多于女性,病变主要发生在中下段食管。其临床表现与其他类型食管癌相似,主要表现为进食习惯改变,如吞咽困难、进食哽咽感等,其他伴随症状有胸背部疼痛、声音嘶哑、体重下降等。原发性食管SCNEC早期缺乏特征性表现,与其他类型食管癌相似,但生物学行为、治疗模式、预后均不同于其他食管肿瘤,常呈现出疗效不佳、早期容易转移、多为恶性等特点,大多数患者在处于晚期,预后比其他亚型食管癌差。原发性食管SCNEC偏好转移至肝脏、肺、骨等。
原发性食管SCNEC的18F-FDG PET/CT表现较食管其他类型恶性肿瘤无特异性,一般认为恶性肿瘤的代谢程度与肿瘤分化程度以及侵袭性相关[3],此例患者为低分化原发性食管SCNEC,表现为较高的代谢(SUVmax为11.8)。18F-FDG PET/CT对于了解病变性质及与周围组织的关系、转移情况有重要意义,且可辅助排除原发性支气管和肺小细胞癌,可有助于原发性食管SCNEC的分期评估。但原发性食管SCNEC在PET/CT研究中的相关报道较少,有待进一步研究。超声内镜因其超声和内镜结合的优势,成为准确判断食管肿瘤的起源层次、大小及边界的最佳方法,并可进行更为准确的镜下穿刺活检。其他检查如食管钡餐造影、CT以及以生长抑素受体显像为主的放射性核素扫描对于原发性食管SCNEC辅助诊断均有一定的意义。
世界卫生组织(World Health Organization,WHO)关于原发性食管SCNEC的组织学标准(2004年)包括小、圆形、椭圆形或纺锤形细胞,细胞质稀少,细胞边界不清,核染色质细颗粒,缺乏或缺失不明显的核仁;免疫组织化学显示肿瘤标志物CK8、AE1/AE3、EMA、Syn、NSE、CD56、Cg-A和TTF-1的阳性表达[4]。Wang等[4]的研究表明,Ki-67增殖指数是食管SCNEC患者的一个独立有利预后因素;一般认为原发性食管SCNEC的Ki-67增殖指数>50%,而该患者的Ki-67增殖指数>70%。Syn和NSE在所有胃肠道小细胞癌中均有表达。原发性食管SCNEC具有神经内分泌和上皮双重特性,Syn、CgA和CD56等阳性率一般高于CK5/6和CK20等。CgA在分化差的原发性食管SCNEC中一般不表达或弱表达,Syn在所有神经内分泌肿瘤中均有表达,是最灵敏的神经内分泌标志物。目前推荐Syn、CgA和CD56作为神经内分泌肿瘤必查项目[5]。本研究患者CD56(+)、Syn(+)和CgA阳性,血液中CYFRA21-1水平升高,符合诊断。
食管SCNEC预后取决于肿瘤分期,以及局部和/或全身治疗的选择。食管SCNEC尚无标准分期系统,一般参照美国退伍军人医院和国际肺癌研究组(Veteran’s Administration Lung Cancer Study Group,VALSG)标准分期,区分为局限期(limited disease,LD)和广泛期(extensive disease,ED)。局限期原发性食管SCNEC指肿瘤局限在食管及其邻近组织,可存在或不存在区域淋巴结转移。而广泛期则为肿瘤超出上述范围。然而,由于相关研究数据的不足,食管SCNEC的治疗策略尚未达成共识。目前尚无明确和最佳的原发性食管SCNEC标准治疗指南,尽管大多数专家建议对原发性食管SCNEC使用包括手术、化疗和放疗在内的综合治疗[6]。随着免疫疗法的广泛应用,可能成为一种新的治疗方法。目前研究[7]表明,原发性食管SCNEC的5年生存率仅为9.00%~13.82%,远低于食管癌总体的平均5年生存率(20.6%~29.7%)。研究[8-9]表明,LD患者的中位生存期为12个月,ED患者的中位生存期为3~11个月。18F-FDG PET/CT检查提示此例患者为ED,尽管进行了各种抗肿瘤治疗,患者的总生存期仅为13.5个月。
总之,原发性食管SCNEC罕见,临床症状和影像学表现与其他食管癌相比无特异性,确诊需要依靠病理和免疫组织化学检查,其转移早、预后差,传统治疗方式均不能有效控制。针对靶点的新药开发和针对免疫检查点的治疗研究将会是原发性食管SCNEC的新希望。PET/CT结合功能和解剖显像的特点,有助于原发性食管SCNEC的临床分期、疗效评价及随访。

