某院137个集采药品药品说明书中药用辅料标注情况分析*
刘 迅,邹莉萍,罗 艳,叶春燕,陈 力
(1.四川省成都市第七人民医院,四川 成都 610041;2.四川省成都市公共卫生临床医疗中心,四川 成都 610016;3.四川省人民医院,四川 成都 610072;4.四川大学华西第二医院,四川 成都 610041)
《药品说明书和标签管理规定》(局令第24号)自2006年6月1日起开始施行以来,至今无新修订版本颁布,仍是所有药品说明书必须遵循的法律依据。其中,第十一条规定:“注射剂和非处方药应当列出所用的全部辅料名称;药品处方中含有可能引起严重不良反应的成份或者辅料的,也应当予以说明。”我国关于药品说明书和标签标注辅料的要求较低,随着2019年新修订《中华人民共和国药品管理法》《药品注册管理办法》(国家市场监督管理总局令第27号)的颁布,以及仿制药一致性评价、国家组织药品集中招标采购政策的推行,药品说明书辅料标注不规范问题日益凸显。本研究中比较了某院集中招标采购(简称集采)药品与原研制剂药品说明书中药用辅料的标注情况,总结了我国药品说明书辅料标注存在的问题。现报道如下。
1 资料与方法
选取某院2021年12月使用的集采药品137个,其中国家集采品规126个、省集采品规11个,查找其药品说明书标注的药用辅料信息,并与同剂型、同规格的原研制剂药品说明书的辅料标注情况进行比较。137个集采药品药品说明书辅料标注信息依据该院纸质的药品说明书,原研制剂药品说明书辅料标注信息依据3.4.3.0版美康合理用药系统(截至2022年3月)收录的电子版药品说明书。其中,13个集采药品未通过一致性评价,41个(包括8个未通过一致性评价的药品)集采药品未在美康系统查询到品规相同的原研制剂。详见表1和表2。

表1 未通过一致性评价的集采药品Tab.1 Centralized-procurement drugs that failed to pass the consistency evaluation
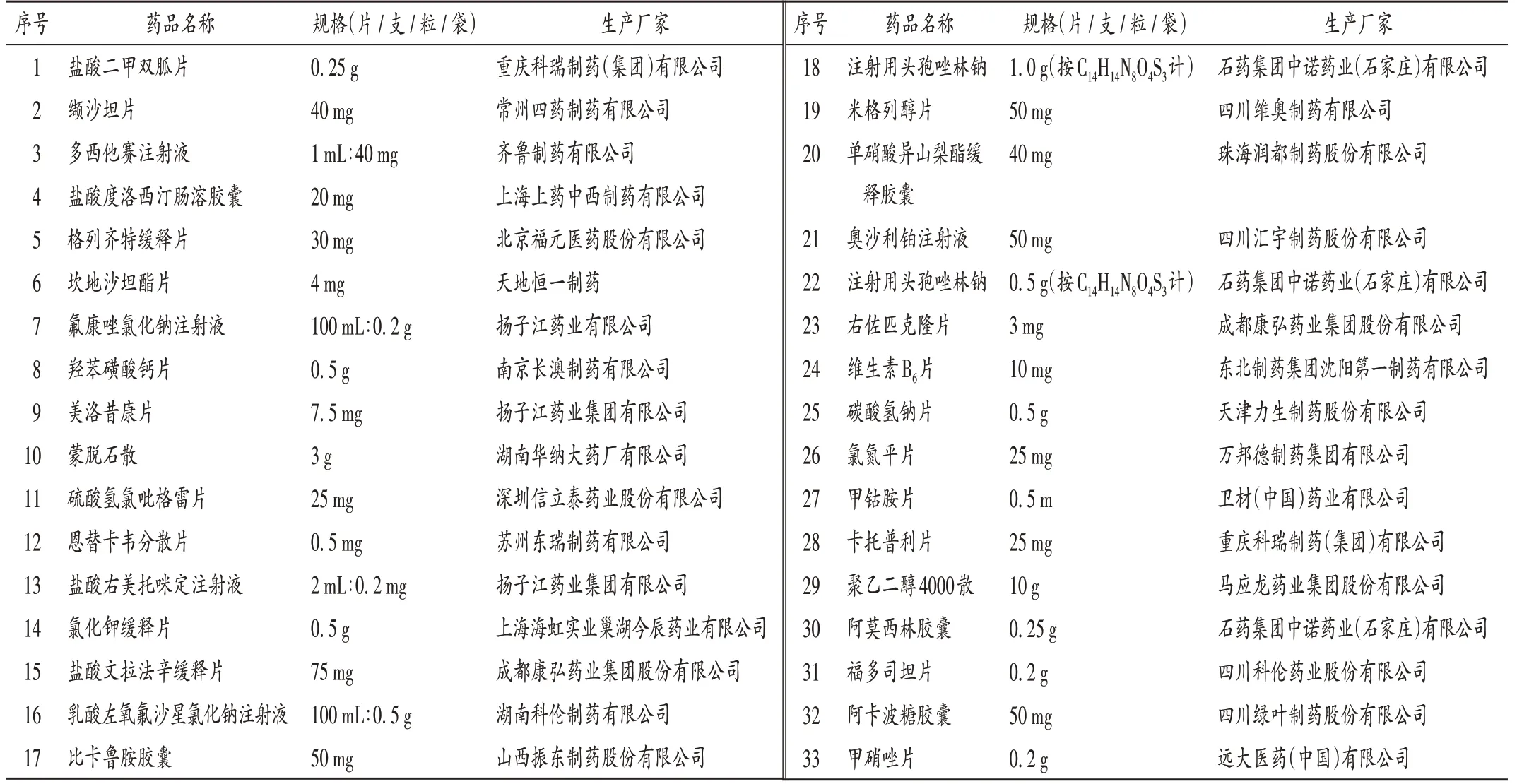
表2 未在3.4.3.0版美康系统查询到与原研制剂品规相同的集采药品(除8个未通过一致性评价的药品)Tab.2 Centrali zed-procurement drugs without the same specifications as the original-patented preparations in the MCDEX (V 3.4.3.0),excepting for eight drugs that failed to pass the consistency evaluation
2 结果
2.1 整体情况
137个集采药品中,口服制剂99个,注射剂35个,滴眼剂2个,雾化吸入剂1个。99个口服制剂中,82个(82.83%)未 标 注辅 料 信息;35个 注射剂 中,7个(20.00%)未标注辅料信息,分别为注射用环磷腺苷葡胺(30 mg)、胞磷胆碱钠注射液(2 mL∶0.25 g)、蔗糖铁注射液(5 mL∶100 mg)、乳酸左氧氟沙星氯化钠注射液(100 mL∶0.5 g)、注射用头孢唑林钠(1 g)、注射用头孢唑 林 钠(0.5 g)、注 射 用 更 昔 洛 韦(0.25 g);1个(100.00%)雾化吸入剂[吸入用硫酸沙丁胺醇溶液(2.5 mL∶5 mg)]未标注辅料信息。
2.2 辅料标注信息一致
96个与原研制剂品规有相同剂型及规格的集采药品中,55个药品均未标注辅料信息,除雾化吸入剂吸入用硫酸沙丁胺醇溶液外,其余均为口服制剂;另外41个药品中,标注辅料信息的有15个。详见表3。
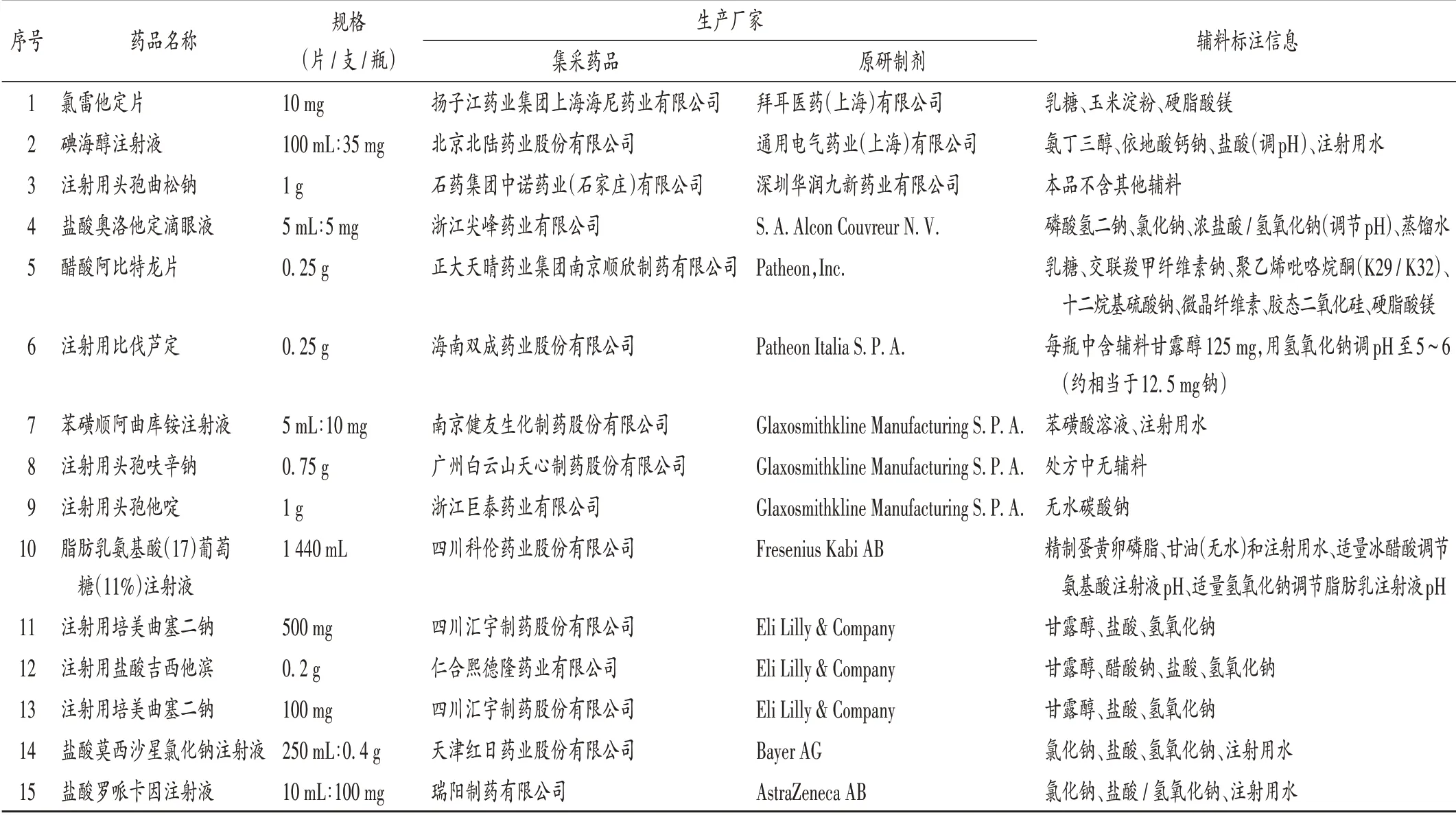
表3 与原研制剂辅料标注信息一致的集采药品Tab.3 Centralized-procurement drugs labeled the consistent information of the excipients with the original-patented preparations
2.3 辅料标注信息不一致
26个集采药品的药品说明书中辅料信息与原研制剂标注不一致,其中7个集采药品未标注辅料,7个原研制剂未标注辅料,12个药品(7个注射剂和5个口服固体制剂)的辅料信息标注不一致。详见表4。
研究表明,制剂中的辅料对药物的理化性质有影响,并最终影响药物的安全性与有效性[1]。2020年5月14日,国家药品监督管理局药品审评中心发布的《化学药品注射剂仿制药质量和疗效一致性评价技术要求》《化学药品注射剂(特殊注射剂)仿制药质量和疗效一致性评价技术要求》《化学药品注射剂仿制药质量和疗效一致性评价申报资料要求》均明确指出,抑菌剂、缓冲剂、pH调节剂等化学药品注射剂仿制药可与参比制剂不同,但需提供相关研究证明这些不同对结果不会产生影响[2]。表4中,注射用胸腺法新原研制剂填充氮气,可提高药物的稳定性;注射用甲泼尼龙琥珀酸钠(40 mg)原研制剂(辉瑞制药有限公司)为双室瓶,而集采药品为普通的西林瓶,但使用的辅料和辉瑞制药有限公司的500 mg注射用甲泼尼龙琥珀酸钠一致。

表4 与原研制剂辅料标注信息不一致的集采药品Tab.4 Centralized-procurement drugs labeled the inconsistent information of the excipients with the original-patented preparations
3 讨论
3.1 存在问题分析
美国食品药物管理局(FDA)将活性药物成分(API)定义为提供所需药物效应的化合物。相反,非活性成分被定义为“药品中除活性成分之外的任何成分”[1]。通过添加这些非活性成分改变制剂的物理性质,以促进吸收或改善稳定性、味道、外观等[2]。我国将药品中的非活性成分统称为辅料,包括崩解剂、填充剂/稀释剂、润滑剂、乳化剂、调味剂、着色剂、防腐剂、防黏剂等[3]。Pillbox数据库的信息显示,42 052种口服固体剂型共包含了354 597种非活性成分,其中596种口服固体剂型含有20种或更多不同的非活性成分,平均每片药片或每粒胶囊含有8.8种非活性成分;美国最常用的18种口服制剂中,每个API平均有82.5种替代配方可供选择[1],强调了相同药物可用辅料的多样性。如43个不同厂家生产了140种辅料不同的左旋甲状腺素制剂,用以治疗甲状腺功能减退症。
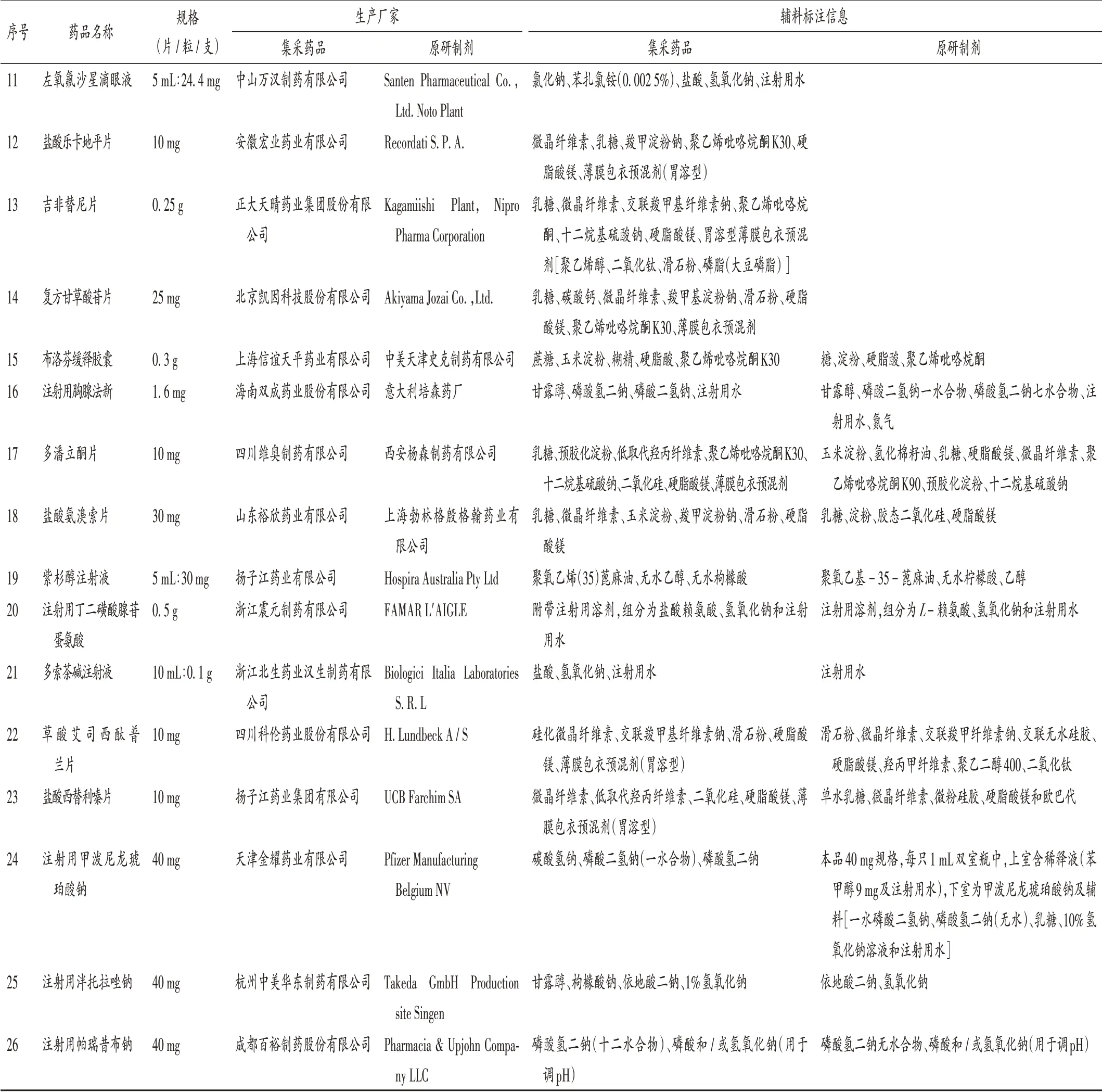
续表4与原研药品辅料标注不一致的集采药品信息Continued Tab.4 Centralized-procurement drugs labeled the inconsistent information of the excipients with the original-patented preparations
99个集采口服制剂中,82个(82.83%)未标注辅料信息,且我国尚无法律法规明确要求口服制剂必须标注辅料信息。35个注射剂中,7个(20.00%)注射剂未标注辅料信息,但我国2006年版《药品说明书和标签管理规定》明确要求注射剂和非处方药应列出所用全部辅料名称。1个雾化吸入制剂未标注辅料信息。据不完全统计,我国制剂使用的药用辅料品种达1 582种[4]。药用辅料标注应遵循2020年版《中国药典(四部)》对药用辅料的相关要求,其中共收载335个药用辅料品种(规格),远不能覆盖已上市制剂中的药用辅料品规。《美国药典》收载了500余个药用辅料各论,且同一辅料的不同规格均收载于同一各论中,故实际收载的品规数是《中国药典》收载的数倍。集采药品标注辅料而原研制剂未标注辅料的7个药品中,除玻璃酸钠注射液和复方甘草酸苷片外,其余均通过一致性评价,表明国家对仿制药一致性评价的重视,有助于促进生产厂家对辅料标注规范性的重视[4]。
对于注射用丁二磺酸腺苷蛋氨酸辅料,集采药品使用盐酸赖氨酸,原研制剂使用L-赖氨酸。赖氨酸在该药品中用作填充剂,按光学活性分为L型、D型和DL型3种构型。D型和L型赖氨酸的吸收效率不同,D-赖氨酸几乎不能被吸收利用,仅L型具有生物活性,主要是L-赖氨酸。虽然通常所说的赖氨酸即指L-赖氨酸,但在药品说明书的辅料标注中应遵循具体的技术指南和规范要求。药用辅料苯甲醇可能在婴儿及不超过3岁的儿童中引起毒性反应和过敏样反应,发生毒性的最低量尚不可知。有研究表明,苯甲醇暴露可能与危重患者死亡风险增加有关[5],故早产儿或足月新生儿不得使用苯甲醇;除非医师或药师建议使用,但3岁以下儿童使用时间不得超过1周[6]。注射用甲泼尼龙琥珀酸钠(40 mg)原研制剂采用双室瓶结构,上室使用苯甲醇作为溶剂,禁止用于儿童肌肉注射;而集采注射用甲泼尼龙琥珀酸钠(40 mg)采用普通的西林瓶,未通过或还未参与仿制药一致性评价,采用的辅料和辉瑞制药有限公司的500 mg注射用甲泼尼龙琥珀酸钠一致,不含有苯甲醇,可用于新生儿及幼儿。对于配制后的稳定性,集采注射用甲泼尼龙琥珀酸钠(40 mg)药品说明书标注配置后的溶液在48 h内物理和化学性质保持稳定,而原研制剂(辉瑞制药有限公司)500 mg单剂量包装的药品说明书要求配制后立即使用。
3.2 需标注的药用辅料信息应有具体的技术指南和规范
本研究结果发现,集采药品和原研制剂药用辅料标注信息有差异。有研究发现,很多体外物理和化学性质稳定的辅料,进入体内后对药物转运蛋白和/或代谢酶显示出影响;API的吸收、分布、代谢和排泄可能会因为掺入的药用辅料而使药品的转运和代谢调节发生改变[7-8]。在辅料选择方面,为了与参比制剂一致,企业通常选用进口辅料,且与原研制剂保持一致。但受近年来的国际贸易摩擦、新型冠状病毒肺炎疫情等的影响,企业易受进口辅料成本和辅料生产国的限制,除了成本因素外,能否及时供应的风险也较高,在进口辅料提价或供应量不足时,企业将处于被动地位。对于国产辅料与进口辅料,建议对比其影响制剂关键质量属性的因素及差异,确定特定指标,并修正辅料内控标准[9]。
药用辅料在药品中起着重要作用,影响药物的有效性和安全性。高敏人群可能对多种辅料产生不同程度的高敏反应[10-11];老年患者可能因服用多种药物而导致辅料服用过量及辅料间的不良相互作用[12-13];新生儿由于对辅料的药代动力学与成人不同[5],可能导致严重后果。药用辅料的多样性、复杂性、部分可替换性及国家现行法律法规有待完善等多方面原因,导致药品说明书的药用辅料信息标注不规范。
药用辅料是药品生产中不可或缺的组成部分,制药行业高质量发展的需求势必会波及药用辅料产业。我国药用辅料产业因历史发展的局限性,与制药发达国家尚有一定差距。目前,药用辅料从注册审批制转变为关联审评审批制,关联审评审批制以制剂需求为核心,推动了辅料供应商自主登记备案进程。但诸多与辅料相关的政策法规、管理文件、技术指南等仍有空缺,如辅料生产管理、变更、供应商审计等。关于药品说明书和标签管理规定的法规不能满足现阶段我国药品实现高质量发展的需求,有完善的法律法规,才能有法可依,以确保药品的安全性和有效性。
3.3 建议
本研究中通过分析某院137个集采药品药品说明书辅料标注信息发现,药用辅料在药品说明书中的标注情况存在一些问题,故关于药用辅料标注的相关法律法规及技术指南体系尚需进一步完善。建议我国相关部门做好顶层设计和统筹谋划,进一步明确药用辅料的定义和标注范围,制订相应的技术指南,促进药品说明书辅料信息的规范标注;在临床药物使用及药物综合评价中,医院和药品生产企业要关注辅料相关的问题;可开发相关综合工具或数据库[14-15],收集药品常见辅料的体内代谢动力学特征及相互作用,促进临床药物的安全使用。

