基于羧基化聚吡咯-氯化血红素和点触发链置换反应信号放大的电化学生物传感器检测转基因作物中CaMV35S序列
翟应惠,夏子豪,张鸿雁,叶永康,2*,操小栋,郑海松,李云飞*
(1.合肥工业大学 食品与生物工程学院,安徽 合肥 230009;2.北方民族大学 生物科学与工程学院,宁夏 银川 750021;3.合肥海关技术中心,安徽 合肥 230022)
在过去20年,转基因技术得到了极大的发展,转基因作物的种植面积也逐年增加[1],我国转基因作物产业化驶入“快车道”,转基因作物产业化布局已覆盖全国。同时,为确保生物安全、生态安全及满足人们对转基因产品的关切,不仅需要制订一系列转基因作物∕产品的安全评价程序、方法和管理措施[2],也对转基因检测技术提出了更高的要求[3]。
目前,针对转基因成分的检测主要有两大类,即针对转基因作物∕产品中特定蛋白质成分[3]和DNA特定序列进行检测[4]。当前针对转基因作物∕食品中常见的外源基因花椰菜病毒35S(CaMV35S)启动子[4]和根癌农杆菌终止子(TNOS)[5]检测的DNA生物传感器已成为筛查转基因作物的重要途经。其中,DNA电化学生物传感器因具有快速、简便和成本低廉等特点,成为转基因作物∕产品检测方法研究的热点之一[6-7]。
纳米聚合物聚吡咯(PPy)因具有良好的导电性、热稳定性、纳米模拟酶活性且易于合成等特性,在电化学传感器中得到了较为广泛的应用[8]。氯化血红素(Hemin)是血红蛋白家族的“活跃分子”,其性质稳定,催化活性与过氧化物酶类似[9-10]。因此,基于Hemin的模拟过氧化物酶活性而设计的电化学DNA传感器亦越来越受到关注[11-12]。
点触发链置换反应(TSDR)是通过核酸辅助扩增来改善生物传感器性能的技术,具有灵敏度高、操作便捷和稳定性高的特点[13]。通过触发反应的单链DNA触发链置换反应,进而暴露出另一段可与其它模板互补的单链区域,并通过引入具有更多的碱基互补配对数的模板链,置换目标DNA,进一步引发新的点触发链置换反应,从而起到信号放大的作用[13]。基于该技术开发的电化学生物传感方法可用于灵敏检测艾滋病毒(HIV)相关的DNA[14]及microRNA-21[15]。
本研究制备了Hemin复合的羧基化聚吡咯纳米复合物(cPPy-hemin),并以其为标记物标记由信号DNA链(Ps)、模板链(Ts)和辅助链(As)结合所形成的DNA双链体结构,利用cPPy-hemin对底物H2O2的模拟酶催化特性和TSDR信号放大作用,建立了一种灵敏检测CaMV35S的电化学生物传感器。
1 实验部分
1.1 试剂与材料
吡咯(Py,纯度> 99.7%),巯基乙醇(MCH,99%),三(2-羧乙基)膦(TCEP)氯,三(羟甲基)氨基甲烷(Tris,99%),氯化血红素(Hemin,95%),聚乙烯醇(72.5% ~ 74.5%,4.2 ~ 5.0 mPa∕s)和氯金酸(三水合物,99%)购自上海阿拉丁生物科技股份有限公司;十六烷基三甲基溴化铵(CTAB,90%)及乙二胺四乙酸二钠盐(EDTA,99%)购自国药集团化学试剂有限公司;dNTP mixture、DNA聚合酶(Taq DNApolymerase)购自生工生物工程(上海)有限公司。实验所用缓冲溶液为:DNA储存缓冲溶液(10 mmol∕L Tris-HCl,1.0 mmol∕L EDTA,pH 7.4),DNA固定缓冲液(10 mmol∕L Tris-HCl,1.0 mmol∕L EDTA,1.0 mmol∕L TCEP,0.1 mol∕L NaCl,1.0 mmol∕L MgCl2),DNA杂交缓冲液(10 mmol∕L Tris-HCl,1.0 mmol∕L EDTA,0.1 mol∕L NaCl,1.0 mmol∕L MgCl2),电化学测试缓冲溶液(0.1 mol∕L磷酸盐缓冲溶液,pH 8.0),CTAB缓冲液(0.1 mol∕L Tris-HCl,20 mmol∕L EDTA,1.4 mol∕L NaCl,2% CTAB)。实验所用其它试剂均为分析纯,实验用水均为超纯水。实验所用的DNA序列由生工生物工程(上海)有限公司合成并纯化,序列如下:
捕获探针(Cs):SH-TTTT AGG AGC GAC TAA。
CaMV35S序列(tDNA):ATT GTG CGT CAT CCC TTA CGT C。
模板链序列(Ts):GAC GTAA GGG ATG ACG CAC AAT CAGGC AGG AGC GAC TAA。
辅助链序列(As):TTTT TTTT TTTT TTTT A GCCTG ATT GTG CGT CAT CCC T。
信标链序列(Ps):NH2-TTT TTT TTT TTT TTA GTC GCT CCT。
综上所述,循证护理系列培训能够在临床护理实践工作中发挥重要作用,对护理人员的护理工作提高有促进作用,对促进我院护患关系的发展有着重要作用。
燃料链序列(Fs):TTA GTC GCT CCT GCC TGA TTG TGC GTC ATC CCT。
单碱基错配序列(Mis1):ATT GTG CGT CAT CCC TTA CTT C。
非互补DNA序列(NOs):GCA TGA CGT TAT TTA TGA GAG A。
非互补DNA序列(FMV):A TCT TTG CAA TAA AGG CAA AGA。
正向引物:CTT CCT TTC TCG CCA CGT T。
反向引物:CTT AAT AAC ACA TTG CGG ACG TT。
1.2 仪器与方法
材料的形貌表征在SU8020场发射扫描电子显微镜(SEM,日本日立公司)上进行。材料的成分及元素分析在ESCALAB250Xi(美国赛默飞世尔科技公司)和X射线光电子能谱仪(XPS)上进行。电化学表征及测试在配有三电极体系的CHI832D电化学工作站(上海辰华仪器有限公司)上进行,以直径为3 mm的修饰玻碳电极(GCE)为工作电极,Ag∕AgCl(饱和KCl)电极为参比电极,铂丝电极为辅助电极。采用电化学阻抗谱(EIS)表征修饰的GCE。EIS实验在含5.0 mmol∕L [Fe(CN)6]3-∕4-的0.1 mol∕L KCl溶液中进行,频率范围为1 ~ 10 000 kHz。采用计时电流法(i-t)测定不同浓度的目标CaMV35S基因,测定电位为-0.4 V,缓冲溶液为0.1 mol∕L pH 7.0的PBS,H2O2浓度为2 mmol∕L。
1.3 cPPy-hemin的制备
1.4 Ts/As/Ps-cPPy-hemin纳米信标的制备
利用信标链序列Ps上的—NH2与cPPy-hemin中—COOH之间的共价键合反应,制备基于cPPyhemin的Ts∕As∕Ps DNA双链结构纳米信标。具体方法如下:将含Ts、As、Ps的核苷酸链混合溶液(浓度均为30 µmol∕L,各100 µL)加热至95 ℃,保持2 min后自然冷却至室温,形成Ts∕As∕Ps三链DNA双链体结构;将含有10 µmol∕L Ts∕As∕Ps DNA双链体结构、10 mg∕mL EDC、5 mg∕mL NHS和2 mg∕mL cPPy-hemin的混合溶液在轻微振荡下反应2 h,离心去除未结合的DNA,将所制备的Ts∕As∕Ps-cPPy-hemin分散于杂交缓冲液中。
1.5 DNA生物传感器的制备
GCE依次用1.0、0.3、0.05 µm氧化铝浆抛光,先后用硝酸(1∶1)、乙醇和水进行超声清洗,并在室温下氮气吹干备用。DNA生物传感器的构建步骤为:将预处理的GCE浸入5.0 mL含3.0 mmol∕L HAuCl4的KNO3(0.1 mol∕L)溶液中,在-0.2 V恒定电位下电化学沉积70 s以获得电沉积AuNPs修饰的GCE(AuNPs∕GCE)。然后,将5 µL 1 µmol∕L的捕获探针Cs滴加至AuNPs∕GCE,顶部罩上离心管密封,并在4 ℃冰箱中放置12 h后,用0.1% SDS溶液和10 mmol∕L Tris-HCl(pH 7.4)溶液冲洗电极以除去未结合的捕获探针,所得修饰电极记为Cs∕AuNP∕GCE。接着,该修饰电极用5 µL MCH(1 mmol∕L)封闭30 min(顶部罩上离心管密封),以消除非特异性吸附。最后,用10 mmol∕L Tris-HCl(pH 7.4)溶液和水冲洗电极,得到MCH∕Cs∕AuNPs∕GCE。
1.6 电化学测量
将不同浓度的目标CaMV35S与10 µL Fs(10 µmol∕L)和10 µL上述制备的Ts∕As∕Ps-cPPy-hemin悬浮液混合,用杂交缓冲液稀释至50 µL;将MCH∕Cs∕AuNPs∕GCE插入上述混合液中,在37 ℃条件下温育90 min,充分淋洗后采用计时电流法进行电化学测量。
1.7 样品的制备与检测
转基因大豆中的CaMV35S片段用CTAB法提取:将0.1 g转基因大豆置于研钵中用液氮研磨后放入5 mL离心管中,加入600 µL CTAB裂解缓冲液,混匀后65 ℃水浴1 h,期间不断晃动。待材料冷却至室温后在10 000 r∕min下离心10 min,上清液加入600 µL氯仿-异戊醇混合液(24∶1,体积比)进行抽提,清液中再加入400 µL异丙醇,-20 ℃条件下预冷后,10 000 r∕min离心10 min,吸取上清液,用75%乙醇清洗沉淀3次,室温下晾干后加入40 µL TE溶解,加入RNase酶37 ℃温育30 min后,所得溶液即为大豆DNA溶液。
PCR反应总体积为50 µL,包括25 µL PCR Mix,5 µL提取的DNA,1 µL正反向引物(10 µmol∕L),18 µL ddH2O。PCR扩增条件为:94 ℃ 5 min(DNA变形,双链解开),采用以下三步进行30个循环:94 ℃45 s(DNA变性,双链解开),64 ℃ 45 s(引物退火),72 ℃ 1 min(DNA链延伸),然后在72 ℃下延伸10 min。最后,将5 µL PCR扩增产物在1%琼脂糖凝胶中进行电泳实验,通过凝胶成像鉴定PCR产物。
2 结果与讨论
2.1 纳米材料与传感器组装的表征
采用TEM表征cPPy-hemin的形貌,结果如图1A所示。可以看出,cPPy-hemin纳米颗粒呈球状均匀分布,粒径约为50 nm。对其进行XPS分析(图1B)发现,谱图中位于723.44、532.22、399.80、284.78 eV处的光电子峰,分别对应于Fe2p、O1s、N1s及C1s的结合能[18]。其中,材料中的Fe2p光电子峰来自复合物中Hemin的铁活性中心。XPS的表征结果表明cPPy-hemin纳米复合物已成功合成。
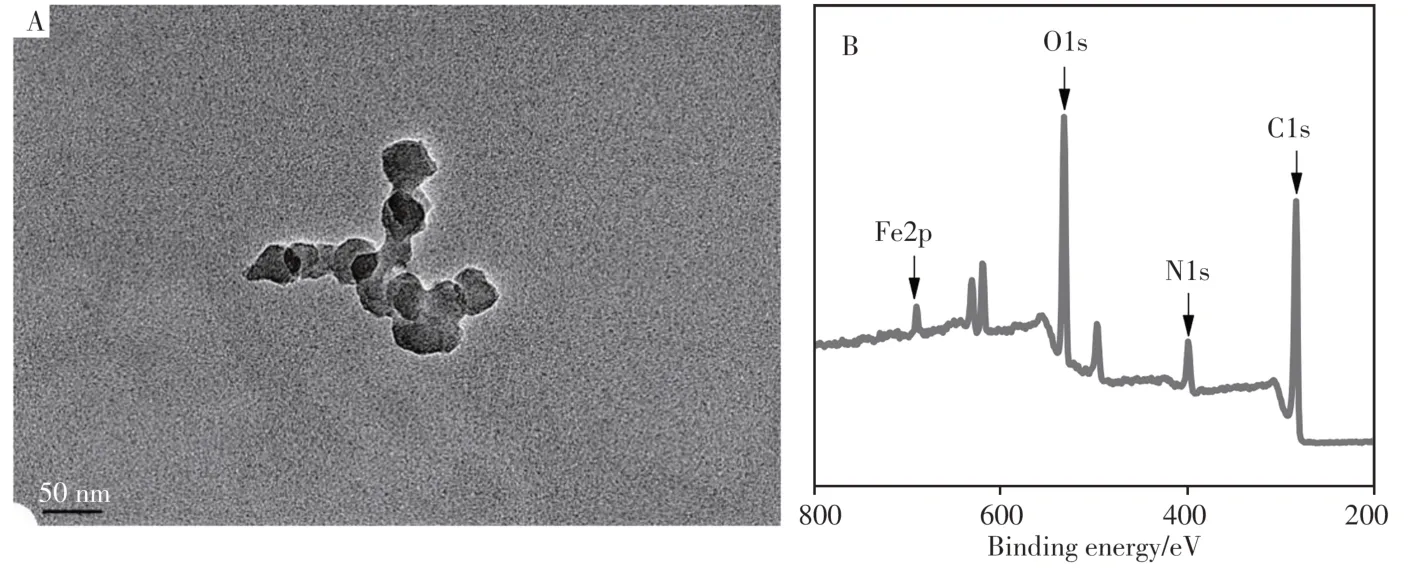
图1 cPPy-hemin的TEM图(A)及XPS表征(B)Fig.1 TEM image(A) and XPS characterization(B) of cPPy-hemin
电化学DNA生物传感器的修饰过程通过EIS进行表征,其半圆直径可用于表示电荷传递阻抗的大小。图2分别为裸GCE、AuNPs∕GCE、Cs∕AuNPs∕GCE、MCH∕Cs∕AuNPs∕GCE和Ps-cPPy-heminMCH∕Cs∕AuNPs∕GCE在含0.1 mol∕L KCl的5 mmol∕L[Fe(CN)6]3-∕4-溶液中的EIS曲线。由图可知,电沉积AuNPs后,AuNPs∕GCE(曲线b)的阻抗较裸GCE(曲线a)小,主要是由于AuNPs有较大的比表面积和优良的导电性,极大地改善了电极的电子传输性能;当Cs通过Au-S键组装到AuNPs∕GCE后,Cs∕AuNPs∕GCE的阻抗(曲线c)较AuNPs∕GCE大幅增大,且当用MCH对Cs∕AuNPs∕GCE上未结合的活性位点进行封闭后,所组装的MCH∕Cs∕AuNPs∕GCE的阻抗进一步增大(曲线d)。这主要是由于组装在电极表面的Cs和MCH阻止了[Fe(CN)6]3-∕4-向电极表面扩散,降低了电子传输 速 率。最 后,当MCH∕Cs∕AuNPs∕GCE在 目 标CaMV35S(100 pmol∕L)和Ts∕As∕Ps-cPPy-hemin混合溶液中温育90 min后,修饰电极的阻抗再次降低(曲线e),表明电子在该修饰电极上传输速率较快。这是由于此时电极表面形成了DNA双链-cPPyhemin纳米结构,即Cs-Ps-cPPy-hemin纳米结构,该结构中的双链DNA的电子传递速率比单链DNA高[19],同时纳米结构中的cPPy-hemin也可提高电子传递速率。
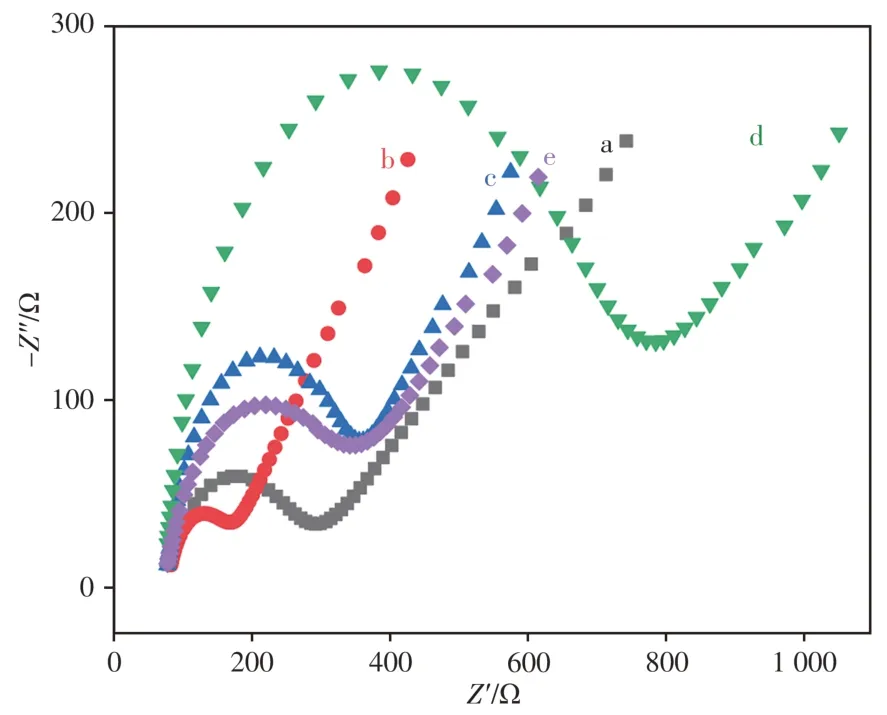
图2 不同修饰电极的电化学阻抗谱Fig.2 Electrochemical impedance curves of different modified GCEs
2.2 CaMV35S基因传感器的原理及可行性分析
CaMV35S基因传感器对目标的灵敏检测主要基于cPPy-hemin对H2O2的模拟过氧化物酶活性及TSDR目标放大策略。该传感器对目标CaMV35S的检测是通过传感界面结合Ps-cPPy-hemin后,所形成的纳米结构中cPPy-hemin对H2O2的催化还原产生的电信号实现,其电信号大小和电极表面所结合的cPPy-hemin的量有关。如图3A所示,当目标CaMV35S触发TSDR后,所释放的信标Ps-cPPyhemin随着CaMV35S浓度的增加,通过Cs-Ps杂交结合在电极表面的cPPy-hemin亦越多(图3B),因而其催化H2O2还原的电信号越大。图4A为传感器在不同条件下对检测体系中H2O2的计时电流法安培响应曲线。当不存在Fs(图4A曲线a)或目标DNA(图4A曲线b)时,TSDR过程无法进行,因而无法释放出信号标签Ps-cPPy-hemin,导致H2O2在电极表面的还原信号低。然而,当使用100 pmol∕L CaMV35S触发TSDR后,释放的Ps-cPPy-hemin与电极表面的Cs通过杂交反应相结合,导致H2O2的催化还原电流信号提高(图4A曲线d)。同时,通过比较采用TSDR策略及夹心策略(图4A曲线c)所记录的H2O2催化还原电流信号的大小,评估了TSDR过程对传感系统信号的放大作用。从图中可明显看出,在100 pmol∕L CaMV35S存在下,TSDR过程极大地放大了传感界面上H2O2的电催化还原信号,起到了很好的信号放大作用。
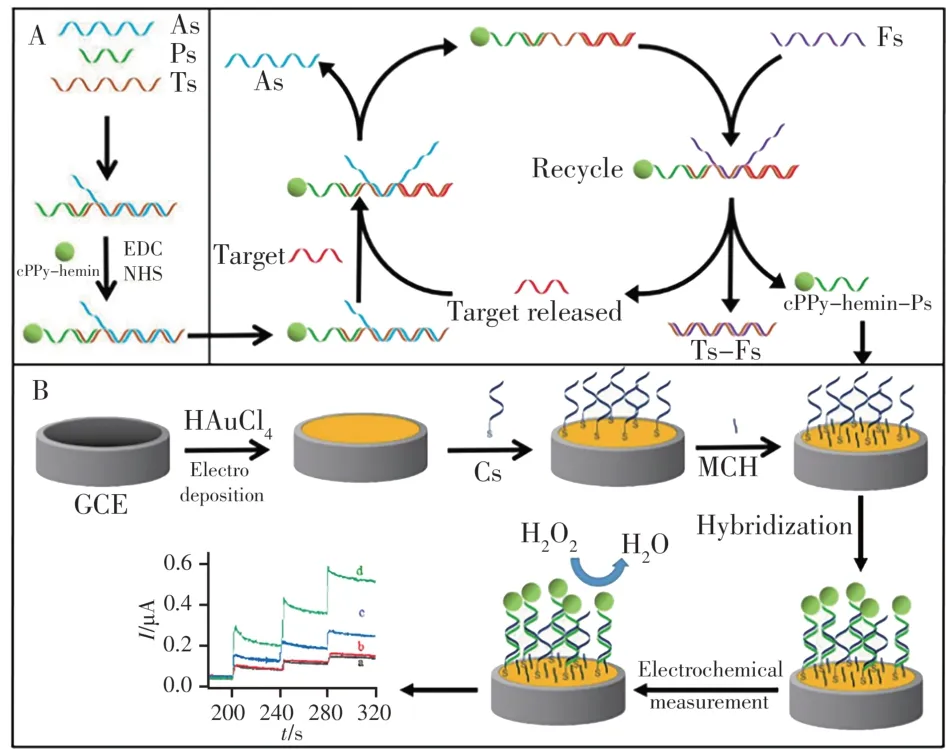
图3 电化学生物传感器的组装过程与策略Fig.3 Stepwise process of the fabrication and strategy of the proposed electrochemical biosensor
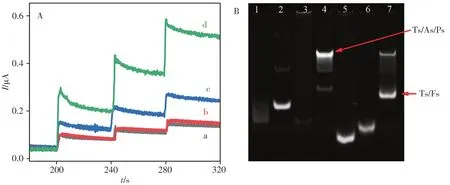
图4 CaMV35S基因传感器的原理及可行性验证Fig.4 The principle and the feasibility of the fabricated CaMV35S genosensor
TSDR的过程也通过凝胶电泳图像进行验证,结果如图4B所示。图中泳道1、2、3分别为Ts、As和Ps三条单链的电泳图,泳道4为由Ts、As和Ps三条单链杂交形成的Ts∕As∕Ps双链结构。由图可看出,该双链结构的迁移速率明显低于其它单链,表明Ts、As和Ps链杂交形成了DNA双链体。图中泳道5和6分别为目标CaMV35S序列和Fs的电泳条带,当在Ts∕As∕Ps双链结构加入目标CaMV35S和Fs充分混合90 min后,其电泳条带(泳道7)中出现两条明显的条带,其中一条对应于Ts∕As∕Ps双链结构,而另一条新获的亮带则对应于Ts∕Fs双链DNA条带。这表明,目标CaMV35S的存在触发了TSDR过程,导致模板链Ts与燃料链Fs结合形成了双链。该结果表明在目标CaMV35S存在下可成功进行TSDR过程。
2.3 CaMV35S基因传感器的分析性能
为使CaMV35S电化学传感器具有最优的分析性能,分别对Ts∕As∕Ps双链结构的浓度、检测缓冲液的pH值、TSDR反应时间及杂交温度等影响因素进行优化,结果如图5A ~ D所示。由图可知,CaMV35S传感器的最优检测条件为:Ts∕As∕Ps双链结构的浓度为10 µmol∕L,缓冲溶液pH值为7.0,TSDR反应时间及杂交温度分别为90 min和37 ℃。
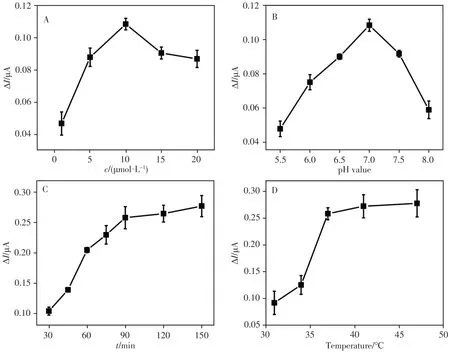
图5 CaMV35S基因传感器检测实验条件的优化Fig.5 Optimization of experimental parameters
在上述最优实验条件下,采用制备的传感器对不同浓度的CaMV35S序列进行检测。如图6A所示,传感器上H2O2的还原电流随着目标物浓度的增大而增大,且电流变化值与CaMV35S浓度(1.0 × 10-14~1.0 × 10-9mol∕L)的对数呈线性关系(图6B),回归方程为ΔI(µA) = 0.042 4 + 0.686 lgc(mol∕L),相关系数(r2)为0.998。传感器对目标CaMV35S的检出限(S∕N= 3)为3.2 × 10-15mol∕L。表1列出了该传感器与其它CaMV35S传感器的性能数据。本文制备的传感器表现出较宽的线性范围和较低的检出限,这可归因于cPPy-hemin的优良模拟酶活性及TSDR的信号放大作用。

表1 不同CaMV35S生物传感器性能的比较Table 1 Comparison of analytical performance of CaMV35S biosensors
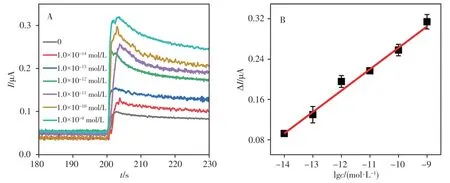
图6 CaMV35S基因传感器对不同浓度CaMV35S的检测Fig.6 Detection of CaMV35S using the fabricated genosensor
2.4 CaMV35S传感器的选择性、重现性与稳定性
通过比较CaMV35S传感器对其它DNA序列(FMV基因序列、NOs基因序列和单碱基错配Mis1)与对目标CaMV35S的电化学响应电流的大小,对其选择性进行评估,结果如图7A所示。由图可知,传感器对目标CaMV35S(100 pmol∕L)的响应电流明显高于对其它序列(分别为1 nmol∕L)的响应电流。此外,传感器对浓度分别为1 nmol∕L的其它DNA序列与100 pmol∕L CaMV35S混合液进行检测后,所得的响应信号为100 pmol∕L CaMV35S的110%。上述结果表明该传感器具有良好的选择性。
采用相同方法分别制备6个传感器,并将其用于检测100 pmol∕L目标CaMV35S,测得其相对标准偏差(RSD)为2.4%(图7B)。将传感器放置冰箱4 ℃保存3、7、14 d后,在相同条件下测定,发现传感器对100 pmol∕L目标CaMV35S的响应信号分别为最初信号(0 d)的96.9%、91.8%和88.2%(图7C)。以上结果表明传感器具有较好的重现性与稳定性。

图7 传感器的选择性(A)、重现性(B)及稳定性(C)Fig.7 Selectivity(A),reproducibility(B) and stability(C) of the fabricated biosensor
2.5 实际样品中CaMV35S序列的检测
为评估该CaMV35S基因传感器实际应用的可行性,采用计时电流法对转基因大豆中的CaMV35S基因片段进行检测。对转基因大豆中总DNA进行提取后,以其为模板,PCR扩增后得到转基因大豆中CaMV35S基因片段的PCR产物,其PCR产物的琼脂糖凝胶电泳如图8A所示。由该图可看出,当以转基因大豆DNA提取物为模板,但未使用引物(泳道2)及非转基因DNA提取物为模板(泳道3)时,电泳图像中并未观察到明显的条带。而以转基因组DNA为模板,且在引物存在条件下(泳道4),图中可观察到250 ~ 500 bp处存在明显的条带(442 bp)。电泳结果表明,以转基因大豆中的DNA提取物为模板成功扩增了CaMV35S基因片段长度为442 bp的PCR产物。随后,以制备的CaMV35S基因传感器对非转基因大豆DNA提取物、转基因大豆DNA提取物(有∕无引物条件)的PCR扩增产物进行检测,结果如图8B所示。由插图可明显看出,传感器对非转基因大豆的PCR产物无明显的响应信号,而对转基因大豆DNA提取物(有∕无引物)的PCR扩增产物均有响应,且对有引物存在条件下的PCR产物响应信号最强,计算得到该PCR产物的浓度为2.83 × 10-10mol∕L。结果证明,该传感器能区分转基因和非转基因作物,可用于实际样品中CaMV35S的检测。
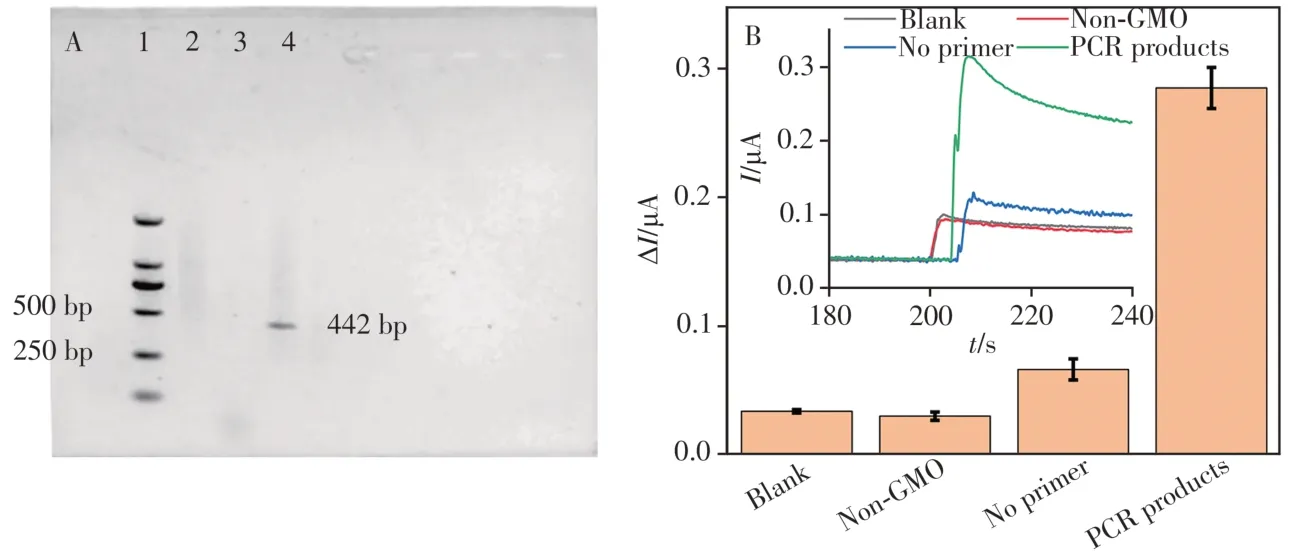
图8 传感器对转基因大豆中CaMV35S基因片段的检测Fig.8 Detection of CaMV35S in genetically modified soybean
3 结 论
本研究利用具有优良过氧化物模拟酶活性的cPPy-hemin作为纳米信标,结合TSDR循环扩增的信号放大策略,建立了一种灵敏检测特定转基因序列的电化学生物传感方法。在优化条件下,通过记录该基因传感器上cPPy-hemin对H2O2的催化所产生的电流信号变化,成功实现了对目标CaMV35S序列的灵敏检测。该传感器具有良好的选择性、重现性和稳定性,可直接区分未经PCR扩增的非转基因和转基因大豆。

