新型冠状病毒肺炎对脑卒中患者病死率影响的Meta分析
皇甫晓娟 ,李小娟 ,陈敏 ,刘吉红 ,翟蕊 ,蔡志鹏 ,李俐涛
新型冠状病毒肺炎(COVID-19)严重影响人类健康和生活。2020年3月上旬,世界卫生组织(World Health Organization,WHO)宣布COVID-19为国际关注的突发公共卫生事件[1]。脑卒中是全球重大公共卫生问题,在世界范围内脑卒中是第二位死亡疾病和第三位致残疾病,给社会和个人造成极大负担。在我国脑卒中已超过心血管疾病成为发病率、病死率和致残率最高的疾病。COVID-19不仅使肺部受累,还可能累及多器官、多系统[2],部分文献报道COVID-19影响神经系统,甚至可以引起脑血管疾病[3-4]。大多数关于COVID-19与脑卒中相关的报道集中在如何护理此类患者[5]、护理系统发生了怎样的变化[6]或有限的病例系列报告[7-8]。面对新的疾病,临床对疾病间的相互影响知之甚少。临床关注的科学问题是:COVID-19对脑卒中预后是否有影响?两者之间有何种相互作用机制目前尚不明确。有部分学者认为COVID-19合并脑卒中的病因可能是血液的高凝状态[9]、继发于颅内细胞因子风暴的血管炎[10]和病毒本身的感染[11]等。基于此,本研究旨在对这一全球关注问题进行Meta分析,通过分析COVID-19与脑卒中的关系,进一步评估COVID-19对脑卒中患者病死率的影响,并对其可能机制进行探讨,从而为COVID-19合并脑卒中患者的科学防治提供可靠的临床理论依据。
1 材料与方法
本Meta分析涉及的方法学均依据首选报告项目PRISMA 声明完成[12]。
1.1 文献纳入与排除标准
1.1.1 研究类型 评价COVID-19对脑卒中患者病死率影响的队列研究或病例对照研究。
1.1.2 研究对象 病例根据WHO利用鼻咽拭子样品的逆转录聚合酶链反应建立的标准[13]行新型冠状病毒检测;根据2018版中国急性缺血性脑卒中诊治指南[14]诊断为脑卒中;患者需完成入院时的美国国立卫生研究院卒中量表(NIHSS)评估及住院期间的实验室检查,有完整转归记录。
1.1.3 干预措施 病例组为合并COVID-19的脑卒中患者;对照组为未合并COVID-19的脑卒中患者。
1.1.4 结局指标 文献中可以获得或推算出脑卒中病死率。
1.1.5 排除标准 (1)数据不完整或统计分析不充分;(2)评论和信件;(3)缺乏COVID-19和脑卒中诊断标准;(4)重复发表文献或基于相同人口数据的多次调查(仅将最新的研究或信息全面的文章纳入);(5)病例报告和病例系列、基础研究或实验室研究等非临床研究。
1.2 检索策略 计算机检索PubMed、EmBase、Web of Science、Cochrane Library、中国知网及万方数据知识服务平台等数据库,收集关于COVID-19对脑卒中患者病死率影响的队列研究或病例对照研究,检索时间为2019年12月至2022年1月。检索词采用主题词与自由词相结合的方式,中文检索词为“COVID-19;脑卒中;新型冠状病毒;脑血管病;死亡率;病死率”,英文检索 词 为“Coronavirus Disease 2019 Virus;Stroke;novel coronavirus;Cerebrovascular disease;Mortality”。同时手动检索纳入文献的参考文献,以尽可能全面地纳入相关研究。
1.3 文献筛选、数据提取及文献质量评价
1.3.1 文献筛选 2名评价员通过筛选标题、摘要和全文评估所有确定的文章,并以协商一致的方式解决分歧。全文评估是在摘要没有提供足够的信息来评估的情况下进行的。如果信息不完整或存在任何不明确之处,则联系相关文章的作者。
1.3.2 数据提取及文献质量评价 提取内容包括:第一作者、发表年份、平均年龄、样本量、研究国家、研究类型、住院病死率、NIHSS评分、实验室检查指标。同时采用纽卡斯尔-渥太华量表(the Newcastle-Ottawa Scale,NOS)对纳入文献的质量进行评估[15],包括8个条目,总分9分,主要包括研究人群的选择(0~4分)、组间可比性(0~2分)、暴露因素测量(0~3分),总分7~9分为高质量,5~6分为中等质量,0~4分为低质量。
1.4 统计学方法 使用RevMan 5.3软件进行Meta分析,异质性分析采用I2检验,若I2≤50%,说明文献间的异质性较小,则采用固定效应模型进行Meta分析;若I2>50%则使用随机效应模型。如果异质性较高,则可以通过敏感性分析技术寻找异质性原因。计数资料总有效率采用相对危险度(relative risk,RR)表示,计量资料采用平均差(mean difference,MD)表示并计算95%置信区间(confidence interval,CI)。绘制漏斗图分析报告发表偏倚的可信度,并分析检验结果的敏感性。以P<0.05为差异有统计学意义。
2 结果
2.1 文献检索结果 本研究共检索出2 805篇文献,利用EndNote筛选,最终纳入18篇文献[16-33],均为英文文献。文献筛选流程及结果见图1,纳入文献的基本特征见表1。
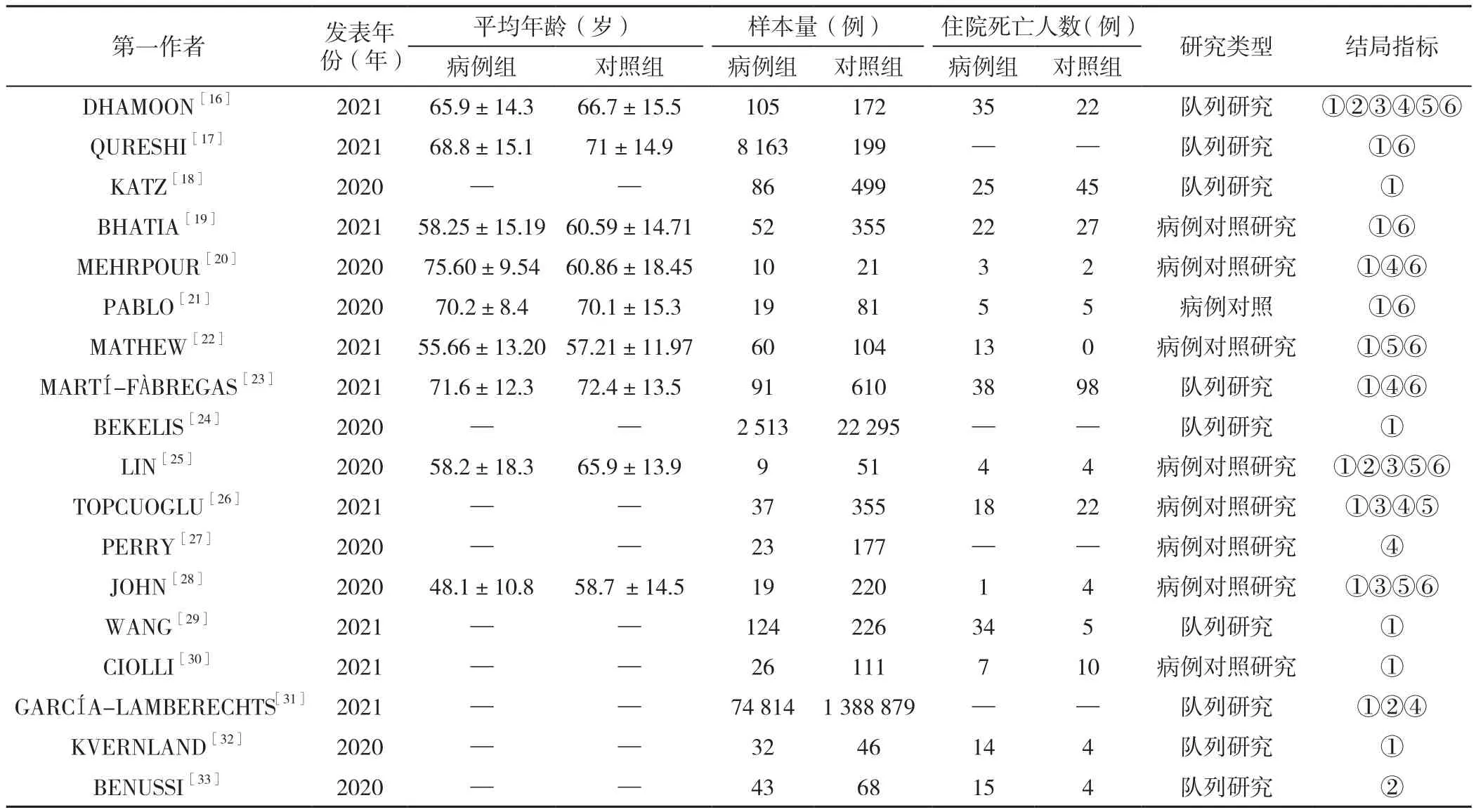
表1 纳入研究的基本特征Table 1 Basic characteristics of included studies
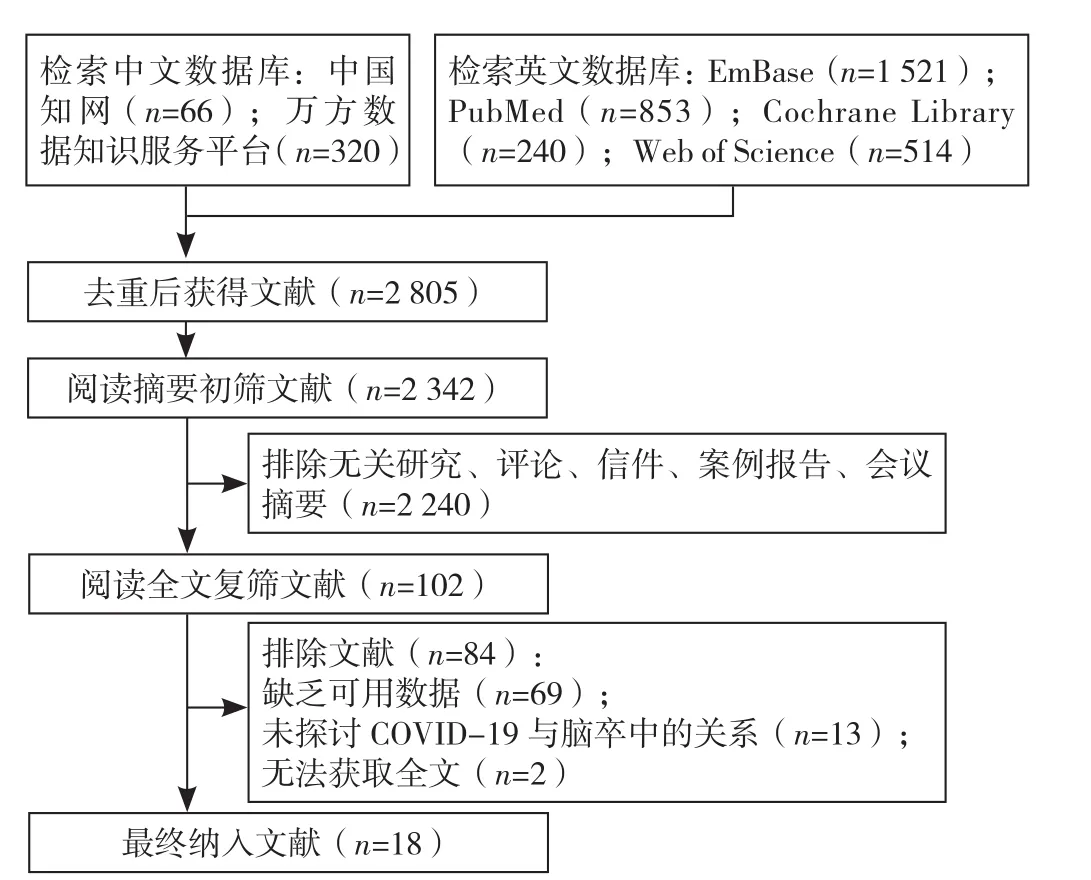
图1 文献筛选流程图Figure 1 Flow chart of literature screening
2.2 质量评估结果 12 篇文献[16,20-23,25-28,30-31,33]质量为高质量,6 篇文献[17-19,24,29,32]质量为中等质量,见表2、3。
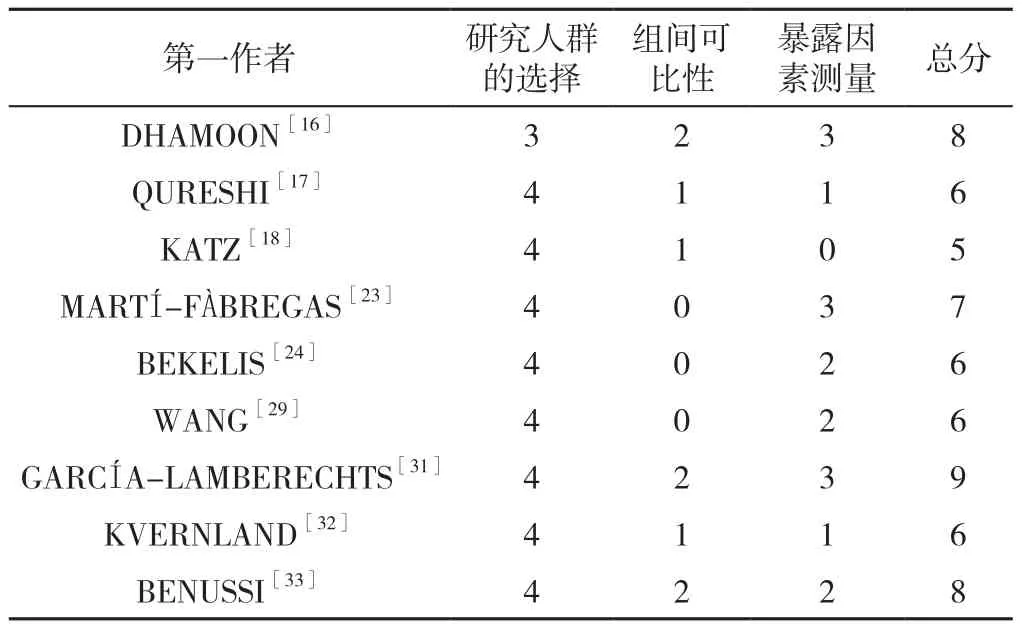
表2 纳入队列研究的NOS评分情况(分)Table 2 Quality of cohort studies assessed using the Newcastle-Ottawa Scale
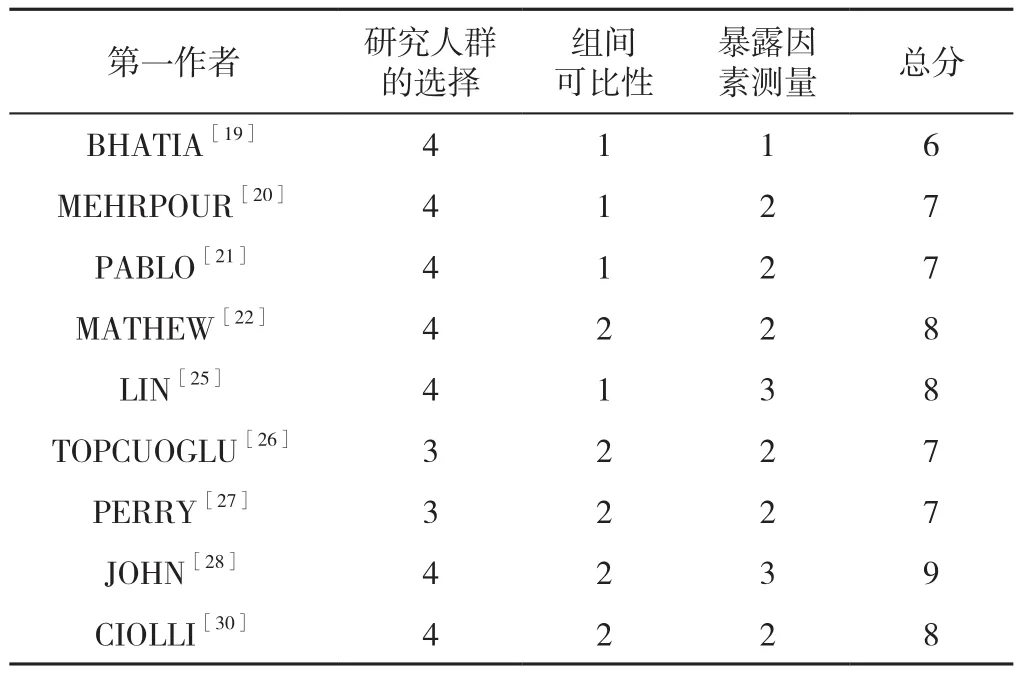
表3 纳入病例对照研究的NOS评分情况(分)Table 3 Quality of case-control studies assessed using the Newcastle-Ottawa Scale
2.3 Meta分析结果
2.3.1 COVID-19对脑卒中病死率的影响 16篇文献[16-26,28-32]对合并COVID-19的脑卒中患者住院期间(<15 d)病死率进行报告,共4 791例患者。异质性结果显示,I2=83%,P<0.000 01,各研究间存在异质性,采用随机效应模型进行分析。Meta分析结果显示,合并COVID-19的脑卒中患者的病死率高于未合并COVID-19的脑卒中患者,差异有统计学意义〔RR=4.16,95%CI(2.82,6.13),P<0.000 01〕,见图2。敏感性分析结果显示,经逐篇剔除文献,结果未发生显著变化。
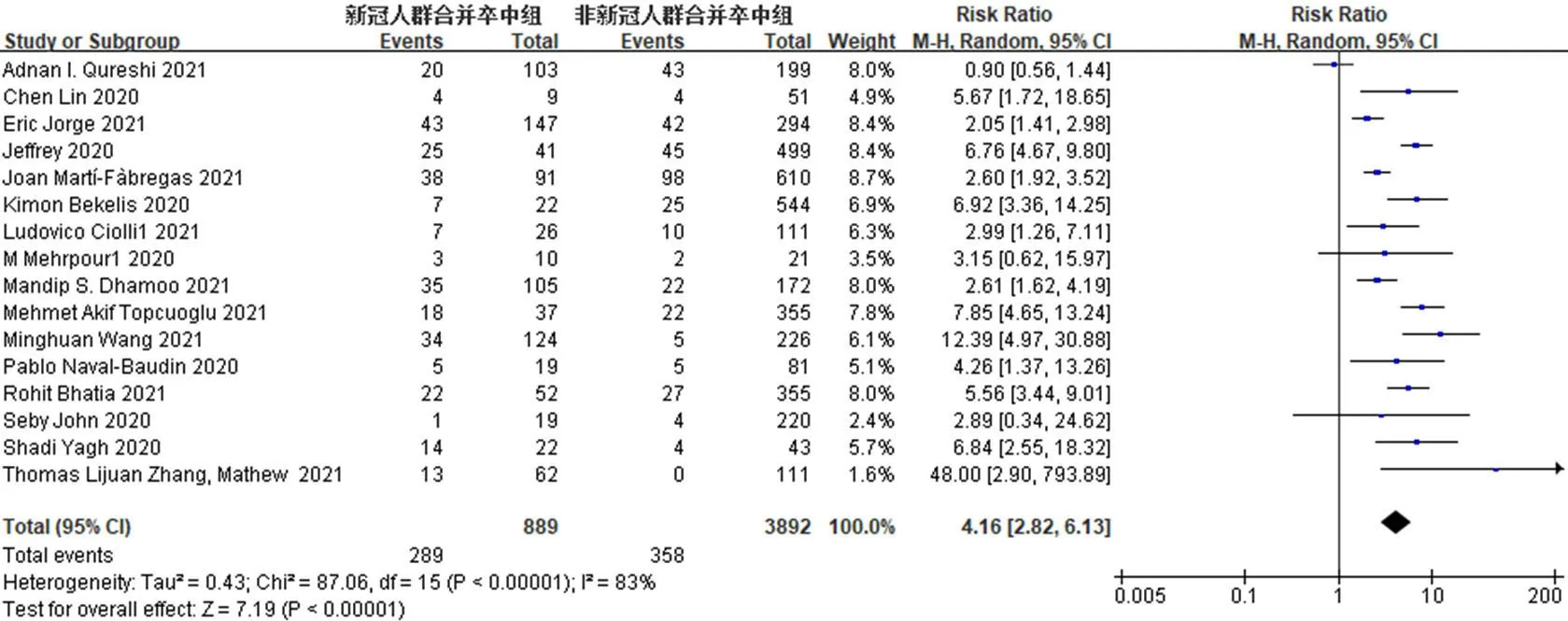
图2 合并COVID-19的脑卒中患者和未合并COVID-19的脑卒中患者病死率比较的森林图Figure 2 Forest plot comparing the mortality of stroke patients with and without COVID-19
2.3.2 COVID-19对脑卒中患者凝血酶原时间(PT)的影响 4 篇文献[16,25,31,33]对合并 COVID-19 的脑卒中患者入院时的PT进行报告,共889例患者。异质性检验结果显示,I2=50%,P=0.11,各研究间存在较小异质性,采用固定效应模型进行分析。Meta分析结果显示,合并COVID-19的脑卒中患者的PT长于未合并COVID-19的脑卒中患者,差异有统计学意义〔MD=0.78,95%CI(0.35,1.20),P=0.000 3〕,见图3。敏感性分析结果显示,经逐篇剔除文献,结果未发生显著变化。
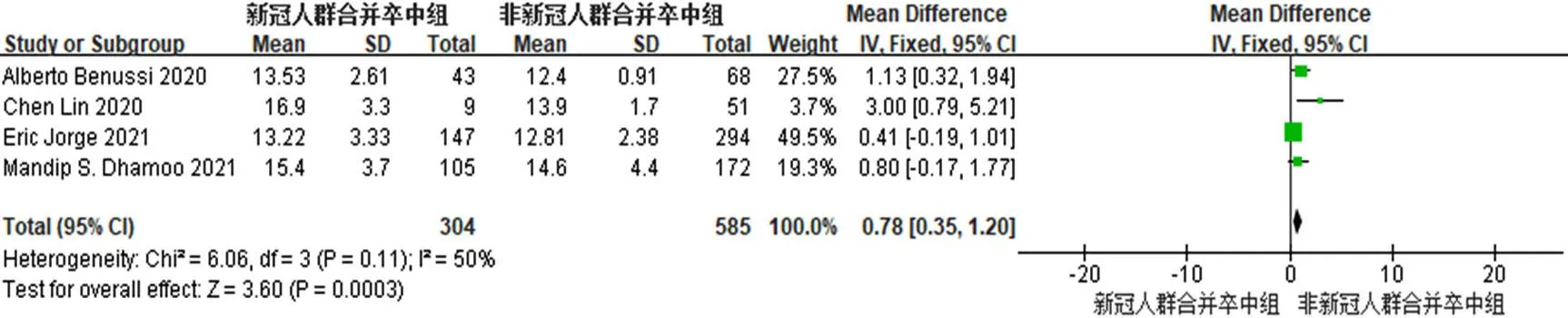
图3 合并COVID-19的脑卒中患者和未合并COVID-19的脑卒中患者PT比较的森林图Figure 3 Forest plot comparing prothrombin time in stroke patients with and without COVID-19
2.3.3 COVID-19对脑卒中患者活化部分凝血活酶时间(APTT)的影响 4 篇文献[16,25-26,28]对合并COVID-19的脑卒中患者入院时的APTT进行报告,共968例患者。异质性检验结果显示,I2=83%,P=0.000 4,各研究间存在异质性,采用随机效应模型进行分析。Meta分析结果显示,合并COVID-19的脑卒中患者和未合并COVID-19的脑卒中患者APTT比较,差异无统计学意义〔MD=2.51,95%CI(-2.69,7.71),P=0.34〕,见图4。
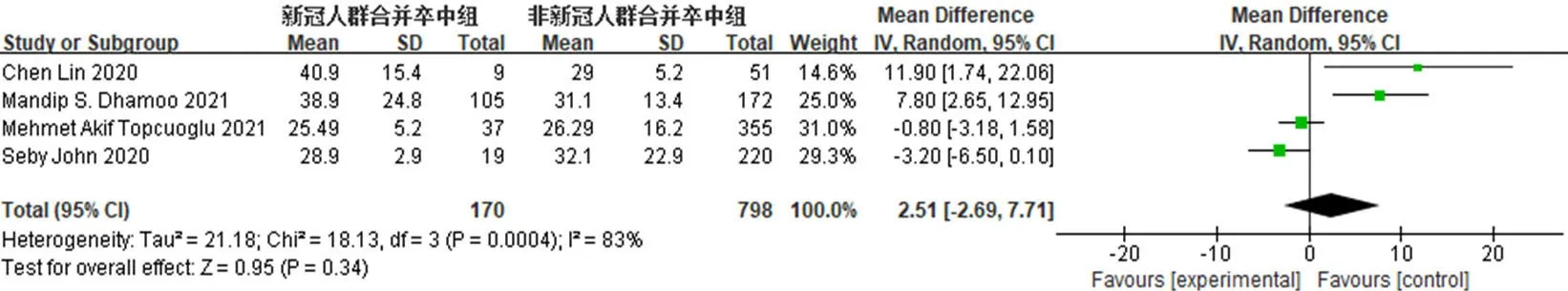
图4 合并COVID-19的脑卒中患者和未合并COVID-19的脑卒中患者APTT比较的森林图Figure 4 Forest plot comparing activated partial thromboplastin time in stroke patients with and without COVID-19
2.3.4 COVID-19对脑卒中患者D-二聚体的影响 6篇文献[16,20,23,26-27,31]对 合 并 COVID-19的脑卒中患者入院时的D-二聚体进行报告,共2 042例患者。异质性检验结果显示,I2=54%,P=0.06,各研究间存在异质性,采用随机效应模型进行分析。Meta分析结果显示,合并COVID-19的脑卒中患者的D-二聚体高于未合并COVID-19的脑卒中患者,差异有统计学意义〔MD=1.34,95%CI(0.83,1.84),P<0.000 01〕,见图5。敏感性分析结果显示,经逐篇剔除文献,结果未发生显著变化。
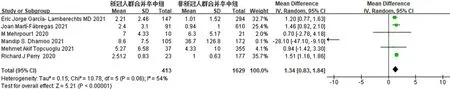
图5 合并COVID-19的脑卒中患者和未合并COVID-19的脑卒中患者D-二聚体比较的森林图Figure 5 Forest plot comparing D-dimer level in stroke patients with and without COVID-19
2.3.5 COVID-19对脑卒中患者NIHSS评分的影响5 篇文献[16,22,25-26,28]对合并 COVID-19 的脑卒中患者入院时的NIHSS评分进行报告,共1 141例患者。异质性检验结果显示,I2=59%,P=0.04,各研究间存在异质性,采用随机效应模型进行分析。Meta分析结果显示,合并COVID-19的脑卒中患者NIHSS评分高于未合并COVID-19的脑卒中患者,差异有统计学意义〔MD=6.66,95%CI(4.54,8.79),P<0.000 01〕,见图6。敏感性分析结果显示,经逐篇剔除文献,结果未发生显著变化。2.3.6 COVID-19对脑卒中患者年龄的影响 9篇文献[16-17,19,21-23,25,28]对合并 COVID-19 的脑卒中患者的年龄进行报告,共2 259例患者。异质性检验结果显示,I2=47%,P=0.07,各研究间异质性较低,采用固定效应模型进行分析。Meta分析结果显示,合并COVID-19的脑卒中患者年龄低于未合并COVID-19的脑卒中患者,差异有统计学意义〔MD=-2.04,95%CI(-3.48,-0.61),P=0.005〕,见图7。敏感性分析结果显示,经逐篇剔除文献,结果未发生显著变化。
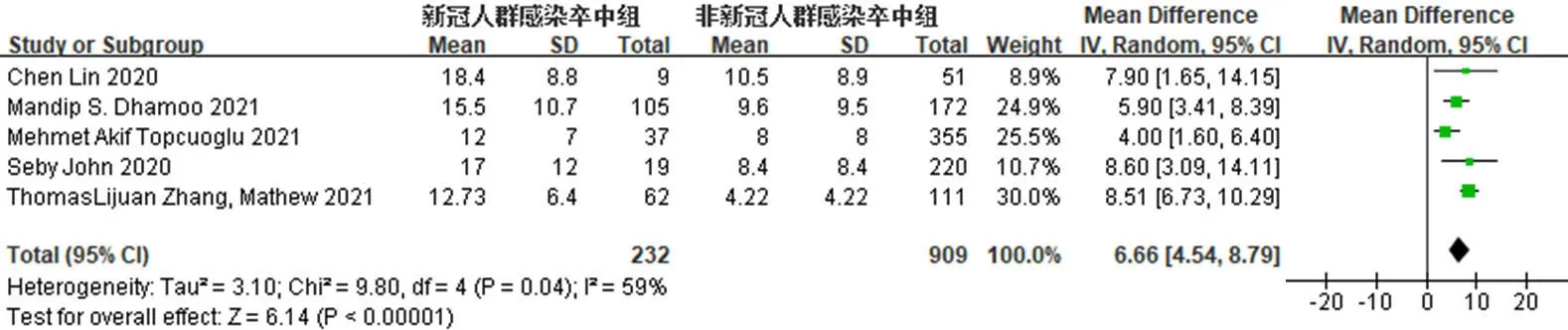
图6 合并COVID-19的脑卒中患者和未合并COVID-19的脑卒中患者NIHSS评分比较的森林图Figure 6 Forest plot comparing NIHSS score between stroke patients with and without COVID-19
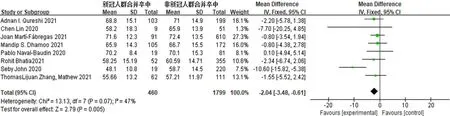
图7 合并COVID-19的脑卒中患者和未合并COVID-19的脑卒中患者年龄比较的森林图Figure 7 Forest plot comparing age between stroke patients with and without COVID-19
2.4 偏倚分析 本研究主要以脑卒中患者病死率改变绘制漏斗图来评价发表偏倚,由漏斗图可以看出,纳入的研究在轴线两侧基本对称分布(图8),不存在发表偏倚,实验结果可信度较高。
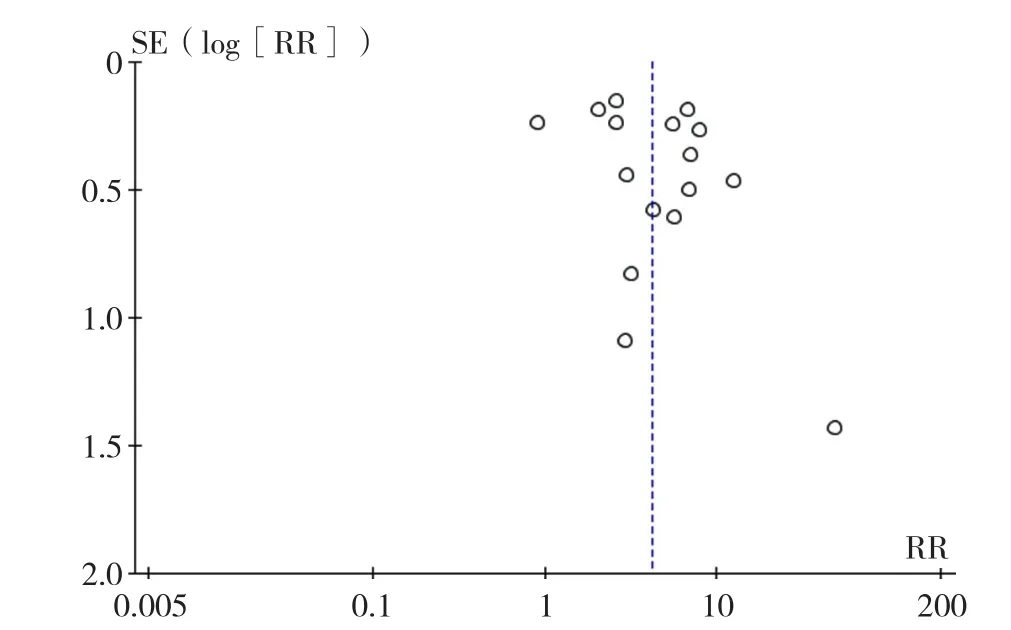
图8 COVID-19对脑卒中患者病死率影响的漏斗图Figure 8 Funnel plot assessing the potential publication bias in included studies on the impact of COVID-19 on stroke mortality
3 讨论
COVID-19可累及多个系统,在脑卒中的发病中也扮演着重要角色[34]。许多病例报告研究表明,COVID-19可导致血栓性疾病,而脑卒中与血栓事件密切相关,COVID-19对脑卒中的预后是否有影响?两者之间有何种相互作用机制目前尚不明确。
在COVID-19流行期间,许多国家报告脑卒中患者入院人数急剧减少,这表明症状轻微的脑卒中患者未入院或者由于担心COVID-19而减少就诊,这与YANG等[35]报道的各个地区脑卒中住院率减少相符。与2019年同期相比,2020年脑卒中入院率下降45%以下,患者均合并COVID-19,这种脑卒中患者入院率降低可能与疫情期间更侧重于COVID-19患者的转移相关,从而无法得出脑卒中发病增加或减少与COVID-19之间的明确关系[35]。本Meta分析发现,在脑卒中患者中,COVID-19患者较未合并COVID-19患者的病死率升高,与一项荟萃分析结果相一致[36]。与未合并COVID-19患者相比,COVID-19导致脑卒中的死亡风险增加3倍。KATSANOS等[37]研究表明既往的脑血管疾病与COVID-19患者预后不良风险增加相关,可能是由于严重的潜在感染以及随之而来的全身和代谢功能障碍所致。
本研究发现在脑卒中患者中,合并COVID-19与非感染COVID-19的脑卒中患者相比凝血指标异常率更高,与 GARCÍA-AZORÍN等[38]报道结果一致,其研究结果显示,合并COVID-19的脑卒中患者比未合并COVID-19患者的D-二聚体水平更高,淋巴细胞计数更高,表明COVID-19会引起免疫功能下降。来自中国的一项报告描述了合并脑卒中的COVID-19患者抗磷脂抗体和D-二聚体异常率更高[39]。D-二聚体是血栓形成后纤维蛋白溶解系统将纤维蛋白网分解,由纤维蛋白的两个D段组成的一个聚合体[40],其水平升高代表纤维蛋白溶解系统的激活。也有研究表明,D-二聚体和纤维蛋白原水平的增加与疾病的严重程度和病死率增加有关[41]。此外,还发现APTT在COVID-19患者和未合并COVID-19患者中无明显差异。PT是反映外源性凝血途径的指标,参考范围是11~13 s,改变3 s以上有临床意义,PT缩短,说明机体存在着高凝状态,容易发生血栓性疾病,如冠心病、心肌梗死、深静脉血栓。APTT是反映内源性凝血途径的指标,本Meta分析结果显示,合并COVID-19的脑卒中患者和未合并COVID-19的脑卒中患者APTT比较无差异。
部分文献报道了合并COVID-19的脑卒中患者的NIHSS评分及年龄等,其中调整相关变量后发现NIHSS评分、年龄与患者病死率相关。本研究结果显示,合并COVID-19的脑卒中患者平均年龄较低、NIHSS评分较高。本研究的一个主要发现是,脑卒中的严重程度也受COVID-19影响,与未合并COVID-19的脑卒中患者相比,合并COVID-19的患者脑卒中严重程度更重,且病死率较高。
然而COVID-19患者发生脑卒中的机制仍有待确定,目前有几个合理的假设:血管壁侵入、凝血障碍、继发于心肌损伤的脑栓塞或现有动脉粥样硬化斑块的不稳定。新型冠状病毒能够侵入血管壁,因为内皮细胞表达血管紧张素转化酶2(ACE2)受体[42],病毒利用该受体进入细胞,通过破坏血管壁或诱导抗磷脂抗体促进血栓形成[43],也可通过激活免疫系统导致血栓形成[44],从而影响凝血、血小板活化和内皮功能并导致机体处于高凝状态。另一种潜在机制是干扰凝血[45],COVID-19一方面引起内皮细胞损伤从而激活组织因子——Ⅶa因子启动凝血,并在病变区域募集血小板和白细胞,加重局部炎症并进一步促进凝血系统的激活。一些病毒还可以同时在某些COVID-19患者中,引起一般炎症状态或“细胞因子风暴”,影响机体凝血功能[46]。合并COVID-19的脑卒中病死率增加可能是全身性高凝的表现,其打破了体内凝血和抗凝系统的平衡,增加了脑卒中的风险[47]。有一些报道发现对COVID-19患者预防性抗凝治疗可以明显降低全身血栓事件的发生率[48],也有一些报道称抗凝治疗会降低脑卒中患者死亡风险[32]。
本研究系统分析了目前已有的小样本回顾性研究,与未合并COVID-19患者相比,合并COVID-19的脑卒中患者与更高的病死率相关。预后与实验室指标如凝血指标(D-二聚体、PT)明显相关,也与脑卒中的严重程度及年龄相关,这为合并COVID-19的脑卒中患者早期识别及治疗开辟了新的思路,并提供了循证依据。本次Meta分析存在一定局限性,如纳入的患者样本量偏小;纳入文献未提及盲法的使用及分配隐藏,易发生选择性偏倚;纳入文献关于正念干预的方法不够详细系统;COVID-19在脑卒中患者中的发病率仍需要高质量的研究证实。
作者贡献:皇甫晓娟负责文章的构思与设计、论文撰写;皇甫晓娟、李小娟、陈敏、刘吉红、翟蕊、蔡志鹏负责数据收集与整理、统计学处理、结果的分析与解释;李俐涛负责论文的修订、文章质量控制与审校。
本文无利益冲突。

