基于生物信息学分析胰腺癌肿瘤浸润性白细胞组成和预后相关的免疫基因①
滕步伟 杨雨翰 郭增亚 张坤东 王晓峰 陈伟伟 裘正军
(南京医科大学康达学院第一附属医院暨连云港市第一人民医院,连云港 222061)
胰腺癌(pancreatic cancer,PC)是最常见的癌症之一,已成为导致美国癌症相关死亡的第二位因素[1]。即便应用了各种治疗手段,包括手术切除和化疗等辅助治疗,PC的五年生存率也不超过5%,平均生存期仅为3~6个月[2]。既往研究表明,PC患者的高病死率主要是由于早期诊断困难、局部侵袭和早期转移[3]。因此,寻找新的PC诊断标志物并了解其潜在的作用机制至关重要。目前,免疫治疗已成为肿瘤治疗的重要手段,它可以通过激活免疫系统来攻击肿瘤[4]。然而,许多对其他癌症有显著疗效的免疫治疗对PC的治疗效果却不理想[5]。小鼠和人类PC肿瘤微环境的特点之一是肿瘤中含有大量的非肿瘤成分,统称为基质[6]。在PC中,基质占肿瘤总质量的50%,并被证明能抑制自发性和治疗性地诱导抗肿瘤免疫[7]。事实上,广泛的免疫策略限制了免疫治疗的效果,癌细胞的主要逃逸机制是通过分泌代谢物、细胞因子、免疫因子和趋化因子使PC对骨髓生成状态敏感,从而改变临床前和临床结果。
肿瘤相关巨噬细胞(tumor-associated macro‐phages,TAM)占免疫细胞总数的15%~20%。一般来说,循环中的单核细胞首先迁移到组织中,然后分化为常驻组织的巨噬细胞[8]。在微生物产物和细胞因子等环境因素的影响下,这些滞留巨噬细胞可以被激活,激活的巨噬细胞通常分为经典激活的(M1)巨噬细胞和交替激活的(M2)巨噬细胞[9]。M1巨噬细胞可诱导T辅助细胞-1(Th1)反应。相反,M2巨噬细胞可以根据诱导信号的不同表现出不同表型,包括IL-4、IL-13、IL-10和糖皮质激素[10]。在多数肿瘤中,巨噬细胞的表型与伤口愈合的分解阶段一致,但TAM往往表现为免疫抑制表型。此外,对TAM转录组的表型分析表明,TAM表达了一些免疫抑制基因,包括精氨酸酶Ⅰ、IL-10、TGF-β等[11]。
效应性T细胞的活化是构成PC免疫治疗的关键环节。细胞毒性CD8+效应T细胞是肿瘤免疫反应的核心,CD8+T细胞在肿瘤中的浸润已被证实与胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)患者的预后有关[12]。然而,在大多数PC患者和小鼠中,CD8+T细胞罕见,其活化水平明显降低,表明肿瘤反应性T细胞的浸润和/或活性受到抑制[13]。
因此,本研究旨在探讨免疫相关基因(immunerelated genes,IRGs)在预测预后方面的潜在临床应用价值及其作为PC治疗生物标志物的可能性。首先,将IRGs的表达与临床数据相结合,利用计算方法评估PC患者的总生存期(overall survival,OS)。随后系统分析IRGs的表达,并筛选出独立的预测PC患者预后的生物标志物。最后,进行生物信息学分析,以探讨其潜在的作用机制。本研究为PC的早期诊断和个体化免疫治疗奠定了基础。
1 材料与方法
1.1 材料 从癌症基因组图谱(The cancer genome atlas,TCGA)数据库(https://tcga-data.nci.nih.gov/tcga/)中获取PC患者的原始基因表达和相应的临床数据。剔除没有足够临床或(和)生存资料的样本。此外,还需包含性别和美国癌症联合委员会(AJCC)分期数据。考虑到TCGA数据库中只有4个正常胰腺组织,本课题组从美国国立卫生研究院共同基金建立的基因-组织表达(genotype-tissue expression,GTEx)数据库中获得了正常胰腺的mRNA表达数据。
1.2 方法
1.2.1 差异基因分析 以|log2倍数变化|≥2和P<0.05作为筛查差异表达基因(differentially ex‐pressed gene,DEG)的标准。根据http://bioconduc‐tor.org/packages/release/bioc/html/limma.html提供的“limma”R软件包,选择DEG进行进一步分析。使用R平台(3.5.2版)提供的“ggplwot2”绘制火山图和热图。
1.2.2 风险评分模型的建立 进行归一化和差异性分析。采用单变Cox模型进行LASSO分析筛选出224个差异显著并且与OS高度相关的IRGs。经数据处理后,使用多变量Cox模型计算12个选定的关键IRGs的系数(βi)。建立由βi和IRGs mRNA表达组成的评分模型如下:风险评分=∑5(βi×Expi)。该公式中计算了每个受试者i=1的风险评分。以平均风险得分为分界值,将所有符合条件的受试者分为高风险组和低风险组。利用Kaplan-Meier生存曲线分析高危和低危患者的预后差异。
1.2.3 功能富集分析 使用“Metascape”和“clus‐terProfiler”网络工具进行GO和KEGG功能富集分析,以研究IRGs参与的生物学过程和潜在的途径[14]。
1.2.4 免疫细胞的组成及其与免疫相关基因的相关性CiberSort算法是一种利用转录数据估计免疫细胞丰度的工具[15]。该软件使用线性支持向量回归(SVR)从基于特征矩阵的大量肿瘤样本的转录谱中解卷积免疫细胞的各部分。用肿瘤免疫评估资源(tumor immune estimation resource,TIMER)工具建立IRGs与免疫细胞的相关性。
2 结果
2.1 PC免疫细胞组成 采用CiberSort计算每种免疫细胞的比例,结果如图1A、B所示,静息CD4+记忆T细胞、M0和M2巨噬细胞、T细 胞CD8和B细 胞 是最常见的5种免疫细胞。与非肿瘤胰腺组织(n=21)相比,PC组织(n=178)中静息记忆CD4+T细胞、活化CD4记忆T细胞、调节性T细胞、M0巨噬细胞、静息树突状细胞和活化树突状细胞明显占优势(P<0.001)。与PC相比,非肿瘤组织中滤泡辅助T细胞、单核细胞和M2巨噬细胞占优势(P<0.001,图1C)。

图1 PC中免疫细胞的组成Fig.1 Compositions of immune cells in PC
2.2 DEG的鉴定 如图2A、B所示,利用“limma”R软件包共鉴定出4 847个DEG,其中2 559个上调,2 288个下调。将从immport数据库(https://www.immport.org/shared/home)下载的共4 678个IRGs与上述DEG取交集,产生了1 206个差异表达的IRGs(图2C)。进一步功能富集分析显示炎症相关通路最为富集,“白细胞迁移”“T细胞活化”和“细胞黏附正向调节”是最常见的生物学术语(图3)。此外,KEGG分析表明,这些IRGs在细胞因子-细胞因子受体和PI3K-Akt信号通路上最为富集(图4)。
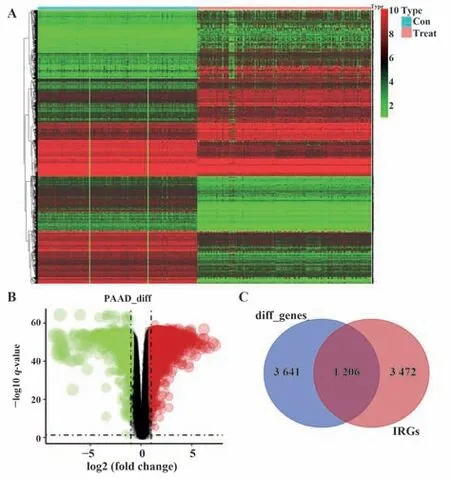
图2 DEG鉴定Fig.2 Identification of DEG
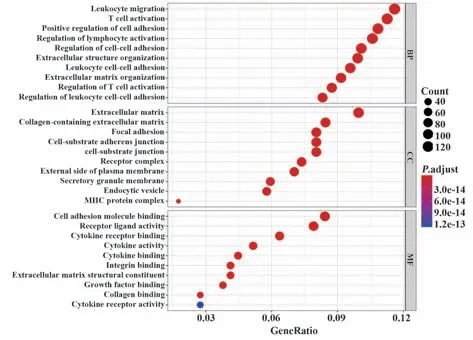
图3 生物过程、细胞成分和分子功能的GO分析Fig.3 GO analysis of biological process,cellular compo⁃nent and molecular function
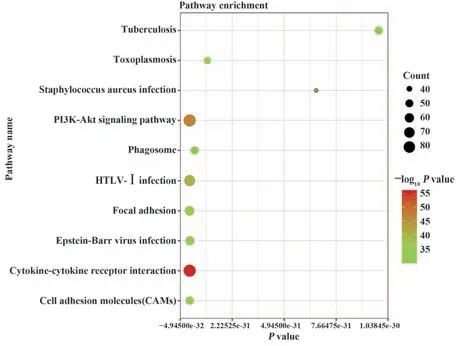
图4 最显著的10条KEGG通路Fig.4 Top 10 most significant KEGG pathways
2.3 OS相关的免疫相关基因的鉴定 为探讨IRGs表达与患者OS的关系,选取224个差异显著(P<0.05)的IRGs进行单因素回归分析。与DEG功能富集分析的结果一致,OS相关的IRGs在与细胞相互作用和运动相关的基因本体论术语中也最为富集。此外,KEGG分析表明,PI3K-Akt途径也最为富集(图5)。
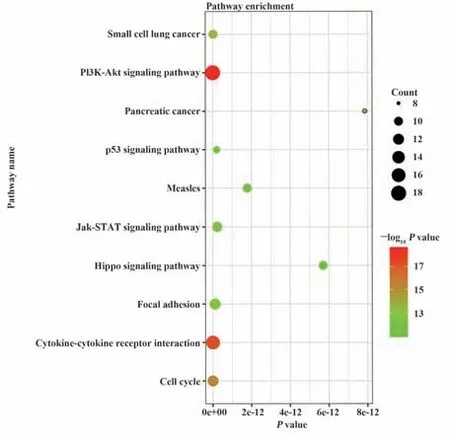
图5 OS相关IRGs的鉴定Fig.5 Identification of OS-related IRGs
2.4 免疫相关中心基因的鉴定 为了鉴定出与PC的发生和预后密切相关的IRGs,选择与临床预后显著相关(P<0.05)的差异表达IRGs进行进一步分析。将这些差异表达IRGs进行String分析,形成蛋白质相互作用(PPI)网络。将处于交叉点并且存在较多蛋白互作的基因认定为HUB基因。PPI网络显示CDK1、Bub1和AURKB是3个HUB基因[见附图1(www.immune99.com)及图6A]。功能富集分析表明,这3个HUB基因积极参与了PI3KAkt途径(图6B)。
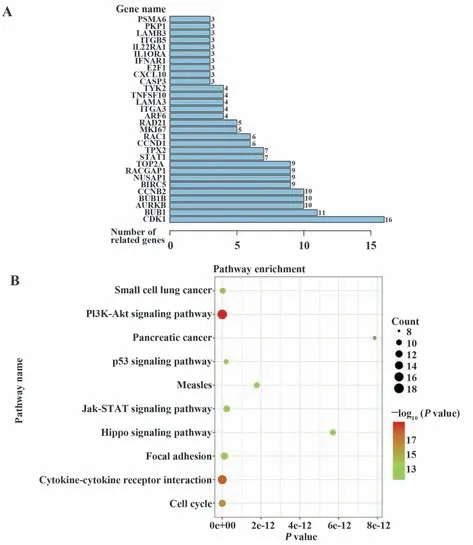
图6 核心IRGs的鉴定Fig.6 Identification of HUB IRGs
2.5 临床预后评估 采用单变量Cox模型,选取224个差异显著(P<0.05)的IRGs进行LASSO分析,筛选出与OS高度相关的IRGs。LASSO分析有助于在拟合广义线性模型时选择变量和进行正则化,在一定程度上可以避免过拟合。此外,由于LASSO分析的复杂度取决于系数(γ),可以通过根据其大小进行惩罚比例来获得变量较少的模型。最后,得到相对较少的密切相关指标,绘制出部分可能性偏差与对数log(γ)的关系图。
根据多变量Cox和LASSO回归分析建立一个预后标志,将PC患者分为两组,两组的OS临床结果不同(图7)。公式如下:CD2AP表达×1.738 56+IL20RB表 达×0.375 56+MYEOV表 达×0.592 51+NUSAP1表达×2.946 30+PCDH1表达×(−2.525 06)+RAB27B表达×1.036 62+TNFSF10表达×1.652 40+TOP2A表达×(−1.556 16)+TPX2表达×2.152 52+TYK2表达×(−3.714 78)+WNT7A表达×0.527 38+BUB1B表达×(−2.276 12)。
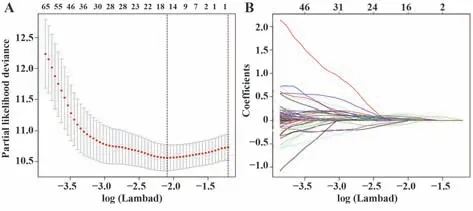
图7 OS相关IRGs的LASSO回归模型Fig.7 LASSO regression model of OS-related IRGs
免疫相关预后指数是根据潜在的离散临床结果区分PC患者的关键工具(图8A~C)。受试者操作特征曲线下的面积值为0.802,表明IRGs对OS具有相当好的判断预后能力(图9)。
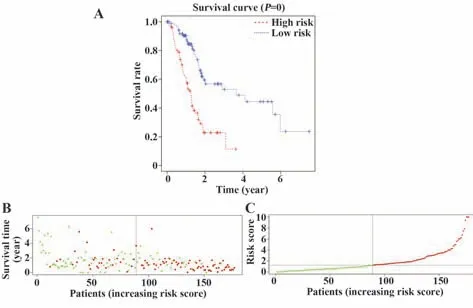
图8 临床预后的评估Fig.8 Assessment of clinical outcomes
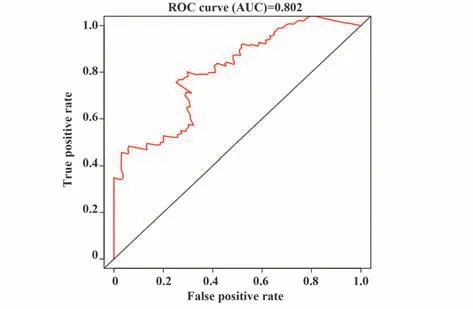
图9 IRGs的受试者工作特征曲线Fig.9 Receiver operating characteristic curve of IRGs
2.6 OS相关的免疫相关基因与免疫细胞的相关性 用Kaplan-Meier分析评估了PC患者OS与12种IRGs表达的关系(图10)。基于TIMER这一综合分析肿瘤浸润免疫细胞的网络服务器,进一步分析12种IRGs的表达与免疫浸润的相关性。如图11A、B所示,RAB27B与CD4+T细胞呈负相关,而TYK2与CD4+T细胞呈正相关。
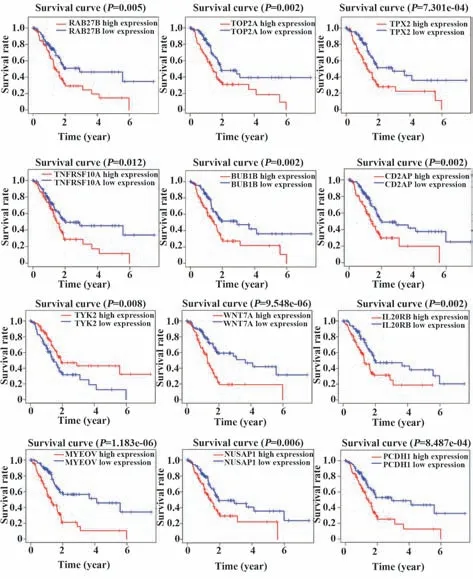
图10 12个重要IRGs分层的患者预后Kaplan-Meier分析Fig.10 Kaplan-Meier analysis of PS of patients stratified by expression of 12 selected key IRGs
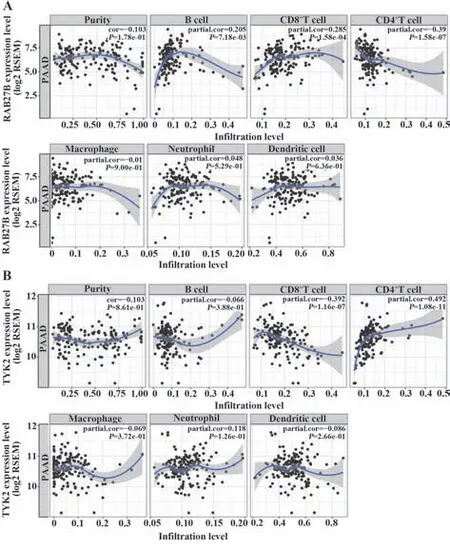
图11 重要IRGs与免疫细胞浸润的相关性Fig.11 Pearson correlation between key IRGs and immune cells infiltrating
3 讨论
虽然肿瘤的免疫治疗已经对包括黑色素瘤和小细胞肺癌在内的多种癌症显示出良好的效果。然而,到目前为止,它对大多数PC患者并不敏感。因此,有必要对PC中肿瘤浸润性免疫细胞和免疫基因进行系统研究,揭示其临床意义和相互关系。事实上,PC的五年生存率非常低,对免疫基因的研究揭示了它们与临床预后存在相关性,有助于评估PC的OS。本研究获得了肿瘤和非肿瘤组织之间的DEG,并研究了它们之间的相互作用。系统的生物信息学分析进一步探讨了它们的分子机制。最重要的是,根据筛选和差异表达的IRGs,提出了一个单独的后处理功能来确定免疫细胞浸润并评估PC患者的潜在临床结果。
根据TCGA和GTEx数据库对免疫细胞组成的分析表明,静息状态下的CD4+记忆性T细胞、M0和M2巨噬细胞、CD8+T细胞和B细胞是主要的免疫细胞。以前的研究表明,PC过去被描述为冷瘤,而TAM是PC组织中最重要的免疫细胞,占免疫细胞的15%~20%[16-17]。许多其他证据表明,TAM主要是M2巨噬细胞,可以诱导PC的上皮-间充质转化(EMT)[18-19]。同时,这些M2巨噬细胞还能分泌CCL22和IL-10等因子,从而抑制CD4+和CD8+T细胞的功能[20-21]。此外,巨噬细胞来源的外泌体也能诱导PC产生耐药性[22]。
据报道,肿瘤内CD4+Th2细胞浸润和FoxP3+调节性T细胞也与PC患者生存率下降有关[23]。此外,激活的调节性T细胞可以诱导M2样巨噬细胞分化,KPC小鼠模型中巨噬细胞的耗尽被证明能显著减少肿瘤转移,并与CD4+和CD25+T细胞水平的降低有关[24-25]。
综上所述,PC是一种典型的冷肿瘤,其免疫微环境主要由促癌的CD4+T细胞和TAM浸润。针对PD-1、CTLA4等免疫检查点的免疫治疗主要促进CD8+T细胞的免疫抑制,对黑色素瘤、小细胞肺癌等热性肿瘤有较好的治疗效果。本研究表明CD4+T细胞是PC的主要细胞。因此,以抑制T细胞和TAM为靶点的免疫治疗对PC可能更为有效。
本课题组对免疫基因的分析表明,差异表达的免疫基因和OS相关的免疫基因主要集中在PI3KAkt信号通路上。有趣的是,PI3K-Akt mTOR被证明是诱发PC的关键信号通路,并且在PC中被频繁激活[26]。
为了建立简便的方法监测PC患者的免疫状态并预测其临床预后,本课题组提出了一种基于免疫的预后标志物,包括12个与OS相关的HUB IRGs。关于TNFSF10、CD2AP、PCDH1、MYEOV、NUSAP1在PC中的作用和机制的研究尚未见报道。其中,CD2AP被报道能诱导CD4+T细胞分化,PCDH1可以与Smad3结合从而抑制转化生长因子-β1诱导的基因转录[27-28]。
TOP2A是β-连环蛋白的共同激活剂,可以激活PCEMT过程[29]。IL20RB、BUB1B和WNT7A的高表达与PC患者较短的生存期相关[30-33],但本课题组基于TCGA数据库的分析表明,BUB1B的高表达与较好的预后相关。TPX2 mRNA和蛋白在PC细胞或肿瘤中高表达,以往的研究表明,用TPX2特异性RNA敲除TPX2可以有效抑制培养液中PC细胞的生长并诱导其凋亡,抑制PC在软琼脂和裸鼠体内的生长[34-35]。
在12个基因中,TYK2与CD4 T细胞呈正相关,而RAB27B与CD4T细胞呈负相关[36]。TYK2属于JAK家族,可以激活STAT3,促进与肿瘤生长、存活和免疫抑制相关的关键基因的表达[37]。此外,TYK2信号在IL-23诱导的γδ T细胞分泌IL-17中也起关键作用,可促进巨噬细胞释放IL-27[38]。同时,IL-27可导致Th1/Tc1、Th2/Tc2、Th17/Tc17、Th9和Th22细胞显著升高[39]。更重要的是,RAB27B被证明是乳腺癌和肺腺癌转移和预后的潜在生物标志物,并在PC细胞的侵袭、增殖和凋亡以及化疗耐药方面发挥重要作用[40-42]。本研究表明RAB27B的表达与CD4+T细胞浸润呈负相关。但RAB27B对CD4+T细胞的抑制作用还有待进一步研究。总之,通过基于TCGA和GTEx数据库对PC患者的分析,本研究获得了差异表达和OS相关的核心免疫基因,然后建立了预后模型。此外,本课题组还分析了免疫细胞在PC中的浸润和聚集及其与上述基因的关联。

