CRISPR/Cas9技术在昆虫基因功能研究中的应用及优化
刘露露,林 哲,邹 振
(1.河北大学 生命科学学院,河北 保定 071002;2.中国科学院动物研究所 农业虫害鼠害综合治理研究国家重点实验室,北京 100101;3.中国科学院大学 生物互作卓越创新中心,北京 100049)
随着基因测序技术的发展,基因编辑系统逐渐成为生物科学领域研究的有力工具,也是昆虫基因功能研究的重要手段。2013年第三代基因编辑技术Clustered regularly interspaced short palindromic repeats/CRISPR-associated protein 9(CRISPR/Cas9)被首次应用在真核细胞中成功进行了基因编辑[1],随后该技术以其操作简便、材料成本低和效率高等优势,被迅速应用于人类细胞[2-4]、小鼠(Mus musculus)[5]、大鼠(Rattus norvegicus)[6]、斑马鱼(Danio rerio)[7]、酵母(Saccharomyces cerevisiae)[8]、果蝇(Drosophila melanogaster)[9]和家蚕(Bombyx mori)[10]等的研究中。本研究系统综述了CRISPR/Cas9技术在非模式昆虫色素表型、杀虫剂抗性和神经行为学研究中的应用情况及优化改良方案,旨在为昆虫基因学的深入研究和农业害虫的绿色防控提供参考。
1 基因编辑技术的由来
在CRISPR/Cas9基因编辑技术诞生之前,锌指核酸酶(zinc finger nuclease,ZFN)技术[11]和类转录激活因子效应物核酸酶(transcription activatorlike effector nuclease,TALEN)技术[12]是常用的基因编辑工具,ZFN技术由锌指蛋白结构域特异性识别靶基因一单链上的三联子位点,FokI核酸切割酶进行切割[13-15];TALEN技术通过TALE蛋白串靶向识别DNA,二聚化的FokI进行切割[16-17],二者均基于蛋白质对DNA的识别。
CRISPR/Cas9原理与ZFN和TALEN的蛋白质-DNA识别模式不同,该技术对DNA靶标位点的识别更加准确。CRISPR/Cas9系统的发展最早源于1987年,Ishino等[18]在大肠杆菌K12中首次发现一段含29个碱基的重复序列。直到2002年Jansen等[19]将这种结构命名为规律间隔成簇短回文重复序列(CRISPR),并认为此序列仅存在于古生菌和细菌中,在真核生物和病毒中不存在。2005年研究者发现在病毒和质粒中也具有CRISPR序列,推测其可能与细菌适应性免疫功能相关[20-22]。科学家利用噬菌体感染嗜热链球菌(Streptococcus thermophilus),终于发现了细菌捕获噬菌体基因片段并插入到自身基因组的机制,证实该系统确是细菌的适应性免疫系统[23]。随后,2008—2012年,研究人员相继发现了CRISPR/Cas9免疫系统的作用靶点及CRISPR RNA(crRNA)、反式激活crRNA(trans-activating CRISPR RNA,tracrRNA)和Cas9蛋白等参与分子,并表明该系统可应用于基因编辑[24-27]。2013年,张锋团队[8]实现了此技术在真核细胞中的首次应用。
CRISPR/Cas9系统含一个源于酿脓链球菌(Streptococcus pyogenes)的Cas9效应蛋白,该蛋白在一条sgRNA(single guide RNA)或gRNA(guide RNA)的引导下即可实现对靶基因的特异性剪切。当靶标DNA产生双链断裂缺口(double stand break,DSB),在其断裂位点,细胞启动自我修复机制,即非同源末端连接(non-homologous end joining,NHEJ)或同源介导的双链DNA修复(homology-directed repair,HDR)。NHEJ是一种容易出错的修复机制,过程中通常出现碱基缺失或插入,导致移码突变,破坏目的基因开放阅读框,实现基因敲除(gene knockout);HDR修复机制则更加精确,通过引入外源DNA作为修复模板,就能够实现基因敲入(gene knockin)。
2 CRISPR/Cas9技术在昆虫基因功能研究中的应用
在昆虫基因功能研究中,遗传学手段主要依靠基因可遗传的操纵。1982年,P element在果蝇中实现敲除而使基因功能丧失。然而在非模式昆虫中,直到21世纪90年代才利用Mariner,piggyBac等转座子技术实现,但繁琐、成功率低。虽然基于双链RNA的基因沉默技术在昆虫中广泛使用,但其存在转染效率低、遗传不稳定等缺点。自从2013年张锋和Church两个团队相继报道CRISPR/Cas9系统在人和小鼠细胞中成功实现基因的定点编辑以来[1,4],此技术已广泛应用于昆虫基因功能研究当中,其中主要是农业昆虫(表1),这极大地推进了昆虫科学研究的发展。
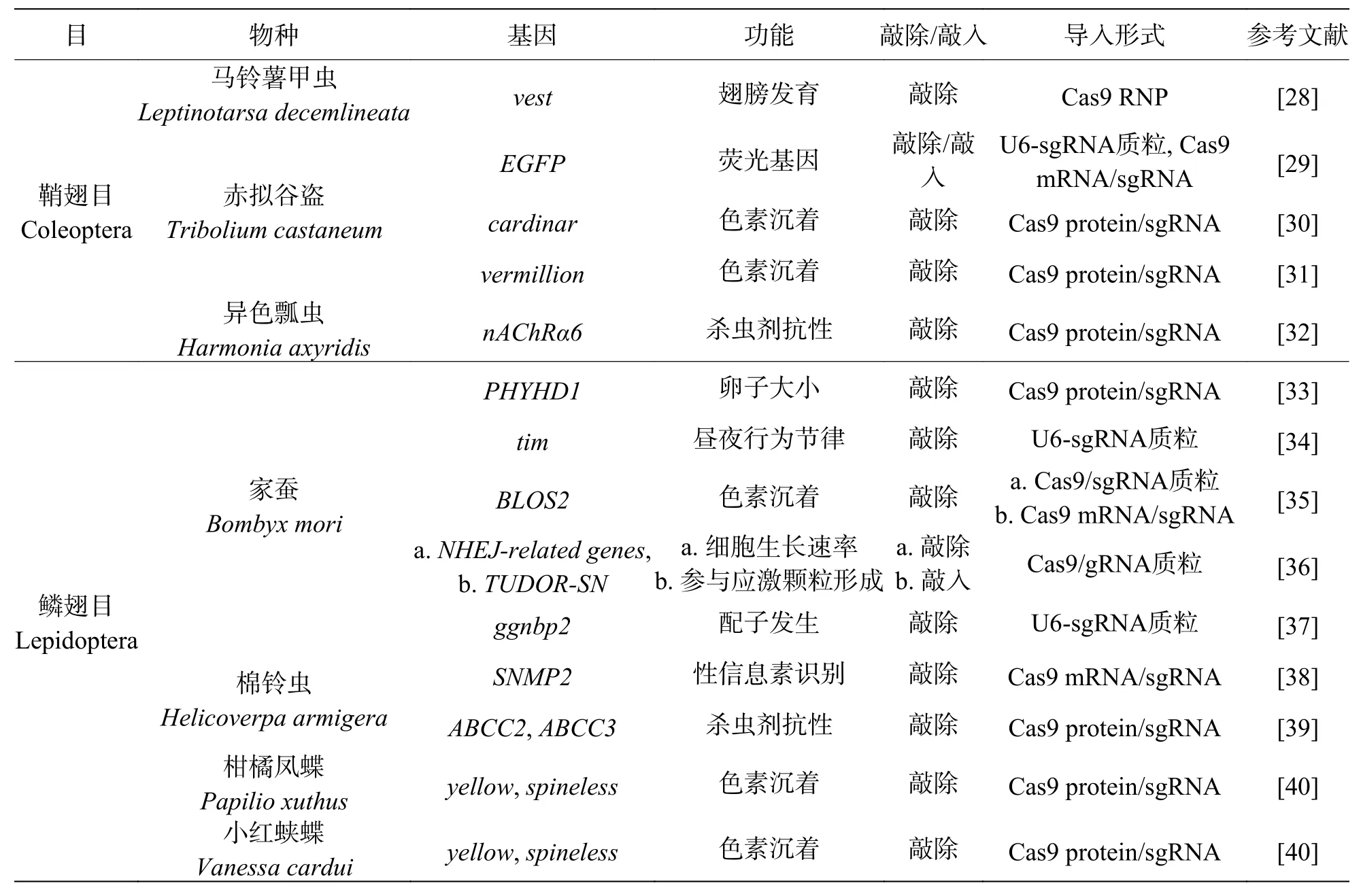
表1 CRISPR/Cas9技术在非模式生物昆虫中的部分应用
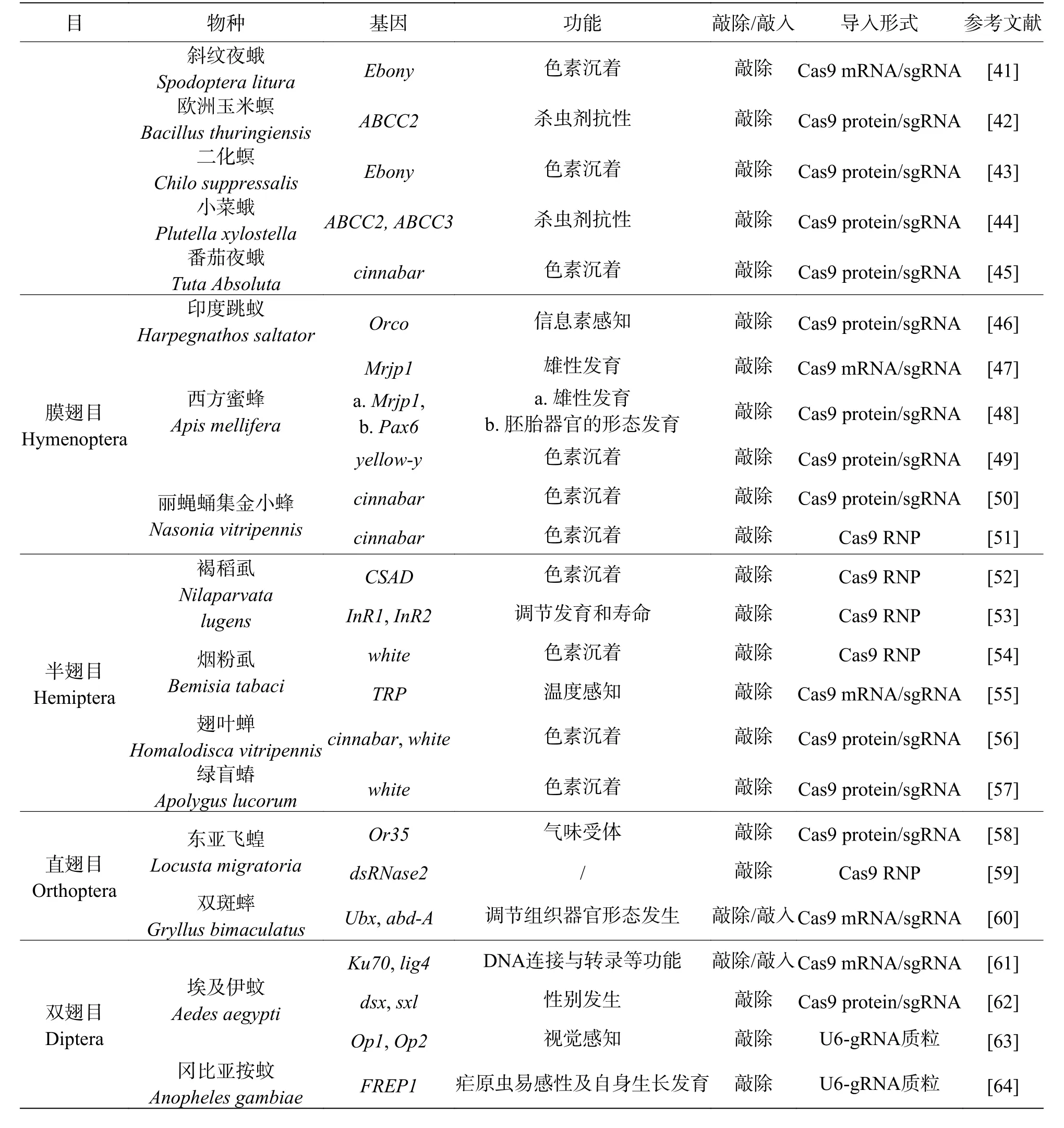
续表1
2.1 基因敲除技术在昆虫基因功能研究中的应用
2.1.1 在昆虫色素沉着的表型可塑性上的应用早期基因敲除技术集中研究昆虫体色、眼色和翅色等色素基因,对于探索昆虫的遗传发育具有重要意义。在褐稻虱(Nilaparvata lugens)中,Chen等[52]敲除黑色素代谢基因CSAD(cysteine sulfinic acid decarboxylase)诱 导G0代 的 突 变,证 明CSAD是成虫正常体色的必需基因;Xue等[65]成功验证cinnabar和white基因的沉默会引起褐稻虱红色复眼和白色复眼可遗传突变。Khan等[66]利用CRISPR/Cas9技术敲除棉铃虫(Helicoverpa armigera)体细胞的色素沉着基因white、brown、scarlet和ok,结果发现:white的敲除对卵、一龄幼虫和成虫眼色有影响;scarlet敲除后产生了一龄无色幼虫和黄色成虫;brown敲除不影响其色素沉着表型;ok的敲除使幼虫角质层变透明及眼色变黑。昆虫的翅色通常也是由多基因决定的。研究人员对偏瞳蔽眼蝶(bicyclus anynana)的眼色进行研究,发现通过CRISPR/Cas9系统敲除TH、DDC、aaNAT、yellow和ebony基因会影响其翅膀的结构组成和翅色[67]。
2.1.2 在杀虫剂抗性研究上的应用研究昆虫对杀虫剂的抗性机制对防治害虫有重要作用。2016年,Wang等[68]通过基因组敲除技术证明棉铃虫CAD基因是Bt(Bactospeine)杀虫剂CrylAc毒素受体;2017年,该团队又通过基因敲除分别建立了1个ABCA2基因第二外显子上2 bp缺失的突变品系和1个类似r2突变的5 bp缺失品系,证明了棉铃虫ABCA2对Bt杀虫剂Cry2Aa和Cry2Ab毒素的高抗性[69]。在对亚洲玉米螟(Ostrinia furnacalis)的研究中发现,ABCC2基因对Cry1Fa具有高水平抗性,而对Cry1Ab和Cry1Ac抗性较低[42]。草地贪夜蛾(Spodoptera frugiperda)ABCC2基因的敲除使其对Cry1F的抗性增加118倍[70]。双酰胺类杀虫剂具有胃毒作用,对鳞翅目昆虫防治效果好,但小菜蛾(Plutella xylostella)由于其繁殖能力强和周期短的特点很快产生了抗药性[71],Troczka等[72]发现其抗药性与鱼尼丁受体G4946E的突变有关。随后Zuo等[73]利用CRISPR/Cas9技术在甜菜夜蛾(Spodoptera exigua)中证明鱼尼丁受体G4946E突变,对氯虫苯甲酰胺、氯虫酰胺和氯虫双酰胺的抗性分别提高223、336和1 000倍以上。
2.1.3 在昆虫神经行为学研究中的应用化学信息素信号通过昆虫神经外周组织接受,触角神经组织处理,进而在脑部中枢神经系统嗅觉和其他感受器官共同指导昆虫觅食、交配、生殖等[74-75]。Garczynski等[76]通过该技术靶向敲除苹果蠹蛾(Cydia pomonella)的OR1基因,发现对突变雌虫繁殖力影响严重。烟草天蛾(Manduca sexta)的嗅觉受体ORCO被敲除后,其觅食行为发生变化,而产卵行为不变[77]。Ye等[78]通过CRISPR/Cas9敲除棉铃虫编码信息素结合蛋白(Pheromone binding proteins)基因PBP1,证实PBP1在雌虫性信息素的感知中具有重要作用,性信息素的感知与交配有关。敲除斜纹夜蛾信息素结合蛋白基因PBP3引起突变体对性信息素感知能力显著下降[79]。
研究昆虫性别分化有利于农业昆虫的种群控制和害虫防治。家蚕和小菜蛾ser2基因敲除引起雄性个体不育,但并不影响突变体的交配行为,最终将雄性不育表型传递给后代[80]。在家蚕和斜纹夜蛾中,osp基因的敲除使突变雌性的交配行为不变,但所产的卵不发育[81]。Markert等[82]利用TALENS和CRISPR/Cas9系统使君主斑蝶(Danaus plexippus)时钟相关基因cryptochrome2(cry2)和clock(cl)突变,发现clk是位于Z性染色体的性别连锁基因;敲除clk会破坏其羽化的昼夜节律。
2.2 基因敲入技术在昆虫基因功能研究中的应用基因敲入难于基因敲除,该技术利用细胞自身的HDR修复机制通过靶向编辑系统将外源基因定点整合到基因组中。果蝇中基因敲入的应用较多。如,Xue等[83]将sgRNA与环状DNA供体注射到果蝇胚胎,成功实现了同源重组介导的荧光基因敲入;Zimmer等[84]使用CRISPR/Cas9系统引入了果蝇nAChRα6受体中的同源突变,发现该受体G275E突变显著增加了果蝇对多杀菌素的抗性;随后Lamb等[85]利用该技术在果蝇的目标位点实现了精确替换。基因敲入在其他农业昆虫中也有一些相关报道。如,2015年,Gillies等[29]将非同源末端连接产生的突变引入赤拟谷盗(Tribolium castaneum),证实这种突变能传递给下一代,并在14%的注射个体中观察到标记的定向敲入;2021年,Matsuoka等[60]通过将供体序列敲入双斑蟀(Gryllus bimaculatus)基因Ubx、abd-A的外显子来破坏目标基因的功能,将成功应用于Hox相关基因的功能分析。
3 CRISPR/Cas9技术的优化与改良
传统的CRISPR/Cas9基因组编辑技术是通过引入DSB进行基因编辑的,但由于细胞修复机制的复杂性和多变性,在实验操作中脱靶效应(offtarget effect)和编辑效率低仍然是目前需要面对的难题。Cas9活性、sgRNA序列设计和靶DNA位点下游PAM序列识别等都是造成脱靶效应或增加脱靶效应风险的因素。目前已经报道了许多针对该技术改良优化以提升基因编辑成功率的方案,如选择不同的Cas9同源蛋白[86-88],优化sgRNA靶点的设计[89-90];也可通过优化Cas9RNP的传递方式和提高sgRNA-Cas9复合物的浓度[91]等进行该技术改良和优化。
3.1 Cas9同源蛋白优化CRISPR/Cas9研究人员将突变引入Cas9蛋白的D10A或H840A,即使一个HNH结构域或RuvC结构域失去活性或同时失活,以得到仅具有结合能力和单链裂解活性或不具裂解活性的dCas9(deadCas9)蛋白;dCas9在sgRNA导向下与DNA结合的功能不受影响[92-93]。CRISPR/dCas9系统能够调控 基因的转录抑制和转录激活[93-94],如Liu等[95]将dCas9与调控因子DNMT3A融合,O'Geen等[96]将dCas9与调控因子FOG1融合,二者的目的均是使基因转录水平得到抑制。上述Cas9蛋白均为来源于酿脓链球菌的SpCas9蛋白,近年来还发现了来自金黄色葡萄球菌(Staphylococcus aureus)的SaCas9蛋白。SaCas9在晶体结构和基因组编辑效率方面和SpCas9非常相似,但其分子量小,首选PAM序列为5′-NNGRRT(N为任意核苷酸;R=A或G),增加了靶位点识别的特异性[97-98]。2017年,Ma等[99]通过用SaCas9替换SpCas9编码序列构建载体,选取BmKu70为靶点,成功验证了SaCas9/sgRNA介导的新型CRISPR/Cas9系统在家蚕中的应用,基因编辑效率达到11.9%。除此之外,Hu、Guo等[100-101]均报道了一种Cas9的变体—xCas9 3.7,它的突变使PAM序列的识别不及Cas9精准,但可灵活识别多个PAM序列,这是由E1219构象变化导致盐桥不稳定引起的。xCas9 3.7变体无论是在体外生化实验还是在胞内实验都表现出优良的PAM识别兼容性和DNA靶向性,为解决基因编辑效率问题提供了更多选择[100]。
3.2 sgRNA靶点设计优化CRISPR/Cas9研究发现,sgRNA基因编辑效率与靶DNA PAM序列附近10~12 bp碱基的GC含量成正比[102],且含量在40%~80%具有切割效率[103]。Gagnon等还发现,5'-GA sgRNAs的切割效率与5'-GG sgRNAs相比存在轻微下降。对于sgRNA的长度设计,研究者存在争议。早期研究通常设计20个核苷酸序列,Fu等[104]认为低于20个核苷酸序列的短sgRNA能够在不影响基因编辑效果的条件下降低脱靶风险,而Kleinstiver等[105]则认为无法增加靶位点识别特异性,且还会降低基因编辑效率,因此问题有待进一步探索。Zhang等[106]根据鳞翅目昆虫的CRISPR/Cas9技术进行了总结,建议使用CasBLASTR web工具识别任一单链的GGN18NGG或N20NGG序列,以确定sgRNA靶位点;并建议基因插入用含有EGFP蛋白编码序列和同源臂的供体质粒来匹配Cas9位点两侧序列。
3.3 Cas9 RNP传递方式优化CRISPR/Cas9 Rodriguez等[107]受卵黄蛋白前体(Yolk Protein Precursor)通过受体介导的内吞作用进入卵巢过程的启发,开发了一种受体介导的卵巢分子转运(Receptor-Mediated Ovary Transduction of Cargo,ReMOT control)技术,使配体P2C肽与Cas9蛋白结合,从而介导Cas9核糖核蛋白(Cas9 RNP)从雌性蚊子血淋巴转导到发育中的卵母细胞,实现了可遗传给后代的基因编辑,效率达到30%。2020年,研究人员又利用ReMOT控制技术融合EGFP对丽蝇蛹集金小蜂(Nasonia vitripennis)基因cinnabar进行编辑,成功观察到卵巢输送的荧光标记[51]。Shirai等[30]利用该技术通过向赤拟谷盗成虫进行显微注射,建立了新的cardinal突变系。Heu等[54]也利用该技术以BtKV作为卵巢靶向肽配体,成功完成了在烟粉虱(Bemisia tabaci)上的基因编辑。此外,Wu等[108]开发了一种新型的蛋白质电晕纳米颗粒——结合介导的蛋白质冠状体,由Cas9 RNP、纳米粒子核心和亲和配体构成,具有高效传递、高稳定性和低细胞毒性等优点。
3.4 sgRNA-Cas9复合物优化 CRISPR/Cas9最新研究认为sgRNA与Cas9蛋白的浓度比例与脱靶效应密切相关[91],复合体的浓度较高时,错配即使发生在PAM区或邻近PAM区,DNA切割仍然继续进行,这种现象在低浓度时则不会发生,因此在实验中应选择合适的启动子以控制sgRNA和Cas9的表达量。此外,Svitashev等[109]的研究表明在体外先将Cas9和sgRNA组装成复合物Cas9 RNP后再导入受体中也有利于降低脱靶效应。
4 展 望
CRISPR/Cas9系统介导的基因编辑技术是近些年最有力的基因编辑技术之一。哺乳动物中利用CRISPR/Cas9技术筛选致病菌和毒素的研究方法已得到广泛应用,在昆虫中亦有报道[110]。在Perrimon教授团队开发的果蝇S2R+细胞全基因CRISPR/Cas9文库基础上[111],董民教授团队开发了一种质粒介导的sgRNA文库转染,通过位点特异性重组实现稳定整合,研究结果表明,在免疫细胞中表达的Vsg是发光杆菌(Photorhabdusluminescens)Tc毒素的特异性受体;Vsg敲除的果蝇血细胞对该毒素具有抗性。此研究为农业昆虫及媒介传染病昆虫靶向毒素和病原菌的鉴定提供了全新的研究方案。虽然在模式昆虫和许多非模式昆虫中都已初步建立了CRISPR/Cas9基因编辑系统,但与基因敲除相比,基因敲入研究鲜有报道,这可能是因为CRISPR/Cas9系统对基因组DNA靶向切割后,虽然通过同源重组修复能够实现目的片段的插入,但整合效率和成功率依然很低,未来的基因敲入系统还需要继续探索优化。
CRISPR/Cas9基因组编辑技术在近些年发展迅速,由于在此基础上构建的基因驱动(gene drive)系统在理论上能驱动性状的变化趋势,因此可用于调控害虫种群的性别比例,为害虫防治提供新策略[112]。化学杀虫剂的不合理使用不仅危及人类健康,也使许多害虫对化学杀虫剂产生强烈的抗药性,从而引起更加严重的药剂滥用,造成恶性循环。基因驱动策略是一个重要的发展方向。基因驱动策略是指特定基因在种群中偏向性地遗传给下一代的现象,最早由帝国理工大学遗传学家Austin Burt在2003年提出[113],其原理是基于归巢内切酶或人工核酸酶构建而成的驱动系统。目前基于CRISPR/Cas9构建的基因驱动系统已在斯氏按蚊(Anopheles stephensi)[114]、冈比亚按蚊(Anopheles gambiae)[115]等昆虫上成功建立了理论模型,为降低疟疾传播风险提供理论支撑。然而,由于这种技术的应用存在不可控性,一旦在种群中广泛扩散,可能对生物种群和生态链造成破坏,因此,建立安全、可控、高效及稳定的基因驱动系统有待科学家继续研究。
目前,利用CRISPR/Cas9工具开展的昆虫相关工作主要集中在鉴定功能基因和实验优化改良等基础研究上;新型和多样CRISPR/Cas9体系的不断发展与构建,将会推动农业害虫的绿色防控工作得到高度重视与快速推进,基于CRISPR/Cas9构建的基因驱动系统的安全性也将得到持续关注。

