猕猴桃果实贮藏期间细胞壁多糖物质降解特性及组织结构差异分析
陆玲鸿 马媛媛 古咸彬 肖金平 宋根华 张慧琴
(浙江省农业科学院园艺研究所,浙江 杭州 310021)
猕猴桃是典型的呼吸跃变型果实,有明显的生理后熟过程,采后易软化腐烂,不耐贮藏。如何延长猕猴桃果实贮藏期已成为猕猴桃产业发展壮大亟待解决的问题[1]。不同基因型猕猴桃果实的耐贮性差异较大[2-3]。红心类型的中华猕猴桃品种如红阳,具有优异的食用品质,近年来得到了快速发展,但这类品种果实软化较快,耐贮性较差,可食期较短[4]。近几年,易剥皮、高维生素C含量的毛花猕猴桃已经开始规模化栽培,发展迅速[5]。毛花猕猴桃新品种华特果实中淀粉在采前已快速下降,导致其采收时硬度较低,但其货架期和可食期较长,耐贮性较好[6-8]。
前期研究发现,不同品种猕猴桃在贮藏过程中果实质地变化存在差异[8]。与美味和中华猕猴桃相比,采前毛花猕猴桃的硬度较低,但在25 ℃贮藏时果实质地更稳定、更耐贮藏。造成这一现象的原因可能与果肉细胞组织结构及内含物成分、状态有关,特别是细胞壁果胶,其在诸多果蔬的结构特性方面发挥着重要作用[8]。目前,针对不同贮藏温度下,不同品种猕猴桃果实采后细胞壁多糖物质降解特性与果实贮藏性相关性的研究仍鲜见报道。本研究以红阳和华特猕猴桃果实为试材,通过测定25和4 ℃贮藏过程中两品种猕猴桃果实的硬度、细胞壁多糖物质含量和果胶降解相关酶活性,并比较两品种在25 ℃贮藏下果实细胞显微结构和钙组分含量差异,旨在为猕猴桃果实采后细胞壁多糖物质降解特性研究及优质耐贮的猕猴桃新品种选育提供参考。
1 材料与方法
1.1 试验材料及处理
供试品种红阳和华特猕猴桃分别采自浙江上虞和浙江仙居的合作试验基地,均于商业采收期采摘。红阳果实于盛花后135 d采摘(2020年9月6日),其可溶性固形物含量为6.9%。华特果实于盛花后170 d采摘(2020年10月30日),其可溶性固形物含量为12.2%。果实采收当天挑选大小均匀、成熟度一致、无病虫害和机械损伤的果实,均匀地放在纸箱中,用保鲜膜包装后分别放置于25和4 ℃环境中供后续分析与取样。贮藏期间,25 ℃贮藏组每3 d取样一次,4 ℃贮藏组每7 d取样一次。果实硬度低于0.02 kg时停止取样。25 ℃贮藏时,将贮藏期分为采收期Ⅰ(采收当天)、可食期Ⅱ(硬度约为0.1 kg)和过熟期Ⅲ(硬度约为0.025 kg,红阳为采后15 d,华特为采后18 d)。猕猴桃果肉用液氮速冻后置于-80 ℃冰箱保存待测。每个重复取用6个果实。
1.2 主要仪器与设备
FA2004型分析电子天平,上海舜宇恒平科学仪器有限公司;MDF-382E型超低温冰箱,日本SANYO公司;Synergy型超纯水仪,美国Millipore公司;FHM-1果实硬度计,日本竹村公司;PAL-1型数显糖度计,日本Atago公司;3-18K型高速冷冻离心机,德国Sigma公司;UV-2600型紫外可见分光光度计,日本岛津公司;Leica DM500 型光学显微镜,德国徕卡公司;微孔板检测酶标仪,美国BIOTEK公司;HH-S显恒温水浴锅,江苏正基仪器有限公司;ZEEnit 700P型原子吸收光谱仪,德国耶拿公司。
1.3 测定指标与方法
在果实赤道部位均匀取3个点,削去约1 cm2果皮,用果实硬度计测定硬度,以kg表示。经蒸馏水调零后采用PAL-1型数显糖度计测定猕猴桃果实赤道部可溶性固形物含量,以%表示。每品种随机测量6个果实,结果取平均值。
半纤维素含量用蒽酮法[9]测定,用葡萄糖作标准物质,结果用mg Glu·g-1FW表示;重量法测定纤维素含量,结果用mg·g-1FW表示。不同溶解性果胶含量测定参考曹建康等[9]的方法,结果用mg GalA·g-1FW表示。
用蛋白定量试剂盒测定蛋白浓度,并采用上海科兴生物科技有限公司的ELISA试剂盒进行酶活性测定。每样品重复3次,结果以U·g-1protein表示。
参考文献[10]的方法。选取25 ℃贮藏条件下的红阳和华特采收期及过熟期的果实为材料,将果实赤道部位果肉切块并用酒精醋酸福尔马林混合固定液固定,制作石蜡切片,并于光学显微镜下观察和成像。
对红阳和华特采收期Ⅰ、可食期Ⅱ和过熟期Ⅲ 3个时期的果样进行不同形态钙含量的测定。准确称取0.6 g果肉干样于10 mL离心管中,分别用去离子水、1 mol·L-1氯化钠、2%醋酸和5%盐酸逐级提取,用原子吸收光谱仪测定各钙组分含量,试验重复3次。
1.4 数据分析
采用Excel 2019软件进行数据统计、分析与绘图,利用SPSS 26.0软件进行相关性及显著性分析。
2 结果与分析
2.1 猕猴桃果实硬度和可溶性固形物含量的变化
果实硬度是反映果实耐贮性的重要指标。贮藏0 d时,华特果实硬度约为0.2 kg,显著低于红阳果实硬度(图1)。两种贮藏温度下,红阳猕猴桃果实硬度均在贮藏前期快速下降,随后缓慢下降;25 ℃贮藏时,华特果实硬度呈缓慢下降趋势,4 ℃贮藏时,华特果实硬度在贮藏7 d时呈现轻微上升趋势,随后呈缓慢下降趋势。25 ℃条件下,红阳和华特果实可分别可贮藏15和18 d;4 ℃条件下,红阳和华特果实可分别贮藏42和28 d。贮藏0 d时,华特果实可溶性固形物含量显著高于红阳,而贮藏末期显著低于红阳。25 ℃贮藏下,红阳猕猴桃果实可溶性固形物含量在贮藏前期快速增加,后期缓慢增加;华特果实可溶性固形物含量随贮藏天数的增加呈缓慢上升趋势。相对于25 ℃贮藏,4 ℃条件下,两品种果实可溶性固形物含量均呈缓慢上升趋势。
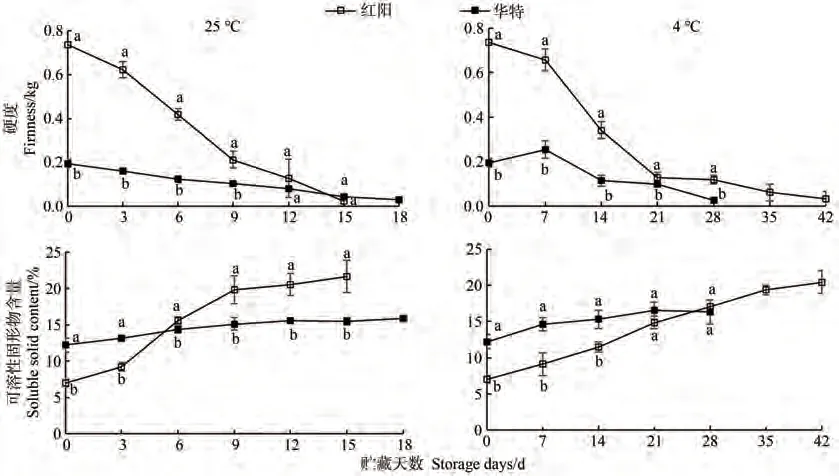
图1 猕猴桃果实贮藏期间硬度和可溶性固形物含量的变化Fig.1 Changes of fruit firmness and soluble solid content during storage of kiwifruit
2.2 猕猴桃果实半纤维素和纤维素含量的变化
半纤维素(hemicellulose, HCL)和纤维素(cellulose,CL)是细胞主要的骨架物质,与果实硬度密切相关。由图2可知,采收时,红阳的HCL和CL含量显著高于华特。不同贮藏条件下,随着贮藏天数的增加,红阳的HCL和CL含量均呈下降趋势,且均在贮藏前期快速下降,而后缓慢降低,而华特的HCL和CL含量在整个贮藏过程中下降缓慢。25 ℃贮藏后期,华特的CL含量显著高于红阳。4 ℃贮藏条件下,红阳的HCL和CL含量始终显著高于华特。相关性分析表明,两种贮藏温度下,红阳果实硬度与HCL和CL含量呈极显著正相关;华特果实硬度与HCL和CL含量仅在25 ℃贮藏条件下呈极显著正相关(表1)。
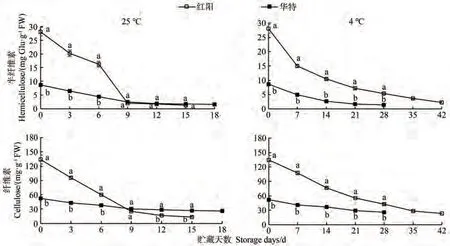
图2 猕猴桃果实贮藏期间半纤维素和纤维素含量的变化Fig.2 Changes of hemicellulose and cellulose contents during storage of kiwifruit
2.3 猕猴桃果实果胶含量的变化
果胶是植物细胞壁的初生壁和中胶层的主要成分,果胶物质含量及成分的变化是影响果实硬度的关键因素之一[11]。由图3可知,贮藏0 d时,红阳果实水溶性果胶(water soluble pectin, WSP)含量显著低于华特,而离子型果胶(ironic soluble pectin, ISP)和共价结合型果胶(covalent soluble pectin, CSP)含量显著高于华特。两种贮藏温度下,红阳果实WSP含量在贮藏前期快速增加,随后缓慢增加;CSP含量在贮藏前期快速减少,随后缓慢减少。华特WSP和CSP含量相对稳定,且WSP含量始终显著高于红阳。两品种果实ISP含量均呈现先增加后减少再增加的波动变化趋势。4 ℃贮藏条件下,红阳ISP含量始终显著高于华特。相关性分析表明,两种贮藏条件下,两品种猕猴桃果实硬度与WSP和CSP含量均存在显著或极显著相关性,但与ISP含量相关性不显著(表1)。
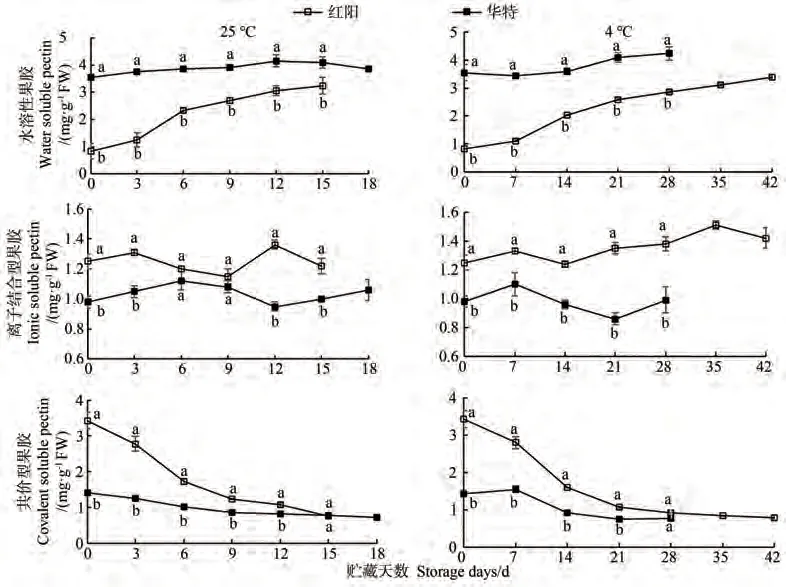
图3 猕猴桃果实贮藏期间果胶含量的变化Fig.3 Changes of pectin content during storage of kiwifruit
2.4 猕猴桃果实果胶降解酶活性的变化
果胶降解与果胶甲酯酶(pectin methylesterase, PME)、内切多聚半乳糖醛酸酶(endo-polygalacturonase, PG)和果胶酸裂解酶(pectate lyase, PL)等活性紧密相关[3]。25 ℃贮藏下,红阳PME活性在贮藏3 d后不断增加直至贮藏结束;华特PME活性在贮藏6 d时达到最低值,随后缓慢增加,但活性始终显著低于红阳(图4);红阳果实PME活性与硬度、WSP和CSP组分含量均达显著相关水平,而在华特果实中的相关性均不显著(表1)。4 ℃贮藏下,红阳PME活性在贮藏7 d时便高达采收时的2.6倍,在贮藏后期有所降低;华特PME活性在贮藏前期缓慢增加,在贮藏21 d时达到峰值。4 ℃贮藏时两品种猕猴桃果实PME活性较25 ℃贮藏时有所提高。相关性分析结果表明,4 ℃贮藏下的华特果实PME活性与CSP、HCL和CL组分含量均呈显著负相关,而在红阳果实中均不显著(表1)。在两种贮藏温度下,红阳PG活性变化幅度相对较小,活性高峰不明显。25 ℃贮藏下,华特PG活性变化趋势与PME活性变化趋势较一致;4℃贮藏21 d时,华特PG活性显著高于红阳,低温抑制了贮藏后期PG活性的上升。PL作用于去甲酯化后的半乳糖醛酸聚糖,催化产生不饱和寡聚半乳糖醛酸。25 ℃贮藏时,两品种PL活性变化趋势相似,在贮藏前9 d,华特PL活性显著低于红阳,但4 ℃贮藏时,除0 d以外,华特PL活性总体高于红阳。相关性分析表明,仅在25 ℃贮藏时,华特果实PL活性与WSP、CSP、HCL和CL组分含量呈显著相关性,而在红阳果实中均不显著(表1)。
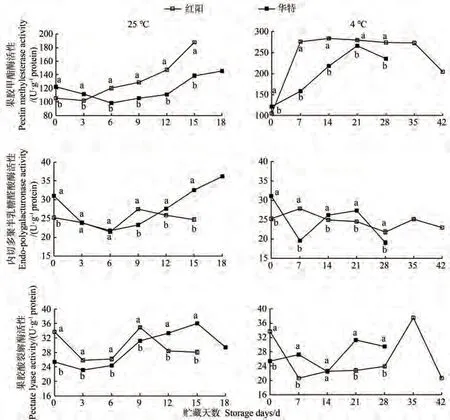
图4 猕猴桃果实贮藏期间果胶甲酯酶、多聚半乳糖醛酸酶和果胶酸裂解酶活性变化Fig.4 Changes of PME, PG and PL activities during storage of kiwifruit
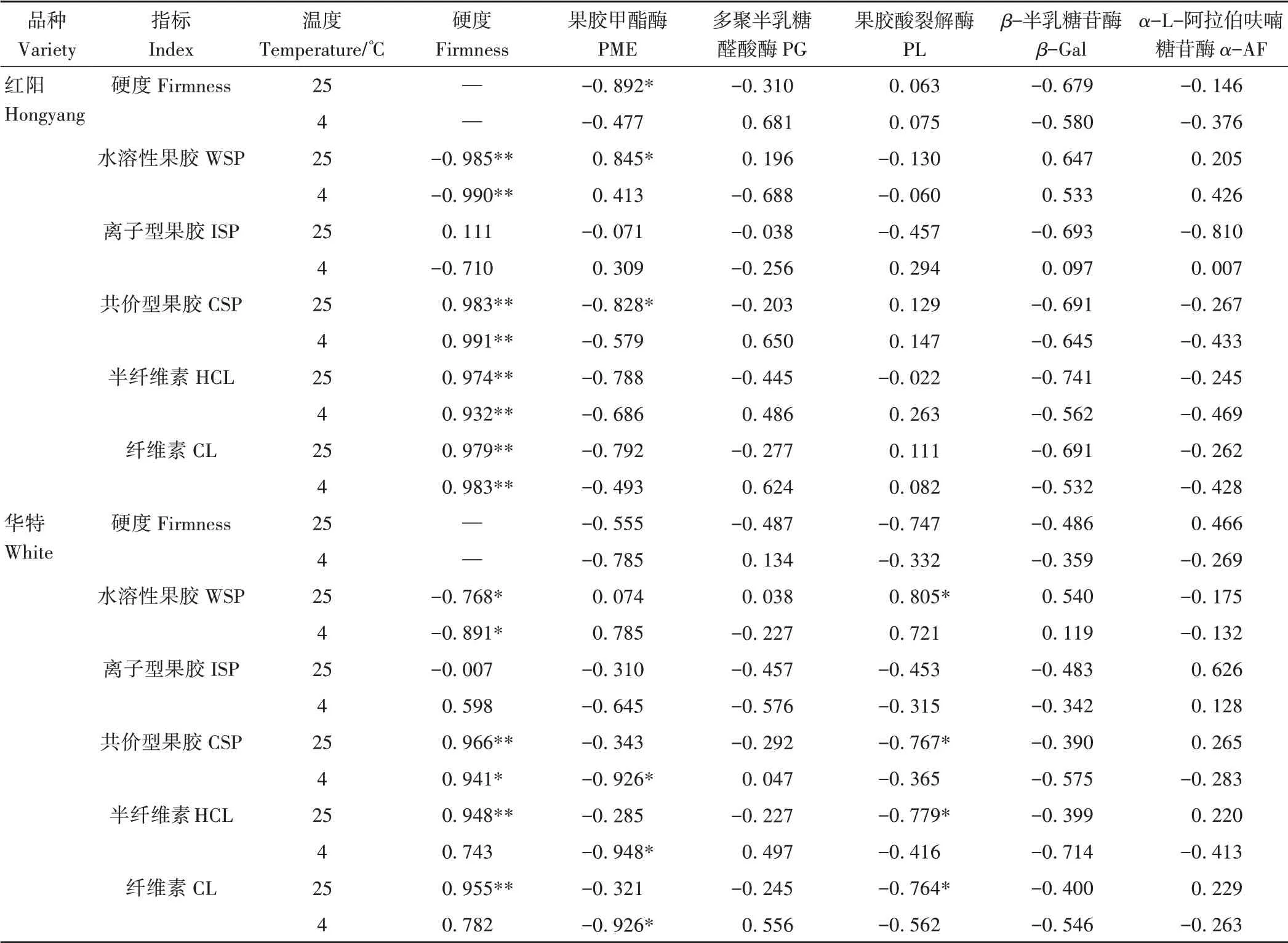
表1 猕猴桃果实硬度、细胞壁组分和果胶降解酶活性之间的相关性分析Table 1 Correlation analysis between firmness, cell wall fractions and pectin-degrading enzymes in kiwifruit fruit
β-半乳糖苷酶(β-galactosidase,β-Gal)和α-L-阿拉伯呋喃糖苷酶(α-L-arabinofuranosidase,α-AF)是两种主要的糖苷酶,能分别水解果胶毛发区和半纤维素上的β-半乳糖和α-阿拉伯呋喃糖。25 ℃贮藏条件下,红阳和华特果实β-Gal活性分别于贮藏9和15 d时达到峰值,且贮藏前12 d,华特果实β-Gal活性显著低于红阳(图5)。相比之下,两品种α-AF活性变化趋势较为一致,且均在贮藏9 d时出现活性高峰。4 ℃贮藏下,β-Gal和α-AF活性变化较为一致,均随贮藏天数的增加呈上升-下降-上升的波动变化。相关性分析结果显示,β-Gal和α-AF活性与硬度和各细胞壁多糖组分含量均无显著相关性(表1)。
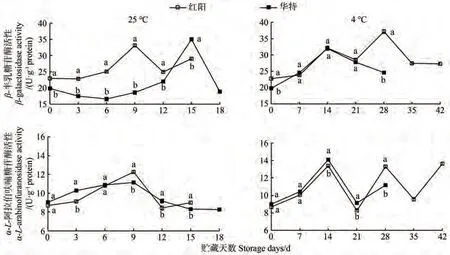
图5 猕猴桃果实贮藏期间β-半乳糖苷酶和α-阿拉伯呋喃糖苷酶活性变化Fig.5 Changes of β-Gal and α-AF activities during storage of kiwifruit
2.5 猕猴桃果实细胞显微结构变化
采收期,华特表皮细胞层数(6层)为红阳(2层)的3倍。华特果肉细胞呈椭圆形,排列紧密,且表皮细胞过渡到果肉细胞是细胞体积逐渐增大的过程。红阳果肉细胞形态不规则,排列松散(图6-I)。可食期,红阳和华特果肉细胞体积增大,细胞壁染色程度降低,部分细胞破裂,红阳近表皮细胞处出现小空腔(图6-Ⅱ)。过熟期,红阳和华特果肉细胞大量破裂,红阳近表皮细胞处出现较大空腔(图6-Ⅲ)。此外,切片结果发现,红阳和华特果肉组织均含有针晶束(草酸钙),但红阳针晶束含量较少(结果未显示),而华特针晶束数量较多(图7)。
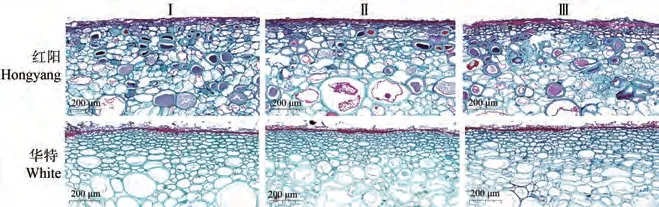
图6 猕猴桃果实贮藏期间细胞显微结构变化比较Fig.6 Comparison of cell microstructure changes during storage of kiwifruit
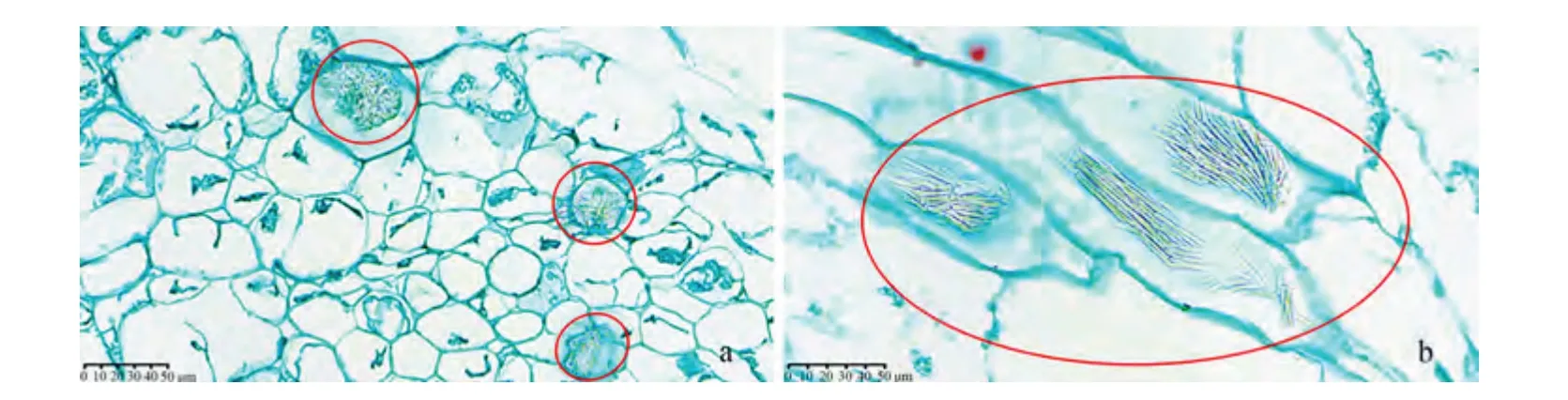
图7 华特果实贮藏期间针晶束分布图Fig.7 Distribution of needle-crystal bundles of White fruits during storage
2.6 猕猴桃果实钙组分含量变化
切片结果显示华特果实含有较多的草酸钙,因此进一步检测两品种果实中的钙含量。果肉样品用去离子水、氯化钠、醋酸以及盐酸逐级提取分别得到水溶钙、果胶钙、磷酸钙和草酸钙。由图8可知,红阳和华特猕猴桃果实中的钙均以水溶钙为主,其次为磷酸钙和果胶钙,草酸钙含量最低。3个取样时期下,华特4种钙组分含量均显著或极显著高于红阳。
3 讨论
植物细胞壁主要由多糖类的纤维素、半纤维素、果胶及少量的糖基蛋白组成[12-15]。细胞壁组分及结构的变化是导致猕猴桃果实软化的关键因素。本试验中,两猕猴桃品种果实贮藏过程中,细胞壁组分发生不同程度的降解,红阳猕猴桃各细胞壁多糖组分含量变化速度较快。采收时,红阳HCL、CL、CSP和ISP含量显著高于华特,WSP含量显著低于华特。在25和4 ℃贮藏下,红阳和华特猕猴桃果实HCL、CL和CSP含量呈降低趋势,WSP含量呈上升趋势,ISP含量相对稳定,这与前人研究结果类似[16]。高萌等[11]研究发现, 在整个贮藏期间,较不耐贮藏的徐香WSP含量极显著高于耐贮藏的海沃德。而本研究发现,华特WSP含量始终显著高于红阳,但其变化幅度较小且更平缓。可见,猕猴桃WSP的含量及其稳定性均可影响果实耐贮性。相关性分析结果显示,两品种猕猴桃果实硬度与WSP含量呈显著负相关,与CSP、HCL、CL含量呈显著正相关,说明猕猴桃果实软化与细胞壁多糖物质的降解紧密相关。
果实软化过程中,细胞壁聚合物的解体和中胶层的溶解主要由细胞壁降解酶或蛋白质协同促进,该过程涉及多个细胞壁结构相关基因[17-18]。果胶是结构最复杂的植物细胞壁多糖,在细胞与细胞间的黏附中具有重要作用。果胶聚合物在果实成熟过程中的降解是几种果胶代谢酶共同作用的结果[19-20]。高萌等[11]研究发现,较不耐贮藏的徐香猕猴桃PG、PME和β-Gal活性高于耐贮藏的海沃德。匡盛[21]也发现红阳猕猴桃PG和β-Gal活性高于耐贮藏的海沃德。本研究发现,25 ℃贮藏前期,红阳猕猴桃PL和β-Gal活性显著高于华特;贮藏中后期,红阳PME活性显著高于华特。这些酶活性的差异可能是华特果实WSP和CSP含量变化速度较慢、变化幅度较小且在25 ℃时贮藏性优于红阳的原因之一。4 ℃贮藏时,除0 d以外,华特PL活性总体高于红阳,华特β-Gal活性较25 ℃贮藏有所提高,在贮藏中期与红阳无显著差异。这些酶活性的变化可能在一定程度上削弱了华特耐贮性的优势。相关性分析表明,25 ℃贮藏时,与红阳和华特果实软化显著相关的果胶降解酶分别是PME和PL;4 ℃贮藏时,与华特果实软化显著相关的果胶降解酶是PME。大量研究表明,不同果胶降解酶在不同物种果实软化中的作用不同。抑制番茄中的PG活性并不能显著延缓转基因果实的软化进程[22],而抑制草莓和苹果中的PG酶基因表达却能显著提高果实硬度,延长果实货架期[23-24]。目前,在物种间造成这种差异的原因仍然未知。
果实耐贮性与果实细胞的结构密切相关。海沃德表皮细胞层数大于徐香,果肉细胞的形变程度小于徐香,均是其耐贮性较好的原因[11]。本研究结果显示,25 ℃贮藏期间,华特表皮细胞层数更多,果肉细胞形状更规则、排列更紧密也可能是其较耐贮的原因。此外,果皮表皮毛及角质层的厚度也影响果实的耐贮性[11]。本研究中,两品种果皮角质层无明显差异,但华特果实表皮毛对其贮藏性可能有积极作用。对两猕猴桃品种果实不同形态钙含量进行测定,发现华特果实的水溶钙、果胶钙、磷酸钙和草酸钙含量均显著高于红阳。果胶钙的形成可增加细胞壁刚性,有助于膜系统的稳定和细胞膨压的改善[25-26],草酸钙晶体具有组织支持作用[27]。华特耐贮性强可能与其高含量的果胶钙和草酸钙等钙组分有关。相关研究表明,在幼果期喷钙可有效提高黄金梨果肉中各钙组分的含量,有效提升贮藏性能[28-29]。采前喷施糖醇螯合钙可有效提高猕猴桃果实钙含量和贮藏性能[30-31]。因此,不耐贮的猕猴桃品种可通过采前适量喷钙来增加果实中钙组分的含量,从而增强其耐贮性。
4 结论
本研究结果表明,猕猴桃果实软化与细胞壁多糖物质的降解显著相关。红阳猕猴桃各细胞壁多糖组分含量变化速度较快。4 ℃低温贮藏可减缓红阳和华特果实细胞壁多糖物质的降解速度,延长其贮藏期限。25 ℃贮藏前期,红阳猕猴桃PL和β-Gal活性显著高于华特,贮藏中后期,PME活性显著高于华特;25 ℃贮藏期间,华特果实表皮细胞层数更多,果肉细胞排列更紧密,果实钙组分含量更高,均可增强华特猕猴桃的耐贮性。4 ℃贮藏前期,红阳β-Gal活性与华特无显著差异,而PL活性则低于华特,是低温贮藏时华特猕猴桃相对不耐贮的原因之一。

