壮药净癣洗剂质量标准研究
韦振源,龚敏阳,钟 江,杨正腾,陈 朝,吴 霜,马家宝,黄 庆
(广西中医药大学第一附属医院,广西 南宁 530023)
壮药净癣洗剂是广西中医药大学第一附属医院皮肤科钟江教授治疗足癣、手癣、头癣、体癣的经验方,其临床疗效良好,且无明显不良反应[1]。净癣洗剂由土荆皮、功劳木、蛇床子、白鲜皮、地肤子、苦参、广藿香等中药组成,具有清热解毒、消炎止痛、消肿杀虫止痒等功效;尤其是在皮肤病渗出期不宜使用外用药膏阶段,可使用净癣洗剂收敛杀菌,提高临床治愈率。为保证临床安全用药,本实验采用薄层色谱法鉴别处方中功劳木、苦参中药材,并采用高效液相色谱法对苦参碱进行含量测定,现报道如下。
1 实验材料
1.1 仪器YOKO-CS紫外线透射反射成像仪(武汉药科新技术开发有限公司);LC-20AT高效液相色谱仪(日本岛津公司);GH-252电子分析天平(日本A&D公司);CD-UPT超纯水机(成都越纯科技有限公司);KQ5200DB超声波清洗机(昆山市超声仪器有限公司);pHS-3E pH计(上海仪电科学仪器股份有限公司);HH-2水浴锅(金坛市科研仪器有限公司);G型薄层层析硅胶板(规格为20cm×20cm,青岛海洋工厂);毛细管(国药控投有限公司)。
1.2 试剂和对照品功劳木对照药材(批号:121461-201503)、盐酸小檗碱(批号:110713-201212)、苦参对照药材(批号:121019-201006)、苦参碱对照品(批号:110805-200508,供含量测定用)均由中国食品药品检定研究院提供;乙腈(色谱纯,国药集团化学试剂有限公司);甲醇(分析纯,西陇科学股份有限公司);磷酸(色谱纯,上海展云化工有限公司);三乙胺(色谱纯,成都市科隆化学品有限公司);三氯甲烷(分析纯,成都市科隆化学品有限公司);浓氨水(分析纯,西陇科学股份有限公司);纯化水为实验室自制。
1.3 样品净癣洗剂(批号:20191110、20191202、20191226)及阴性样品均由广西中医药大学第一附属医院制剂室制备。
2 方法与结果
2.1 功劳木的薄层鉴别[2]
2.1.1 对照品溶液的制备取功劳木对照药材0.1 g,加10 ml甲醇超声处理15 min,滤过,蒸干,残渣加甲醇1 ml使溶解,作为对照药材溶液。另取盐酸小檗碱对照品,加甲醇制成每1 ml含0.2 mg的溶液,作为对照品溶液。
2.1.2 供试品溶液的制备取净癣洗剂10 ml,置宽口锥形瓶中,蒸干,残渣加甲醇10 ml,超声处理15 min,滤过,滤液蒸干,残渣加甲醇1 ml使溶解,作为供试品溶液。
2.1.3 缺功劳木阴性溶液的制备取缺功劳木药材制成的阴性样品10 ml,同2.1.2项供试品溶液制备方法制成阴性对照溶液。
2.1.4 薄层层析照薄层色谱法(《中华人民共和国药典》2015年版四部通则0502)试验,分别吸取供试品溶液、阴性对照溶液各2 μl,对照品溶液、对照药材溶液各1 μl,分别点于同一硅胶G薄层板上,以正丁醇-冰醋酸-水(7∶1∶2)为展开剂,展开,展距约8.0 cm,取出,晾干,紫外灯(365 nm)下检视。供试品色谱中,在与对照药材和对照品色谱相应的位置上,显相同颜色的斑点,而阴性无此斑点。结果见图1。

图1 功劳木薄层色谱图
2.2 苦参的薄层鉴别[2]
2.2.1 对照品溶液的制备取苦参对照药材0.2 g,置磨口锥形瓶中,加25 ml氯仿、0.3 ml浓氨水,超声处理15 min,滤过,蒸干,残渣加氯仿1 ml使溶解,制成对照药材溶液。另取苦参碱对照品,加乙醇制成每1 ml含0.2 mg的溶液,作为对照品溶液。
2.2.2 供试品溶液的制备取净癣洗剂5 ml,置磨口锥形瓶中,蒸干,残渣加25 ml氯仿、0.3 ml浓氨水,超声处理15 min,放置过夜,滤过,滤液蒸干,残渣加氯仿1 ml使溶解,作为供试品溶液。
2.2.3 缺苦参阴性溶液的制备取缺苦参药材制成的阴性样品5 ml,同2.2.2项供试品溶液制备方法制成阴性对照溶液。
2.2.4 薄层层析照薄层色谱法(《中华人民共和国药典》2015年版四部通则0502)试验,分别吸取供试品溶液、阴性对照溶液各2 μl,对照药材溶液5 μl、对照品溶液3 μl,点于同一硅胶G薄层板上,以甲苯-丙酮-甲醇(8∶3∶0.5)为展开剂,展开,展距8 cm,取出,晾干,再以甲苯-乙酸乙酯-甲醇-水(2∶4∶2∶1)10℃以下放置的上层溶液为展开剂,展开,展距8 cm,取出,晾干,依次喷以碘化铋钾试液和亚硝酸钠乙醇试液。供试品色谱中,在与对照药材和对照品色谱相应的位置上,显相同的橙色斑点,而阴性无此斑点。结果见图2。
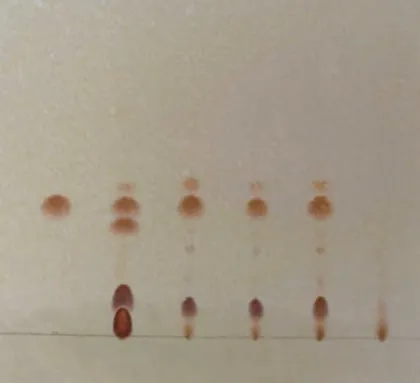
图2 苦参薄层色谱图
2.3 苦参碱的含量测定参照文献[3]方法,采用高效液相色谱法对苦参中苦参碱进行定量测定。
2.3.1 色谱条件色谱柱:Inertsil ODS-3柱(4.6 mm×250 mm,5 μm);流动相:乙腈-0.1%磷酸溶液(10∶90),用三乙胺调pH值至6.5;流速:1.0 ml/min;柱温:30℃;进样量:10 μl;检测波长:220 nm;理论塔板数以苦参碱峰计算不小于4 000;苦参碱分离度大于1.5。
2.3.2 对照品溶液的制备精密称定苦参碱对照品5 mg,加入甲醇溶解并定容至10 ml容量瓶中,摇匀,制成每1 ml含0.5 mg苦参碱的对照品溶液。
2.3.3 供试品溶液的制备精密量取净癣洗剂5 ml,转移至分液漏斗,加入2 ml浓氨水,轻轻摇匀。用氯仿提取3次,每次10 ml,收集3次氯仿液,于60℃水浴锅上蒸干,将得到的残渣先加入适量的甲醇溶解,再转移定容至50 ml容量瓶中,摇匀,0.22 μm微孔滤膜滤过,取续滤液,即得。
2.3.4 阴性对照溶液的制备按处方称取除苦参以外的各味药材,并参考“2.3.3”项下的方法制成阴性对照溶液。
2.3.5 专属性试验分别精密吸取对照品溶液、供试品溶液、阴性对照溶液各10 μl,注入高效液相色谱仪测定,记录色谱图。对照品溶液中苦参碱色谱峰的保留时间为20.574 min,在供试品溶液中,苦参碱色谱峰保留时间为20.012 min,两者出峰时间对应。而阴性对照品中在对应的保留时间无色谱峰吸收,表明阴性样品对测定无干扰。结果见图3。

图3 HPLC色谱图
2.3.6 线性关系考察精密吸取上述对照品溶液,按“2.3.1”项下色谱条件,分别进样2 μl、4 μl、6 μl、8 μl、10 μl、12 μl、14 μl、16 μl、20 μl,测定相应的峰面积值,并记录下来。以苦参碱进样量(X,μg)为横坐标,峰面积(Y)为纵坐标,绘制标准曲线,得到回归方程为Y=74 133X-5 914.7(r2=0.999 7)。结果表明,苦参碱的进样量在1~10 μg范围内与峰面积呈良好线性关系。
2.3.7 精密度试验精密吸取苦参碱对照品溶液(0.5 mg/ml)10 μl,按“2.3.1”项下色谱条件连续进样6次,并记录峰面积值,以峰面积计算苦参碱的RSD为1.73%(n=6)。结果表明仪器精密度良好。
2.3.8 稳定性试验选取同一供试品溶液(批号为20191108),分别于0 h、2 h、4 h、8 h、12 h、24 h进样测定,并记录峰面积值,结果苦参碱的峰面积RSD为1.40%(n=6),表明供试品溶液中苦参碱在24 h内基本稳定。
2.3.9 重复性试验选取净癣洗剂(批号为20191108)1份,按“2.3.3”项下方法平行制备成6份供试品溶液,再按“2.3.1”项下的色谱条件分别进样测定,记录峰面积值。结果苦参碱含量分别为:16.368 6 mg/ml、16.297 6 mg/ml、15.711 0 mg/ml、16.096 9 mg/ml、16.345 0 mg/ml、16.568 2 mg/ml,平均值为16.23 mg/ml,RSD为1.87%(n=6),表明该方法重复性良好。
2.3.10 加样回收率试验精密量取已知含量的样品(批号为20191108,浓度为16.23 mg/ml)5 ml,共6份,再精密加入22.6 mg/ml的苦参碱对照品1.0 ml,按“2.3.3”项下方法制备成6份供试品溶液,分别按“2.3.1”项下色谱条件进样,记录峰面积值,计算加样回收率。结果平均回收率为100.77%,RSD为0.60%(n=6),表明该方法准确度较好。结果见表1。
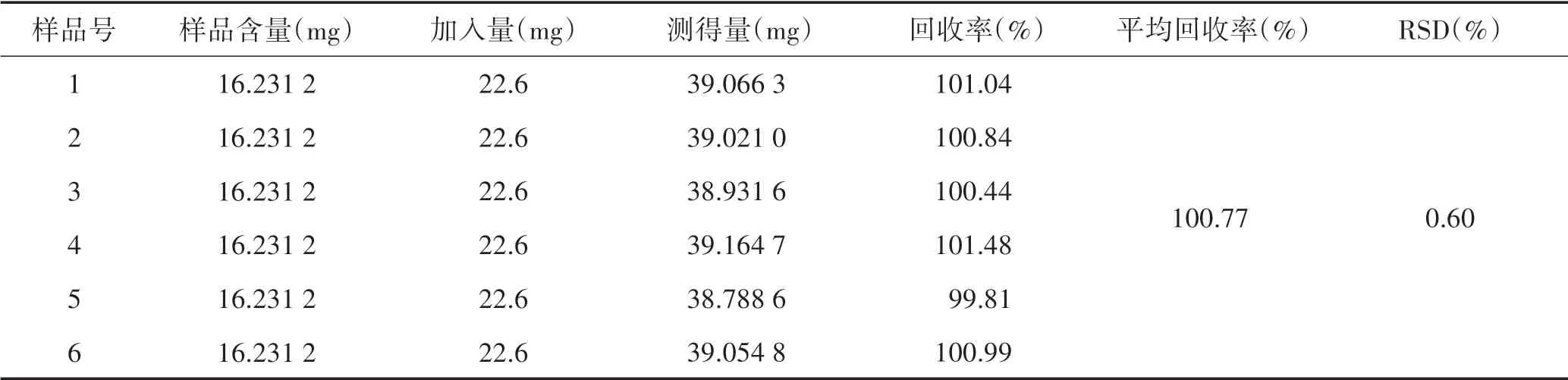
表1 加样回收率试验结果 (n=6)
2.3.11 样品含量测定取3批不同批次的净癣洗剂,每批各取3份,按“2.3.3”项下方法制备供试品溶液,按“2.3.1”项下色谱条件进样,进行含量测定。结果见表2。

表2 样品含量测定结果 (n=3)
3 讨论与小结
3.1 检测波长的考察通过查阅《中华人民共和国药典》2015版一部[4]203和相关文献[5]记载,苦参碱在215~225 nm处有较大的吸收峰,为保证得到较好的检测结果,故本次实验中选择220 nm作为检测波长。
3.2 供试品提取方法的考察绝大多数的生物碱在水中的溶解度几乎为0,但在一些有机溶剂中有着较高的溶解度。在本实验的供试品制备中,经查阅有关文献[6-7],比较了乙醚与氯仿对苦参碱提取效果的影响,最终的实验结果表明:使用氯仿的提取效果更佳,可较大程度地提取其中的有效成分,且相应色谱峰无干扰杂质,分离度较好。
3.3 流动相的考察在使用苦参碱对照品进行预实验中,对甲醇-水-三乙胺(50∶50∶0.05)[6]、乙腈-甲醇-磷酸盐缓冲液(pH=6.8)-三乙胺(22∶22∶70∶0.1)[8]等多种流动相进行考察,结果发现基线不稳定,苦参碱色谱峰分离度和峰形较差,有拖尾现象,对峰面积值的数据准确性有影响,随后选用乙腈-0.1%磷酸溶液(用三乙胺调pH值至7.6)[4]895。通过调整流动相乙腈-0.1%磷酸溶液的组成比例(10∶90、20∶80、25∶75、30∶70),发现当乙腈的组成比例增加时,苦参碱的出峰时间也随之变短(分别为25.945 min、17.463 min、12.589 min、8.649 min),考虑到后期需通过调节流动相的pH值来改善峰形,为得到合适的保留时间,故选择乙腈-0.1%磷酸溶液的组成比例为10∶90。在对0.1%磷酸溶液的pH值进行优化时,发现流动相在pH=6.5时,苦参碱色谱峰与溶剂峰分离度好,无干扰,保留时间适中,且拖尾现象得到改善。
3.4 误差分析从本次实验数据来看,苦参碱的保留时间不完全一致对应,有较大的误差。有可能是因为流动相中的0.1%磷酸溶液(用三乙胺调pH值至6.5)为实验人员自行配制,存在过滤不全、流动相不均匀等问题,从而导致保留时间的提前或延后。
3.5 小结本文采用薄层色谱法,以专属性好的对照品及对照药材为对照,对功劳木、苦参进行定性鉴别研究。实验结果表明,各供试品色谱中,在与对照品及对照药材相应的色谱位置上有相同橙黄色的荧光斑点,相应药材空白对照无干扰,专属性良好。在含量测定项中,建立了HPLC法测定净癣洗剂中苦参碱总含量的方法,通过方法学考察和含量测定,提示该方法可行性强、操作简单、准确可靠,可为净癣洗剂质量标准的制定和深入研究提供参考依据。

