非洲猪瘟病毒I226R蛋白原核表达及检测I226R抗体间接ELISA方法的建立
柯军男,张国军,岳慧贤,张艳艳,齐 宇,蒋依倩,陈 腾,李 影,扈荣良*
(1.吉林农业大学 动物医学学院,吉林 长春 130118;2.吉林大学 动物医学学院 人兽共患病研究教育部重点实验室,吉林 长春 130062;3.中国农业科学院 长春兽医研究所,吉林 长春 130122)
非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒(African swine fever virus,ASFV)引起猪的一种接触性传染的急性、热性、高度致死性传染病,给世界生猪养殖业造成了巨大经济损失,被世界动物卫生组织(OIE)列入须通报的动物疫病[1]。ASF于1921年在肯尼亚首次被发现,随后传播到欧洲、美洲和亚洲其他国家[2]。该病2007年第2次跨大陆传播到格鲁吉亚,之后迅速传播到俄罗斯等国,并继续在这些地区传播[3-4]。2018年8月,ASF在我国首次暴发[5-6]。随后,在不到2年的时间里,迅速传播到我国多个省份,给养猪业造成严重经济损失。
为了防控本病,自20世纪60年代后期以来,全球科学家一直在努力开发一种有效且安全的疫苗来保护猪免受 ASFV 感染[7-9]。然而,由于ASFV结构复杂,对病毒蛋白功能了解有限,目前世界尚未有可靠安全的商业化疫苗[10]。
本实验室构建了缺失I226R基因的SY18△I226R减毒株,在接种后用致死剂量的ASFV SY18毒株攻击,免疫的家猪均能达到100%保护,可以作为ASF疫苗候选株[11]。为了区别ASFV其他毒株和SY18△I226R减毒株,以便针对性检测猪体内的I226R抗体,本试验拟建立了以原核表达的重组蛋白pI226R作为包被抗原,检测猪血清中I226R抗体的间接ELISA方法。
1 材料与方法
1.1 菌株和载体大肠埃希菌DH5α感受态细胞、BL21(DE3)感受态细胞、原核表达载体pET-32a均购自宝生物工程(大连)有限公司。
1.2 猪原代肺泡巨噬细胞(primary alveolar macrophages,PAM)的制备取新鲜无菌无猪源性病毒(猪繁殖与呼吸综合征病毒、流行性腹泻病毒、猪细小病毒、经典猪瘟病毒、猪圆环病毒、猪伪狂犬病毒和ASFV)污染的家猪肺脏组织,使用止血钳或棉线结扎喉头下方及主动脉,在生物安全柜中经喉管灌入灭菌PBS,至各肺叶全部隆起,轻拍表面 3~5 min 后,倒出灌洗液,收集于灭菌瓶中;重复3 次,收集第 2、3 次肺泡灌洗液;使用细胞滤器过滤收集灌洗液,将过滤后的细胞液收集至50 mL 离心管中,1 500 r/min离心 5 min;弃上清,将多管细胞富集于1管,加入细胞清洗液重悬,1 500 r/min 离心5 min;弃上清,使用3~5 倍体积的红细胞裂解液吹悬细胞,再加入细胞清洗液至总体积40 mL,终止裂解,1 500 r/min离心5 min;重复此步骤2~3 次至红细胞充分裂解。完成裂解后,使用40 mL的细胞清洗液重悬细胞,1 500 r/min 离心 5 min,重复清洗1~2 次。完成最后一次清洗后,弃去上清,使用配制好的原代细胞培养基重悬细胞,取混好的细胞液进细胞计数仪计数。
1.3 病毒ASFV SY18毒株由军事科学院军事医学研究院军事兽医研究所于2018年8月在沈阳某猪场病死猪中分离,在P3实验室-80℃冰箱中保存。
1.5 主要设备高电流电泳仪购自北京六一生物科技有限公司;凝胶成像仪和化学发光成像仪购自上海天能生命科学有限公司;吸收光酶标仪购自美国Bio-Rad公司。
1.6 试验动物2月龄雌性新西兰大白兔购自辽宁长生生物技术股份有限公司。
1.7 ASFVI226R基因扩增根据ASFV SY18毒株(登录号:MH766894)中I226R基因序列和原核表达载体pET-32a(+)的XhoⅠ、NdeⅠ酶切位点设计引物,引物序列见表1,引物由吉林省库美生物科技有限公司合成。以ASFV SY18毒株的基因组DNA为模板,用引物I226R-F、I226R-R扩增I226R基因。PCR扩增参数:预变性98℃ 1 min;98℃ 10 s,56℃ 20 s,72℃ 10 s,进行35个循环;最后延伸72℃ 7 min。PCR扩增产物经1.0%琼脂糖凝胶电泳检测正确后,按AxyPrep DNA凝胶回收试剂盒的说明书对其进行回收纯化。

表1 I226R 基因扩增引物序列
1.8I226R基因原核表达载体的构建将1.7中的产物用限制性内切酶NdeⅠ和XhoⅠ进行双酶切,回收相应片段。根据T4DNA连接酶的操作说明,将pET-32a(+)和I226R酶切后的片段在16℃ 金属恒温仪中连接过夜,连接产物转化DH5α感受态细胞,涂布到LB培养板过夜培养。挑选单菌落在LB培养基中于37℃、200 r/min扩大培养,经PCR鉴定的阳性克隆菌液进一步进行测序鉴定,将阳性克隆菌提取的重组质粒命名为pET-32a-I226R。
1.9 pI226R蛋白诱导表达、可溶性分析及纯化将pET-32a-I226R质粒和pET-32a(+)空载体质粒分别转化BL21(DE3)感受态细胞,在LB平板上过夜培养。分别挑取单菌落过夜培养后取200 μL菌液转接到5 mL LB液体培养基中,待培养至D600 nm值为0.6~0.8时,加入IPTG至终浓度为1 μmol/L,而后分别在培养到2,4 h时,收集菌体进行SDS-PAGE电泳分析。
按照以上摸索诱导表达条件诱导20 mL菌液,收集菌体加入2 mL的PBS重悬后超声破碎至菌液清澈透明,离心收集沉淀和上清液进行SDS-PAGE电泳分析。重新诱导菌液500 mL后离心收集菌体,加入含8 mol/L尿素的平衡缓冲液重悬后超声破碎30 min,离心取上清加入处理好的镍柱中结合4 h;待镍柱中的液体自然流出后依次用10,20,30 mmol/L 咪唑缓冲液对杂蛋白进行洗脱,最后用200,500 mmol/L咪唑缓冲液分别洗脱3次目的蛋白,将纯化后的蛋白进行SDS-PAGE电泳,分析结果。
1.10 重组蛋白的反应原性鉴定重组蛋白样品进行SDS-PAGE电泳后,将目的蛋白用半干法转印至NC膜,用TBST(含5%脱脂奶粉溶液)37℃封闭2.5 h;TBST洗3 次(10 min/次),一抗用TBST稀释的ASFV阳性血清(1∶500)4℃过夜孵育;TBST洗3 次(10 min/次),二抗用TBST稀释的HRP标记山羊抗猪IgG(1∶12 000)室温孵育1 h;TBST洗3 次(10 min/次),将HRP化学发光底物A液与B液以1∶1比例分别加100 μL于1.5 mL EP管中混匀,在暗盒中滴加在NC膜涂匀后充分结合1 min,然后用全自动化学发光图像分析设备进行拍照分析。
在水库水产养殖过程中,浮游动物的物种组成,数量,生物量及浮游动物多样性指数与水体营养状态密切相关,因此,调查研究水域中浮游动物组成,具有重要的生态和经济意义[1]。如今利用浮游动物群落结构特征的变化监测和评价河流、湖泊等水体污染程度和自净作用,在国内外应用较为广泛[2]。有关汾河二库的浮游动物类群研究报道极少。本文调查研究了春、夏季汾河二库浮游动物群落特征,并结合汾河二库多样性指数H、综合营养状态指数(TLI)及浮游动物生物量对汾河二库水质进行了分析研究,旨在为汾河二库水环境评价与保护、渔业资源合理利用和可持续发展提供理论依据。
1.11 兔抗pI226R多克隆抗体的制备和鉴定用纯化后的蛋白免疫新西兰白兔,制备兔抗pI226R蛋白多抗。第1次免疫将700 μg重组蛋白与弗氏完全佐剂按1∶1剂量混合并充分乳化,采用皮下注射的方法免疫白兔。首免后间隔14 d进行二免,将500 μg重组蛋白与弗氏不完全佐剂按1∶1剂量混合并充分乳化后免疫白兔。二免后间隔14 d进行三免,将500 μg重组蛋白与弗氏不完全佐剂乳化后免疫白兔。三免后10 d,耳缘静脉采血,将血液经37℃静置1 h后4℃静置过夜,8 000 r/min离心10 min 分离血清,于-80℃保存备用。利用Western blot方法和间接免疫荧光方法鉴定该多克隆抗体。
1.12 基于pI226R蛋白的间接ELISA方法的建立采用方阵滴定法,来确定最佳抗原包被质量浓度和最佳血清稀释度。纯化后用0.1 mol/L 碳酸钠-碳酸氢钠缓冲液(pH9.6)分别将抗原蛋白稀释至质量浓度为1.0,2.5,5.0,10.0 g/L。并用此不同包被质量浓度的包被液包被在酶标板,每孔加100 μL,每个质量浓度重复2孔,4℃过夜包被;使用 PBST 溶液洗涤3 次,每孔加入300 μL封闭液(5%脱脂奶粉的PBST),置于37℃温箱封闭2 h;使用 PBST 溶液洗涤3 次,用抗体稀释液(加入1%BSA的PBST)分别以样品∶抗体稀释液=1∶100,1∶200,1∶500,1∶1 000的比例稀释ASF阳性猪血清和阴性猪血清样品,每孔100 μL,每个稀释度重复2孔,25℃孵育1 h;使用 PBST 溶液洗涤3 次,每孔加100 μL用抗体稀释液(1%BSA的PBST)1∶10 000 稀释后的HRP标记山羊抗猪IgG抗体,25℃孵育1 h;使用 PBST 溶液洗涤 3 次,每孔加50 μL 显色液TMB,置室温避光反应10 min;每孔加入50 μL终止液(2 mol/L H2SO4)终止反应,加完终止液后立即利用酶标仪测D450 nm值。同时,用以上条件在同一板的其他孔以制备的兔抗pI226多克隆抗体为一抗,HRP标记的山羊抗兔IgG(H+L)为二抗,作为阳性对照。以P/N值最大时的抗原包被质量浓度和血清稀释度确定为抗原的最佳包被质量浓度和血清的最佳稀释度。在蛋白最佳包被质量浓度和血清的最佳稀释度下对封闭液的选择及作用时间、酶标二抗最佳稀释度等条件进行优化。
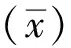
1.14 特异性试验用上述优化的间接 ELISA 方法对PRRSV、PPV、CSFV和PCV抗体阳性猪血清进行检测,每种血清设置 3 个重复,评价该间接ELISA方法的特异性。
1.15 重复性试验选取同一批次包被的3块酶标板,用建立的间接 ELISA方法检测5 份ASF抗体阳性猪血清和5 份ASF抗体阴性猪血清,计算其变异系,评价该方法的批内重复性。选取3 块不同批次包被的酶标板,用该方法检测5 份ASF抗体阳性猪血清和 5 份ASF抗体阴性猪血清,计算其变异系数,评价该方法的批间重复性。
1.16 临床样品检测利用以上建立的间接ELISA方法对本实验室保存已知感染ASFV背景的临床家猪血清样本进行检测,同时用西班牙INGENASA(英吉纳)ASF诊断试剂盒检测相同样品。
2 结果
2.1I226R原核表达载体构建及鉴定以ASFV SY18的毒株基因组DNA为模板进行PCR扩增,得到735 bpI226R基因片段(图1A)。pET32a载体和I226R片段均用XhoⅠ、NdeⅠ限制性内切酶酶切,获得5 366 bp 线性化pET32a载体(图1B)和700 bpI226R片段(图1C)。在T4连接酶的作用下,获得重组质粒pET-32a-I226R。对原核表达重组质粒进行双酶切后,检测到大小为700 bp的目的片段(图1D)。综合测序结果,表明成功构建了pET-32a-I226R原核表达重组质粒。
A.ASFV I226R基因的PCR 扩增; B.空载体pET-32a双酶切;C.I226R基因双酶切;D.pET-32a-I226R 重组质粒酶切鉴定。M.DL5000 DNA Marker;1.ASFV I226R基因 PCR 产物; 2.空载体pET-28a双酶切产物; 3.I226R基因双酶切产物;4.pET-32a-I226R重组质粒的双酶切
2.2 pI226R蛋白的诱导表达及可溶性分析将pET-32a-I226R原核表达重组质粒转化BL21(DE3)感受态细胞中,利用IPTG进行诱导表达,经SDS-PAGE电泳,用考马斯亮蓝染色鉴定,发现在28 kDa左右出现蛋白条带(图2A),且4 h时表达量较高,与预期结果一致。而后取诱导后菌液离心弃上清,加2 mL PBS重悬沉淀于冰上超声破碎。离心分别收集沉淀和上清液进行SDS-PAGE电泳,用考马斯亮蓝染色鉴定(图2B),结果表明pI226R重组蛋白诱导成功且主要以包涵体形式表达。

A.重组蛋白pI226R的诱导表达;B.pI226R 重组蛋白的可溶性分析。M.蛋白质分子质量标准;A1.诱导2 h的空载体菌体样品;A2.诱导2 h的阳性菌体样品;A3.诱导4 h的空载体菌体样品;A4.诱导4 h阳性菌体;B1.诱导阳性菌体裂解的上清;B2.诱导阳性菌体裂解的沉淀;B3.诱导阳性菌体
2.3 pI226R蛋白纯化及Western blot鉴定利用Ni-NTA亲和纯化层析柱对重组蛋白I226R进行纯化,SDS-PAGE结果表明,获得了单一的目的蛋白,相对分子质量约为28 kDa(图3A)。用阳性ASF血清鉴定纯化的重组蛋白I226R的免疫反应原性,Western blot结果表明,阳性ASF血清能识别重组蛋白pI226R,且空载体菌体不与阳性ASF血清反应,说明重组蛋白pI226R具有良好的反应原性(图3B)。

A.重组蛋白pI226R的纯化;B.重组蛋白pI226R的 Western blot 鉴定。M.蛋白质分子量标准; A1~A3.洗脱蛋白咪唑200 mmol/L;A4~A6.洗脱蛋白咪唑500 mmol/L;B1.pET-32a诱导后的菌液;B2.纯化的pI226R重组蛋白
2.4 兔抗pI226R多克隆抗体的鉴定以制备的兔抗pI226R多克隆抗体血清及兔阴性血清为一抗,对纯化后的原核表达重组蛋白pI226R进行Western blot鉴定,对ASFV SY18株感染的PAM细胞进行间接免疫荧光鉴定。结果显示,兔抗pI226R多抗血清能与重组蛋白pI226R发生特异性反应,而未免疫pI226R重组蛋白的兔血清不能识别重组蛋白(图4)。而且兔抗pI226R多抗能特异性识别ASFV SY18株感染PAM细胞中的pI226R蛋白(图5),且发现病毒中I226R基因表达位于胞浆中的病毒工厂中。

M.蛋白质分子质量标准;A1.阳性血清;B1.阴性血清

A.感染 ASFV SY18 毒株的PAM细胞与阳性血清相互作用;B.未感染ASFV SY18毒株的PAM细胞与阳性血清相互作用
2.5 间接ELISA抗体检测方法建立
2.5.1ELISA 最佳反应条件的确定 利用方阵滴定法优化间接 ELISA 的反应条件,结果显示当抗原蛋白的包被质量浓度为 2.5 g/L、血清稀释度为 1∶500时P/N值最大(表2)。利用以上条件又筛选出二抗最佳稀释度为1∶12 000,TMB显色为室温避光作用10 min。

2.5.3间接 ELISA 方法的特异性试验 利用初步建立的 ELISA 方法检测PRRSV、PPV、CSFV和PCV抗体阳性猪血清,每种血清进行 3 个重复,结果显示,只有ASF抗体阳性对照D450 nm>0.381,其他血清样品D450 nm值均小于 0.381,表明该方法具有良好的特异性(表3)。

表3 间接 ELISA 方法的特异性试验结果
2.5.4间接 ELISA 方法的敏感性试验 将ASF抗体阳性猪血清从1∶100 开始倍比稀释,用以上建立的ELISA 方法进行检测,根据检测结果判定阳性血清的最大稀释度,结果见表4。当阳性血清稀释度为1∶1 600 ,检测的D450 nm值仍大于0.381,表明该方法能够检测的ASF阳性血清的最大稀释度为1∶1 600。

表4 间接 ELISA 方法的敏感性试验结果
2.5.5间接 ELISA 方法的重复性试验 选取同一批次包被的酶标板检测5 份ASF抗体阳性猪血清和5 份ASF抗体阴性猪血清,每份样品进行3个重复,计算其变异系数(CV),结果显示批内变异系数均<10%(表5)。另外,用3个不同批次包被的酶标板检测5份ASF抗体阳性猪血清和 5 份ASF抗体阴性猪血清,计算其变异系数,结果显示批间变异系数均<10%,表明所建立的 ELISA方法重复性良好(表5)。

表5 间接 ELISA 方法的重复性试验结果
2.5.6临床样品的检测 利用本试验建立的ELISA方法对本实验室保存已知感染ASFV背景的临床家猪血清样本进行检测,同时,利用西班牙INGENASA(英吉纳)ASF诊断试剂盒检测相同样品。由表6可知,当检测样品以pI226R为抗原的间接ELISA方法检测结果判定为阳性时,则说明该样品含有ASF抗体;当此方法检测结果为阴性,而其他抗原检测结果为阳性时,则说明该样品含有ASF抗体但未有pI226R的抗体,进而说明该家猪体内感染的毒株为缺失I226R基因的缺失株。所以,此方法可以有效检测家猪体内是否产生针对pI226R蛋白的抗体,并且在其他抗体检测试剂盒配合下可有效区别I226R基因缺失株接种和其他毒株感染。
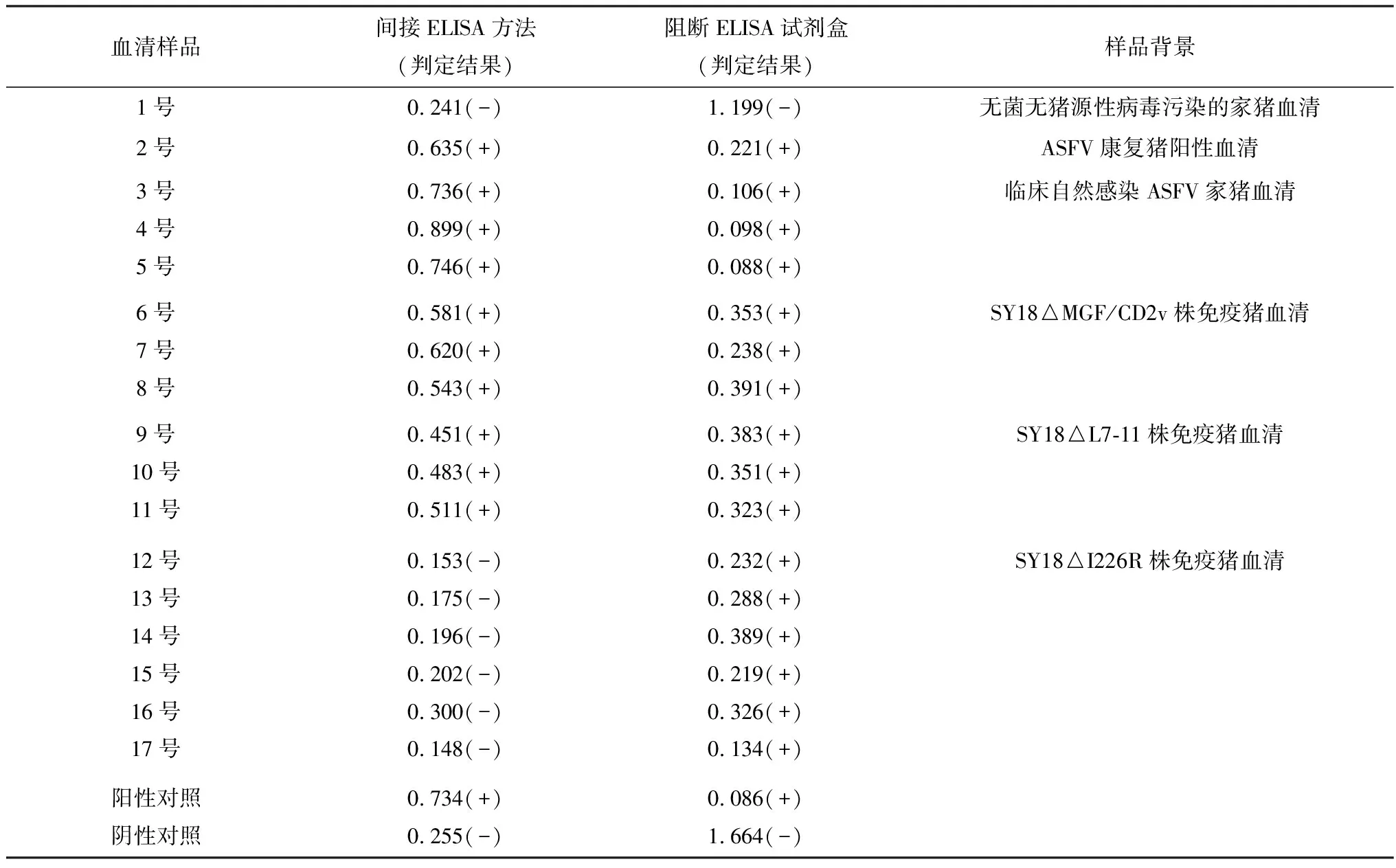
表6 间接ELISA方法与阻断ELISA试剂盒结果对比
3 讨论
ASFV是一种基因组170~193 kb的大型囊膜双链DNA病毒,是非洲猪瘟病毒科目前已知唯一的代表种。病毒直径为175~215 nm,包括125 kb的中心保守区域和2个多基因家族构成的末端可变区域,含有150~167 个开放阅读框,编码150~200种蛋白,其中结构蛋白50多种和非结构蛋白100 多种,目前ASFV大多数蛋白的结构和功能还有待研究[12-13]。ASFV病毒粒子具有二十面体结构,由里到外主要由5部分组成:含病毒基因组DNA的拟核、内核芯壳、内膜、衣壳和囊膜[14]。正因为ASFV 结构复杂、基因组庞大,制约了ASF疫苗和相关研究的开展[15]。
本实验室构建了缺失I226R基因的SY18△I226R减毒株,高(107TCID50)和低(104TCID50)单剂量的SY18△I226R接种家猪21 d 后,无任何明显症状,并产生较高水平的抗体。在用致死剂量的ASFV SY18毒株攻击后,免疫猪均能达到100%保护,具有作为基因缺失疫苗的潜力。为了建立一种利用本试验方法和其他如p30抗体检测试剂盒配合下,区别野毒感染和缺失I226R基因的减毒株接种的血清监测方法,利用包被pI226R蛋白的方式,建立了一种检测pI226R抗体的间接ELISA方法。尽管前期我们通过I226R基因缺失发现I226R基因为一种毒力相关基因,但通过针对血清样品的检测证明,在强毒感染耐过猪体内和弱毒株感染过程中也产生了相应的抗体,说明这个间接ELISA抗体检测的方法在临床上应用是可行的。检测部分样品用来模拟临床样品也说明了该方法的实用性。
通过针对pI226R抗体检测阳性结果D450 nm值的分析,与ASFV其他蛋白抗体检测试剂盒的检测结果相比,pI226R蛋白产生的抗体水平相对较低。因此,大部分阳性样品的D450 nm值和阴性样品的D450 nm值相差绝对值较小,较容易受检测操作等客观因素的影响。产生抗体水平较低的原因,一方面与I226R具有毒力相关性有关,另一方面可能与其在病毒感染过程中蛋白产生水平低有关。因此,在使该方法成为商品化试剂盒以前,需要更多阴性样品的检测,以确定更加准确的临界值。
pI226R蛋白表达和纯化以后,蛋白呈现出保存不稳定的特点,表现在容易降解,导致每次包被之前需要重新检测浓度,具体原因尚不清楚。猜测可能与蛋白保存环境、保存温度、保存时的pH值及盐离子浓度有关。
该检测方法的建立不仅可以帮助检测人员快速便捷检测大量血清样品中是否有针对I226R蛋白的抗体,同时对ASF血清学抗体检测、流行病学、I226R蛋白结构与功能的研究,以及疫苗的研发和临床检测方法的建立等奠定了基础。

