中等强度噪声暴露对幼年豚鼠听觉中枢的影响*
林莹 戴晨逸 苏婷卉 应航 徐飞
噪声暴露是听力下降和听觉外周受损的最常见原因之一[1],有研究发现,经强噪声短暂暴露引起暂时性阈移的发育早期动物,虽然其成年后的听阈正常,但在强度感知和时域处理等阈上听觉处理方面表现异常[2]。这提示听觉中枢的发育成熟是一个可塑性过程,在很大程度上依赖于外周为其提供的输入性刺激,强噪声暴露可能作为异常输入导致了听觉中枢的可塑性改变。这种影响不仅限于高强度噪声,孙伟等[3]发现对发育期大鼠进行70 dB SPL噪声长时暴露,会导致其听觉皮层发育迟缓,并引起其成年后的时域处理敏锐度低下。
近几年,陆续有学者开展长时低、中等强度噪声暴露对幼年动物的危害研究,发现上述中等强度噪声暴露会使内侧膝状体和下丘等中枢部位出现适应性变化[4,5],但目前尚缺乏这类噪声在幼年期长时暴露对中枢影响的研究。由于听觉中枢各级水平之间存在多重联系,具有明显的整体性,因此本研究采用听性脑干反应(ABR)和听觉惊跳反射(ascoutic startle reflex,ASR)这两项分别反映听觉整体功能的电生理与反射性行为测试来探究听觉中枢反应与响度感知表现之间的关系;并通过噪声间隙听性脑干反应(GIN-ABR)测试评估动物听觉时域处理能力,进一步探讨幼年期长时、非损伤性噪声暴露对听觉中枢功能的影响。
1 材料与方法
1.1实验动物及分组 选取健康幼年(3周龄)雄性白色红目豚鼠10只,体重150~180 g,无外耳、中耳疾病,耳廓反射正常,由浙江中医药大学动物实验研究中心提供,随机分成对照组和实验组,每组5只。
1.2噪声暴露方法 对照组在正常安静环境(<30 dB SPL)下饲养至7周龄,实验组给予85 dB SPL白噪声(20 Hz~20 kHz)暴露,每日12小时,连续暴露4周,暴露时间为晚上9点至第2天上午9点,暴露期间豚鼠可在笼中自由活动。扬声器置于鼠笼正上方,一个笼子有4格,每次可对 4只豚鼠进行暴露。声强校准借助AWA6228+型多功能声级计进行,鼠笼内各部位声强变化不超过1 dB。暴露后豚鼠置于正常安静环境下喂养至相应时间点。
1.3听功能测试 实验组在噪声暴露结束当日和结束后2周进行测试;对照组于7周龄进行1次测试。
1.3.1听觉电生理测试 测试在隔声屏蔽箱中进行,采用TDT System 3和BioSigRZ测听软件进行闭合声场给声、记录,测试前对豚鼠使用3%戊巴比妥钠(40 mg/kg)腹腔注射麻醉,待麻醉状态稳定后进行测试,测试过程中维持动物体温(37℃)。
通过DPOAE测试评估外毛细胞功能,测试频率为6、8、12、16 kHz,两个刺激原始音频率关系为f2/f1=1.2,固定强度关系为L1=L2=65 dB SPL,记录DPOAE幅值,2f1-f2幅值高于本底噪声6 dB时即为引出DPOAE。
通过ABR测试评估听觉中枢(听神经到丘脑水平听觉神经系统)的听反应[6],记录电极置于豚鼠两侧耳廓前缘连线中点皮下,参考、接地电极置于测试耳、非测试耳耳后皮下,极间电阻小于1 kΩ。刺激声为6、8、12、16 kHz短纯音(时程10 ms,上升/下降时间0.5 ms),刺激速率为11.1次/秒,扫描时间10 ms,叠加512次,带通滤波500~3 000 Hz,50 Hz陷波防止交流电干扰,以能分辨出可重复的ABR波Ⅲ的最低刺激声强度为阈值,并记录刺激声强度为80 dB SPL时ABR波Ⅰ潜伏期、幅值及波Ⅳ的幅值。
通过GIN-ABR测试评估时域处理能力[7],电极放置同ABR测试,刺激声为80 dB SPL宽带噪声(WBN)和无声间隙(Gap)组成的脉冲串,两个WBN(NB1、NB2)间嵌入一个Gap,共7种脉冲串(Gap为0、1、2、4、8、16、32 ms),WBN持续时间为25 ms,上升、下降时间为0.5 ms,刺激速率为3.3次/秒,记录叠加200次,扫描时间为200 ms,记录由NB2触发的ABR波Ⅰ、波Ⅳ幅值。
1.3.2听觉行为测试 通过ASR测试评估动物的响度感知,ASR指动物对突然的高强度声刺激产生的防御性行为反射(面、颈部和肢体骨骼肌的运动)[8],可通过重力传感器记录反射运动强度来评估。采用行为测试系统Panlab和软件Packwin2.0进行测试。测试方法:开始前豚鼠在测试箱中安静习服3分钟,测试共5种路径,分别为不含惊跳刺激声的基线路径和4种强度(70、80、90、100 dB SPL)的惊跳刺激(白噪声,时程40 ms)试验路径(图1),每种路径重复10次(共50次),以伪随机顺序出现,相邻两次刺激之间的间隔在7~15 s之间随机变化,以防动物对刺激产生适应。每种路径10次惊跳反射的平均值,即为对应强度下的ASR幅值(仪器默认单位为%)。

图1 ASR测试信号模式图

2 结果
2.1DPOAE测试结果 如表1所示,噪声暴露结束当日,实验组豚鼠6、8 kHz的DPOAE幅值与对照组相比无统计学差异(P>0.05),12 kHz的DPOAE幅值小于对照组,但差异无统计学意义(P=0.068),16 kHz的DPOAE幅值显著低于对照组(P<0.01),于暴露结束后2周恢复至与对照组无统计学差异(P>0.05)。
2.2ABR测试结果 噪声暴露结束当日,实验组豚鼠在6、8 kHz的ABR阈值与对照组相比无统计学差异,12(P<0.05)、16 kHz(P<0.01)的ABR阈值显著高于对照组,但于暴露结束后2周恢复,与对照组相比无统计学差异(表2)。暴露结束当日实验组豚鼠各频率80 dB SPL刺激声的ABR波Ⅰ潜伏期、幅值与对照组相比均无统计学差异(P>0.05)(表3、4);暴露结束当日,实验组豚鼠在6(P<0.05)、8 kHz(P<0.01)(强度为80 dB SPL)的ABR波Ⅳ幅值显著降低,暴露结束后2周仍与对照组存在统计学差异(P<0.05)(表5)。
2.3GIN-ABR测试结果 两组在Gap为0、1 ms脉冲串刺激下均未引出ABR波形。噪声暴露结束当日与对照组的比较,t2值为实验组暴露结束后2周与对照组的比较; *P<0.05,**P<0.01; 余表相同当日,实验组豚鼠在8、32 ms间隙的GIN-ABR波Ⅰ幅值显著降低(P<0.05),暴露结束后2周恢复,与对照组间无统计学差异(P>0.05)(表6);暴露结束当日,实验组豚鼠各间隙的GIN-ABR波Ⅳ幅值均显著降低(2 ms,P<0.05;4、8、16、32 ms,P<0.01),暴露结束后2周,4 ms间隙的波Ⅳ幅值仍显著小于对照组(P<0.05)(表7)。

表1 各组各频率DPOAE幅值

表2 各组各频率tb-ABR阈值
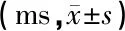
表3 各组各频率tb-ABR波Ⅰ潜伏期

表4 各组各频率tb-ABR波Ⅰ幅值

表5 各组各频率tb-ABR波Ⅳ幅值

表6 各组各时程间隙GIN-ABR波Ⅰ幅值

表7 各组各时程间隙GIN-ABR波Ⅳ幅值
2.4听觉行为测试结果 表8为ASR测试结果,噪声暴露结束当日,实验组豚鼠在各强度刺激声的惊跳程度和对照组相比均无统计学差异(P>0.05);暴露结束后2周,实验组豚鼠的惊跳程度与对照组相比仍无统计学差异(P>0.05),但对于100 dB SPL刺激声,实验组豚鼠的惊跳反射有减弱趋势。
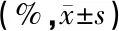
表8 各组各强度惊跳刺激声ASR幅值
3 讨论
听敏度通常借助DPOAE、ABR等电生理测试进行评估,相较于可损伤耳蜗毛细胞导致永久性听力损失的高强度噪声暴露,较低剂量的噪声暴露仅引起暂时性阈移(无毛细胞丢失)[9],因此,在听敏度评估时极具隐匿性。本实验中,暴露结束后2周,实验组12、16 kHz的DPOAE幅值及ABR阈值显著恢复,很好地验证了非损伤性噪声暴露的后果——暂时性阈移,说明85 dB SPL白噪声暴露对该频段外毛细胞功能的损害是可恢复的。有研究表明可引起暂时性阈移的中等强度噪声暴露虽不会损伤外毛细胞,但是会导致耳蜗内毛细胞带状突触的不可逆减少,并伴有波Ⅰ振幅下降[10]。本研究实验组的暂时性阈移仅发生在12、16 kHz,可能与耳蜗的声音传递部位编码机制有关,即:虽然白噪声(20 Hz~20 kHz)会造成基底膜各部位的振动,但由于行波在基底膜上的传播都经过耳蜗底部,这里是耳蜗内液体脉冲波的集中作用点,承受着较大而频繁的声负荷,因此,蜗底(感受高频区)比蜗顶(感受低频区)更易受到声创伤。文中实验组各频段(强度为80 dB SPL)的ABR波Ⅰ幅值仅略低于对照组,且波Ⅰ潜伏期与对照组无显著差异,表明外周听功能未受到显著伤害,但也不排除暴露频宽外频段的ABR波Ⅰ幅值降低的可能[11]。
关于长时中等强度噪声暴露对听觉中枢的可塑性影响,在明确没有听力损失的基础上,需要对听觉中枢功能进行评估。ABR能反映听觉上行传导通路不同水平神经元的同步放电,是衡量整体听觉中枢系统不同水平输入输出增益变化的重要工具。在啮齿动物模型中,ABR波Ⅳ等同于人类的波Ⅴ,通常认为波Ⅳ来源于外侧丘系/下丘附近。本实验中,实验组6、8 kHz的DPOAE幅值、ABR阈值及波Ⅰ幅值与对照组间无统计学差异,表明噪声暴露未损害实验组动物该频段的外周听觉功能,而实验组在6、8 kHz(强度为80 dB SPL)的ABR波Ⅳ幅值显著降低,与Sheppard等[12]的发现一致,该现象被称为负向中枢增益,指在中、低强度噪声暴露未改变外周听觉功能的前提下,外侧丘系/下丘的听反应活动在特定频率出现减弱。这与高强度噪声暴露的中枢可塑性后果相悖,如100 dB SPL噪声暴露会起引动物外周听觉的损伤,从而听觉中枢会因外周输入的减少而代偿性增强神经活动,即中枢代偿增益弥补外周损失以恢复部分听功能[13,14],可见,无论噪声暴露是否引起损伤都会导致一定的中枢可塑性后果。本实验中的较低强度噪声刺激的持续输入导致动物听觉中枢对噪声环境产生了适应,这种可塑性变化可能与治疗听觉过敏的低级声疗法有关。
听觉惊跳反射通路由听神经、耳蜗腹侧核、外侧丘系、脑桥尾侧网状核和脊髓运动神经元等组成[15],有研究发现经强噪声短时暴露的幼年大鼠成年后听觉反应正常,但对高强度白噪声的ASR幅度显著降低,因未成熟的听觉系统通常表现出较低的兴奋性,提示了噪声诱发的听觉发育不良后果[16]。本实验中,实验组噪声暴露结束当日的听觉惊跳程度与对照组无差异,暴露结束后2周ABR反应阈恢复,同时其对100 dB SPL刺激声的惊跳程度有减弱趋势,表明85 dB SPL白噪声暴露对发育期听觉中枢的影响是一个渐进过程,可能提示了中等强度噪声长期暴露对中枢可塑性的影响。Rybalko等[17]发现经噪声暴露处理的幼年动物听觉惊跳程度异常增加,虽然惊跳程度的变化具有年龄依赖性和频率依赖性,但其成年后的惊跳程度显著低于对照组,表明噪声暴露导致的发育障碍包括了复杂的适应性和代偿性变化,与成年动物的暴露后果不同。
Amanipour等[7]曾将GIN-ABR测试应用于强噪声暴露动物的听觉评估中,发现噪声暴露会损害动物的时域处理能力。GIN-ABR刺激声由两个WBN(NB1、NB2)间嵌入一个无声间隙(Gap)组成,每次给声听觉系统需要从NB1恢复以便有效地处理NB2,因此NB2触发的ABR波形分化可反映听觉脑干处理无声间隙的能力。本研究发现Gap的时程越长,总体上NB2触发的ABR波幅越高,能引出NB2完整ABR波形的间隙均大于2 ms。动物因听觉中枢退化引起的听觉时域处理异常可通过NB2波Ⅰ、Ⅳ幅值来评估,本研究分析了NB2触发的ABR波Ⅰ、Ⅳ幅值,暴露结束后2周,实验组在各频段反应阈恢复的基础上,4 ms间隙的ABR波Ⅳ幅值并未恢复,ABR反应幅值降低正是脑干神经回路兴奋性降低的表现,推测是噪声暴露干扰了中枢的自然可塑性发育过程。Williamson等[18]曾提出,机体老化带来的听觉时间编码困难,除了耳蜗、蜗神经损伤等外周处理问题外,还与听觉中枢的神经缺陷有关,因此,推测中等强度噪声暴露对听觉中枢的影响与机体老化机制类似,但因为幼年个体的听觉中枢仍处于发育阶段,导致听觉中枢的神经编码能力发生了复杂的渐进性变化。这也提示阈上听功能测试更有助于发现噪声暴露的隐匿性危害。可见,阈上听功能测试对噪声性隐匿性听力损失的评估至关重要,希望将来可以结合形态学分析和更多行为学分析,来探究中、低强度噪声暴露对听觉通路的系统性影响。
综上所述,本研究中实验组幼年豚鼠的高频听力产生暂时性阈移(于暴露结束后2周恢复),但ABR的波I幅值未发生显著变化,根据Kujawa等[11]的研究,这不符合突触损伤的隐性听力损失表现,因此推测本研究实验组动物的耳蜗毛细胞及其突触形态可能无显著改变,并在此基础上对听觉中枢的可塑性变化展开探究。当然,也不完全排除ABR波I振幅与毛细胞突触损失不一致的结果。希望今后能专门针对这一问题进行研究,为综合评估中、低强度噪声暴露对听觉中枢可塑性的隐匿影响提供参考。

