不同级别胰腺内分泌肿瘤的CT、MRI特征与临床病理特征对照分析*
张亚斌 陈殿森
河南科技大学第一附属医院(河南 洛阳 471000)
胰腺神经内分泌肿瘤(Pancreatic neuroendocrine neoplasms,PNENs)作为异质性肿瘤,比较少见,但近年来发病率有增高的趋势[1]。PNENs分泌各种激素导致不同临床表现,不同分级的PNENs具备不同程度的恶性潜能[2],同时也意味着不同的预后、治疗方案[3],有研究表明[4],TNM分级是影响PNENs患者生存期的危险因素,分级越高,患者预后越差。所以早发现、早诊治对降低肿瘤恶化的发生率,意义重大。磁共振(Magnetic resonance imaging,MRI)、X射线断层成像(Computed axial tomography,CT)是较常见的影像学检测方法,但临床上目前关于PNENs研究大部分以CT检查为主[5-6],联合MRI进行分析的较少,本研究因此对照分析不同级别PNENs的CT、MRI特征与临床病理特征,为该疾病的临床影像学提供可参考的理论依据。
1 资料与方法
1.1 临床资料选取2019年9月至2020年9月于本院收治的PNENs患者86例,其中男性37例(43.02%)、女性49例(56.98%),年龄25~70岁,平均年龄(49.23±10.59)岁,临床表现头晕心慌者13例、低血糖间歇发作者18例、腹痛7例、剩余48例无明显特征,根据WHO的相关标准[7]将PNENs分为G1、G2、G3不同级别。本研究经医院医学伦理委员会批准。
纳入标准:符合中华医学会肿瘤学分会胰腺癌学组对PNENs的诊断标准[8];经病理活检和免疫组化检测确认;均行CT和MRI检查;临床资料齐全,图像清晰。排除标准:胰腺癌;严重心、肺、肾等功能异常;合并其他恶性肿瘤;图像模糊不清,无法满足检查要求。
1.2 方法CT检查:所有患者接受CT平扫和增强扫描,采用螺旋CT机,自右侧膈顶处到髂嵴连线处,增强扫描采用对比剂钆喷酸葡胺溶液30mL,注射速率3mL/s,延迟时间:动脉期30s,门静脉期50s,平衡期180s。
MRI检查:患者检查前禁饮禁食,然后接受菲利普1.5TMRI扫描仪扫描,使用腹部相控阵线圈,行腹部平扫和动态增强扫描。扫描序列主要包括:①常规怕序列T1WI、T2WI;②脂肪抑制T2加权(FST2WI);③脂肪抑制T1加权(FST1WI)、动态增强,增强扫描时注射对比剂钆喷酸葡胺溶液30mL,速率为3mL/s,延迟时间:动脉期30s,门静脉期60s,平衡期180s。
1.3 影像分析及相关指标由本院影像科2位高年资医生各自独立阅片,分析结果不一致时,经讨论达成一致决定。通过阅片观察患者病灶位置、边界以及信号特点,同时检查胰管是否扩张、胰周血管、脏器有无侵犯等,以及强化是否均匀。
1.4 统计学方法应用IBM SPSS 24.0软件行统计学分析,对偏态分布的计量资料以[M(P25,P75)]表示,采用Mann-WhitneyU检验;对正态分布的计量资料以()表示,采用独立t检验,计数资料的比较采用χ2检验,采用ROC曲线分析CT、MRI诊断不同分级PNENs的效能,P<0.05被认为差异有统计学意义。
2 结果
2.1 不同分级PNENs患者一般资料病理检测结果显示,所有患者病灶均为单发,病理检查分级中G130例、G249例、G37例,G1患者病发部位主要在胰尾(60.00%),G2患者主要在胰头(71.43%),G3患者均在胰颈(100%),且三组患者病发部位比较,差异有统计学意义(P<0.05);此外三组患者年龄、性别、是否功能性比较,差异无统计学意义(P>0.05),见表1。
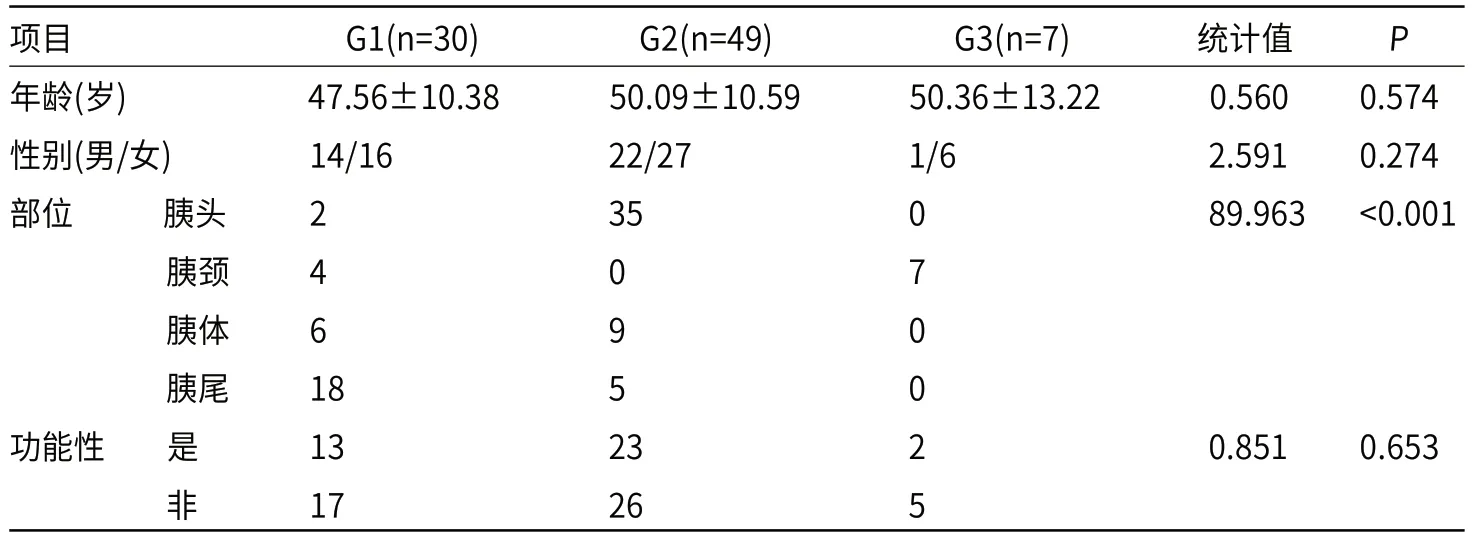
表1 不同分级PNENs患者一般资料

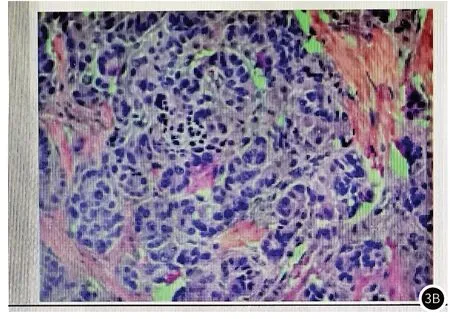
图1 女,43岁,左上图示:胰腺体尾部示类圆形低密度影,边界尚清,增强后包膜可见轻度强化。右上图示DWI呈高/低信号。左下图示T2WI体尾部类圆形等低信号。右下图示病理神经内分泌肿瘤。图2 女,74岁,左上图示:胰腺体部可见椭圆形T2WI稍高、高信号,边界尚清,右上图示病变增强扫描呈较明显欠均匀强化,内可见斑片状无强化低信号影,左下图示动态增强冠状位,病变呈明显欠均匀强化,右下图示病理为胰腺神经内分泌瘤。图3 女,81岁,左上图示:胰头钩突区混杂信号影,边界不清,增强MRI病变呈明显欠均匀强化,其边缘可见无明显强化低信号影,右上图示术后病理为神经内分泌瘤。
2.2 不同分级PNENs患者CT形态特征比较结果显示,不同分级患者的肿瘤直径、病灶边缘、形状和远端转移、胰管扩张、囊变坏死、CT强化值比较,差异有统计学意义(P<0.05),见表2。
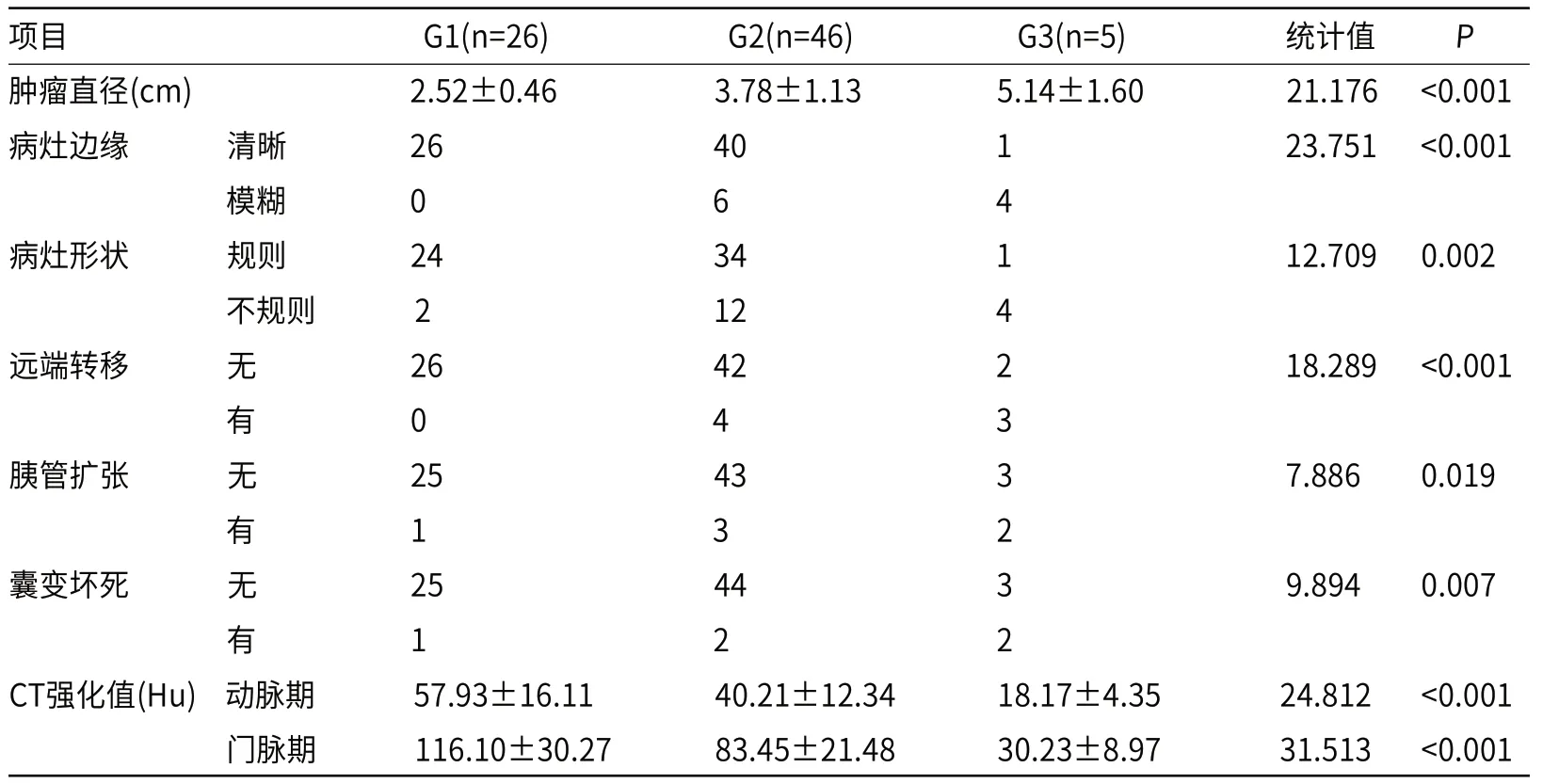
表2 不同分级PNENs患者CT形态特征比较
2.3 不同分级PNENs患者MRI形态特征比较结果显示,不同分级患者的肿瘤直径、病灶边缘、形状和远端转移、胰管扩张、囊变坏死、MRI高信号比较,差异有统计学意义(P<0.05),见表3。

表3 不同分级PNENs患者MRI形态特征比较
2.4 不同影像学检查诊断PNENs结果对比结果显示,以病理检查为金标准,两种检测手段检查PNENs的检出率比较,差异无统计学意义(P>0.05),见表4。
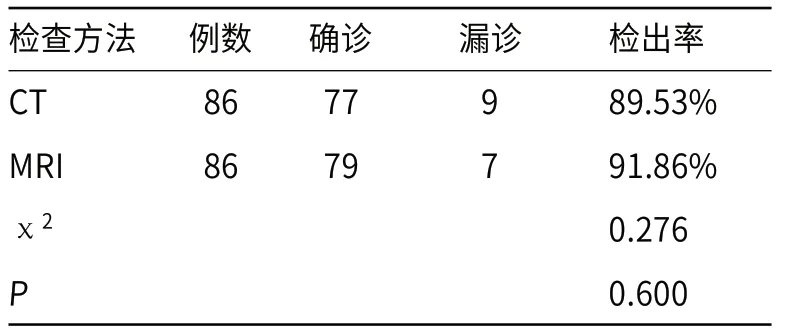
表4 不同影像学检查诊断PNENs结果对比(n,%)
2.5 CT、MRI及联合检测对低、高级别PNENs的诊断价值将PNENs患者分为低级别(G1)、高级别(G2+G3),ROC分析结果显示,CT、MRI两种检测方法诊断低、高级别PNENs的AUC分别为0.771、0.793,其中CT检测的灵敏度、特异度分别为74.30%、80.00%,MRI检测的灵敏度、特异度分别为78.57%、81.50%,CT联合MRI检测低、高级别PNENs的诊断效能为0.879,灵敏度、特异度分别为85.71%、90.00%,明显优于单一检测(P<0.05),见表5、图4。
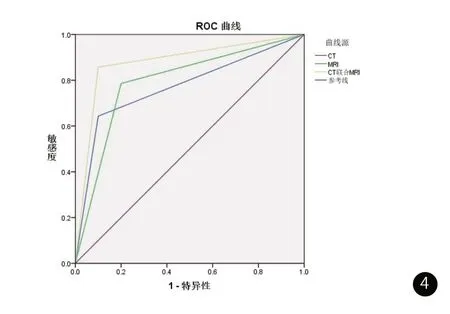
图4 CT、MRI及联合检测诊断低、高级别PNENs的ROC曲线分析
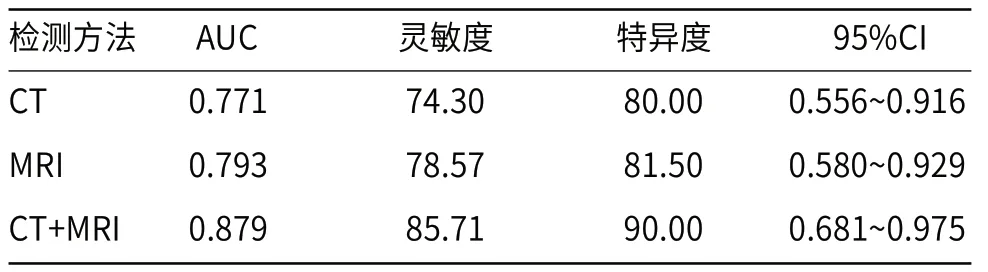
表5 CT、MRI及联合检测对低、高级别PNENs的诊断价值
3 讨论
目前PNENs的临床治疗方式主要行切除术,然而不同分级的肿瘤手术方式不尽相同,良性肿瘤患者只需摘除肿瘤即可,而恶性肿瘤患者往往需将整节段胰腺切除,甚至可能涉及脏器[9]。有研究表明[10],不同的治疗方式对PNENs患者预后产生较大影响,所以对PNENs进行病理分级有助于临床治疗方案的制定。近些年影像学技术发展迅速,CT与MRI在各医院临床应用已非常普遍,然而联合二者的相关研究并未成熟,因此本研究对比分析CT与MRI对不同分级PNENs患者的影像学特征,为PNENs分级提供较可靠的依据。
本次研究结果显示,86例PNENs患者,女性患者49例,发病率略高于男性,与较早前Goh[11]等人的研究结果保持一致。其中G1患者病发部位主要在胰尾(60.00%),G2患者主要在胰头(71.43%),G3患者均在胰颈(100%),且三组患者病发部位比较,差异有统计学意义,提示病灶部位对PNENs分级具有一定评估价值,与刘群[12]等人的研究结果不同,考虑到本研究与之的研究样本量均偏少,且刘的研究并未将G2、G3进行细分,而是一并归为高级别组,所以具体联系仍需扩大样本量予以证实。另外研究显示,不同分级患者的功能性与非功能性例数比较,差异无统计学意义,提示PNENs功能性与非功能性病理特征呈现多样化、复杂的态势,临床应重视该类现象。
目前对PNENs的病理分级,多数根据肿瘤的位置、大小、形态和强化方式等,本研究对患者行CT扫描结果显示,不同分级患者的肿瘤直径、病灶边缘、形状和远端转移、胰管扩张、囊变坏死、CT强化值比较,差异有统计学意义;而MRI检测结果亦表明,不同分级患者的肿瘤直径、病灶边缘、形状和远端转移、胰管扩张、囊变坏死、MRI高信号比较有明显差异,提示不同级别PNENs患者的CT、MRI影像学形态特征,均存在明显差异,G3患者肿瘤直径较大、病灶形状不规则、边缘更模糊,同时较易向远端转移和发生胰管扩张,与徐香红[13]的研究结果不谋而合。
另一方面,罗乔[14]在103例PNENs诊治经验及预后因素分析中得出这样结论,CT和MRI对PNENs的检出率基本相同。而本次研究对两种影像学检测方法的检出率比较中,发现差异无统计学意义,与王海彬[15]的报道较好地保持一致,提示CT和MRI的检出效果较为相当,He[16]表示,多排螺旋CT是PNENs患者首选的影像检测方式,但李斯婕[17]认为,G1、G2病灶存在的差异性,是CT漏诊的主要原因之一;而Rocio[18]提出,MRI的T2WI和DWI弥散成像的高b值能提高检出率,但一旦病灶仅在动脉期强化,而其他期呈现等密度、等信号形态时,同样易导致漏诊,表明临床CT、MRI检测PNENs的效果各有优劣。张涛[19]在多病灶PNENs的影像学特征分析中,认为CT和MRI可为PNENs提供较好的分级依据。同样,本研究将不同分级的PNENs患者分为低级别(G1)、高级别(G2+G3),分析两种检测方式对不同级别的PNENs诊断效能,结果显示,CT和MRI均有较好的诊断低、高级别PNENs的效能,同时CT联合MRI的诊断效能明显优于单一检测,提示临床可对PNENs患者进行联合检测,能有效提高诊断效能。
综上所述,PNENs作为较少见的胰腺肿瘤,不同级别的患者,其CT、MRI影像学特征均有明显差异,而CT、MRI的检查各有优劣,联合检查能明显提高对低、高级别PNENs患者的诊断效能,有条件可进行联合检测。而本研究不同分级PNENs患者呈现的影像学形态,对其临床病理的分级,呈现出较重要的价值。同时本研究作为回顾性分析与单中心研究,纳入样本量偏少,存在一定选择偏倚,都是研究的不足之处,仍亟待多中心、前瞻性研究对结果进行验证,提高对PNENs的影像学认识水平。

