不同波动光对黄瓜幼苗光合和抗性生理特性的影响
康红旗,姜玮莉,孙启颖,周璇,孔静雯,孙坡,刘彬彬,李清明3
不同波动光对黄瓜幼苗光合和抗性生理特性的影响
康红旗1,姜玮莉1,孙启颖1,周璇1,孔静雯1,孙坡1,刘彬彬2*,李清明3*
1. 山东农业大学园艺科学与工程学院, 山东 泰安 271018 2. 作物生物学国家重点实验室, 山东 泰安 271018 3. 中国农业科学院都市农业研究所, 四川 成都 610218
本研究以‘津优35号’黄瓜品种作为供试材料,在相同的日累积光量DLI(9.288 mol·m-2·d-1)和光周期(10 h·d-1)条件下设置稳态光照(光强为258 µmol·m-2·s-1,CK)、移动光照(光强在8分钟的循环周期内由80→460→80 µmol·m-2·s-1逐渐变化,由低到高和由高到低变化时间均为240 s,YD)和频闪光照(光强在8分钟的循环周期内由80→460→80 µmol·m-2·s-1交替变化,低光强光照时间为130 s,高光强光照时间为220 s,PS) 3个光照处理,研究了波动光对黄瓜幼苗光合和抗性生理特性。结果表明,不同波动光处理均显著降低最大电子传递速率(J)和净光合速率,但对气孔导度(G)、胞间CO2浓度(i)、蒸腾速率(T)、光呼吸速率(R)以及CO2补偿点和饱和点没有显著影响。同时,波动光均会明显增加黄瓜幼苗丙二醛和H2O2含量,并提高超氧阴离子清除速率以及超氧化物酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAD)等抗氧化酶活性,频闪光照比移动光照处理下黄瓜幼苗抗逆性更高。综上所述,波动光虽然会降低黄瓜幼苗的净光合速率,但会提高自身抗逆性,所以在黄瓜工厂化育苗中,应全面客观地理解波动光的影响。
黄瓜; 光敏性; 抗性生理
自然环境中植物完全发育的叶片经常受到光照强度波动的影响,通过动态适应改变自身光合能力,这种动态适应在提高植物适应性方面起着重要作用[1,2]。光照强度在较短时间内由弱变强的变化使得光合机构所接受的光能超过之前稳定光合作用需要的能量,光系统I和Ⅱ之间的激发不平衡在高等植物类囊体膜中产生氧化还原信号,从而引起光合机构的结构适应性变化[3],比如损伤光系统II的DI蛋白[4]。这种电子传递的氧化还原信号是短期适应和长期适应的重要调节器[5],实现叶绿体和细胞核之间的信号交换,迅速改变其他区域的代谢途径和抗氧化防御系统[3,6],如质体醌氧化还原状态、光合代谢产物、活性氧(ROS)、糖和激素,核基因表达的状态变化[7,8]。已有研究表明,当光量子吸收超过CO2固定的所需通量时,光合电子传递组分的氧化还原变化在改变入射光强度后立即发生[9],首先电子传递链过度减少,来自两个光系统过量的电子会“溢出”到氧气中,从而产生ROS,最直接的包括单线态激发氧、超氧阴离子自由基、过氧化氢(H2O2)和羟基自由基[10]。Pospíšil(2011)的研究表明,强光胁迫触发的H2O2等系统信号能通过逆行信号传导过程产生超氧化物歧化酶(SOD)等抗氧化酶[11],最终使叶片对后续胁迫抵抗能力增强[12]。
目前学者对波动光的研究中,大部分研究为高光强的间歇性波动,然而,自然环境中除多云天气外,光照强度在从秒到天时间范围内不断发生变化的。为了更好地探究在较低光强背景下,短时间波动变化的光环境对植物的光合和抗性的影响,本试验通过移动光照方式模拟自然环境的光强变化,揭示了波动光对黄瓜幼苗光合和抗性生理特性,为黄瓜工厂化育苗技术应用提供理论依据。
1 材料与方法
1.1 实验材料和培养条件
实验时间为2021年9~11月,地点为山东农业大学园艺实验站,材料为‘津优35号’黄瓜(L.)。将种子于28 ℃恒温箱进行催芽后,播于50孔的穴盘中,基质配制比例为草炭:蛭石:珍珠岩=3:1:1,待幼苗生长至一叶一心时,挑选长势相同且整齐一致的幼苗定植于外径10 cm、高12 cm的营养钵中,在温室中缓苗2 d后,二次挑选长势一致幼苗放入自制光照培养装置进行处理,每个处理24株。
光照培养装置内置不同数量的功率为30 W的黄瓜幼苗生长专用LED灯管形成适合植株生长的光环境。其中,稳态光照处理使用4根LED灯管以40 cm为间距整齐并列放置形成稳定光环境;频闪光照处理使用8根LED灯管以15 cm的间距并列放置,通过定时器控制部分灯管开闭,形成交替性波动光环境;移动光照处理通过以慢速电动机为动力,以钢丝绳为传动载体的移动装置带动间距为10 cm的3根LDE灯管在植株生长的上方水平均匀往返移动,模拟自然环境中渐变性光环境,移动装置原理示意图见图1。
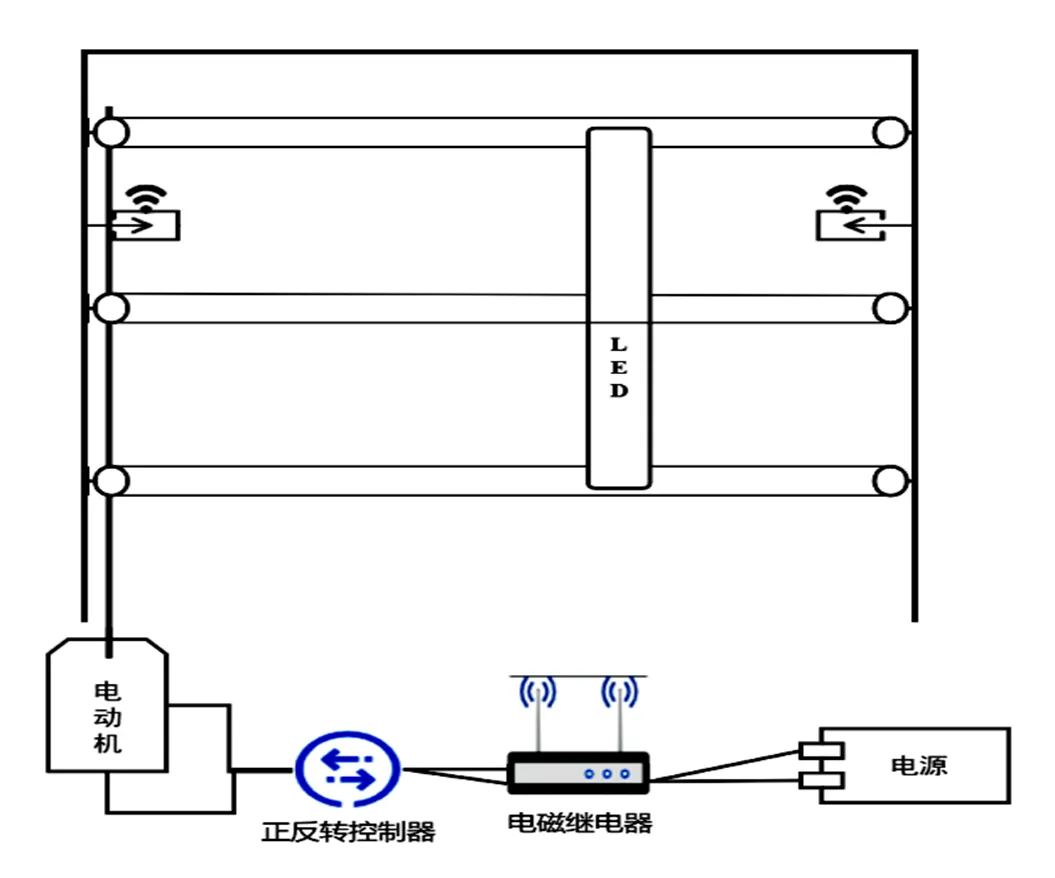
图 1 移动补光装置原理示意图
1.2 试验设计
在相同9.288 µmol·m-2·d-1的日累积光量(Daily light integral, DLI)和光周期条件下设置3个光照处理:稳态光照(光强为258 µmol·m-2·s-1,CK)、移动光照(光强在8 min的循环周期内由80→460→80 µmol·m-2·s-1逐渐变化,由低到高和由高到低变化时间均为240 s,YD)和频闪光照(光强在8分钟的循环周期内由80→460→80 µmol·m-2·s-1交替变化,低光强光照时间为130 s,高光强光照时间为220 s,PS)。实验设计相关参数见表1,光量子通量变化和光源光谱如图2所示。处理10 d后测定生理指标并选取第二片真叶作为样本,结束实验处理。

表 1 实验设计相关参数
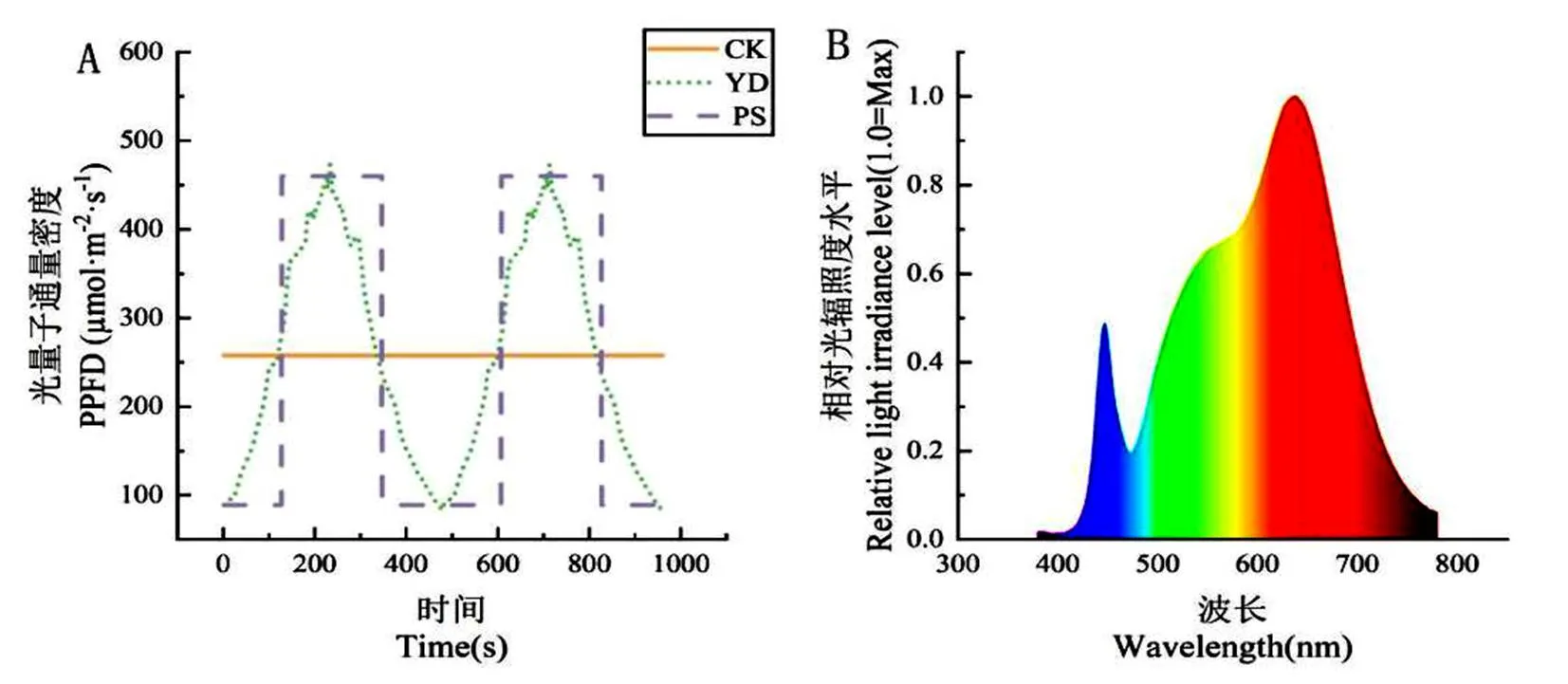
图 2 不同试验处理光量子通量变化(A)和光源光谱(B)
1.3 测定指标与方法
1.3.1 光量子通量密度的测定3415FX光度计(Spectrum Technologies,USA)测定光量子通量密度。
1.3.2 光谱测定用地物光谱仪GER1500型(Ocean Optical,USA)测定光源的光谱,测定波长范围为310-1100 nm。
1.3.3 光合气体交换参数的测定利用Li-Cor 6800便携式气体交换系统(LI-COR, Inc., Lincoln, NE, USA)测定黄瓜功能叶片的光合参数,包括净光合速率()、胞间CO2浓度()、气孔导度()及蒸腾速率(),其中设定参数为:流速为200 µmol·s-1,CO2浓度为400 µmol·mol-1,叶片温度为25 ℃,光合有效辐射(PAR)为800 µmol·m-2·s-1,湿度为空气湿度的80%左右,光质为90%的红光和10%的蓝光。
1.3.4 光合-CO2响应曲线的测定利用Li-Cor 6800便携式气体交换系统(LI-COR, Inc., Lincoln, NE, USA)测定黄瓜功能叶片的光合-CO2曲线,其中设定参数为PAR=800 µmol·m-2·s-1,叶温为25 ℃,空气湿度为60%~70%(通过系统的加湿器和干燥剂维持稳定),光质为90%的红光和10%的蓝光,CO2浓度为响应曲线所需浓度。测定完毕后,对响应曲线进行拟合分析[13,14]。
1.3.5 叶片丙二醛、ROS含量的测定丙二醛(MDA)含量采用硫代巴比妥酸(TBA)显色法测定[15];过氧化氢(H2O2)含量按照试剂盒(Comin Biotechnology Co. Ltd, Suzhou, China)说明测定。
1.3.6 抗氧化酶活性测定用NBT法测定超氧化物歧化酶(SOD)活性[16]、用愈创木酚法测定过氧化物酶(POD)活性[17]、用紫外吸收法测定过氧化氢酶(CAT)活性[18];超氧阴离子清除能力按照试剂盒(Comin Biotechnology Co. Ltd, Suzhou, China)说明测定。
1.4 数据处理
采用软件Microsoft Excel 2019 (Microsoft Corporation, USA)和DPS15.10(浙江大学,中国杭州)来进行数据处理,图表中的数据为平均值±标准差,采用Duncan检验法进行多重比较和差异显著性检验(=0.05),使用Origin 2021(OriginLab, USA)软件作图。
2 结果与分析
2.1 不同波动光对光合气体交换参数的影响
由表2可以看出,移动和频闪光照处理降低了黄瓜幼苗的净光合速率(P),分别降低4.6%、3.6%,而气孔导度(G)、胞间二氧化碳(C)、蒸腾速率(T)差异没有达到显著水平,说明气孔不是限制波动光下植株光合速率的因素。

表 2 不同波动光对黄瓜幼苗光合气体交换参数的影响
2.2 不同波动光对光合响应曲线特征参数的影响
由表3可以看出,移动和频闪光照处理都提高了黄瓜幼苗的最大电子传递速率,分别降低3.3%、4.6%,但是对CO2补偿点、饱和点和光呼吸速率的影响没有达到显著差异水平,不同波动光处理间差异没有达到显著水平。

表 3 不同波动光黄瓜幼苗CO2响应曲线特征参数
2.3 不同波动光对黄瓜幼苗活性氧和丙二醛的影响
由图3可以看出,频闪光照处理提高了过氧化氢(H2O2)的含量,提高了44.4%,而移动光照处理相对于稳态光并没有达到显著差异水平;移动和频闪光照处理会明显提高丙二醛(MDA)的含量,分别提高14.8%、29.2%,频闪光照处理的影响要比移动光照处理大;整体而言,波动光都会黄瓜幼苗产生有害物质,频闪光照处理相对较多。
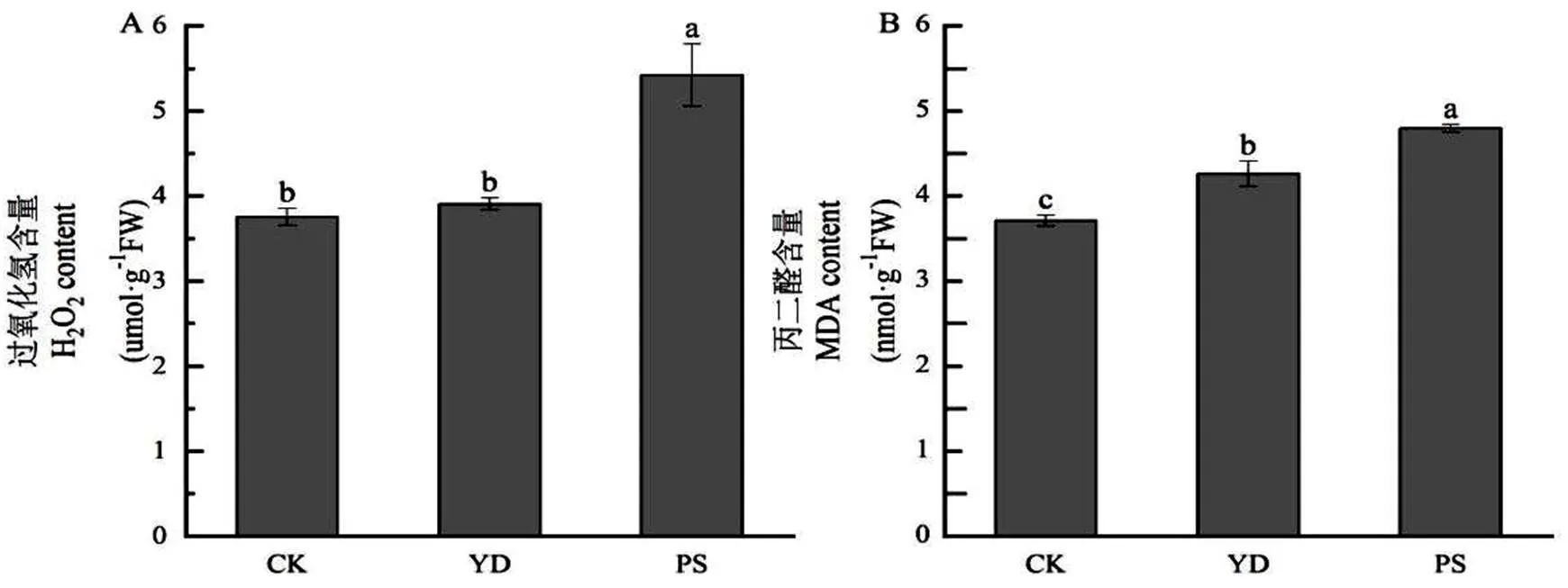
图 3 不同波动光对黄瓜幼苗过氧化氢和丙二醛的影响
2.4 不同波动光对抗氧化酶活性的影响
由图4可以看出,移动和频闪光照处理均会明显提高黄瓜叶片的SOD活性,分别提高9.8%、13.0%,频闪光照处理的影响程度大于移动光照处理;移动光照处理对POD活性和CAT活性的影响和稳态光没有达到显著差异水平,频闪光照处理下黄瓜幼苗POD和CAT酶的活性会增大,分别增大21.1%、23.4%;移动和频闪光照处理均提高了超氧阴离子清除能力,分别提高10.4%、12.0%,而不同波动光处理间差异没有达到显著水平。
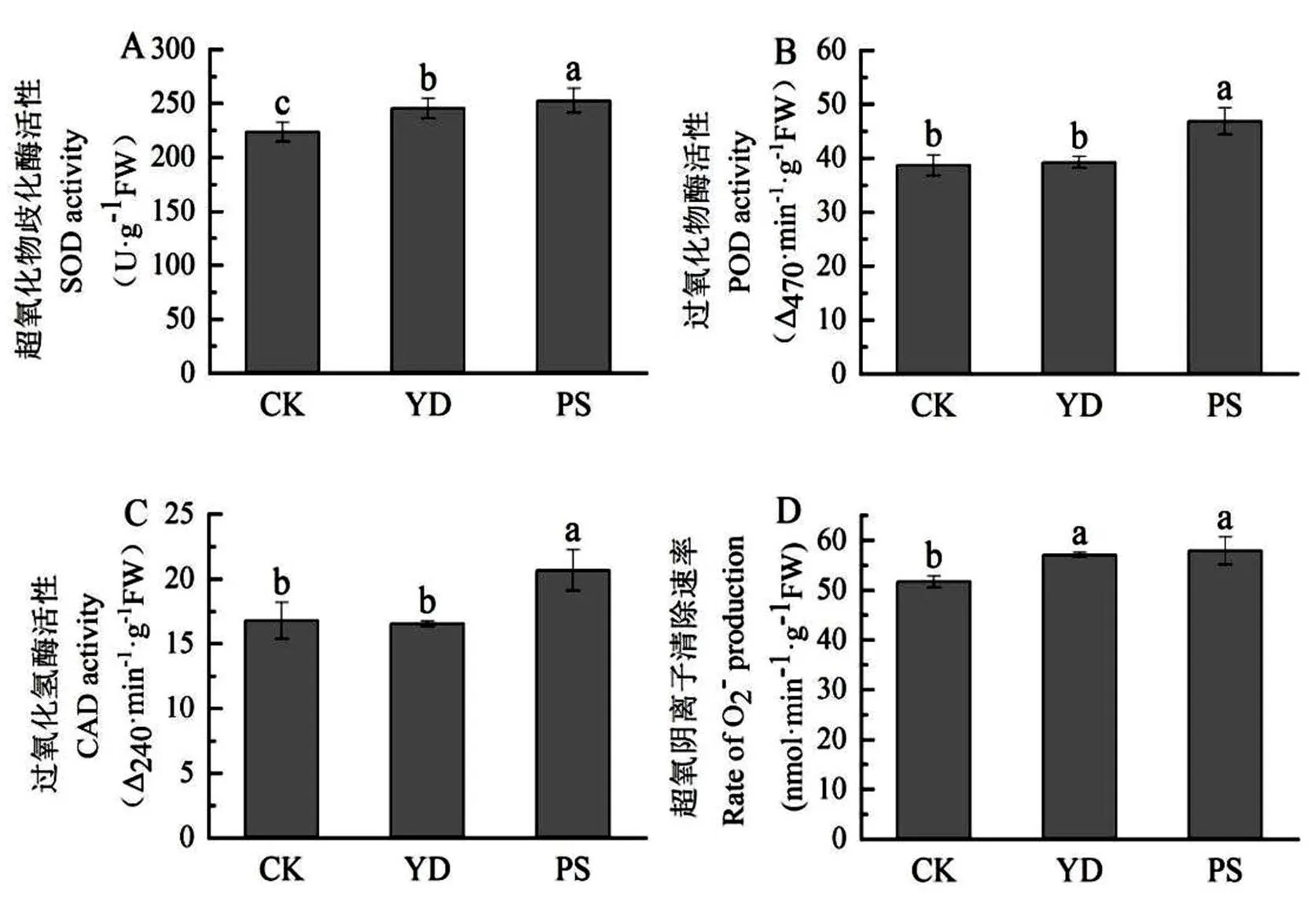
图 4 不同波动光对黄瓜幼苗抗氧化酶活性的影响
3 讨 论
前人研究试验表明,在波动光下,处于稳定光合状态的反应中心会快速响应光照强度由弱到强的变化,外界光量子的迅速增加[19],超过光合作用所能利用的光能,导致大量光量子剩余,过剩光量子对光合机构产生不良影响[20],在本试验结果中,波动光会显著降低黄瓜幼苗的净光合速率(表1),这与Sui的研究结果一致[21],其原因主要是波动光会降低光合最大电子传递速率(表2),说明植物自身以动态和高度协调的方式调节电子传递应对光照强度的变化,在光利用和光保护之间取得平衡。波动光会引起光合反应中心电子传递链等因素限制,进而影响光反应中心的活性,所以电子传递链的适应是与光保护有关的一个调节过程。通过降低电子传递速率来减少光化学反应中能量的传递,目的是为了减少因激发态叶绿素分子中的能量不能被快速转移而产生的非光化学淬灭和ROS所带来的伤害,增强PSⅡ和PSⅠ之间激发平衡的调节能力[1,19],降低光氧化损伤的程度[22]。
在改变入射光强度后,在电子传递链过度减少的同时,会伴随ROS产生,并作为氧化还原信号将有关电子传递链内氧化还原状态的基本信息从叶绿体中传递到细胞核[23]。叶绿体到细胞核的信号传导称为逆行信号传导,会引起基因表达的变化导致蛋白质丰度的后续变化[24,25]。正如本试验研究结果中,不同波动光下会产生氧化还原物质(图18)会通过这种逆行信号激活细胞核等代谢过程,引起超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)等抗氧化酶活性增加,并提高了超氧阴离子清除速率(图19)[26]。研究表明,丙二醛的产生和积累会加剧对细胞的毒害,使膜的结构和功能受损也间接反映组织中自由基的含量[27]。当植物体内ROS的累积超出ROS清除系统的能力范围时,氧自由基会大量累积,导致生物膜脂过氧化, 进而使细胞膜透性增加,细胞功能失常[28]。植物通过该自由基清除系统来为维持活性氧代谢实现体内自由基的产生和清除处于动态平衡状态,比如激活大量的活性氧清除机制,以尽量减少活性氧升高对植物造成的有害影响[23]。本研究中,波动光会处理下黄瓜幼苗的SOD、POD和CAT酶活性升高,目的是为减缓波动光环境做出了适应性反应,提升抗自由基伤害能力和抵抗逆境的性能。
4 结 论
综上所述,波动光虽然会降低黄瓜幼苗的净光合速率,能够一定程度上提高根系抗氧化酶活性从而提高抗氧化酶系统的防御能力,抑制ROS的积累量,防止膜脂过氧化,从而提高自身抗逆性,所以在黄瓜工厂化育苗中,应全面客观地理解波动光的影响。
[1] Kaiser E, Morales A, Harbinsona J. Fluctuating light takes crop photosynthesis on a rollercoaster ride [J]. Plant Physiology, 2018,176(2):977-989
[2] Athanasiou K, Dyson BC, Webster RE,. Dynamic Acclimation of photosynthesis increases plant fitness in changing environments [J]. Plant Physiology, 2010,152(1):366-373
[3] Fey V, Wagner R, Braütigam K,Retrograde plastid redox signals in the expression of nuclear genes for chloroplast proteins of Arabidopsis thaliana [J]. Journal of Biological Chemistry, 2005,280(7):5318-5328
[4] Aro E, Suorsa M, Rokka A,. Dynamics of photosystem II: a proteomic approach to thylakoid protein complexes [J]. Journal of Experimental Botany, 2005,56(411):347-356
[5] Escoubas JM, Lomas M, Laroche J, et al. Light intensity regulation of cab gene transcription is signaled by the redox state of the plastoquinone pool [J]. Proceedings of the National Academy of Sciences, 1995,92(22):10237-10241
[6] Río L, Sandalio LM, Palma JM,. Reactive oxygen metabolism, and stress-related enzyme activities [J]. Springer Netherlands, 2002:221-258
[7] Mullet JE. Dynamic regulation of chloroplast transcription [J]. Plant Physiology, 1993,103(2):309-313
[8] Chan KX, Phua SY, Crisp P,. Learning the languages of the chloroplast: retrograde signaling and beyond [J]. Annual Review of Plant Biology, 2016,67:25-53
[9] Ramel F, Ksas B, Akkari E,. Light-induced acclimation of the arabidopsis chlorina1 mutant to singlet oxygen [J]. Plant Cell, 2013,25(4):1445-1462
[10] Ravindra K, Annette E, Hebert LK,. Amino acid oxidation of the D1 and D2 proteins by oxygen radicals during photoinhibition of Photosystem II [J]. Proceedings of the National Academy of Sciences of the United States of America, 2017,114(11):2988-2993
[11] Pospíšil P. Molecular mechanisms of production and scavenging of reactive oxygen species by photosystem II [J]. Biochimica et Biophysica Acta, 2011,1817(1):218-231
[12] Karpinski S. Systemic signaling and acclimation in response to excess excitation energy in[J]. Science, 1999,284(5414):654-657
[13] Ye ZP, Suggett, DJ, Robakowski P,. A mechanistic model for the photosynthesis-light response based on the photosynthetic electron transport of photosystem II in C3and C4species [J]. New Phytol, 2013,199(1):110-120
[14] 叶子飘,于强.光合作用光响应模型的比较[J].植物生态学报,2008,32(6):1356-1361
[15] Dhindsa RS, Pamela PD, Thorpe TA. Leaf senescence: correlated with increased levels of membrane permeability and lipid peroxidation, and decreased levels of superoxide dismutase and catalase [J]. Journal of Experimental Botany, 1981(1):93-101
[16] Beyer WF, Fridovich I. Assaying for superoxide dismutase activity: Some large consequences of minor changes in conditions [J]., 1987,161(2):559-566
[17] Omran RG. Peroxide levels and the activities of Catalase, Peroxidase, and indoleacetic acid oxidase during and after chilling Cucumber seedlings [J]. Plant Physiology, 1980,65(2):407-408
[18] Maehly AC, Chance B. The assay of catalases and peroxidases [M]//Glick D. Methods of Biochemical Analysis. New York: Interscience Publish Inc., 1954:357-366
[19] Thormählen I, Zupok A, Rescher J,. Thioredoxins play a crucial role in dynamic acclimation of photosynthesis in fluctuating light [J]. Molecular Plant, 2017,10(9):168-182
[20] Armbruster U, Galvis VC, Kunz HH,. The regulation of the chloroplast proton motive force plays a key role for photosynthesis in fluctuating light [J]. Current Opinion in Plant Biology, 2017,37:56-62
[21] Sui XL, Mao SL, Wang LH,. Effect of low light on the characteristics of photosynthesis and Chlorophyll a fluorescence during leaf development of sweet pepper [J]. Journal of Integrative Agriculture, 2012,11(10):1633-1643
[22] Palatnik JF, Tognetti VB, Poli HO,Transgenic tobacco plants expressing antisense ferredoxin‐NADP (H) reductase transcripts display increased susceptibility to photooxidative damage [J]. The Plant Journal, 2003,35(3):332-341
[23] Foyer CH. Reactive oxygen species, oxidative signaling and the regulation of photosynthesis [J]. Environmental and Experimental Botany, 2018,154:134-142
[24] Mubarakshina MM, Ivanov BN, Naydov IA,. Production and diffusion of chloroplastic H2O2and its implication to signalling [J]. Journal of Experimental Botany, 2010,61(13):3577-3587
[25] Exposito-Rodriguez M, Laissue PP, Yvon-Durocher G,. Photosynthesis-dependent H2O2transfer from chloroplasts to nuclei provides a high-light signalling mechanism [J]. Nature Communications, 2017,8(1):4
[26] 张子山,杨程, 高辉远,等.低温光抑制恢复过程中黄瓜叶片PSⅡ活性及其电子传递对PSⅠ的影响[J].应用生态学 报,2012,23(4):1049-1054
[27] 丁玲,吴雪,杜长霞,等.短期干旱胁迫对黄瓜幼苗叶片抗氧化系统的影响[J].浙江农林大学学报,2015,32(2):285-290
[28] 李仪曼,贺新蕊,李清明,等.CO2加富对干旱胁迫下黄瓜幼苗根系抗氧化系统的影响[J].植物生理学报,2019,55(7):1011-1019
Effect of Different Fluctuant Lighting on Photosynthetic and Resistance Physiological Characteristics of Cucumber Seedlings
KANG Hong-qi1, JIANG Wei-li1, SUN Qi-ying1, ZHOU Xuan1, KONG Jing-wen1, SUN Po1, LIU Bin-bin2*, LI Qing-ming3*
1.271018,2.271018,3.610218,
In this study, the cucumber variety 'Jingyou 35' was used as the test material and set under the same daily accumulated light DLI (9.288 mol·m-2·d-1) and photoperiod (10 h·d-1) conditions with steady-state light (light intensity of 258 µmol·m-2·s-1, CK), moving light ( The light intensity varied gradually from 80→460→80 µmol·m-2·s-1over an 8-min cycle, with a low-to-high and high-to-low variation time of 240 s, YD) and stroboscopic light (light intensity alternated from 80→460→80 µmol·m-2·s-1over an 8-min cycle, with a low light intensity light time of 130 s and a high light intensity light time of (220 s, PS), the effects of fluctuating light on photosynthetic and resistance physiological characteristics of cucumber seedlings were investigated. The results showed that the maximum electron transfer rate (J) and net photosynthetic rate were significantly reduced by the different fluctuating light treatments, but there were no significant effects on stomatal conductance (G), intercellular CO2concentration (C), transpiration rate (T), photorespiration rate (R) and CO2compensation and saturation points. At the same time, fluctuating light significantly increased the malondialdehyde and H2O2contents of cucumber seedlings, and increased the rate of superoxide anion scavenging and the activities of antioxidant enzymes such as superoxide dismutase (SOD), peroxidase (POD) and catalase (CAD), and cucumber seedlings were more resistant to stress under frequent light than under moving light treatment. In conclusion, although fluctuating light will reduce the net photosynthetic rate of cucumber seedlings, it will improve their own resistance to stress, so the effects of fluctuating light should be understood comprehensively and objectively in cucumber factory nurseries.
Cucumber; light sensitivity;resistance physiology
S642.2
A
1000-2324(2022)06-0918-07
2022-01-05
2022-03-15
国家自然科学基金项目(31872154, 31902092);中国农业科学院科技创新工程(34-IUA-03)
康红旗(1995-),男,硕士研究生,研究方向:设施蔬菜生理生态. E-mail:kanghongqi2022@163.com
Author for coorespondence.E-mail:liqingming@caas.cn; lbroom@163.com
10.3969/j.issn.1000-2324.2022.06.017

