凤型大曲储藏期不同部位理化指标及微生物群落演替规律分析
张 艳,曹 丹,孟勤燕,张永利,闫宗科
(陕西西凤酒股份有限公司,陕西凤翔 721406)
近年来,各香型白酒对大曲培曲过程中理化指标[1]、功能性酶活性[2]、风味物质产生[3]及微生物菌群结构[4-5]研究较多,但对大曲储藏过程中各项质量指标的变化规律研究甚少。有研究表明[6-8],大曲经过一个月的培曲发酵,形成了多菌共存的微生物环境,使曲坯中含有大量生酸菌等杂菌,因而大曲培曲结束后必须经过一段时间的储存后熟期,待曲坯的各项生理生化指标及微生物菌群结构经过自然选择趋于稳定后投产,避免因部分杂菌增殖造成酒醅生酸过猛,影响基酒质量及产能;储存期间部分有益微生物会继续增殖进而产生多种酶系,这些酶系在酒醅发酵时不仅有助于原料的利用,还能促进白酒香气的形成。研究表明大曲储藏期对大曲质量具有重要影响。为了从理论方面进一步提高对凤型大曲的认识,构建以微生物群落结构为中心,辐射理化指标的理论构架,本研究在前期研究的基础上,追踪凤型大曲储藏阶段理化指标及微生物菌群环境的动态变化规律,综合分析凤型大曲储藏过程对白酒生产的重要价值,为后期功能微生物的筛选和凤香型白酒生产工艺的改进提供科学支撑。
1 材料与方法
1.1 材料、试剂及仪器
大曲样品:选取凤型大曲38#、64#两房出房大曲进行6个月的储存期跟踪。
试剂:乙酸钠、葡萄糖、斐林试剂、乙酸、可溶性淀粉等,均为分析纯。
仪器设备:冷冻高速离心机DH-2000R,上海德洋意邦仪器有限公司;生化培养箱SPX-250-Ⅱ,上海龙跃仪器设备有限公司;立式压力蒸汽灭菌器,上海博讯实业有限公司;恒温水浴锅SYG-2S,常州朗越仪器制造有限公司;电陶炉。
1.2 试验方法
1.2.1 取样
分别取储藏1~6 个月的大曲样品进行相关指标测定(储存4 个月的大曲样本因疫情影响未获得)。曲块外围样品粉碎作为曲皮样,中心样品粉碎作为曲心样,完整大曲粉碎作为混合样。
1.2.2 理化指标检测
理化指标测定参照QB/T 4257—2011《酿酒大曲通用分析方法》。
1.2.3 微生物群落多样性检测
大曲样品送上海派森诺生物科技有限公司进行微生物多样性检测。
2 结果与分析
2.1 凤型大曲储存阶段理化指标变化规律研究
2.1.1 水分变化规律
水是微生物繁殖代谢必不可少的物质,在大曲储藏期间参与到相关功能酶系及风味物质的合成过程[9]。从图1 可以看出,曲皮水分流失较快,整个储藏过程中始终低于曲心,整体变化规律基本一致。与储藏前相比,储藏过程中部分水分流失或被微生物利用,六个月后水分含量略有降低。混合样水分处于曲皮和曲心之间,变化规律与曲皮曲心基本相似。

图1 大曲储存期水分含量变化
2.1.2 淀粉含量变化规律
淀粉是微生物生长必不可少的营养物质,淀粉含量的变化可反映微生物对淀粉的利用情况,与大曲发酵储藏过程中糖化酶和液化酶活性关系密切[10]。由图2可知,储藏期间由于微生物的分解利用,大曲中淀粉含量随储藏期的延长整体呈下降趋势。储存前期大曲曲皮曲心微生物生长消耗淀粉,淀粉含量逐渐降低;后期曲心微生物受水分、氧气等影响,生长缓慢,淀粉利用率降低,含量稳定,曲皮微生物仍可消耗淀粉进行生长繁殖。
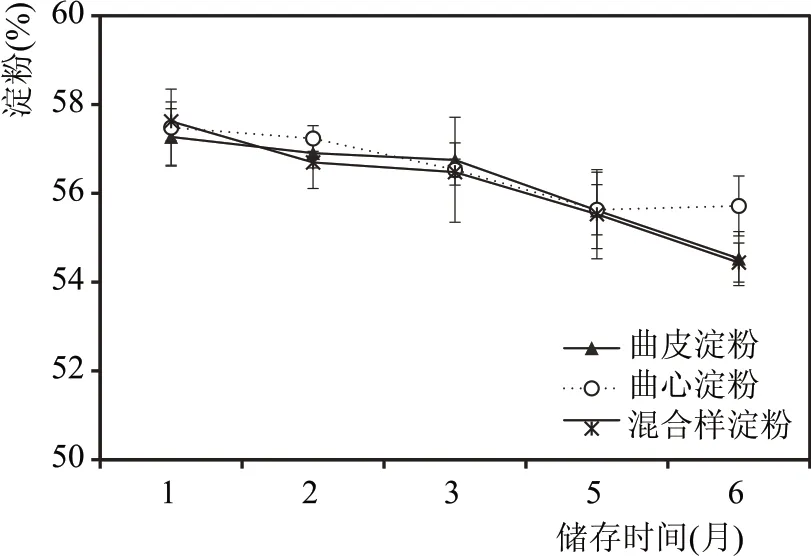
图2 大曲储存期淀粉含量变化
2.1.3 酸度变化规律
酸度是评价大曲质量好坏的重要指标。如图3所示,储藏前期大曲酸度有所降低,储藏至三个月时由于产酸微生物(主要是乳酸菌和醋酸菌)等代谢产生有机酸使大曲的酸度升高,后期由于水分、能量物质等的消耗以及代谢产物的积累,微生物生长受到抑制,部分有机酸被微生物利用以及参与到香味物质等的合成中,大曲酸度逐渐降低后趋于稳定。整体来看,大曲曲皮酸度高于曲心,主要与曲皮微生物相对丰度较高,繁殖较快有关。
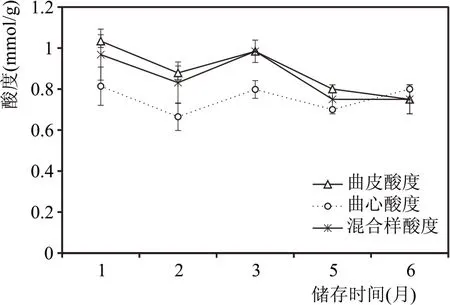
图3 大曲储存期酸度变化
2.1.4 糖化力变化规律
如图4 所示,随着储存时间的延长,受曲皮表面水分流失、温度变化等的影响,曲皮糖化力有所降低,储存至3 个月时,曲皮中霉菌繁殖使糖化酶活力增强,大曲糖化力明显升高,后期由于水分流失,营养物质消耗以及代谢产物的积累[11],微生物生长缓慢,使曲皮糖化力逐渐降低后趋于稳定。曲心水分、温度等受环境影响较小,糖化力变化较小,储存3 个月时曲心内部霉菌增殖使糖化力略有升高,后期逐渐趋于稳定。整个储藏过程中,曲皮糖化力始终高于曲心。混合样大曲的糖化力变化规律与曲皮相似,表征曲坯在储存期间糖化力的基本变化情况。

图4 大曲储存期糖化力变化
2.1.5 发酵力变化规律
大曲发酵力与酵母菌关系密切,发酵力高低直接关系到出酒率的高低[12]。由图5可知,储藏初期,大曲发酵力处于较低水平,随着曲坯中酵母菌等微生物的增殖,曲皮曲心发酵力有不同程度提高;储藏2 个月后,由于水分、氧气以及环境等的变化,微生物生长受到抑制,曲皮曲心发酵力有所降低;后期微生物菌群动态变化使得大曲发酵力又有所升高。整个储藏过程中,曲皮发酵力始终高于曲心,结合微生物多样性分析,可能与凤型大曲曲皮中乳酸菌相对丰度高于曲心有关。大曲混合样的发酵力始终处于曲皮和曲心之间,变化趋势同曲心基本相似。

图5 大曲储存期发酵力变化
2.1.6 酯化力变化规律
大曲酯化力高低受细菌影响较大,关系到大曲风味物质及其前体物质的产生[13]。从图6 可以看出,整个储藏过程中曲皮曲心的酯化力变化基本一致,曲心酯化力始终高于曲皮,混合样酯化力介于曲心和曲皮之间。储藏前期两房大曲酯化力都较低,随着储藏期的延长,大曲中微生物繁殖产生大量酶系,酯化力逐渐增强,储存至3 个月时酯化力达到较高水平,在随后的储藏过程中,受环境及大曲自身温度、水分条件的影响,大曲酯化力逐渐降低后趋于稳定直至储存期结束。这与李洁等[14]的研究结果相吻合。
2.2 凤型大曲储存阶段微生物群落结构演替规律分析
2.2.1 真菌微生物群落结构演替规律分析
2.2.1.1 物种分类学分析
由图7 可知,大曲储存阶段曲坯中真菌群落归属于4 个菌门,分别为子囊菌门(Ascomycota)、毛霉亚门(Mucoromycita)、担子菌门(Basidiomycota)、被孢霉菌门(Mortierellomycota)。储存期大曲曲皮中Ascomycota 占绝对优势,相对丰度在85 %以上,Mucoromycita 占比在9.68%以上,Basidiomycota、Mortierellomycota 占比极小;曲心中Ascomycota 占比达99.9%以上;混合样中Ascomycota 占比在98 %以上,含有少量的Mucoromycita,占比在1%左右。

图7 储存期大曲门水平真菌群落结构分布
大曲中微生物种类繁多,不同菌群间相互作用不仅促进了大曲的成熟,而且产生众多酶系为白酒发酵提供动力[15]。从图8 可以看出,储藏期曲坯中真菌属种类较少,曲皮曲心种群丰富度差异较大,但均以Thermoascus(嗜热子囊菌)为主,大曲在发酵过程中经过大火期,高温条件使大部分微生物死亡,耐高温的Thermoascus得以存活。大曲储藏1个月时曲皮中优势菌群除Thermoascus外,还有一定量的Aspergillus(曲霉菌属)、Pichia(毕赤酵母属)以及Rhizopus(根霉菌属),后随着储存期的延长,曲皮中优势菌群Thermoascus占比略有降低,直至储存六个月时又有所升高;Aspergillus相对丰度在储存两个月时迅速降低直至储藏期结束,占比均在1 %以下;Pichia和Rhizopus占比在整个储藏过程中变化不大。由于曲心内部受水分、温度变化影响较小,微生物数量变化不明显,曲心菌群中Thermoascus和Aspergillus占绝对优势,整个储存过程中相对丰度达99 % 以上;混合样中Thermoascus始终占主导地位,储存期相对丰度在46.96 %~60.90%之间,呈先增大后降低的趋势,在储存的第三个月相对丰度最大,Aspergillus和Pichia也占有一定比例,随着储存时间的延长,Aspergillus与Thermoascus相对丰度呈现此消彼长的变化趋势,Pichia在整个发酵期相对丰度为8.11 %~14.34 %。大曲中优势微生物对白酒酿造至关重要,不同大曲中优势菌属不同形成了不同香型的白酒[16-17]。

图8 储存期大曲属水平top10真菌组成柱状图
2.2.1.2 Alpha多样性分析通过Illumina高通量测序对凤型大曲储存阶段曲坯不同部位真菌群落进行多样性分析,在97 %相似度水平下对序列聚类并进行OTU 划分,结果见表1。

表1 大曲储存阶段不同部位真菌Alpha 多样性指数
Alpha 多样性是对单个样本内微生物群落进行多样性和丰富度分析。表1 中coverage 数值在0.999957~0.999994 之间,表明本次测序结果能完整反映储存期大曲中真菌菌群组成的真实情况。由表1 可知,大曲储存阶段曲皮、曲心及混合样品中真菌群落丰富度随储存时间的变化呈现不同的变化规律,多样性受储存时间影响较小。整体来看曲皮中真菌群落多样性和丰富度明显高于曲心,混合样品居于曲皮和曲心之间,接近曲皮。大曲储存期是曲坯后熟阶段,出房新曲中含有的真菌在储存阶段经过自然生长消亡逐渐达到平稳状态,大曲的生化性能等也逐渐趋于稳定,为后期酒醅发酵提供动力基础[18]。
2.2.1.3 层次聚类分析
图9 是储存期大曲真菌群落层次聚类树及对应的属水平top10 物种丰度,根据0.2 聚类距离划分,图中所有样本被分为三大类,储存2 个月、3 个月、5 个月、6 个月的曲皮样本被分为一类,曲心样本被分为一类,混合样本、储存一个月的曲皮样本被分为一类,三大类下又被分为不同小类。整体而言,除QC1P 样本外,曲皮、曲心、混合样本分别被划分为不同类,说明储存期大曲曲皮、曲心、混合样中真菌群落组成及相对丰度存在明显差异。对比物种丰度图来看,混合样本中真菌组成主要包括Thermoascus、Aspergillus、Pichia、Rhizopus,曲心样本中真菌组成主要包括Thermoascus、Aspergillus,曲皮样本中真菌组成主要包括Thermoascus、Pichia、Rhizopus,不同类别下真菌菌群物种组成及相对丰度各不相同。
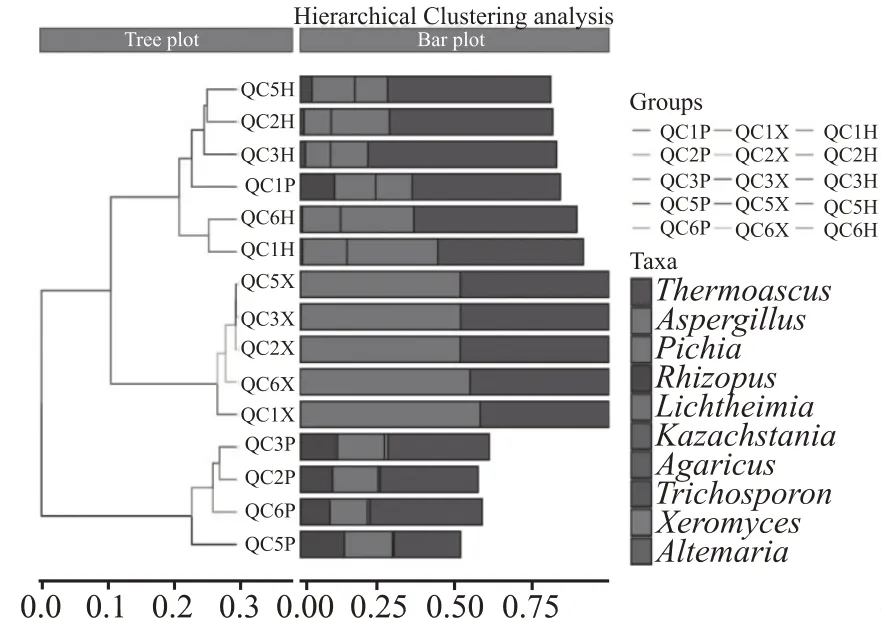
图9 储存期大曲样本中真菌聚类树图
2.2.2 细菌微生物群落结构演替规律分析
2.2.2.1 物种分类学分析
凤型大曲储存阶段门水平下共检出25 种细菌门,分别为厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、蓝藻门(Cyanobacteria)、拟杆菌门(Bacteroidetes)等。由图10可知,储存期大曲曲皮、曲心、混合样品中Firmicutes 为优势菌门,但相对丰度有所差异,曲皮占比56.83%~76.64%,曲心占比15.73%~30.13%,混合样占比63.89 %~71.99 %;Actinobacteria 和Proteobacteria 也占有一定比例,二者在曲皮和混合样中的相对丰度明显高于曲心,这主要是因为大曲培曲后期曲皮环境利于细菌生长,故相对丰度较高,曲心因高温缺氧抑制了细菌的生长,相对丰度较低。

图10 储存期大曲门水平细菌群落结构分布
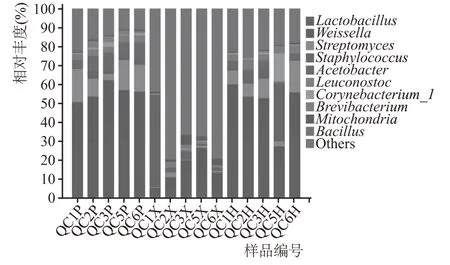
图11 储存期大曲属水平top10细菌组成柱状图
大曲储存期间细菌物种组成丰富,曲皮曲心细菌种类及占比差异较大。在整个储藏过程中,曲皮细菌主要以Lactobacillus(乳杆菌属)、Weissella(魏斯氏菌属)、Streptomyces(链霉菌属)为主,Lactobacillus在储藏3 个月时相对丰度增大至39.27 %,后期又降低至30 %左右,Weissella占比在20.88 %~26.48%;储藏前期曲皮中Staphylococcus(葡萄球菌属)占比极小,只有0.29 %,在储藏的第2 个月,对环境有所适应的微生物再次生长繁殖,Staphylococcus占比迅速增大至3.85%,直至储藏期结束相对丰度变化不大;Streptomyces在储藏的前期和后期相对丰度占比较大,但储藏2~3 个月时由于Lactobacillus、Acetobacter(醋杆菌属)等细菌的增殖,Streptomyces占比有所降低;曲皮中Brevibacterium(短杆菌属)和Corynebacterium(棒状杆菌属)在储藏中期相对丰度明显增大,后期随着曲皮水分流失及微生物衰亡,相对丰度降低。曲心细菌主要以Lactobacillus和Weissella为主,随着储藏期延长,二者相对丰度呈现先增大后减小的趋势,这可能是大曲培曲阶段曲心内部细菌受条件限制繁殖情况较曲皮弱,营养物质消耗少,储存阶段曲心细菌会小幅度增殖,至储存6 个月时随着营养物质消耗、产物积累等生长环境变化抑制了其进一步生长繁殖,相对丰度降低;储藏前期Staphylococcus占比达到48 %,但从第2 个月开始占比迅速降低至2 %,直至储藏期结束占比一直较低,这可能是因为Staphylococcus生长对氧气、水分等的需求较大,其他微生物的生长对氧气等的消耗抑制了它的生长。储存5 个月的混合样中Staphylococcus和Corynebacterium占比较大,区别于其他月份。混合样中细菌主要以Lactobacillus、Weissella和Streptomyces为主,占比60.54%~72.48%。大曲储藏过程中细菌群落结构在自然环境下不断调整,形成最佳的微生态环境,为后期酿造发酵提供动力基础[19]。
2.2.2.2 Alpha多样性分析
通过Illumina高通量测序对储存期大曲样本进行细菌多样性分析,在97 %相似度水平下对序列聚类并进行OTU划分,结果见表2。
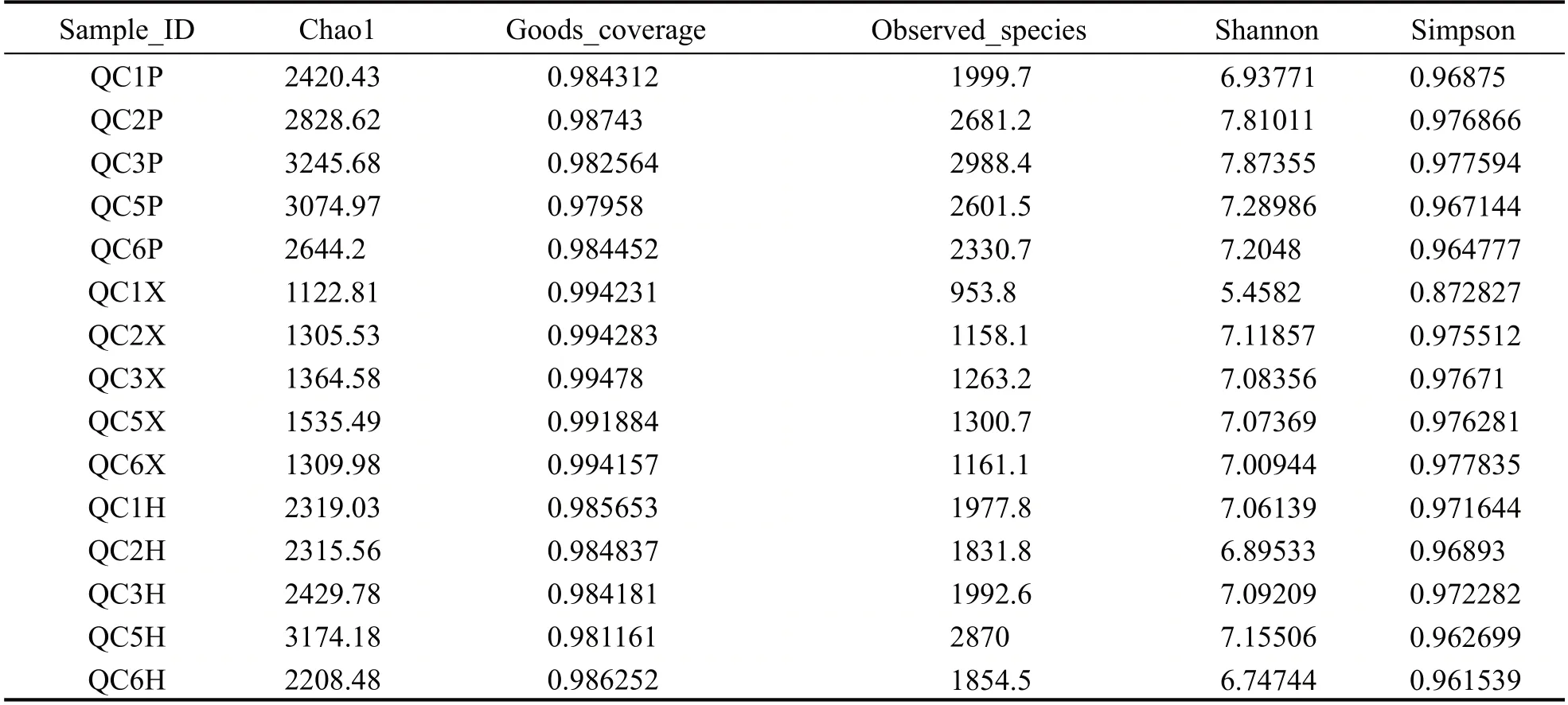
表2 储存大曲细菌Alpha多样性指数
对储存期大曲中不同部位的细菌菌群进行Alpha 多样性分析,结果见表2。表中coverage 数值在0.97958~0.99478 之间,表明本次测序结果能完整反映储存期大曲中细菌菌群组成的真实情况。Chao1 和Observed_species 指数反映了大曲中细菌的丰富度,从表2 可以看出,储存期大曲曲皮中细菌丰富度高于曲心和混合样,且随着储存时间的延长,曲皮、曲心、混合样中细菌丰富度均呈现先增大后降低的趋势,这与储存期大曲中真菌丰富度的变化规律相同,表明大曲储存期间仍有部分真菌和细菌继续增殖,通过自身不断的代谢调整逐渐形成稳定的微生物群落结构[20]。储存一个月的曲皮曲心中细菌多样性较低,第2 个月开始随着微生物增殖,细菌多样性有所增大。
2.2.2.3 层次聚类分析
对储存期大曲中细菌群落基于Weighted Unifrac 距离算法进行层次聚类分析,可直观反映各样本之间的相似性。根据0.25 聚类距离划分,图12中所有样本被分为两大类,每一类下又被分为多个小类,同一分支的样本表明其相似性高。整体来看,曲心样本中细菌群落结构组成和曲皮样本差异较大,混合样本的相似性和曲皮较为相似,对应属水平top10 物种丰度图可知,这种差异主要源于大曲不同部位细菌组成的多样性和丰富度。

图12 储存期大曲样本中细菌聚类树图
3 结论
本试验对凤型大曲储存后熟期的理化指标和微生物菌群演替规律进行了研究,结果表明:凤型大曲储藏期微生物会小范围增殖,大曲水分下降5%左右,曲心始终高于曲皮;微生物对淀粉的利用率在2%~7%之间;储存期大曲中酸、醇等物质相互作用,使曲坯酸度在储存结束后有所降低;储存期大曲糖化力、发酵力曲皮高于曲心,酯化力曲心较曲皮高,储藏2~3 个月时随着微生物的变化,糖化力、发酵力、酯化力较高,后期逐渐趋于稳定。储存期大曲曲皮和曲心中真菌群落结构组成不同,曲皮以Thermoascus、Pichia、Rhizopus为主,相对丰度占比52 %~84 %,曲心以Thermoascus、Aspergillus为主,占比99 %以上。对比培曲阶段曲坯真菌群落结构来看[21],储存阶段曲皮真菌结构组成变化较大,由出房曲的以Thermoascus、Issatchenkia为主演变为以Thermoascus、Pichia、Rhizopus为主,曲心微生物优势菌属始终为Thermoascus和Aspergillus。储存期大曲中曲皮曲心细菌组成种类相似,均以Lactobacillus、Weissella、Streptomyces为主,但相对丰度占比差异较大,曲皮在77%~88%之间,曲心在20 %~55 %之间。Alpha 多样性结果进一步表明储存期大曲曲皮微生物多样性较曲心高。聚类分析结果表明凤型大曲曲皮、曲心中微生物多样性和丰富度存在明显差异。

