TRPV4在眼科疾病中的研究进展
王 烽,赖江峰,曹玲英,邵 毅
0 引言
瞬时受体离子通道是果蝇视觉传导研究中首次发现的一组蛋白质超家族结构,主要位于质膜上[1]。瞬时受体电位(TRP)超家族根据氨基酸同源性细分为七个亚家族:TRPC(canonical),TRPV,TRPM(melastatin),TRPN(NOMPC),TRPA(ANKTM1),TRPP(polycystin) and TRPML(mucolipin)[2]。瞬态电位受体香草醛4(TRPV4)是一种广泛表达、多模门控、非选择性阳离子通道,适用于钙、钠、钾和镁等离子。各种刺激因素,如适度的热量、渗透压、细胞肿胀、内源性和外源性化合物,都会影响TRPV4的活性。TRPV4通道能够在无刺激的情况下被激活,并参与多种生理功能,包括渗透压调节、Ca2+稳态、凋亡和自噬[3]。TRPV4在眼球各种组织中表达,包括角膜、晶状体、睫状体、小梁网和视网膜,由于其在各种生理功能中的作用,TRPV4已成为许多疾病状态的一个有吸引力的靶点[4]。越来越多的研究发现,TRPV4通道在多种眼病中发挥调控作用,本文就TRPV4信号通道在近年来眼科疾病中的研究进展进行综述,为眼科疾病的病理机制研究及治疗提供思路。
1 TRPV4与角膜上皮损伤
角膜对温度、机械和化学等刺激的感受依赖于各种伤害性感受器[5]。角膜上皮是覆盖角膜的一层上皮细胞,负责保护角膜免受环境危害。泪膜渗透压的变化会损害组织的完整性,最终导致视力障碍[6]。研究表明,角膜上皮细胞可通过激活各种离子通道来调节损伤后的角膜[6]。TRPV4是参与渗透压的重要离子通道,而TRPV4表达仅限于角膜上皮最外层的非典型结构域,因此其功能对角膜上皮内紧密连接的形成至关重要[7]。Luka等研究了小鼠角膜上皮细胞的肿胀、温度、应变和化学转导机制,结果发现通过TRPV4的钙离子流入转导角膜上皮的渗透和热输入,并促进半通道依赖性ATP释放[8]。因此TRPV4-半通道-ATP信号轴可能调节过度机械、渗透和化学刺激引起的角膜疼痛。此外,Pan等[9]使用siRNA敲除TRPV4基因时,发现角膜上皮细胞的调节容积减少(regulatory volume decrease,RVD)活性会受到抑制,这提示TRPV4在调节角膜上皮内的渗透压方面起着重要作用。角膜的损伤会导致炎性细胞因子的释放,从而导致纤维化。Okada等[10]使用TRPV4拮抗剂治疗角膜碱烧伤的小鼠,免疫组织化学显示,小鼠的角膜瘢痕形成和炎症明显减少,研究结果显示通过阻断TRPV4通道激活可能有助于角膜碱烧伤伤口愈合过程中发生的严重纤维化和炎症反应。Okada等[11]建立了神经营养性角膜病的小鼠模型,发现敲除TRPV4基因抑制了小鼠角膜上皮修复,而将TRPV4基因插入受损的三叉神经可通过上调神经生长因子恢复角膜上皮的愈合,这说明TRPV4可能是改善严重损伤引起的角膜伤口愈合结果的潜在药物靶点。上述研究表明,TRPV4通道在角膜上皮细胞感知外在压力源及角膜损伤的愈合修复中都发挥着重要的作用(图1)。
2 TRPV4与青光眼
青光眼是一种不可逆的致盲性眼病,由眼压间歇性或持续性升高导致视网膜神经节细胞(retinal ganglion cells,RGC)凋亡,视神经萎缩,最终导致视野缺损[12]。眼压的形成与房水循环密切相关,房水动力学异常,会引起病理性眼压升高[13]。研究证实,TRPV4通道在调节眼压功能方面具有关键作用,TRPV4通道在睫状体非色素睫状上皮(non-pigment epithelium,NPE)中选择性表达,负责感知渗透性改变和分泌房水,因此这对于滋养眼睛的无血管结构和将眼压维持在生理值范围内非常重要[14]。Andrew等发现小鼠NPE细胞肿胀产生的低渗效应可以直接触发TRPV4介导的Ca2+向内流动,TRPV4通道可以被PLA2途径释放的花生四烯酸(arachidonic acid,AA)间接激活,最终导致房水的大量产生,这结果可能为房水分泌和眼压调节的机制提供新的见解[14]。Hanan等探讨了TRPV4激动剂GSK1016790A在人类非色素睫状上皮细胞衍生的细胞系中调节褪黑激素产生的作用,结果发现TRPV激动剂可导致人NPE细胞中褪黑激素的细胞外水平呈浓度依赖性增加[15]。而褪黑激素可以通过该组织中存在的褪黑激素受体,减少睫状上皮产生氯化物的增加来降低眼压[16]。青光眼的标志是RGC的死亡,免疫化学表明,大量的TRPV4位于RGC中的视神经乳头和轴突的神经纤维层。研究发现,TRPV4激动剂会增加RGC的放电率,导致Ca2+流入,这些通道的持续激活会导致RGC死亡[17]。Taylor等[18]通过免疫组织化学标记物以及形态学染色评估TRPV4活性,对视网膜变性体外模型中神经元和神经胶质激活的调节作用,研究结果发现抑制视网膜内的TRPV4显著提高了神经节细胞的存活率,改善了视网膜层状结构的维持并减弱了胶质细胞反应,这表明抑制TRPV4可用作青光眼的潜在治疗方法。此外,研究发现TRPV4通道与小梁网(trabecular meshwork,TM)内的机械传导有关,其中TM细胞的拉伸或通过TRPV4激动剂的激活会导致Ca2+内流、黏着斑激酶(focal adhesion kinase,FAK)的磷酸化、纽蛋白的重组和应力纤维的重塑[16],这些都对维持眼压至关重要。Ryskamp等[19]应用生化和功能分析将TRPV4定位到原代人类TM(hTM)细胞的质膜,结果发现,当钙离子升高时,TRPV4激活会导致小梁网细胞中的应力纤维和黏着重塑,而GSK1处理的3D小梁网模型会增加F-肌动蛋白应力纤维的形成和纤维连接蛋白的表达,TRPV4拮抗剂可以减弱这些影响,并且发现眼内注射TRPV4拮抗剂可降低青光眼小鼠眼睛的眼压,并保护视网膜神经元免受眼压诱导的死亡。因此,上述研究表明TRPV4是传统流出通路中潜在的眼压传感器,同时也是治疗青光眼降低眼压和保护神经节细胞免受损伤的新靶点(图2)。
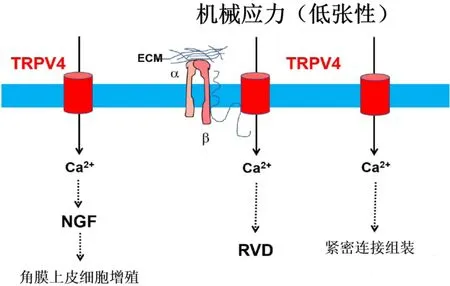
图1 TRPV4通道在角膜上皮的维持和修复中的激活机制 低张力诱导的机械应力激活TRPV4通道,通过调节体积减少(RVD)使细胞体积正常化。角膜上皮中TRPV4的激活导致Ca2+内流,导致跨上皮阻力增加,这是紧密连接组装所需的,也与神经生长因子的释放和角膜上皮细胞的增殖有关。
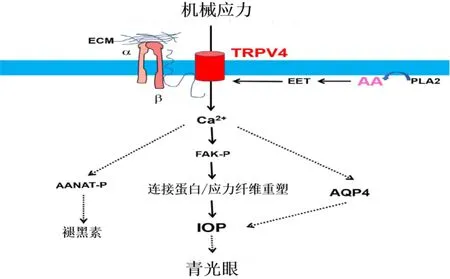
图2 TRPV4通道在睫状体/小梁网中的激活机制及作用 渗透性细胞膨胀拉伸质膜并激活PLA2酶,PLA2酶将磷脂分解为花生四烯酸(AA)及其代谢产物EET。EET激活TRPV4通道,导致Ca2+内流和随后的信号级联。TRPV4介导的钙流入依赖的FAK磷酸化诱导连接蛋白重组和应力纤维重塑,这与眼压(IOP)的升高有关。TRPV4介导的Ca2+内流激活AQP4也有助于眼压的维持。此外,TRPV4的激活涉及N-乙酰基转移酶(AANAP-P)的磷酸化,导致褪黑激素的产生。
3 TRPV4与年龄相关性白内障
白内障是透明晶状体内部的混浊,会改变晶状体的透明度和折射率,从而导致严重的视力障碍[20]。晶状体的透明度和折射特性由内部微循环系统提供的细胞生理学维持,老化对晶状体运输、离子降解和水分稳态产生负面影响,并导致晶状体水分含量的变化。这会改变晶状体的性质,导致光学质量和调节幅度的变化,最初会导致中年老视,最终表现为年龄相关性白内障[21]。研究表明,TRPV1和TRPV4是晶状体中重要的渗透压调节剂,通过调节钠转运活性来响应静水压力的变化[22]。TRPV4表达最初被认为定位于晶状体的上皮细胞中[23],然而Nakazawa等[24]对晶状体冷冻切片进行免疫标记,证实了TRPV4在晶状体的所有区域都有表达。Chen等[25]测试了牛晶状体中的压力反馈调节机制以及是否会调节整体晶状体的光学特性,研究结果表明,TRPV4介导的晶状体静水压力反馈控制可以确保晶状体水传输的任何波动,以及因此产生的水分含量,不会导致晶状体功率的变化,从而导致整体视觉质量的变化。因此,研究表明TRPV4是维持晶状体内稳态所必需的。Nakazawa[26]研究了白内障形成有效的关键化合物,发现由Na+/K+-ATP酶控制的晶状体静水压力的相关变化有助于延缓白内障的发展。在晶状体中,Na+/K+-ATP酶已被证明受TRPV4调节,如果晶状体中负压持续存在,那么Na+/K+-ATP酶活性会降低,相反,TRPV4检测晶状体中的正压并引导依赖P2Y/SFK的级联反应,导致Na+/K+-ATP酶活性增加,从而钠从上皮细胞中运输出来,以恢复压力,而渗透压的变化对晶状体微循环极大影响。因此上述研究提示TRPV4在白内障的发展中发挥重要作用,可以作为预防和延缓白内障的新靶点(图3)。
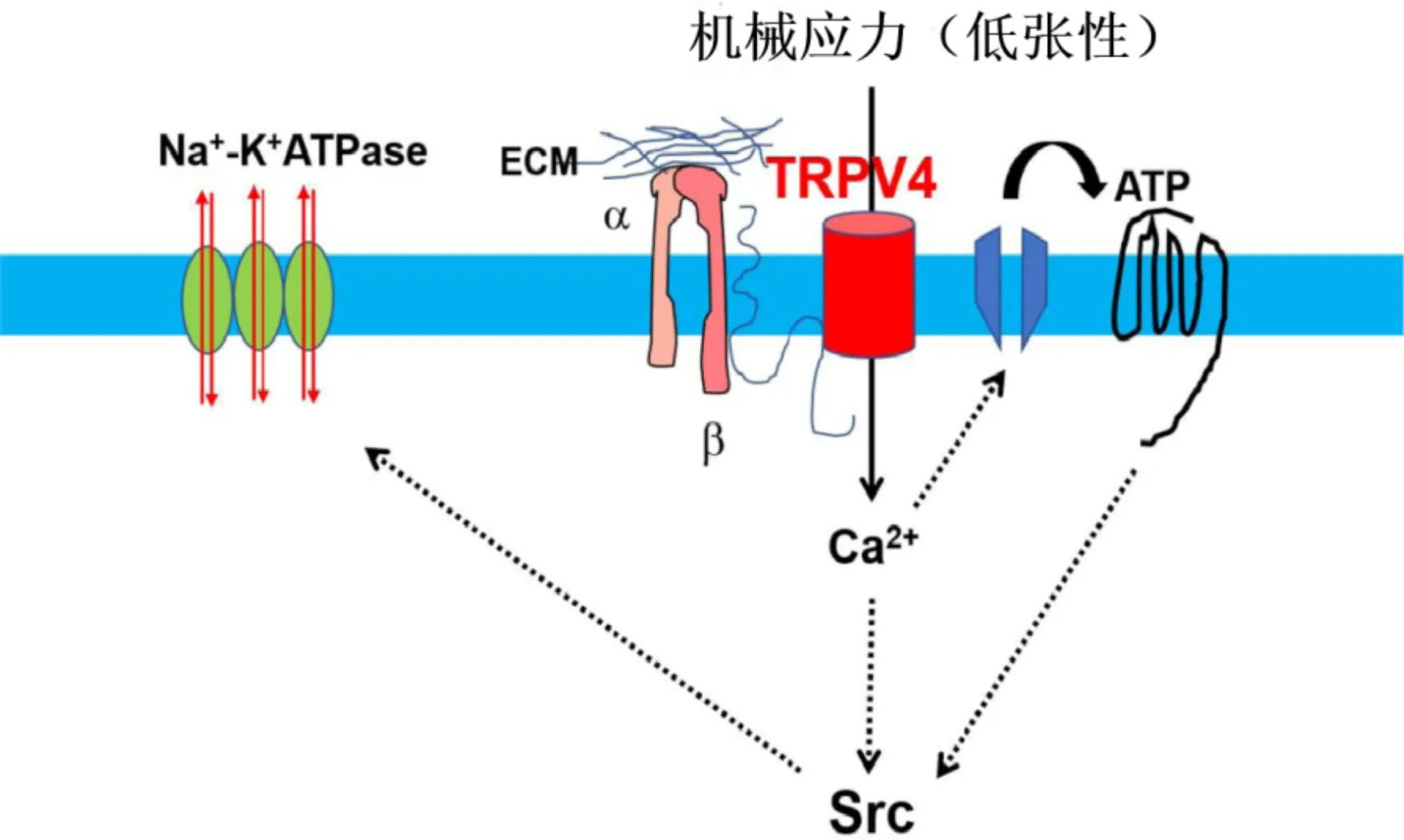
图3 晶状体TRPV4通道对离子和水稳态的调节机制 TRPV4在渗透压或晶状体上皮损伤时被激活,TRPV4介导的钙内流通过连接蛋白和泛素连接蛋白半通道诱导ATP释放。然后ATP结合嘌呤能受体并诱导Src依赖性Na+/K+-ATP酶激活,恢复晶状体中的压力和离子稳态。
4 TRPV4与视网膜疾病
4.1TRPV4与糖尿病视网膜病变糖尿病视网膜病变(diabetic retinopathy,DR)是一种威胁视力的糖尿病并发症,也是导致视力丧失的主要原因[27]。糖尿病视网膜病变的主要发病机制不仅涉及视网膜血管的结构改变,还涉及血管周围神经元或神经胶质组织的功能障碍[28]。使用连续固定焦点视网膜电图,RGC和双极细胞在早期糖尿病视网膜病变中表现出异常活动。此外,RGC和Müller细胞(一种视网膜神经胶质细胞)显示凋亡增加[29]。TRPV4在小鼠的RGC、Müller细胞和视神经头中表达[30-31]。TRPV4在视网膜内充当代谢、渗透、机械和炎症信号的哨兵,并参与调节一系列病理生理功能,如RGC和光感受器的丧失、Müller细胞的肥大和病理性肿胀,以及BRB的维持。Lakk等[30]研究发现,TRPV4可以在Müller细胞中介导胆固醇依赖性多模式转导。此外,高胆固醇血症视网膜表现出类似的病理学,包括反应性胶质增生、视网膜微血管内皮屏障通透性升高、RGC变性和病理性胶质肿胀,以及TRPV4过度激活。Ryskamp等[17]的研究表明,RGC中TRPV4的激活介导了对膜拉伸的反应,导致细胞内Ca2+水平升高,兴奋性增强。持续暴露于TRPV4激动剂会导致过度的Ca2+内流,这可能会激活Ca2+依赖性促凋亡信号通路,并在RGC中诱导时间和剂量依赖性凋亡。而DR的主要特征之一是血-视网膜屏障(blood-retinal barrier,BRB)的破坏,从而导致血管源性水肿和神经组织损伤。Kevin等通过定量PCR和免疫染色证明TRPV4在培养的牛视网膜微血管内皮细胞中的功能性表达,并且通道表达和活性都被高血糖下调,研究结果表明TRPV4功能的丧失可能导致糖尿病中的内皮功能障碍[32]。Arredondo Zamarripa等[33]评估了玻璃体内注射TRPV4拮抗剂在链脲佐菌素诱导的糖尿病小鼠视网膜BRB分解的结果,发现TRPV4拮抗剂可将BRB分解缓解至与血管抑制素相似的水平,结果表明TRPV4拮抗剂和血管抑制素通过激活互补途径协同作用,抵消了对RPE通透性的影响。Ordua等[34]评估了TRPV4抑制剂是否可消除链脲佐菌素诱导的糖尿病小鼠的视网膜水肿,结果显示TRPV4基因敲除小鼠中的视网膜变薄,这表明TRPV4的缺失可消除视网膜水肿,有助于控制糖尿病视网膜病变中BRB分解和水扩散增加的发展。总之,这些研究强调TRPV4是治疗糖尿病视网膜病变的潜在靶点。
4.2TRPV4与视网膜脱离视网膜脱离(retinal detachment,RD)可导致感光细胞死亡,从而导致视力下降,其中神经元和神经胶质的病理性肿胀是RD的一个重要特征[35]。Müller细胞是贯穿视网膜全层的主要神经胶质细胞,Müller细胞的神经源潜能可通过其靶向特异性激活相应信号通路,启动胶质反应去分化为神经元[36]。Matsumoto等[37]建立了急性RD小鼠模型以研究RD引发的感光细胞死亡的分子机制,研究结果发现敲除了TRPV4的小鼠中视网膜凋亡光感受器的数量相较于野生型小鼠减少了约50%。研究显示在Müller胶质细胞中表达的TRPV4可以被RD诱导的这些细胞肿胀引起的机械刺激激活,导致细胞因子MCP-1的释放,据报道它是Müller胶质细胞衍生的介质RD诱导的光感受器死亡的强介质。并且体温的升高可以显著提高TRPV4通道的敏感性。因此,敲除TRPV4可以抑制RD病理条件下的细胞死亡,并表明Müller神经胶质细胞中的TRPV4可能是防止RD后感光细胞死亡的新治疗靶点。
4.3TRPV4与早产儿视网膜病变早产儿视网膜病变(retinopathy of prematurity,ROP)是儿童失明的最常见原因之一,它是一种分两个阶段发生的血管增生性疾病。首先,早产使婴儿处于相对高氧的环境中。高氧会减少视网膜中包括血管内皮生长因子(vascular endothelial growth factor,VEGF)在内的生长因子的产生,从而导致血管成熟延迟。其次,随着视网膜的成熟,增加的代谢活动使现有血管的氧合供应不足,导致视网膜缺血。这反过来导致VEGF的产生增加,从而导致异常的新生血管增殖[38]。O’Leary等[39]研究了TRPV4通道对视网膜血管生成的作用,发现在早产儿视网膜病变的小鼠氧诱导缺血性视网膜病变(oxygen-induced ischemic retinopathy,OIR)模型中,通过玻璃体内注射TRPV4抑制剂可抑制早产儿视网膜病变小鼠模型中缺血驱动的新生血管形成,同时增强缺血视网膜内的血管恢复。这可能为早产儿视网膜病变的治疗干预提供新的靶点(图4)。
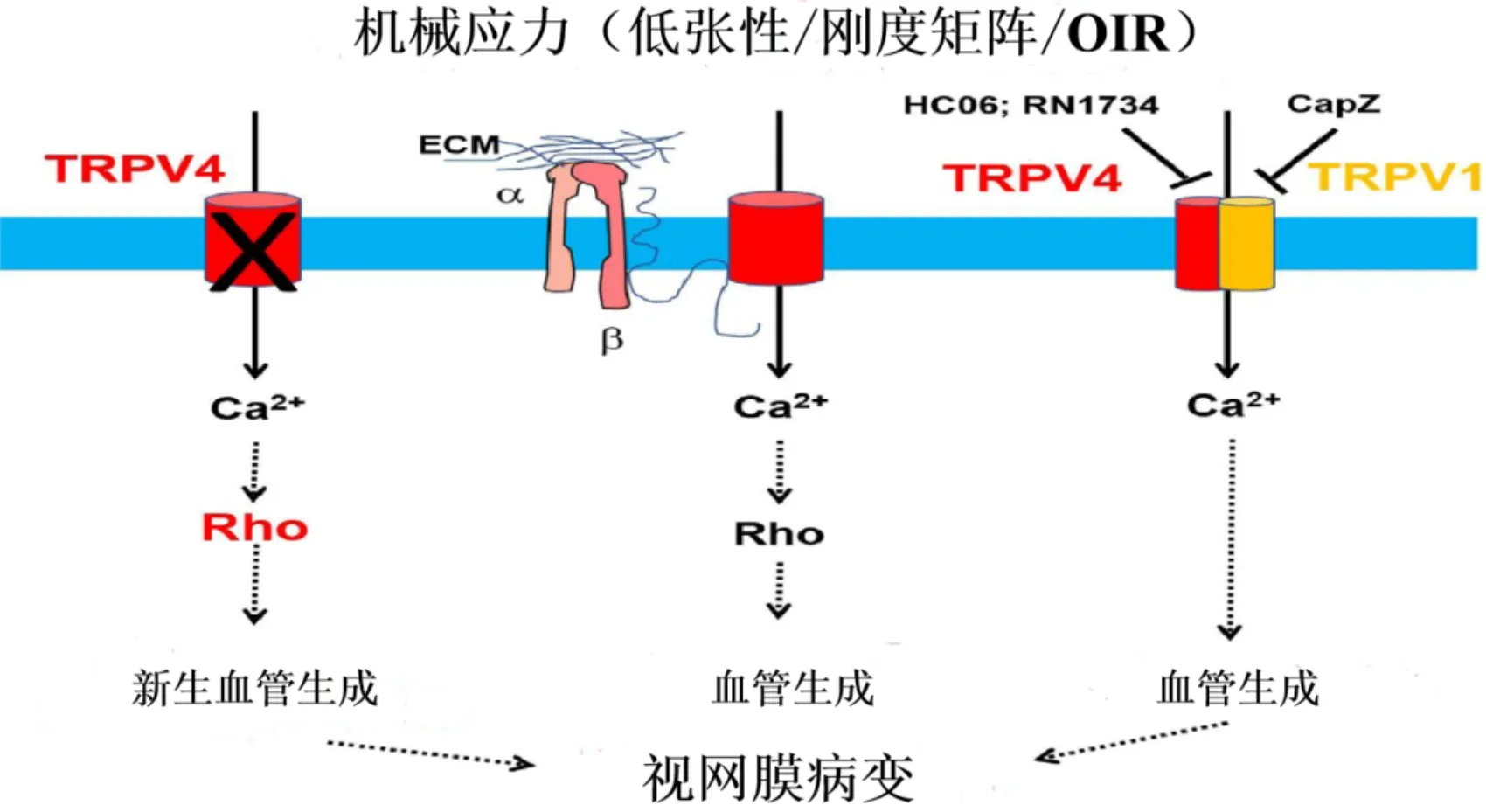
图4 TRPV4通道调节视网膜血管生成机制 TRPV4保持内皮细胞中Rho/Rho激酶活性在最佳水平,从而导致生理(最佳)血管生成。然而,TRPV4的减少或缺失导致机械感应异常,增强Rho/Rho激酶活化,导致血管生成异常,这可能导致视网膜病变。TRPV4在视网膜内皮细胞中与TRPV1通道形成异聚体通道,抑制这两种通道可以抑制OIR诱导的异常血管生成。
5 总结和展望
综上所述,研究证明TRPV4通道在维持正常的眼部生理机能和在眼部疾病发生发展中都发挥了非常重要的作用,TRPV4是组成型表达并且能够在无刺激的情况下自发激活,这与它通过调节细胞Ca2+水平以及细胞内水平衡来参与控制稳态功能有关。TRPV4在眼球不同的细胞类型中表达,这表明它在正常生理条件下具有多种活性。例如,TRPV4可检测眼压、剪切应力的变化,并维持眼内的渗透压。基于其在眼部病变中的作用,TRPV4功能障碍是与这些疾病状态相关的表型变化的部分原因。但是由于目前对TRPV4通道在眼部结构中表达的定位以及具体机制还不是完全清楚,特别需要在视网膜病变和青光眼中的作用进行更多研究,TRPV4应被视为治疗眼部疾病的潜在靶点,相关的TRPV4抑制剂的开发也在相关眼病的治疗过程中显示出巨大的潜力,并为治疗眼病提供更多的帮助。

