持续低氧胁迫对长丰鲢血液指标和组织抗氧化酶活性及相关基因表达的影响
李晓晖,邹桂伟,梁宏伟,何萱,沙航,冯翠,崔峰*
持续低氧胁迫对长丰鲢血液指标和组织抗氧化酶活性及相关基因表达的影响
李晓晖1,邹桂伟1,梁宏伟1,何萱2,沙航1,冯翠1,崔峰2*
(1.中国水产科学研究院长江水产研究所,湖北 武汉 430223;2.安徽科技学院生命与健康科学学院,安徽 凤阳 233100)
将长丰鲢置于质量浓度为(2.0±0.5) mg/L的低溶解氧环境中,分析低氧处理后不同时间(0、3、6、12、24、36、48、60、72、84 h)长丰鲢的血液指标、脑和肝脏的抗氧化酶活指标及相关基因的表达变化。结果表明:持续低氧胁迫48 h,导致长丰鲢血液中血红蛋白质量浓度和白细胞数显著增加;血清中总抗氧化能力显著上升;低氧胁迫下,长丰鲢肝脏中GSHPX活性除36和48 h外均显著降低,且脑中GSHPX活性在24~60 h内显著低于对照组的;长丰鲢肝脏中CAT活性从36 h开始显著上升,而脑中CAT活性从6 h时开始上升,60 h及之后又显著下降;长丰鲢肝脏中SOD活性在低氧胁迫后3 h内迅速下降至最低值,之后呈缓慢上升趋势,但仍显著低于对照的,而脑中SOD活性从3 h时开始上升,除72 h时外,均与对照组的持平或显著高于对照组的;和在长丰鲢脑和肝脏中均有较高的表达,低氧胁迫下其表达量存在波动,但除个别时间点外,均显著高于对照组的。可见,在持续低氧胁迫下,长丰鲢通过增加血红蛋白质量浓度提高氧气运输能力,而这一生理响应可能受到及基因表达的调控,长丰鲢脑和肝脏组织中的抗氧化酶系统被激活,用来抵御持续低氧胁迫诱发的组织损伤。
长丰鲢;持续低氧胁迫;血液指标;抗氧化酶;基因表达
自然状况下空气中的氧气溶于水中以及水生生物光合作用产生氧气是水体溶解氧的主要来源。水体中溶解氧的含量通常很低,且季节、昼夜及生命体在水体中的呼吸作用等的变化都会导致溶解氧浓度的变化[1]。水体中的溶解氧浓度对于鱼类正常生长、发育和繁殖十分重要。对鱼类而言,一般水体中溶解氧水平需维持在4 mg/L以上,才能正常生长发育;当溶解氧水平低于2 mg/L时,大部分养殖鱼类会浮头;若溶解氧水平低于1 mg/L时,大部分鱼类会严重浮头,甚至窒息死亡[2]。
自然界中水环境的低氧现象时有发生[3]。目前,关于水体低氧对鱼类影响的研究主要集中在鱼类生理生化指标、氧化和抗氧化系统及低氧胁迫下机体的分子响应机制等。血液指标通常可用来评估鱼类的生理和病理变化情况[4]。在低氧条件下,鱼类血液中红细胞数、白细胞数和血红蛋白浓度显著增加,淋巴细胞、嗜酸性粒细胞比例下降,血清中肌酸激酶、谷草转氨酶、谷丙转氨酶、尿酸会显著增加[5]。鱼类在低氧胁迫下会出现非常强烈的应激反应,导致鱼体内产生过度活跃的自由基,从而导致蛋白质和核酸遭到破坏,甚至会引发基因复制错误等[5]。为减少氧化应激反应所带来的危害,鱼类机体内的抗氧化体系,尤其是其中的抗氧化酶体系发挥着重要的作用。谷胱甘肽过氧化物酶(GSH–Px)在抗氧化酶体系中的功能主要是去除在细胞中积累的过氧化物和有机过氧化物,同时超氧化物歧化酶(SOD)能够将应激反应产生的活性氧(ROS)自由基进行分解,再通过机体内的反应体系生成过氧化氢,而后再在过氧化氢酶(CAT)的作用下,过氧化氢被转化为H2O和O2,实现减少氧化应激反应所带来的危害[6]。鱼类应对缺氧胁迫时,机体会通过氧感受器和信号转导通路上调或者下调一些基因的表达,以适应环境的改变,保持内环境的稳定。其中,最关键的也是研究得最多的信号转导途径是低氧诱导因子(HIF)介导的转录激活反应途径,HIF–1蛋白和脯氨酸羟化酶(PHD)是HIF信号通路中的关键信号分子。HIF–1对氧含量很敏感,其通过与缺氧应答元件特异性结合,调控下游基因的转录,调控能量代谢、血管生成、细胞增殖与凋亡等生理过程,以适应低氧条件[7]。此外,PHD通过控制HIF–1α蛋白的稳定性和活性来响应低氧应激,在缺氧条件下,PHD蛋白的活性受到抑制,HIF–1α停止在细胞体中分解和聚集[8]。
长丰鲢()是中国水产科学研究院长江水产研究所采用人工雌核发育、混合选择和分子标记辅助选择相结合的综合育种技术培育出的养殖品种(品种登记号为GS01–001– 2010)[9]。与普通鲢相比,它具有生长快、出肉率高、体形好、适应性强、遗传性状稳定等特点,适合在全国范围内可控的淡水水体中养殖[10]。相较于其他鱼类,鲢耐低氧能力差,对水体溶解氧含量变化较为敏感,在养殖过程中易发生浮头和“泛塘”等缺氧现象,在运输的过程中若密度过高也极易发生缺氧,导致死亡[11]。目前,关于鲢耐低氧的研究尤其是持续低氧胁迫对长丰鲢生理生化指标及基因表达水平变化的影响等方面的研究还较少。笔者开展持续低氧胁迫对长丰鲢的生理水平影响及其应对低氧胁迫的组织抗氧化酶活和基因表达变化的研究,以期为鲢耐低氧性状改良和耐低氧新品种(系)的培育提供依据。
1 材料与方法
1.1 供试材料
供试长丰鲢体质量为(100±20) g,来自中国水产科学研究院长江研究所梁子湖试验基地。
1.2 方法
1.2.1试验设计
试验于2021年3月至4月在中国水产科学研究院长江研究所梁子湖试验基地进行。选取健康、无损伤的长丰鲢,在充分曝气的池塘水中驯养2 d。准备3个装有300 L水的水箱(水温(15±0.5) ℃),持续向水箱中充入氮气,待水中溶解氧降至(2.0±0.5) mg/L后,同时向水中通入氧气,使溶解氧维持在(2.0±0.5) mg/L不变,随后向每个水箱加入40尾驯养后健康的试验鱼。在持续低氧处理0、3、6、12、24、36、48、60、72、84 h时取样,其中0 h作为对照组。每个时间点分别在3个水箱中各随机选取3条鱼,共计9条鱼。同一个水箱中的3条鱼的样本进行混合,作为1个生物学重复。
1.2.2样品采集
取样前,用MS–222麻醉剂对低氧处理后的长丰鲢进行麻醉。采用尾静脉取血,为防止血液凝固,加入1%的肝素钠溶液抗凝。血样取出后,部分放入4 ℃冰箱内静置,24 h后上层血清析出,取上层血清于–20 ℃冰箱中保存,备用。采血后迅速解剖鱼体,取出脑和肝脏组织,装入干净无菌的样品管中,经液氮速冻后于–80 ℃冰箱保存,备用。
1.2.3酶活性及血液指标测定方法
取脑和肝脏各0.1 g,按1∶9的比例加入0.9%氯化钠水溶液,研磨后在超低温离心机中以2500 r/min离心10 min,上清即为10%的组织匀浆。采用南京建成生物工程研究所的试剂盒测定组织匀浆的酶活性。用红细胞稀释液和白细胞稀释液对全血进行稀释后,用血球计数板测量红细胞和白细胞的数量。采用南京建成生物工程研究所的血红蛋白测试液测定血清中血红蛋白含量。采用南京建成生物工程研究所的总抗氧化能力检测试剂盒测定血清的总抗氧化能力。
1.2.4总RNA提取和逆转录及荧光定量PCR检测
采用Trizol法提取总RNA;运用微量分光光度计NP80(德国,IMPLEN)测定RNA溶液的浓度和纯度;采用1%琼脂糖凝胶电泳检测RNA的完整性,将其分装后保存于–80 ℃冰箱中备用;采用HiScript Ⅱ QRT Super Mix for qPCR试剂盒将提取的脑和肝脏的总RNA反转录为cDNA,于–20 ℃保存;运用实时荧光定量PCR法检测各时间点脑和肝脏组织中、、、的表达量的变化。实时荧光定量PCR反应体系为20 μL,包括10 μmol/L上、下游引物各0.4 μL、cDNA模板1 μL、2×ChamQ Universal SYBR qPCR Master Mix 10 μL及ddH2O 8.2 μL。反应条件为:95 ℃预变性5 min;95 ℃变性5 s,60 ℃退火15 s,40个循环;72 ℃延伸30 s。以为内参基因最终结果采用2–ΔΔCt法[12]来进行相对表达量的计算。实时荧光定量PCR引物列于表1。

表1 试验中用到的引物序列
1.3 数据分析
试验数据运用Microsoft Excel 2019整理;运用SPSS 22.0进行单因素方差分析,不同时间点的数据进行LSD和Waller–Duncan多重比较。
2 结果与分析
2.1 低氧胁迫对长丰鲢血液指标和总抗氧化能力的影响
从表2可知,低氧处理后3 h,血液红细胞数相对于对照组显著(<0.05)下降,随后红细胞数开始上升,6 h时显著(<0.05)多于3 h的,之后又逐渐下降,24 h时最低,随后又显著(<0.05)增加,36 h时最多,36 h后基本稳定,除72 h时外,与对照组的差异均无统计学意义;低氧胁迫后0~24 h内,血液白细胞数无显著变化,除60 h外,36 h及之后血液白细胞数均显著(<0.05)高于对照组的;血红蛋白质量浓度在低氧胁迫3 h时显著(<0.05)下降,后逐渐上升,48 h时最高,之后保持较高水平,均显著(<0.05)高于对照组的;低氧处理后血清中的总抗氧化能力先显著(<0.05)上升,12 h时达到最高,随后开始下降,但均显著(<0.05)高于对照组的。
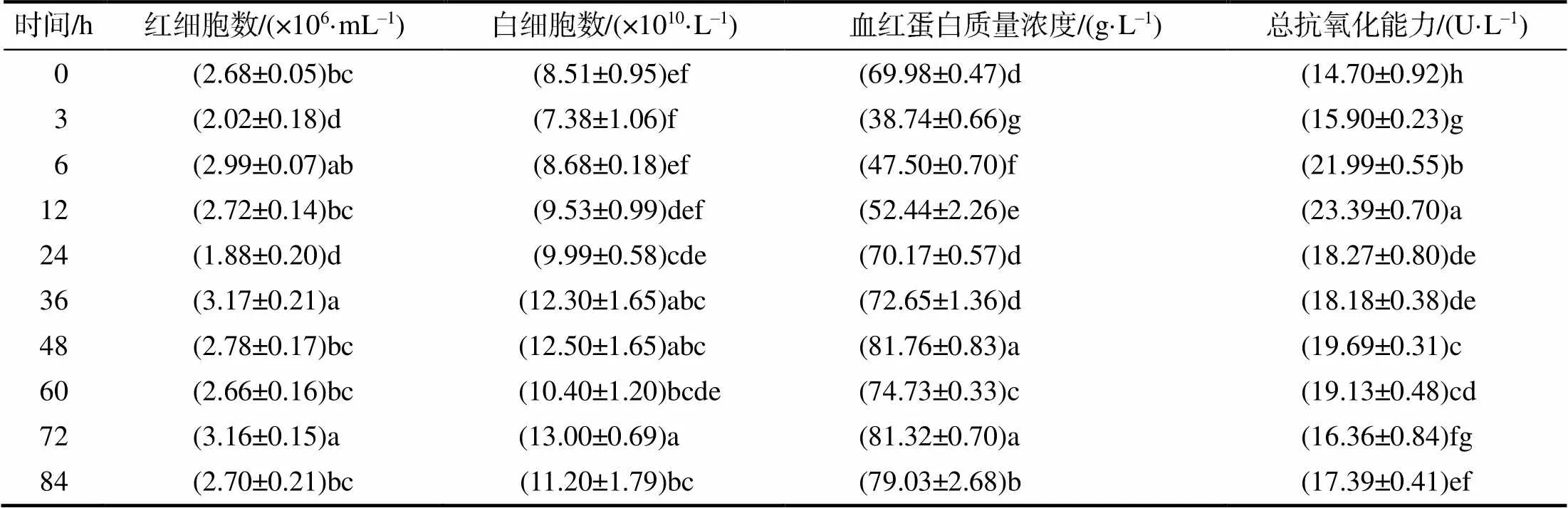
表2 持续低氧胁迫下长丰鲢的血液指标和总抗氧化能力
同列不同字母示处理间差异有统计学意义(<0.05)。
2.2 低氧胁迫对长丰鲢组织抗氧化酶活性的影响
从表3可知,低氧处理后长丰鲢脑中GSH–PX活性显著(<0.05)上升,12 h后开始下降,24~60 h内其活性显著(<0.05)低于对照组的,72、84 h时又有所上升,与对照组的差异无统计学意义;肝脏中GSH–PX活性除在36 h时有短暂的波动外,其他时间点一直持续较低水平,且3~24 h和60~84 h内均显著(<0.05)低于对照组的。长丰鲢脑中CAT活性6 h开始上升,在36 h时达到峰值,且12、36、48 h时均显著(<0.05)高于对照组的,48 h后,CAT活性迅速下降,60~84 h内显著(<0.05)低于对照组的;肝脏中的CAT活性变化趋势与脑中相似,但12 h时CAT活性才开始上升,之后除24 h外,其他时间点的均显著(<0.05)高于对照组的。持续低氧处理3~24 h内,长丰鲢脑中的SOD活性均显著(<0.05)高于对照组的,从36 h开始,SOD活性呈下降趋势,72 h时最低,且显著(<0.05)低于对照组的,84 h时又显著升高;肝脏中的SOD活性在低氧胁迫后3 h内迅速下降至最低值,之后呈缓慢上升趋势,但酶活性仍显著(<0.05)低于对照组的。

表3 持续低氧胁迫下长丰鲢脑和肝脏中的抗氧化酶活性
同列不同字母示处理间差异有统计学意义(<0.05)。
2.3 低氧胁迫对长丰鲢相关基因表达的影响
从表4可知,在长丰鲢脑中,低氧处理后phd基因家族中相对表达量最高的是,与的相对表达量相当;除36 h外,、和的表达均上调,均在48 h时达到峰值,且显著(<0.05)高于对照组的;在低氧处理后相对表达量迅速升高,3 h时即达到峰值(<0.05),随后呈缓慢下降的趋势,但下降过程中其表达存在波动,12、60 h时的相对表达量均显著高于其前后时间段的。
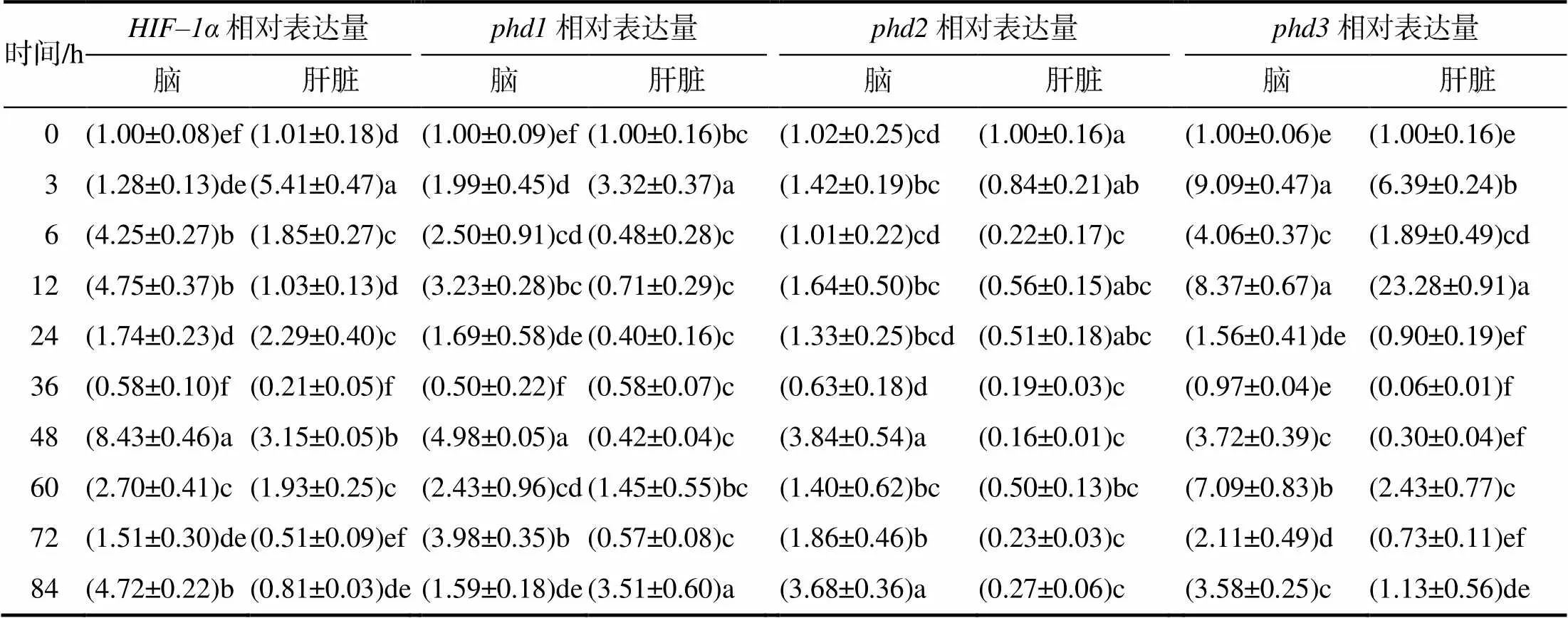
表4 持续低氧胁迫下长丰鲢脑和肝脏中低氧相关基因的相对表达量
同列不同字母示处理间差异有统计学意义(<0.05)。
在长丰鲢肝脏中,低氧处理后phd基因家族中相对表达量最高的仍然是,、和均迅速响应溶解氧的变化,在3 h时相对表达量急剧上升(<0.05),6 h开始相对表达量已经回落,但的相对表达量在12 h又急剧上升达到峰值,24 h时再次回落;的相对表达量均低于对照的,且其表达趋势也与同家族的另外2个基因的不同,说明在长丰鲢肝脏中该基因对低氧胁迫具有较低的敏感性。
3 结论与讨论
在没有外界刺激的情况下,鱼类自身有一套稳定的系统,机体内的血细胞相对稳定,使血细胞数保持平稳[13];当受到各种有毒物质和环境因素的破坏时,红细胞和白细胞数及血红蛋白含量将发生显著变化[14]。本研究中,长丰鲢在进行低氧处理3 h后红细胞和血红蛋白显著降低,可能是由于低氧导致的应激反应,而持续低氧胁迫使血红蛋白质量浓度显著增加,以维持机体对氧的需求。此外,持续低氧胁迫会对长丰鲢机体产生伤害,从而引起机体的免疫反应,导致白细胞数显著增加。在不同溶解氧对吉富罗非鱼影响的研究中发现,随着溶解氧水平的下降,鱼体血液中红细胞数先下降后趋于稳定,而白细胞数和血红蛋白含量均先下降后上升,且最高值均出现在低氧组[15]。本研究的结果与其基本一致,说明血液指标的变化在不同鱼中具有相似性。可见,血液指标可作为反映鱼类遭受低氧胁迫程度的指标。
本研究中,低氧处理后长丰鲢血清中的总抗氧化能力显著上升,表明机体通过增加抗氧化能力来应对低氧胁迫对机体的损害。此外,在正常的溶解氧水平下,鱼体内ROS产生和去除处于动态平衡状态,当遭受到低氧胁迫时,机体内线粒体电子传递链载体失活,导致ROS大量生成[16–18],当ROS的生成速率超过消除速率时,便会发生氧化应激反应。为应对过量的ROS并减少由此产生的损伤,鱼类机体通过不断进化形成了抗氧化剂防御体系[19–20]。
本研究中,持续低氧导致长丰鲢肝脏中GSH– PX活性除36和48 h外均显著降低,且脑中GSH–PX活性在24~60 h内显著低于对照组的;肝脏中的SOD和CAT活性在低氧处理前期都显著降低,CAT在6 h后呈平稳上升趋势,且在48 h时上升至峰值后又逐渐降低,但36~84 h内均显著高于对照组的,而SOD活性一直显著低于对照组的。这些结果与鲢急性低氧相关研究结论一致[21],说明慢性持续低氧与急性低氧一样,都可引起鲢机体的氧化应激反应。持续低氧处理后,肝脏中CAT活性显著高于对照的可能原因是该时段肝脏产生的ROS量较少,为保持体内抗氧化酶平衡,反而促进了CAT的活性。此外,SOD在反应过程中所产生H2O2会被CAT清除,SOD活性显著下降,从而导致H2O2的产生量减少,这也可能是CAT活性上升的原因。脑中SOD活性从3 h时开始上升,除72 h时外,均与对照组的持平或显著高于对照组的,可能归因于长期低氧胁迫下进行的自我调节,以缓解机体的应激状态。
低氧诱导因子作为氧敏感的转录激活因子,会在低氧处理下被诱导并表达,同时可能会参与反应调节[22–23]。HIF–1信号通路是调控低氧应答的重要途径,其中,HIF–1α是最关键的调控蛋白[24]。PHDs在机体内是细胞氧气水平最直接的感受器,调控HIF–1α的稳定性,同时在生命生长发育的过程中承担着重要功能[25]。本研究中,低氧处理后,和在长丰鲢脑和肝脏中的表达水平较高,而和在脑和肝脏中,尤其是在肝脏中的表达水平较低;肝脏中和均迅速响应溶解氧的变化,在3 h时相对表达量急剧上升(<0.05),6 h开始相对表达量已经回落,但的相对表达量在12 h又急剧上升达到峰值,24 h时再次回落。在团头鲂肝脏中的HIF–1α蛋白水平随着溶解氧浓度下降及低氧处理时间的延长而升高,且在常氧条件下也在肝脏中表达最高,低氧处理后其在所检测的9个组织中都上调表达[25],说明和在低氧条件下有可能具有协同作用,共同促进鱼体对低氧条件的适应。在长丰鲢肝脏和脑中应对低氧胁迫时表达变化趋势具有波动性,而在团头鲂中,其低氧处理后仅在鳃中表达量升高,说明的功能兼具物种和组织特异性。在长丰鲢脑和肝脏组织中的表达情况有所不同,应对低氧胁迫的变化趋势也有所不同,这可能是组织之间的差异性所致,不同基因在不同组织中对于氧浓度的敏感度存在差异。此外在长丰鲢各组织中的相对表达量也相对较低,在团头鲂中,该基因在低氧处理后表达量反而呈略微下降趋势,暗示该基因可能并非鲤科鱼类应对低氧胁迫的主效基因[24]。
[1] WU R S S.Hypoxia:from molecular responses to ecosystem responses[J].Marine Pollution Bulletin,2002,45:35–45.
[2] 徐贺,陈秀梅,王桂芹,等.低氧胁迫在水产养殖中的研究进展[J].饲料工业,2016,37(2):33–37.
[3] STRAMMA L,JOHNSON G C,SPRINTALL J,et al Expanding oxygen-minimum zones in the tropical oceans[J].Science,2008,320,655–658.
[4] 王慧娟.低氧对团头鲂生理生化指标及低氧应答基因表达的影响[D].武汉:华中农业大学,2015.
[5] 熊向英,黄国强,彭银辉,等.低氧胁迫对鲻幼鱼生长、能量代谢和氧化应激的影响[J].水产学报,2016,40(1):73–82.
[6] ZHANG G S,MAO J Q,LIANG F F,et al.Modulated expression and enzymatic activities of Darkbarbel catfish,for oxidative stress induced by acute hypoxia and reoxygenation[J].Chemosphere,2016,151:271–279.
[7] MANDIC M,BEST C,PERRY S F.Loss of hypoxia- inducible factor 1α affects hypoxia tolerance in larval and adult zebrafish()[J].Proceedings of the Royal Society B,2020,287:20200798.
[8] WANG M,WU F L,XIE S G,et al.Acute hypoxia and reoxygenation:effect on oxidative stress and hypoxia signal transduction in the juvenile yellow catfish ()[J].Aquaculture,2021,531:735903.
[9] 吴新燕,梁宏伟,罗相忠,等.长丰鲢生长性状相关微卫星标记的初步筛选[J].水产学报,2022,46(1):20–30.
[10] 吴新燕,梁宏伟,罗相忠,等.不同月龄长丰鲢形态性状对体质量的影响[J].南方水产科学,2021,17(3):62–69.
[11] 丁晨雨,胡利双,李云,等.低氧胁迫对鲢心肌细胞凋亡及其调控基因Bax、Bcl–2表达的影响[J].淡水渔业,2018,48(2):10–15.
[12] LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔCtmethod[J].Methods,2001,25(4):402–408.
[13] 何勤,贾睿,曹丽萍,等.氧化应激对鲤抗氧化状态和免疫功能的影响[J].水产学报,2021,45(1):33–43.
[14] AHMED I,RESHI Q M,FAZIO F.The influence of the endogenous and exogenous factors on hematological parameters in different fish species:a review[J]. Aquaculture International,2020,28(3):869–899.
[15] 陈德举,强俊,陶易凡,等.不同溶氧水平对吉富罗非鱼幼鱼生长、血液生化、脂肪酸组成及其抗海豚链球菌病的影响[J].淡水渔业,2019,49(4):83–89.
[16] 崔惟东,冷向军,李小勤,等.虾青素和角黄素对虹鳟肌肉着色和肝脏总抗氧化能力的影响[J].水产学报,2009,33(6):987–995.
[17] LUSHCHAK V I,BAGNYUKOVA T V.Hypoxia induces oxidative stress in tissues of a goby,the rotan[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2007,148(4):390–397.
[18] LUO S Y,LIU C,DING J,et al.Scavenging reactive oxygen species is a potential strategy to protectagainst environmental hypoxia by mitigating oxidative stress[J].Zoological Research,2021,42(5):592–605.
[19] DASGUPTA S,DIGIULIO R T,DROLLETTE B D,et al.Hypoxia depresses CYP1A induction and enhances DNA damage,but has minimal effects on antioxidant responses in sheepshead minnow() larvae exposed to dispersed crude oil[J].Aquatic Toxi- cology,2016,177:250–260.
[20] CAO L,HUANG W,SHAN X J,et al. Tissue- specific accumulation of cadmium and its effects on antioxidative responses in Japanese flounder juveniles[J]. Environmental Toxicology and Pharmacology,2012,33(1):16–25.
[21] 凌晨,张美东,沙航,等.低氧胁迫对鲢抗氧化酶活性及SODs基因表达的影响[J].淡水渔业,2021,51(3):53–59.
[22] 孙盛明,祝孟茹,潘方艳,等.低氧对甲壳动物的影响及其分子调控研究进展[J].水产学报,2020,44(4):690–704.
[23] WANG X W,XIAO S S,ZHANG R,et al. Physiological changes and transcriptional modulation of HIF-αs inin response to hypoxia[J]. Aquaculture,2021,545:737219.
[24] 张国松.瓦氏黄颡鱼()应对低氧胁迫的分子机制研究[D].南京:南京师范大学,2017.
[25] 陈楠.团头鲂基因家族参与低氧应答的分子机理解析[D].武汉:华中农业大学,2017.
Effects of continuous hypoxia stress on blood indicators, tissue antioxidant enzymes activity and genes expression in Changfeng silver carp
LI Xiaohui1,ZOU Guiwei1,LIANG Hongwei1,HE Xuan2,SHA Hang1,FENG Cui1,CUI Feng2*
(1.Yangtze River Fisheries Research Institute, Chinese Academy of Fishery Sciences, Wuhan, Hubei 430223, China; 2.College of Life and Health Science, Anhui Science and Technology University, Fengyang, Anhui 233100, China)
To study the physiological regulatory mechanisms of Changfeng silver carp(, CF) on continuous hypoxia stress, the blood indicators, tissues antioxidant enzymes activities and genes expression levels were analysed at different time(0, 3, 6, 12, 24, 36, 48, 60, 72, 84 h) after hypoxia treatment with a dissolved oxygen of (2.0±0.5) mg/L. The results showed that continuous hypoxia stress caused a significant increase of hemoglobin content and white blood cell count in blood, and a significant increase of the total antioxidant capacity in the serum. In addition, under continuous hypoxia stress, the GSH-Px activity in liver of CF decreased significantly except for 36 and 48 h, and the GSH-Px activity in brain was significantly lower than that in control group within 24 to 60 h. The CAT activity in the liver of CF increased significantly from 36 h, and the CAT activity in the brain increased from 6 h, and decreased significantly at 60 h and later. The SOD activity in the liver of CF rapidly decreased to the lowest value within 3 h after hypoxia stress, and then showed a slow rising trend, but it was still significantly lower than that of the control, while the SOD activity in the brain began to rise from 3 h, except for 72 h, and was equal to or significantly higher than that of the control group. The expression levels ofandandFurthermore, the antioxidant enzyme systems of brain and liver of CF were activated to resist tissue damage induced by continuous hypoxia stress.
Changfeng silver carp(); continuous hypoxia stress; blood indicators; antioxidant enzyme; gene expression
S965.113;S917.4
A
1007-1032(2022)06-0723-07
李晓晖,邹桂伟,梁宏伟,何萱,沙航,冯翠,崔峰.持续低氧胁迫对长丰鲢血液指标和组织抗氧化酶活性及相关基因表达的影响[J].湖南农业大学学报(自然科学版),2022,48(6):723–729.
LI X H,ZOU G W,LIANG H W,HE X,SHA H,FENG C,CUI F.Effects of continuous hypoxia stress on blood indicators, tissue antioxidant enzymes activity and genes expression in Changfeng silver carp[J].Journal of Hunan Agricultural University(Natural Sciences),2022,48(6):723–729.
http://xb.hunau.edu.cn

2021–10–09
2022–11–30
财政部和农业农村部国家现代农业产业技术体系专项(CARS–45);中国水产科学研究院基本科研业务费(2020TD33);国家重点研发计划项目(2018YFD0900302)
李晓晖(1989—),女,河南驻马店人,博士,助理研究员,主要从事鱼类遗传育种研究,lixiaohui@yfi.ac.cn;*通信作者,崔峰,副教授,主要从事水生动物种质资源与水产养殖研究,cuifeng10@163.com
10.13331/j.cnki.jhau.2022.06.015
责任编辑:邹慧玲
英文编辑:柳正

