乳蛋白对甜菜红苷热稳定性的影响
芦霞,胡飞
(华南理工大学食品科学与工程学院 广州 510640)
甜菜色素(Betalain)是一种含氮水溶性色素,主要存在于藜科、苋科、紫茉莉科以及仙人掌科等多种植物中[1]。其中,人们最为熟悉的植物是藜科中的红甜菜及仙人掌科的火龙果皮和果肉。甜菜色素属于吡啶类衍生物,基本发色团是1,7-二偶氮庚甲碱,其颜色由1,7-二偶氮庚甲碱共振所产生。甜菜色素主要包含甜菜红素(Betacyanin)和甜菜黄素(Betaxanthin)两大类,其中甜菜红素的主要成分为甜菜红苷(Betanin,Bt,分子式C24H26N2O13)[2]。甜菜红苷是从红甜菜根中提取出的成分,被欧盟批准为红色食品着色剂,被广泛用作果酱、冰激凌、蛋糕、酸奶等食品着色[3-4]。目前,因甜菜红苷安全无毒[2]且具有抗炎[5-6]、护肝[7-9]、降血压[10-12]、降血脂[13-14]等特性,而获得研究人员的广泛关注[15]。虽然甜菜红苷具有诸多有益特性,但是其易受温度、酸碱度、光、氧气等因素的影响,稳定性较差[16]。国内外研究者通过形成络合物[17]、微胶囊化[18]等尝试改善甜菜红苷的稳定性,然而,形成的络合物易分解,降低了甜菜红苷的长期护色效果。微胶囊化也有明显的局限性,有的壁材对pH 值有极强的依赖性,且在合成中可能引入对人体有害的物质,这些限制了甜菜红苷的深入开发和应用[19]。
通过生物大分子与甜菜红苷相互作用来保护甜菜红苷是一种良好的思路和技术途径。在食品大分子中脂类溶解性不好,多糖类消化性较差,而蛋白质具有两亲性、消化性好等优点,利用蛋白质与小分子相互作用来实现保护小分子的活性,是目前研究的热点之一[19]。目前对蛋白质与花青素结合方面的研究已较为成熟[20-21],而对于蛋白质与甜菜红苷相互作用的研究较少。本文采用乳蛋白中的乳清蛋白(Whey Protein,WP)和牛血清白蛋白(Bovine Serum Albumin,BSA)分别与甜菜红苷作用,研究生成的复合物中乳蛋白组分对甜菜红苷热稳定性的影响,并用荧光光谱(MFS)、傅里叶变换红外光谱(FTIR)以及圆二色光谱(CD)分析甜菜红苷与乳清蛋白和牛血清白蛋白的作用机制,乳蛋白与甜菜红苷复合物的结构特征及构型。
1 材料与方法
1.1 试剂与仪器
甜菜红苷、牛血清白蛋白,生物技术级,阿拉丁试剂有限公司;乳清蛋白,麦克林试剂有限公司;磷酸氢二钠、磷酸二氢钠、氢氧化钠、盐酸,以上均为AR 级,国药集团化学试剂有限公司。
Nicolet IS50 -Nicolet Continuum 型傅里叶变换红外光谱仪,Thermo Fisher Scientific 公司;F-7000 分子荧光仪,日立高新技术公司;Chirascan 型圆二色光谱仪,英国Applied Photophysics公司;雷磁PXSJ-226 型离子计,上海仪电科学仪器股份有限公司;722N 可见分光光度计,上海仪电科学仪器股份有限公司;FDU-2110 冷冻干燥机,杭州嘉维创新科技有限公司。
1.2 试验方法
1.2.1 热稳定性分析
1.2.1.1 温度对甜菜红苷稳定性的影响 称取适量的甜菜红苷(Bt)溶于pH6.3 的PBS 缓冲液中,得到质量浓度为2.5 mg/mL 的Bt 溶液,将50,100,150 mg 乳清蛋白(WP)和牛血清白蛋白(BSA)分别溶于上述PBS 缓冲液中,得到质量浓度分别为0.5,1.0,1.5 mg/mL 的蛋白质溶液。将配好的Bt 溶液和蛋白质溶液在常温下按体积比1∶1 混合,涡旋振荡20 min 使其混合充分,然后,分别在不同温度(35,45,55,65,75 ℃)下水浴加热3 h,用可见分光光度计测定在最大吸收波长535 nm[22]处处理前、后的吸光度,计算甜菜红苷的保留率。以不加蛋白质的Bt 溶液为空白对照。重复3次试验,取平均值。
采用高冬菊等[23]的方法计算色素保留率,公式如下:

式中:A——甜菜红苷处理后的吸光度;A0——甜菜红苷处理前的吸光度。
1.2.1.2 不同pH 值条件下甜菜红苷的降解规律
用0.1 mol/L Na2HPO4和0.1 mol/L NaH2PO4溶液配制母液,氢氧化钠和盐酸调节pH 值,最终配成pH 值分别为1.0,3.0,5.0,7.0,9.0 的缓冲液。称取适量甜菜红苷、WP 和BSA 分别溶于上述缓冲液中,以获得质量分数分别为2.0 mg/mL 的Bt 溶液和1.0 mg/mL 的蛋白质溶液。将配好的Bt 溶液和蛋白质溶液在常温下按体积比1∶1 混合,涡旋振荡20 min,使其混合充分,然后,在65 ℃下避光加热5 h,每隔1 h 测定各组甜菜红苷含量变化。以不加蛋白质的Bt 溶液为空白对照。每组试验重复3 次,取平均值。
1.2.2 光谱测试
1.2.2.1 样品制备 用pH 6.3 的PBS 缓冲液溶解甜菜红苷,涡旋振荡10 min,使甜菜红苷最终质量浓度分别为1.0,2.0,3.0,4.0,5.0 mg/mL。用上述PBS 缓冲液溶解适量的WP 和BSA,以得到最终质量浓度分别为1 mg/mL 的WP 溶液和0.5 mg/mL 的BSA 溶液。
将配好的Bt 溶液和蛋白质溶液在常温下按体积比1 ∶1 混合,涡旋振荡20 min 使其混合充分,最终样品中WP 的质量浓度为0.5 mg/mL,BSA的质量浓度为0.25 mg/mL,Bt 的质量浓度分别为0.5,1.0,1.5,2.0,2.5 mg/mL。在温度4 ℃下避光保存,备用。同时,取部分样品于冷冻干燥机内,设置预冻温度-20 ℃,冷阱温度低于-40 ℃,冻干48 h,得到Bt-pro 固体样品。
1.2.2.2 荧光光谱测试 取1.2.2.1 节样品3 mL于1 cm 石英比色池中,荧光扫描条件为激发波长280 nm,发射波长300~540 nm,激发和发射的狭缝宽度均为2.5 nm,扫描速度240 nm/s,电压700 V。同时,以波长差分别为Δλ=15 nm 和Δλ=60 nm测定样品的同步荧光光谱。采用Origin 9.0 软件分析。
1.2.2.3 傅里叶变换红外光谱测试 取1.2.2.1 节经冷冻干燥的1 mg 样品与100 mg KBr 混合,用研钵研细后制得透明样品薄片,以空白KBr 来调整基线水平并对差异化光谱进行归一化处理,以空气为参比,测定波段为4 000~500 cm-1,扫描32次,采用Omnic 软件分析数据。
1.2.2.4 圆二色谱测试 取1.2.2.1 节1 mL 样品,稀释一定倍数使蛋白质量浓度至0.1 mg/mL,吸取300 μL 于1 mm 样品池中,设置扫描波长范围190~260 nm,扫描速度60 nm/min,光谱分辨率0.2 nm,响应时间0.25 s,光谱带宽1.0 nm,重复扫描3次。采用Pro-Data Viewer 和CDNN 软件分析蛋白质二级结构的组成及含量。
1.2.3 统计学分析 采用SPSS 26.0 统计软件进行统计学分析,对热稳定性数据采用单因素方差法分析,显著水平为P<0.05。
2 结果与讨论
2.1 热稳定性
2.1.1 温度对甜菜红苷稳定性的影响 甜菜红苷的稳定性可用保留率的变化来表示,保留率越高,甜菜红苷的稳定性越好。由图1 可知,随着水浴加热温度的升高,所有样品组的甜菜红苷含量呈下降趋势,此时甜菜红苷因受热而发生脱羧反应,生成脱羧甜菜红苷[24]。此外,添加WP 组的保留率明显高于对照组,而添加BSA 组的效果不明显,表明WP 能更有效抑制甜菜红苷的降解,保护其稳定性。随着WP 浓度的增加,其抑制效果变好。在75 ℃加热3 h 条件下,当添加WP 的质量浓度为1.5 mg/mL 时,甜菜红苷保留率约为对照组保留率的2 倍。
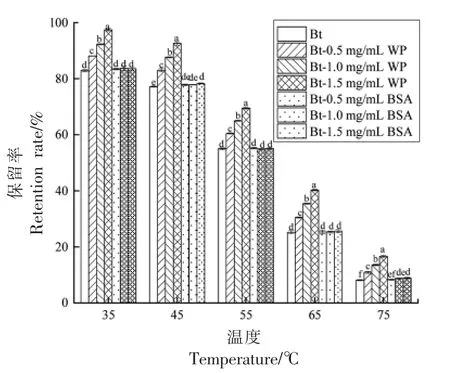
图1 不同温度下不同浓度乳蛋白对甜菜红苷保留率的影响Fig.1 Effects of different concentrations of milk protein on the retention of Bt at different temperatures
2.1.2 不同pH 值条件下甜菜红苷的降解规律研究[25]表明,甜菜红苷的降解规律遵循一级动力学,可用其模拟不同pH 值条件下甜菜红苷的降解。动力学公式如下:

式中:C0——甜菜红苷的初始质量浓度(mg/mL);t——加热时间(h);Ct——t 时刻甜菜红苷的质量浓度(mg/mL);k——速率常数;t1/2——半衰期(h)。
依据公式(2)、(3)拟合得出不同pH 值条件下甜菜红苷及其蛋白复合物的降解动力学参数,见表1。不同pH 条件下甜菜红苷及其蛋白复合物的热稳定性不同。随着pH 值的增大,甜菜红苷及其蛋白复合物的降解k 呈先下降后上升的趋势,表明对甜菜红苷的破坏程度先减弱后增大,在pH 5.0 时各组样品的稳定性最佳,甜菜红苷的半衰期最长,其中Bt-WP 复合物的半衰期达2.99 h。这是由于甜菜红苷在酸性溶液中加热或碱性条件下甜菜红苷会被水解为环多巴-5-葡萄糖苷和甜菜醛氨酸,而在加热数小时后,甜菜醛氨酸的醛基和环多巴-5-葡萄糖的氨基间发生亲核反应,生成相应的Schiff 碱,又有部分甜菜红苷重新生成[24]。甜菜红苷的重生在pH 5.0 附近最多,这与各组甜菜红苷在pH=5.0 左右时降解速率k 最小相一致。此外,甜菜红苷和蛋白质形成复合物后,甜菜红苷降解得到有效抑制,WP 对甜菜红苷的保护作用优于BSA,这与2.1.2 节结果一致。

表1 不同pH 值甜菜红苷及其蛋白复合物在65 ℃条件下的降解动力学参数Table 1 Kinetic parameters for degradation of Bt and Bt-pro under different pH values at 65°C
2.2 光谱分析甜菜红苷与蛋白质互作
2.2.1 红外光谱分析结果 通过FTIR 光谱评价添加蛋白质后Bt-pro 复合物间的相互作用和蛋白质二级结构变化[26]。冷冻干燥后的Bt、蛋白质及Bt-WP、Bt-BSA 的FTIR 光谱如图2 所示。添加蛋白质前Bt 在酰胺Ⅱ带(<1 548 cm-1)未出现峰值,而加入WP 和BSA 后分别在1 545.18 cm-1和1 545.73 cm-1处出现新峰,推断形成Bt-pro 复合物。该复合物中WP 酰胺Ⅰ带(1 600-1 700 cm-1)的峰值位置从1 650.23 cm-1移至1 650.16 cm-1,酰胺Ⅱ带的峰值位置从1 543.96 cm-1移至1 545.18 cm-1,表明Bt 与WP 发生作用导致C=O、N-H、CN 变化。Bt 组分的结合使BSA 二级结构发生类似变化,其酰胺Ⅰ带的峰值位置从1 657.50 cm-1变到1 655.86 cm-1,酰胺Ⅱ带1 543.43 cm-1变到1 545.73 cm-1,酰胺A 带(3 300~3 400 cm-1)范围的特征峰从3 334.13 cm-1变到3 425.15 cm-1,说明Bt 与BSA 间相互作用导致BSA 中C=O 伸缩振动,N-H 弯曲振动,C-N 伸缩振动发生改变。

图2 Bt 与WP、BSA 相互作用的FTIR 光谱Fig.2 The FTIR spectra of WP and BSA in absence and presence of Bt
2.2.2 荧光光谱分析结果
2.2.2.1 甜菜红苷含量对蛋白质荧光猝灭光谱的影响 蛋白质因含有色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe)残基而具有内源荧光性[27]。在激发波长280 nm 处,蛋白质的内源荧光主要取决于Trp 和Tyr[28]。可根据荧光强度值的变化来判断WP和BSA 是否与Bt 发生相互作用,研究WP 和BSA构象的变化以及发色团附近微环境的改变。
波长280 nm 处WP 和BSA 的荧光发射光谱如图3 所示。WP 的最大荧光发射波长(λmax)在329 nm 附近,BSA 的λmax在338 nm 附近。在Bt 加入之后,WP 和BSA 的荧光强度均显著降低,且随Bt 浓度的增加,WP 的荧光强度从3 827.96 降至1 692.20,BSA 的荧光强度从9 899.83 降至4 062.81,说明甜菜红苷的加入使WP 和BSA 出现内源性荧光猝灭现象,即WP、BSA 分别和Bt 发生作用。此外,随着Bt 浓度的增加,WP 的λmax从329 nm红移到335 nm,BSA 的λmax从338 nm 红移到342 nm。红移现象表明WP 和BSA 中Trp 和Tyr 残基附近的微环境极性发生变化。

图3 Bt 对乳清蛋白(a)及牛血清白蛋白(b)的荧光强度的影响Fig.3 Effect of Bt on the fluorescence intensity of WP(a)and BSA(b)
2.2.2.2 甜菜红苷对蛋白质荧光猝灭方式的影响通过Stern-Volmer 方程可判断Bt 与蛋白质相互作用的猝灭类型[29]:
要以矫正为主要目的,切实推进劳动改造功能回归,在按体施劳、劳动保护等制度的基础上,对劳动改造制度进行理性化设计,从而适应罪犯作为人的本质需要和重新社会化的需要,充分发挥劳动改造在矫正罪犯恶习、培养劳动习惯、培训劳动技能等方面的作用。

式中:F0——未添加猝灭剂甜菜红苷时的荧光强度;F——添加猝灭剂甜菜红苷时的荧光强度;KSV——Stern-Volmer 猝灭常数(L/mol);[Q]——甜菜红苷的浓度(mol/L);τ0——不存在猝灭剂时荧光分子的平均荧光寿命,一般为10-8s;Kq——生物大分子猝灭速率常数【L/(mol/s)】。
不同温度(308.15,318.15,328.15 K)下 的Stern-Volmer 特征参数见表2。两种蛋白质与Bt相互作用的Stern-Volmer 方程呈良好的线性关系,表明存在单一的静态或动态猝灭机制[30]。动态猝灭通过碰撞和扩散形成,导致其猝灭常数KSV随温度的升高而增大;静态猝灭是由于分子间的相互作用形成新的复合物,其猝灭常数KSV随温度的升高而降低[31]。在WP 和BSA 与Bt 相互作用过程中,随着温度的升高,猝灭常数KSV值逐渐降低,表明Bt 通过静态猝灭的形式对两种蛋白质的固有荧光进行有效抑制,WP 和BSA 与Bt 形成复合物。BSA 与Bt 结合后,猝灭速率常数Kq远大于极限扩散速率常数[2×1010L/(mol/s)],说明Bt-BSA 复合物的生成。

表2 不同温度下Bt-pro 的猝灭常数Table 2 Quenching constants of Bt-pro at different temperatures
2.2.2.3 甜菜红苷与蛋白质的结合常数、结合位点数及热力学参数分析 因Bt 与WP、BSA 之间的猝灭机制为静态猝灭,依据公式[30](5)分析两种蛋白质在3 个温度下与Bt 复合的结合常数(Ka)和结合位点数(n):
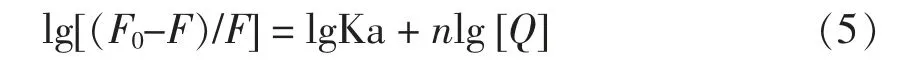
式中:Ka——Bt 与蛋白质的结合常数;n——Bt 与蛋白质的结合位点数。
lg[(F0-F)/F]和lg[Q]的双对数回归曲线如图4所示,根据回归曲线的斜率和截距可知复合物的结合位点数和结合常数,见表3。

图4 Bt 与蛋白质相互作用的双对数曲线Fig.4 Double logarithmic curve of Bt-pro interaction
由表3 可知,随着温度的升高,两种蛋白质与Bt 的结合常数Ka均逐渐减小,表明温度升高不利于蛋白质与甜菜红苷的结合。当温度为308.15 K时,复合物Bt-WP 的Ka值高于Bt-BSA,说明此条件下WP 对Bt 的结合亲和力强于BSA,这与WP能有效抑制Bt 的热降解作用结果一致。此外,两种蛋白质的结合位点数n 值均在1 附近,表明Bt与WP 和BSA 都只有一个结合位点,即Bt 与WP和BSA 反应后生成物质的量比为1∶1 的复合物。
通过热力学方程可以判断大分子蛋白质与Bt小分子间的主要结合作用力,通过Vant' Hoff 公式(6)、(7)、(8)可计算热力学参数吉布斯自由能变化(ΔG)、焓变(ΔH)和熵变(ΔS)[32]。其中,当ΔH>0 且ΔS>0 时,为疏水相互作用;当ΔH<0 且ΔS<0 时,为范德华力和氢键作用;当ΔH<0 且ΔS>0 时,为静电相互作用;当ΔH>0 且ΔS<0 时,为静电力和疏水相互作用[31]。

式中:T——绝对温度(K);Ka——与温度相关的结合常数;R——气体常数[8.314 J/(mol·K)]。当温度变化不大时,反应的ΔH 和ΔS 可看作常数。
由表3 可知,Bt-WP 和Bt-BSA 的ΔH 均小于0,且ΔS 均大于0,说明Bt 与WP 及BSA 的分子间作用力主要表现为静电相互作用。此外,Bt-WP 和Bt-BSA 的ΔH 值分别为-2.4 kJ/mol和-2.1 kJ/mol,表明Bt 与两种蛋白质的结合反应为放热反应;ΔG 均为负值,表明Bt 与两种蛋白质之间的结合作用均为自发进行的。

表3 不同温度下Bt-pro 的结合常数、结合位点及热力学参数Table 3 Binding constants,binding sites and thermodynamic parameters of Bt-pro at different temperatures
2.2.3 甜菜红苷与蛋白质相互作用的同步荧光光谱 Bt 与蛋白质相互作用的同步荧光光谱如图5所示。当Δλ=15 nm 时的同步荧光谱图为Tyr 残基周围的微环境变化,Δλ=60 nm 时所得谱图为Trp残基周围微环境的变化[33]。如图5a、5c 所示,当Δλ=15 nm 时,固定蛋白质浓度,逐渐增加Bt 的浓度,两种蛋白质Tyr 残基的荧光强度均逐渐降低,WP 和BSA 的λmax均发生红移(WP:从292.78 nm变到294.02 nm;BSA:从286.21 nm 变到287.01 nm),表明Tyr 残基的疏水性减弱,极性变强,Tyr残基随Bt 的加入逐渐暴露出来。如图5b、5d 所示,当Δλ=60 nm 时,两种蛋白质Trp 残基的荧光强度随Bt 的加入逐渐降低,WP 和BSA 的λmax同样也发生红移(WP:从274.69 nm 变到277.04 nm;BSA:从279.66 nm 变到283.20 nm),说明随着Bt的加入,Trp 残基的疏水性减弱,极性逐渐增强。Tyr 残基和Trp 残基周围微环境的变化表明两种蛋白质的构象因与Bt 结合形成复合物而改变。


图5 Δλ=15 nm(a、c)和Δλ=60 nm(b、d)时Bt 与蛋白质相互作用的同步荧光光谱图Fig.5 Synchronous fluorescence spectra of the interaction between Bt-pro at 15 nm(a,c)and 60 nm(b,d)
2.2.4 甜菜红苷与蛋白质相互作用的圆二光谱蛋白质具有圆二色性,不同的构象表现出不同的光谱性质,通过圆二色谱可以定量分析形成Btpro 复合物前、后WP 和BSA 二级结构组成类型的变化,进一步验证Bt 与WP 和BSA 的相互作用。由图6 和表4 可知,WP 在92 nm 附近有一正峰,在210 nm 处有一负峰,为典型的蛋白质α-螺旋结构的特征峰。形成Bt-WP 复合物之后,特征峰的强度显著降低,WP 二级结构发生改变,α-螺旋含量减少,从19.57%降至16.17%;β-折叠含量增加,从31.52%增至33.63%;β-转角含量减少,从16.80%降至15.93%;无规则卷曲含量增加,从32.12%增至34.28%。BSA 在远紫外区表现出两个明显的负峰(208 nm 和223 nm),添加Bt 后其特征峰强度降低,二级结构发生明显变化,α-螺旋含量减少,从80.53%降至75.05%;β-折叠含量增加,从2.32%增至3.25%;β-转角含量增加,从10.09%增至10.85%;无规则卷曲含量增加,从7.06%增至10.85%,说明Bt-pro 复合物的形成对WP、BSA 的二级结构有很大影响。

表4 WP 和BSA 及其Bt 复合物的二级结构含量Table 4 Secondary structure analysis of WP and BSA in absence and presence of Bt

图6 Bt 与WP、BSA 相互作用的圆二色谱图Fig.6 The CD spectra of WP and BSA in absence and presence of Bt
3 结论
利用光谱技术研究甜菜红苷与WP 和BSA 之间的作用机制,并探究甜菜红苷及其Bt-pro 复合物的热稳定性。结果表明:添加WP 和BSA 能有效抑制甜菜红苷的热降解,其中WP 对甜菜红苷的保护作用优于BSA。同时,pH 值的变化对甜菜红苷的热降解也有影响,在pH 5.0 时各组样品中甜菜红苷的半衰期最长。此外,复合物中Bt 组分导致WP 及BSA 发生荧光猝灭,猝灭类型均为静态猝灭,Bt 与两种蛋白质均按照1∶1 物质的量比形成复合物,其结合过程为自发的放热反应,Bt 与蛋白质分子间作用力主要表现为静电相互作用。形成Bt-pro 复合物后,WP 和BSA 两种蛋白质中Trp 和Tyr 残基附近的疏水性减弱,极性增强,残基周围微环境发生改变。同时,Bt-pro 复合物的形成导致两种蛋白质在酰胺Ⅰ带和酰胺Ⅱ带的特征峰位置发生改变,其中WP 的α-螺旋和β-转角含量减少,β-折叠和无规则卷曲含量增加;BSA 的α-螺旋含量减少,β-折叠、β-转角及无规则卷曲含量增加。

