铜基催化剂在电还原二氧化碳领域的应用研究
汤 静,张子宁,郑 翔
(华东师范大学 化学与分子工程学院 上海市绿色化学与化工过程绿色化重点实验室,上海 200062)
0 引 言
自工业革命以来,化石燃料的大规模开采利用使大气中二氧化碳(CO2)的排放量持续增加[1],全球气温随之升高,带来了严重的环境问题.如何实现CO2的高效捕获和循环利用[2],是未来科技发展的重点课题之一.近年来研究发现,若以低成本的可再生能源发电,以电催化将CO2还原转化为高附加值的一氧化碳、甲烷、乙烯和乙醇等化学品[3-4]是实现二氧化碳循环利用的有效途径;为了实现这一目标,开发高效、低成本的CO2电还原催化剂不可或缺.
在二氧化碳电还原制C1产物(一氧化碳、甲烷、甲酸盐等)方面,催化剂对C1产物的选择性已接近100%.例如,清华大学的陈晨教授团队在空心氮掺杂多孔碳球上负载具有原子级分散的Co-N5活性位点,可将CO2还原为CO,法拉第效率大于99%[5].在CO2电还原制备高附加值的多碳产物(C2+)方面,铜基催化剂在产物的催化选择性和法拉第效率(faradaic efficiency,FE)方面均表现优异,是目前开发的重点.然而,针对不同的CO2电还原产物,铜基催化剂的催化机理依然存在争议.本文将以国民生产必需的乙烯为CO2电还原的主要目标产物,归纳现有的铜基催化剂的种类,阐述其结构特点和催化机理.
现有研究表明,铜基催化剂中铜的电子状态是影响产物选择性和催化效率的关键.根据铜的电子状态可将铜基催化剂大致分为以下4类:单原子铜基催化剂、定向晶面铜基催化剂、氧化态铜基催化剂和铜基合金/复合催化剂.本文将简要介绍以上4类铜基催化剂的常见制备方法、结构特点、在电还原二氧化碳制备乙烯方面的催化效果和可能的催化机理.
1 单原子铜基催化剂
近年来,单原子金属催化剂由于其高效的活性原子利用率,被广泛开发为能源存储与转化领域的电化学催化剂.将单原子铜基催化剂应用于电还原二氧化碳领域,可获得高效的C1产物选择性和转化率,并且部分单原子铜基催化剂还具有C2产物的选择性.因此,本章将从C1产物和C2产物两个方面介绍铜单原子催化剂的研究进展.
1.1 单原子铜基催化剂电还原生产C1产物
目前,单原子铜基催化剂在将CO2电还原为C1产物方面(主要为CO)已具有较高的选择性.Zheng等[6]报道了一种由不饱和配位的单原子Cu与固定在石墨烯基质中的N配位组成的铜基纳米片催化剂(Cu-N2/GN).该催化剂中Cu与两个N原子配位,形成了具有高度暴露的、不饱和配位的和原子级分散的活性中心,在—0.5 V vs.RHE(reversible hydrogen electrode)的低电位下,电还原CO2生成CO的法拉第效率为81%.理论计算表明,Cu-N2能促进CO2分子的吸附,Cu-N2较短的化学键加速了电子从Cu-N2位向*CO2的转移,从而有效提高了*COOH中间体的生成和向产物CO的转化.此外,Xu等[7]开发了一种基于N掺杂石墨烯基体(Cu-N4-NG)的Cu单原子组成的催化剂.与传统的大颗粒铜基催化剂相比,Cu-N4-NG在约—1.0 V vs.RHE时,电还原CO2生成CO的法拉第效率更高,为80.6%;这是由于Cu-N4有利于CO2的吸附活化,并且部分锚定石墨烯促进水分解,为CO2还原提供了丰富的质子.Yang等[8]报道了一种简便且可扩展的策略来制备具有出色CO生产性能的Cu单原子催化剂(Cu SAs/NC).所制备的Cu SAs/NC催化剂在—0.7 V vs.RHE下,电还原CO2生成CO的法拉第效率高达92%,并且可连续工作30 h,具有出色的耐久性.
Cu单原子催化剂在电还原CO2生成其他C1产物方面也具有一定的性能.例如,Chen等[9]报道了一种以Lewis酸位为载体的单原子中心铜催化剂将CO2电还原为CH4.理论计算表明,金属氧化物(如Al2O3和Cr2O3)中的Lewis酸位可调节Cu原子的电子结构,优化中间体的吸附,从而促进CO2向CH4转化.在此基础上,探索了以富含Lewis酸位的超薄多孔Al2O3为Cu单原子载体,在—1.2 V vs.RHE时电还原CO2生成CH4的法拉第效率为62%,电流密度为153 mA·cm—2.以上研究展现了调控单原子Cu电子结构的一些有效策略通常只适用于涉及单分子的催化反应,对于涉及多个分子的过程,可以通过开发具有更高复杂性的原子分散催化剂来改善催化性能.例如,Jiao等[10]报道了一种具有两个相邻Cu原子的催化剂,称之为“原子对催化剂”,它们共同作用以进行CO2还原中关键的双分子步骤.“原子对催化剂”具有稳定的Cu10-Cu1x+对结构,Cu1x+吸附H2O,相邻的Cu10吸附CO2,从而促进CO2活化,使竞争性的析氢反应几乎完全被抑制,电还原CO2生成CO的法拉第效率超过92%.
1.2 单原子铜基催化剂电还原生产C2产物
尽管单原子铜基催化剂在电还原CO2生产C2+产物方面的文献报道较少,但也不乏一些优秀示例.有研究团队将块状Cu加入熔融的Li中,直到在超声波作用下完全溶解.在Li熔化至室温的淬火过程中,Cu仍然被原子分离,在增湿的空气中将Li转化为LiOH,形成Cu-LiOH混合物.然后将混合物与碳载体混合并用水浸出LiOH,最后Cu原子转移到碳表面,在—0.7 Vvs.RHE下电还原CO2生成乙醇的法拉第效率高达91%,催化剂能稳定运行超过16 h[11].Fu等[12]研究了Cu-C3N4电还原CO2为C2H4的17种可能途径和反应机制.通过密度泛函理论(density functional theory,DFT)计算获得了可能的反应中间体及Cu-C3N4催化剂上可能的活性位点上的不同反应途径.由于Cu-C3N4催化剂上Cu与C的协同效应,g-C3N4衬底上C原子的存在为第一个从Cu位还原的CO2中间体*OCH2提供了一个完美的结合位点,为第二次CO2还原留下了空缺的Cu.重复利用此Cu位点进行CO2还原,大大提高了反应效率.
CO2电还原过程中重要的中间体是*CO,*CO的偶联是CO2还原为多碳产物的关键步骤,因此,研究CO的电化学催化还原过程对CO2电还原研究有十分重要的借鉴作用.Li等[13]开发了一种双金属原子催化剂,使两个相邻的Cu-Cu或Cu-Ni原子均匀分布在N掺杂的碳骨架上,如图1(a)的SEM图和图1(b)的TEM图所示,开发了独特的CO电还原催化位点.本文进一步通过理论计算证明,双Cu原子位点有利于两个CO分子的电还原以及随后的C-C耦合,而用Ni取代双Cu原子中的一个会导致CO吸附过强(图1(c)).因此,只有单个Cu原子充当C1还原途径的催化位点.由于相邻金属位点之间的协同效应,双Cu-Cu原子催化剂能够在—1.6 Vvs.RHE时,电还原CO转化为乙烯、乙醇和醋酸盐等C2+产物的法拉第效率高达91%,且C2+产物的分电流密度超过90 mA·cm—2(图1(d)—(f)).所以,Cu-Cu双原子位点可以有效地催化CO转化为C2+产物,并有可能进一步应用到CO2电还原之中.
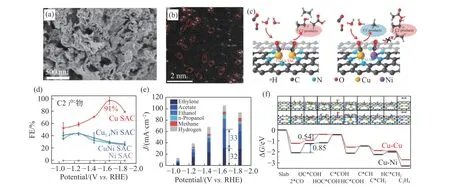
图1 双铜原子催化剂的形貌性能机理图Fig.1 Morphology,properties,and mechanism of a double copper atom catalyst
2 铜晶面的定向调控
研究表明,结晶化铜的暴露晶面对电还原CO2产物的选择性和法拉第效率有着重要影响.本章将从单晶Cu与多晶Cu两类铜基催化剂出发,阐述此类催化剂在电还原CO2制备C2+产物(主要为C2H4)方面的重要进展和催化机理.
2.1 单晶铜催化剂
在单晶铜方面,Takahashi等[14]以99.999%的Cu为原料,在石墨炉中生长了Cu单晶,此材料由n排原子的Cu(100)平台和1个Cu(111)或Cu(110)平台组成.催化结果表明,在Cu面心立方晶体的Cu (111)面上,CH4的生成占优势,而在Cu(100)面上,C2H4的生成占主导,证明了Cu电极的晶面取向影响着CH4和C2H4的生成.CO2电还原过程中重要的中间体是*CO,*CO的偶联是CO2还原为多碳产物的关键步骤,因此,研究CO的电化学催化还原过程对CO2电还原研究有十分重要的借鉴作用.Schouten等[15]研究了CO在两个单晶Cu电极上的电化学还原反应,并观察到两种不同的反应机理:一种途径是与CH4的生成有共同的中间产物,并且优先发生在Cu(111)面或台阶上;另一种途径是在Cu (100)面,并在相对较低的过电位下选择性地将CO还原为C2H4,CO在单晶铜上的有效电化学催化还原的深度研究为单晶催化剂电还原CO2为C2H4提供了思路.
众所周知,单晶Cu的生长较为困难,存在较多挑战.Hahn等[16]在大尺寸(约6 cm2)单晶衬底上通过物理气相沉积得到Cu薄膜,并成功合成了Cu(100)、Cu(111)和Cu (751)取向的外延生长.结果表明,在3种Cu晶面取向中,Cu(751)晶面对含氧烃官能团的多碳产物的选择性高,Cu(100)晶面对C2H4产物选择性更高.
2.2 多晶铜催化剂
除单晶Cu外,目前最具C2+选择性的铜基催化剂主要为多晶纳米Cu,这可能源于多晶纳米Cu中欠配位或高米勒指数表面组成的强结合位点的存在.Gregorio等[17]研究了具有不同暴露晶面的Cu纳米立方体、Cu纳米八面体和Cu纳米球的催化活性,形貌如图2(a)—(c).其中,Cu纳米立方体具有更多的Cu (100)晶面,而其他形貌的Cu具有更多的Cu(111)晶面,分别对应于XRD衍射图(图2(d))中43°与50°处的衍射峰.电化学测试结果表明,Cu纳米立方体电还原CO2产C2H4的法拉第效率达57%,如图2(e),优于暴露Cu(111)晶面的Cu纳米催化剂.Cu(100)晶面对C-C耦合过程的热力学和动力学更为有利,故具有较高的C2H4产物选择性.除了Cu的晶面调控,也可通过调控Cu颗粒的大小获得不同的催化性能.例如,Reske等[18]制备了平均粒径为2~15 nm的Cu NPs催化剂,模拟并计算了球形Cu颗粒表面晶面暴露与尺寸的依赖关系,结合实验结果进行了解释分析.结果表明,随着Cu颗粒尺寸的减小(<5 nm),Cu(100)晶面暴露较少,催化剂对H2和CO的催化活性和选择性显著提高.当粒径适中时,即铜颗粒介于5~8 nm时,Cu纳米粒子会优先暴露Cu (100)晶面,进而增加C2H4产物的选择性.
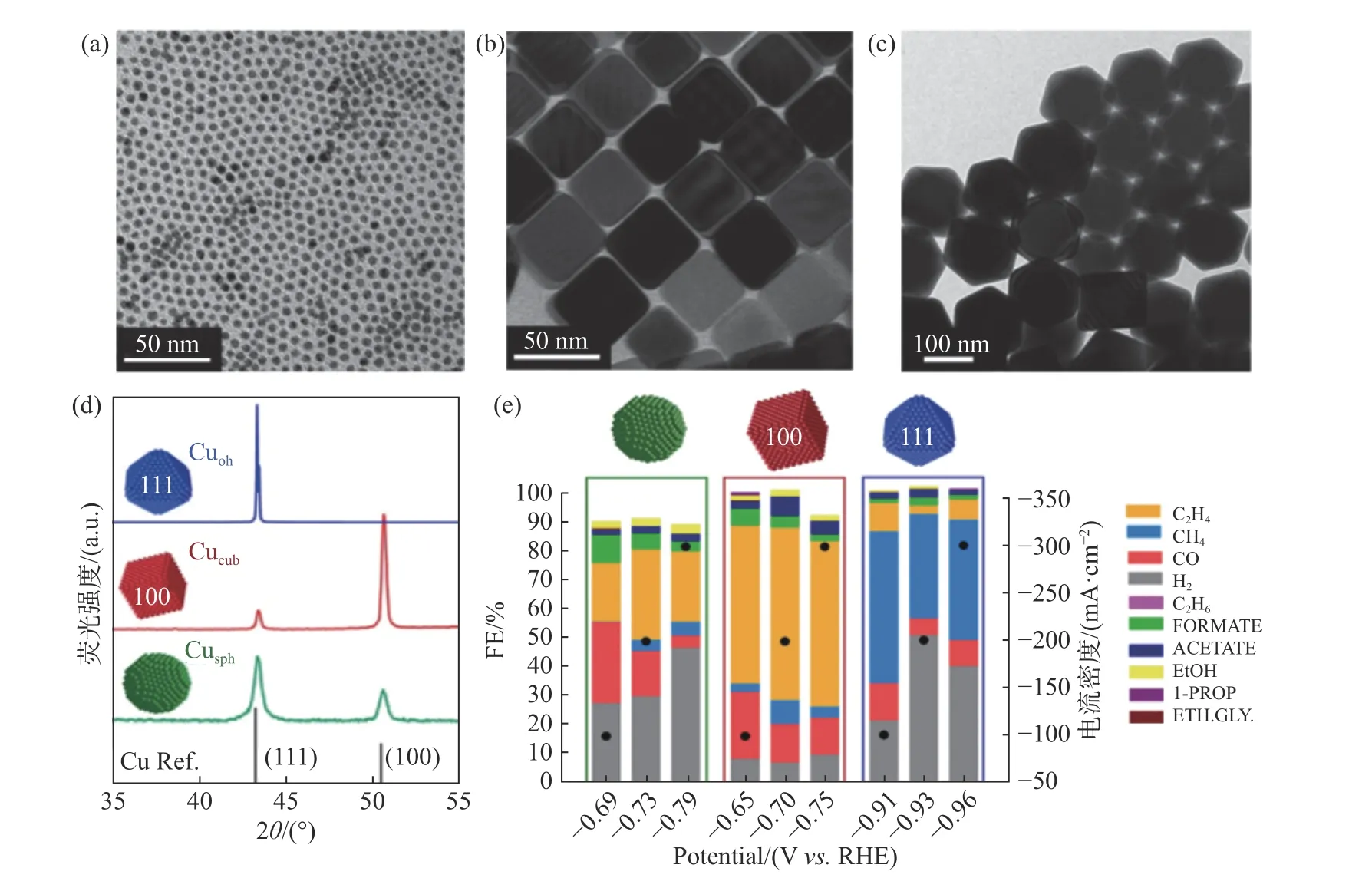
图2 铜不同晶面的形貌物相表征及性能研究Fig.2 Characterization of the morphology,phase,and properties of different copper crystal planes
不仅单质铜的晶面选择对不同产物具有选择性,氧化态铜的晶面选择也同样具有不同的选择性.例如,Gao等[19]制备了具有不同晶面的Cu2O纳米颗粒,即具有Cu2O(100)晶面的c-Cu2O纳米颗粒、具有Cu2O(111)晶面的o-Cu2O纳米颗粒和同时具有Cu2O(111)和Cu2O(100)晶面的t-Cu2O纳米颗粒,并评价了它们对CO2还原为C2H4的电催化性能.结果表明,3种催化剂电还原CO2为C2H4产物的法拉第效率依次为c-Cu2O(38%)<o-Cu2O(45%)<t-Cu2O(59%),C2H4生成的选择性和活性强烈依赖于Cu2O纳米颗粒中暴露的晶面.该研究将t-Cu2O纳米粒子性能的提高归因于Cu2O(100)和Cu2O(111)晶面的协同作用,它不仅促进了C-C偶联和C2H4的脱附,而且能够促进多电子参与的C2H4生成动力学.此外,当Cu (100)晶面与其他晶面耦合时同样可促进C2+产物生成.例如,Zhong等[20]设计了具有不同晶面的铜催化剂并进行了性能对比,其中,Cu(100)晶面与Cu (110)晶面耦合的催化剂在电还原CO2为C2+产物时表现出高达87%的法拉第效率和217 mA·cm—2的局部电流密度.该研究认为,不同晶面起到了协同催化的作用,Cu(110)促进了CO的吸附,Cu (100)促进了C-C偶联.进一步调节晶面暴露的比例可以进一步提高C2H4产率,Li等[21]通过原子层沉积技术改变前驱体脉冲序列的方法选择性地覆盖Cu(111)晶面,以增加Cu(100)/Cu(111)的表面率,高Cu (100)/Cu(111)晶面比的涂层催化剂(Cu/Al2O3)显著提高了C2H4的法拉第效率,其机理是涂层阻止了催化剂中活性物质在恶劣条件下的动态运动和聚集, 从而抑制了CH4的生成.在5 mol/L KOH电解液中,当电流密度为300 mA·cm—2时,涂层催化剂电还原CO2为C2+产物的法拉第效率为60.4%.
3 氧化态铜基催化剂
相比于铜单质/零价铜(Cu0),多价态铜的氧化物因其对C2+产物的高选择性而受关注;其中,Cu+已经被证实是电还原CO2产C2H4的重要活性物质[22].本章从铜的不同氧化态的角度出发,阐述氧化态的铜基催化剂在电还原CO2产C2H4方面的重要研究进展,并总结了典型催化剂的催化效果(表1).
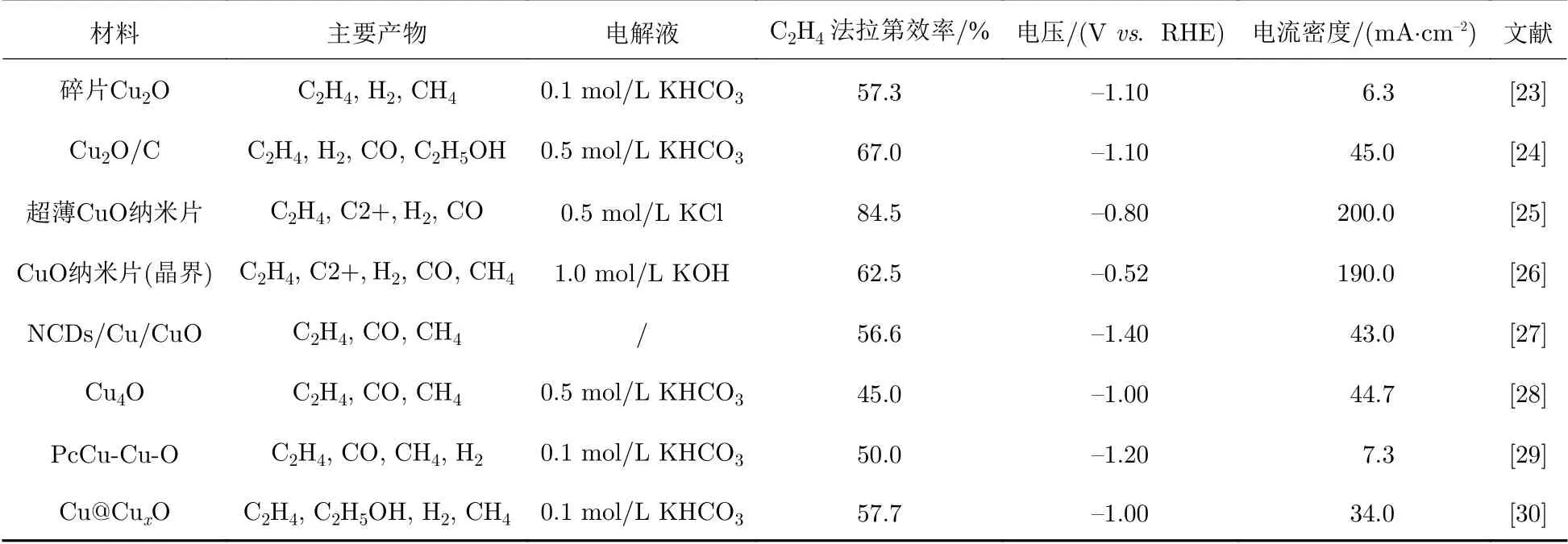
表1 不同氧化态铜基催化剂电还原CO2的性能对比Tab.1 Electroreduction performance of CO2 using Cu-based electrocatalysts with different Cu oxidation states
3.1 含一价铜的Cu2O催化剂
如图3(a)所示,Jung等[23]通过一步湿化学法合成了20 nm左右尺寸可控的Cu2O纳米颗粒,在电催化CO2还原的初始阶段破碎成2~4 nm的Cu2O碎片.这种原位电化学碎片对电还原CO2产C2H4具有高选择性,法拉第效率为57.3%.这是由于其独特的形貌以及Cu2O纳米颗粒紧密的排列组合,在抑制析氢反应的同时促进了C-C的偶联反应.Gao等[24]用两步湿化学法将Cu2O纳米颗粒锚定在碳纳米材料基底上(图3(b)),其电还原CO2产C2H4法拉第效率高达67%.这是由于Cu2O与碳之间形成的异质结构能够提高C-C的耦合能力,同时抑制C2H5OH等竞争产物的生成,因此表现出较好的C2H4选择性.Yang等[22]以醋酸铜为Cu前驱体,以水合肼作为还原剂,将醋酸铜还原形成固体Cu2O纳米颗粒,使用盐酸腐蚀固体结构,最后合成具有多孔的Cu2O纳米球.在电催化过程中,此催化剂在孔道内原位生成碳中间体,并且在此孔道空间限制条件下,防止了CO2RR下Cu+的过度还原,生成了含Cu0/Cu+混合价态的催化结构,孔结构起到稳定Cu的氧化态的作用.此多孔Cu2O纳米球在—0.61 Vvs.RHE下电还原CO2生成C2+产物的法拉第效率高达75.2%.
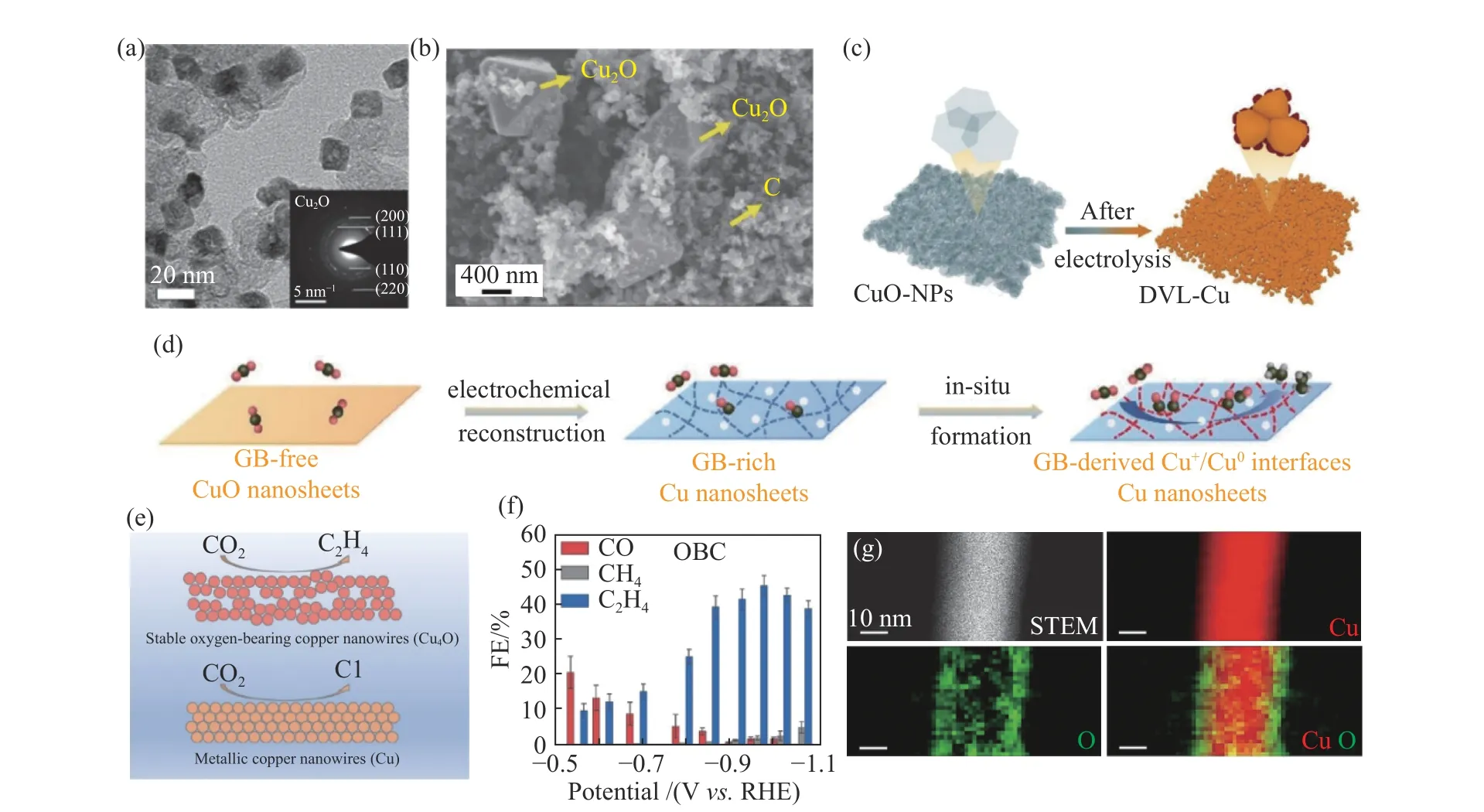
图3 多种氧化态铜基催化剂的形貌、性能、催化机理分析图Fig.3 Morphology,performance,and mechanism diagram for various oxidation states of copper-based catalysts
3.2 含二价铜的CuO催化剂
研究表明,CuO催化剂在电还原CO2过程中会转化为Cu+/Cu0界面作为实际的催化位点.如图3(c)所示,Liu等[25]报道了一种简单且可扩展的阳极腐蚀法来制备超薄CuO纳米片材料,这些片层结构在电还原CO2过程中通过自进化形成Cu/Cu2O非均相界面.该催化剂可高效电还原CO2生产C2H4,其法拉第效率为84.5%,在以中性KCl为电解液的流动电解槽中能稳定催化55 h.该催化剂稳定的纳米结构和原位转化的Cu/Cu2O界面能提高*OCCOH中间体的吸附能力,降低C-C的耦合能垒,从而提高了C2H4的选择性.Zhang等[26]通过超声辅助电沉积法制备了CuO纳米片,可在低过电位下电还原CO2生产C2H4,其法拉第效率为62.5%.如图3(d)所示,CuO纳米片在电催化时发生原位重组形成大量的晶界.在重构的晶界区域中,低配位的Cu原子形成了稳定的Cu+/Cu0界面作为CO2还原的高活性位点.Cu+/Cu0界面提供了较高的*CO表面覆盖率,降低了*CO二聚反应的活化势垒,协同促进了CO2向C2H4的转化.此外,对CuO催化剂进行复合改性也是值得关注的研究.Zhou等[27]报道了一种-NH-改性碳位点复合CuO/Cu的新型催化剂NCDs/Cu/CuO,其C2H4的法拉第效率为改性前的1.2倍.研究表明,-NH-改性碳位点降低了Cu/CuO粒子间电子转移阻力,电子沉淀效应能显著提高催化剂表面的电子浓度,这种电子调控行为能够促进C-C的偶联反应从而提高C2H4的选择性.
3.3 非典型Cu4O催化剂
如图3(e)和图3(f)所示,Zhang等[28]报道了一种具有分级多孔结构的Cu4O催化剂,对C2H4表现出独特的催化选择性.对C2H4优异的选择性源于Cu4O表面位点能够增强*CO的吸附和二聚反应,从而促进了C-C的偶联反应.Qiu等[29]将Cu4O与PcCu-(OH)8复合,获得了具有双活性位点的金属有机框架材料(PcCu-Cu-O),其电还原CO2产C2H4的法拉第效率(FEC2H4为50%)远高于具有单一活性位点的PcCu-(OH)8催化剂(FEC2H4为25%).CuPc位点和Cu4O位点的协同作用降低了C-C二聚反应的能垒,为双活性位点在铜基氧化物催化剂的研究提供了新思路.
3.4 含Cu2+/Cu+混合价态的催化剂
Lyu等[30]利用O2和H2O2分别对铜纳米线(CuNWs)进行表面氧化获得了Cu@CuxO核壳结构(图3(g)).结果表明,经O2处理的CuNWs表面以CuO为主,并含有部分Cu2O,其电还原CO2产C2H4法拉第效率为57%,高于经H2O2处理的表面为CuO的CuNWs催化剂(FEC2H4为52%).本文探究了表面粗糙度和氧化层电化学还原过程中产生的缺陷对电还原CO2产C2H4的影响,并提出了基于Cu2+/Cu+混合价态电还原CO2机理的初步理论验证和新的思路.
4 铜合金/复合催化剂
将铜与其他异质元素复合,使不同元素之间产生协同效应、约束效应、合金效应、串联效应、化学态效应和微观结构效应等[31]能提高铜基催化剂在电还原CO2制备C2H4的选择性和法拉第效率,其中串联效应与协同效应占据主导地位,相关研究受到广泛关注.本章将从以下两方面介绍近年来铜复合异质元素催化剂方面的重要研究:① 将Cu与其他金属元素复合,形成双/多金属催化剂;② 在铜基催化剂中引入非金属元素,生成复合型催化剂,并总结了典型催化剂的催化效果(表2).
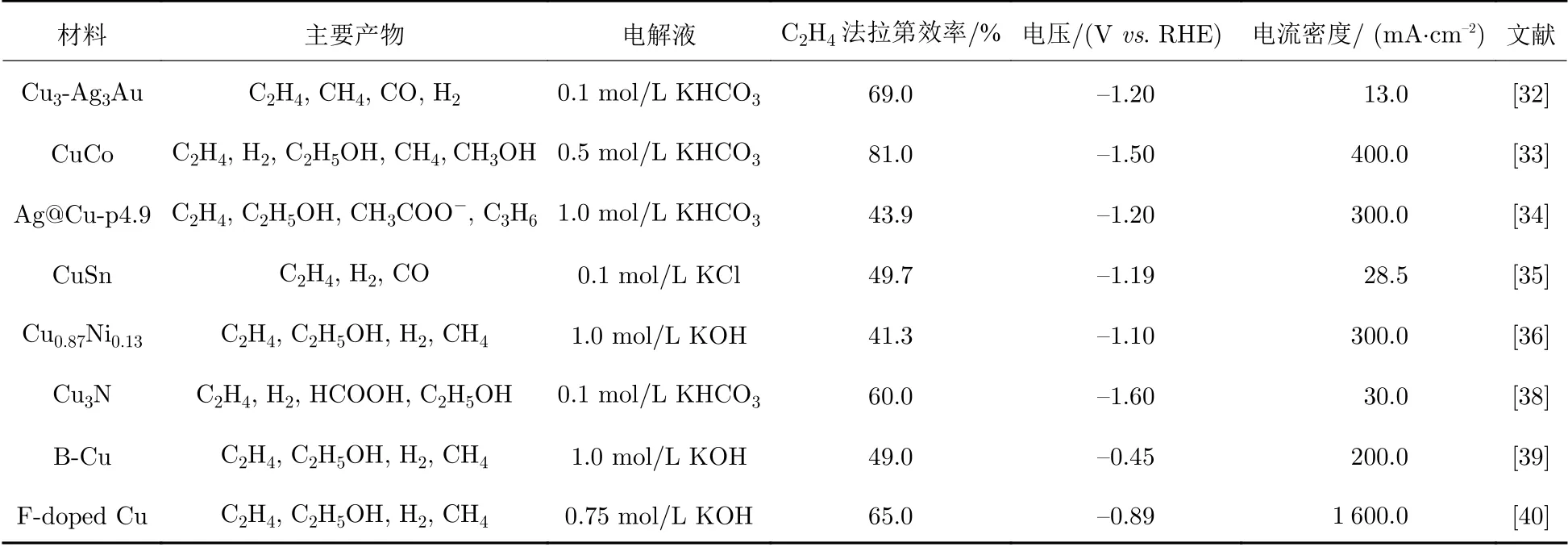
表2 复合异质元素的铜基催化剂的电还原CO2的性能对比Tab.2 Electroreduction performance of CO2 using different Cu-based electrocatalyst composites
4.1 双/多金属铜基催化剂
由于不同金属元素之间具有配体效应、电子效应和几何效应等,研究者们制备了一系列铜基合金催化剂,其中,Au、Ag、Pd、Ni、Co、Zn、Sn和Bi等被认为是较有前景的与Cu复合的金属元素.如图4(a)所示,Xiong等[32]制备了一种Cu3-Ag3Au三元催化剂,其电还原CO2产C2H4的法拉第效率高达69%(图4(b)).合金化的Ag/Au基底促进了CO的生成,高应变和变形的Cu网格化结构加速了C-C的耦合,由于Ag/Au与Cu之间存在强的晶格失配电子相互作用,带正电荷的Cu晶格也降低了电子转移能垒(图4(c)).这项工作通过串联效应、电子调控、缺陷工程及开放式结构设计提高了C2H4的产率.如图4 (d)所示,Yan等[33]以2-氨基芘为配体,采用配体组装的方法制备了超薄CuCo纳米片.该配体能够促进金属原子的面内键合,通过π-π键和氢键自组装成类石墨烯基元.CuCo双金属催化剂在—1.5 Vvs.RHE电位下电还原CO2产C2H4的法拉第效率高达81%(图4 (e)).CuCo双金属催化剂对中间体*CO的吸附能有所提高,Co的d带更接近费米能级,有利于CO的解离吸附,促进碳链的生长.Cu-Co的协同作用又可加快反应动力学,电荷转移加快,功函数减少,不同催化组分之间的协同作用及电还原CO2反应路径的能垒降低,提高了C2H4的选择性.
调节反应中间产物的局部约束对于促进C-C耦合具有重要意义.Zhong等[34]通过电化学还原法制备了以Ag为核Cu为壳的核壳结构Ag@Cu-p4.9催化剂(图4 (f)),其产C2H4的法拉第效率为43.9%,C2+产物的法拉第效率高达73.7%.本文调节Cu壳层的孔径提高*CO的表面覆盖率,形成具有约束效应的线性吸附构型从而促进了C-C的耦合.Jia等[35]通过一步法共还原金属前驱体合成了Cu-Sb催化剂.Cu-Sb合金的多孔结构、特殊的电子构型、较大的电化学表面积和较低的电荷转移电阻使其具有较好的催化性能,在—1.19 Vvs.RHE电位下产C2H4法拉第效率达49.7%.Song等[36]合成了一种可互溶并且成分含量可控的CuNi固溶体催化剂,其电还原CO2产C2H4法拉第效率达41.3%.CuNi固溶体中Cu的电子结构发生变化但不会产生重叠几何效应,该作者通过调控中间产物*H与*CO的吸附提高C2+产物的选择性.理论计算模拟是预测和研究电催化材料性能的重要方法,Zhang等[37]运用第一性原理对Zn掺杂Cu (100)晶面后的催化剂进行了研究.结果表明,Zn掺杂能改变Cu周围的电子结构,调整活性位点上的原子排列,使催化剂表面具有电负性,有利于酸性CO2分子的活化和C-C二聚反应的能垒降低,对电还原CO2产C2H4具有积极促进作用,但如何通过实验将Zn锚定在(100)晶面将会是面临的新挑战.
4.2 非金属元素复合的铜基催化剂
将O、N、B、F和Se等非金属元素与Cu复合,是提高铜基催化剂性能的另一种有效方法.Yin等[38]报道了一种新型钙钛矿型Cu3N催化剂,其产C2H4的法拉第效率高达60%.其研究表明,Cu+在Cu3N结构中被N稳定,稳定的Cu+促进了*CO与*CHO中间体的耦合,进而加速了CO2向C2H4的转化.Song等[39]开发了一种B掺杂Cu基催化剂,在气体扩散电极体系下C2H4的法拉第效率达49%,Cu+的稳定存在及*OCO的过电位正移使其具有优异的催化性能.Ma等[40]采用溶剂热法合成了Cu(OH)F前驱体,再通过电还原制备了F改性的Cu基催化剂F-Cu.该催化剂电还原CO2产C2H4的法拉第效率高达65%,电流密度高达1 600 mA·cm—2.如图4(g)所示,该作者提出了一种*H辅助促进C-C耦合的机理.吸附的*CO和*CHO是关键的反应中间体,活化H2O生成*H是一个重要的步骤.F的改性能够加速H2O的活化,促进了*CO在Cu表面的吸附和加氢,吸附的*CHO可以较容易地在Cu表面进行耦合,从而提高了C2H4的选择性.卤素元素这一特性为开发高选择性和高活性铜基电CO2催化剂带来了美好的前景.
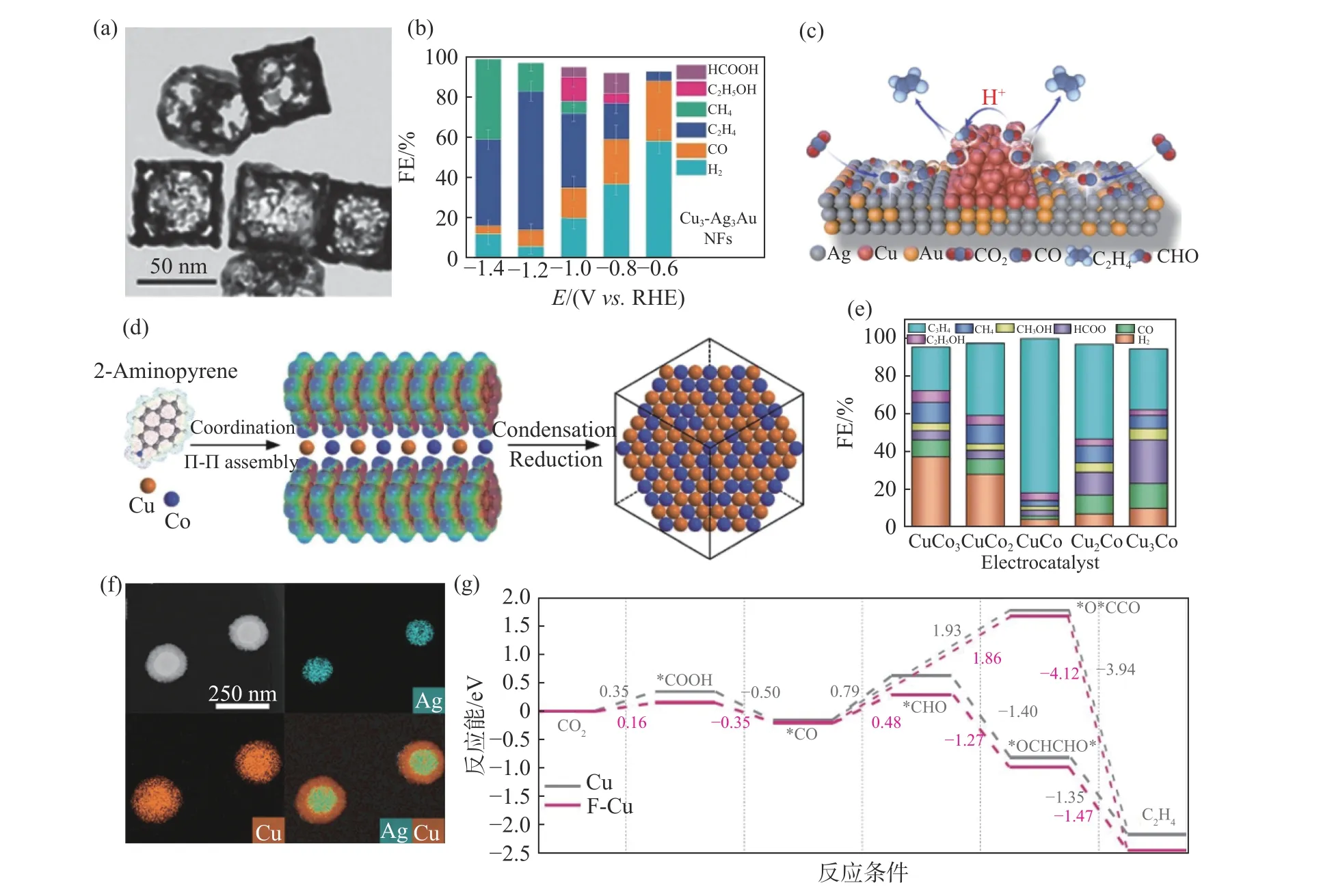
图4 多种元素复合铜基催化剂形貌性能机理图Fig.4 Morphology,performance,and mechanism diagram of various copper based-catalyst composites
5 结 论
电催化还原CO2为高附加值的一氧化碳、甲烷、乙烯、乙醇等化学品,是实现二氧化碳循环利用的有效途径.本文将常见的铜基催化剂大致归纳为单原子铜基催化剂、定向晶面铜基催化剂、氧化态铜基催化剂和铜基合金/复合催化剂,并简要介绍了其制备方法、结构特点,以及在电还原二氧化碳方面的催化效果和可能的催化机理.单原子铜基催化剂由于活性铜位点之间的距离较远,二氧化碳被还原为*CO中间体后的密度较低,不利于碳-碳偶联生成多碳产物.因此,单原子铜基催化剂对一氧化碳和甲烷的选择性较好;对于具有定向晶面的铜基催化剂中,Cu(100)晶面对碳-碳耦合过程的热力学和动力学更为有利,故具有较高的C2H4和C2+产物选择性;相比于铜单质/零价铜(Cu0),多价态铜的氧化物能降低*CO二聚反应的活化能势垒,促进了二氧化碳向C2+产物的转化;最后将铜与其他异质元素复合,使不同元素之间产生协同效应、约束效应、合金效应、串联效应、化学态效应和微观结构效应,促进了电还原二氧化碳转化.

