木兰花碱对溃疡性结肠炎模型大鼠的治疗作用及其机制*
徐志红,陈磊垚,许立,徐德荣
(1.南京中医药大学附属南京市中西医结合医院药学部,南京 210014;2.南京中医药大学江苏省中药药效与安全性评价重点实验室,南京 210046)
溃疡性结肠炎(ulcerative colitis,UC)是炎症性肠病 (inflammatory bowel disease,IBD) 的一种,其特点是腹部疼痛,并伴有带血腹泻、疲劳、直肠出血和体质量下降[1]。环境因素和遗传因素是导致UC的两大要素,二者相互作用可导致肠道发生免疫反应和炎症[2]。异常激活的核因子κB (nuclear factor-κB,NF-κB)促进促炎症细胞因子转录,呈炎症反应放大现象,决定UC的发生与发展[3]。在IBD患者中,结肠上皮细胞和黏膜巨噬细胞上发现了NF-κB活化[4]。根据NF-κB表达水平可判断UC的严重程度和药物干预效果[5]。激活Nod样受体家族含pyrin结构域蛋白3 (NOD-like receptor family pyrin domain containing 3,NLRP3)导致caspase-1活化[6-7]、成熟白细胞介素(IL)-1β释放[8],通过激活淋巴细胞、促进白细胞在损伤或感染部位的渗透,参与全身和局部感染反应的产生[9]。据报道,NLRP3基因多态性与人类患IBD的风险呈正相关[10]。NF-κB和NLRP3轴可能是开发IBD新疗法的潜在靶点。木兰花碱是中草药木兰和马兜铃的主要活性成分。LI等[11]发现大剂量木兰花碱具有较强的抗炎作用,可以抑制一氧化氮(NO)的产生,保护小鼠巨噬细胞免受脂多糖诱导的凋亡。木兰花碱通过负调控MAPK信号通路的Braf蛋白,抑制铜绿假单胞菌PAK株诱导的炎症反应[12]。GUO等[13]关于木兰花碱对脂多糖诱导的体内外急性肺损伤的抗炎作用研究表明,木兰花碱可剂量依赖性降低促炎细胞因子的表达。但是,笔者尚未见木兰花碱治疗UC的相关报道。本实验拟考察木兰花碱对UC模型大鼠的缓解作用及其机制。
1 材料与方法
1.1材料和试剂 木兰花碱(上海梵态生物科技有限公司,含量≥98%,批号:FT10031227),3%葡聚糖硫酸钠(dextran sodium sulfate,DSS,德国MP Biomedicals公司,批号:S3045),IL-1β(批号:ab22957)、IL-18(批号:ab24562)、肿瘤坏死因子(TNF)-α(批号:22784)等酶联免疫吸附实验(ELISA)试剂盒购自美国Abcam公司,FITC anti-CD11b(批号ab12452)、NLRP3(批号:ab13544)、IKKβ-1(批号:ab34631)、Iκβα(批号:ab32524)、p-IκBα(批号:ab34246)、p-IKKβ(批号:ab41744)、p-NF-κB p65(批号:abs124475) 等抗体均购自美国Abcam公司,cleaved caspase-1抗体(上海爱必信生物科技有限公司,批号:abs143596),其他试剂和化学品均来自标准的商业公司。
1.2实验动物 SPF级雄性SD大鼠,6~8周,体质量(200±20) g,购自南通大学,合格证号:SCXK(苏)2019-0001。自由饮用食物和水,温度25 ℃,湿度45%。
1.3仪器 酶标仪(美国MD公司,型号SpectraMax 190);荧光显微镜(日本 Olympus公司,型号IX71);石蜡切片机(德国Medite公司,型号M530);高速冷冻离心机(德国Eppendorf公司,型号5430R)。
1.4造模与分组 SD大鼠进入SPF级动物实验中心适应性饲养1周后,按随机数字表法分为正常对照组、模型对照组、5-氨基水杨酸组(100 mg·kg-1)和木兰花碱小、中、大剂量组(25,50,100 mg·kg-1),每组10只,根据相关文献造模[14]。自实验第1天开始,正常对照组大鼠灌胃纯净水,其余5组大鼠灌胃给予相应药物,每天1次,连续10 d 。第11天,处死大鼠后解剖取结肠组织,一部分冷冻(-80 ℃)保存,一部分用10%甲醛溶液固定,用于后续分析。
1.5疾病活动指数分析(disease activity index,DAI) 评估大鼠DAI,指标包括质量、大便性状、便血情况。
1.6髓过氧化物酶(myeloperoxidase,MPO)活性分析 称取大鼠结肠组织50 mg,冰上充分匀浆后取上清液,依据MPO试剂盒说明书中方法测定MPO活性。
1.7苏木精-伊红(HE)染色及病理组织学评分 大鼠结肠组织置于10%甲醛溶液固定,包埋后切片(厚度5 μm),HE染色,显微镜下观察并摄像。根据以下5个参数评分,①病变范围:0分=0%,1分=1%~25%,2分=26%~50%,3分=51%~75%,4分=76%~100%;②病变深度:0分=无损伤,1分=黏膜上皮,2分=黏膜固有层,3分=黏膜下层,4分=肌层和浆膜层;③隐窝损伤:0分=无损伤,1分=1/3隐窝损伤,2分=2/3隐窝损伤,3分=隐窝缺失或者表面上皮完整,4分=隐窝、表面上皮两者都缺失;④炎症细胞浸润:0分=无浸润,1分=轻微浸润,2分=轻度浸润,3分=中度浸润,4分=重度浸润;⑤纤维组织增生:0分=无增生,1分=轻微增生,2分=轻度增生,3分=中度增生,4分=重度增生。
1.8ELISA法检测炎症因子含量 结肠组织中炎症细胞因子(IL-1β、IL-18和TNF-α)根据相应ELISA试剂盒的操作步骤进行定量分析。
1.9Western blotting分析蛋白表达 提取组织蛋白后,采用二喹啉甲酸(bicinchoninic acid,BCA)试剂盒定量分析,10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophore-sis,SDS-PAGE)凝胶分离,转膜,脱脂牛奶封闭1.5 h。分别加入一抗稀释液:IκBα、p-IκBα、p-IKKβ、p-NF-κB p65、NLRP3、IKKβ、cleaved caspase-1,4 ℃,过夜。TBST洗膜后加入二抗,孵育1 h。TBST洗膜后加入化学发光试剂,用电化学发光法监测蛋白表达,Image J软件分析灰度值。
1.10免疫组化分析 被石蜡包埋的结肠组织切片(厚度5 μm),脱蜡,修复抗原,双氧水灭活内源性过氧化物酶,5%牛血清蛋白(albumin from bovine serum,BSA)封闭后滴加1:200稀释的一抗(p-NF-κB p65、NLRP3、cleaved caspase-1),4 ℃过夜后,加二抗后滴加现配的二氨基联苯胺(diaminobenzidine,DAB )显色液,然后用苏木精染核,封片,显微镜下观察后摄像。
1.11免疫荧光分析 被石蜡包埋的组织切片后,依次进行脱蜡、水化、修复、1%磷酸盐缓冲液(PBS)洗涤、10%山羊血清封闭等操作后,滴加提前稀释的直标的荧光抗体(CD11b-FITC),避光4 ℃孵育过夜。PBS洗涤后滴加4’,6-二脒基-2-苯基吲哚染液,避光孵育0.5 h。PBS洗涤后加防荧光猝灭剂,最后用镊子夹取盖玻片封片。荧光显微镜观察,分析结果。

2 结果
2.1木兰花碱对DSS诱导UC大鼠一般状态、DAI评分和MPO活性的影响 正常对照组大鼠毛发光泽鲜亮,活泼好动,正常饮食和排便;模型对照组大鼠饮用DSS溶液第2天,毛发色泽暗淡,活动减少,体质量减轻,稀便,上述症状随着时间延长加重,并出现便血;用5-氨基水杨酸和木兰花碱干预后,可不同程度改善上述病症。治疗结束后,与正常对照组比较,模型对照组DAI评分显著提高(P<0.01);木兰花碱中、大剂量组DAI评分明显低于模型对照组(P<0.01),其中大剂量组DAI评分最低;木兰花碱小剂量组DAI评分显著高于5-氨基水杨酸组(P<0.05),但是木兰花碱中、大剂量组DAI评分与5-氨基水杨酸组差异无统计学意义。模型对照组MPO含量较正常对照组增加(P<0.01);木兰花碱中、大剂量组可逆转模型对照组中MPO值升高(P<0.01),其中木兰花碱大剂量组MPO值最低;木兰花碱小、中剂量组MPO值显著高于5-氨基水杨酸组(P<0.05,P<0.01),木兰花碱大剂量组MPO值与5-氨基水杨酸组差异无统计学意义,见表1。

表1 6组大鼠DAI、MPO比较
2.2结肠组织病理形态的改变 正常对照组中大鼠结肠上皮结构完整清晰,固有层炎症细胞数量不变,黏膜腺体整齐完好,黏膜下层、肌层、浆膜层无病变特征。模型对照组大鼠可见杯状细胞丢失,黏膜层和黏膜下层炎症细胞浸润严重,隐窝结构损坏;DSS引起大鼠的病理组织学评分显著提高(P<0.01)。木兰花碱小、中、大剂量及5-氨基水杨酸均可以减轻结肠组织损伤,显著改善结肠组织结构(图1)。5-氨基水杨酸组和木兰花碱各剂量组大鼠病理组织学评分较模型对照组显著降低(P<0.05或P<0.01);木兰花碱3个剂量组中大剂量组的病理组织学评分最低;木兰花碱各剂量组病理组织学评分高于5-氨基水杨酸组,其中小、中剂量组与5-氨基水杨酸组的差异有统计学意义(P<0.01)。
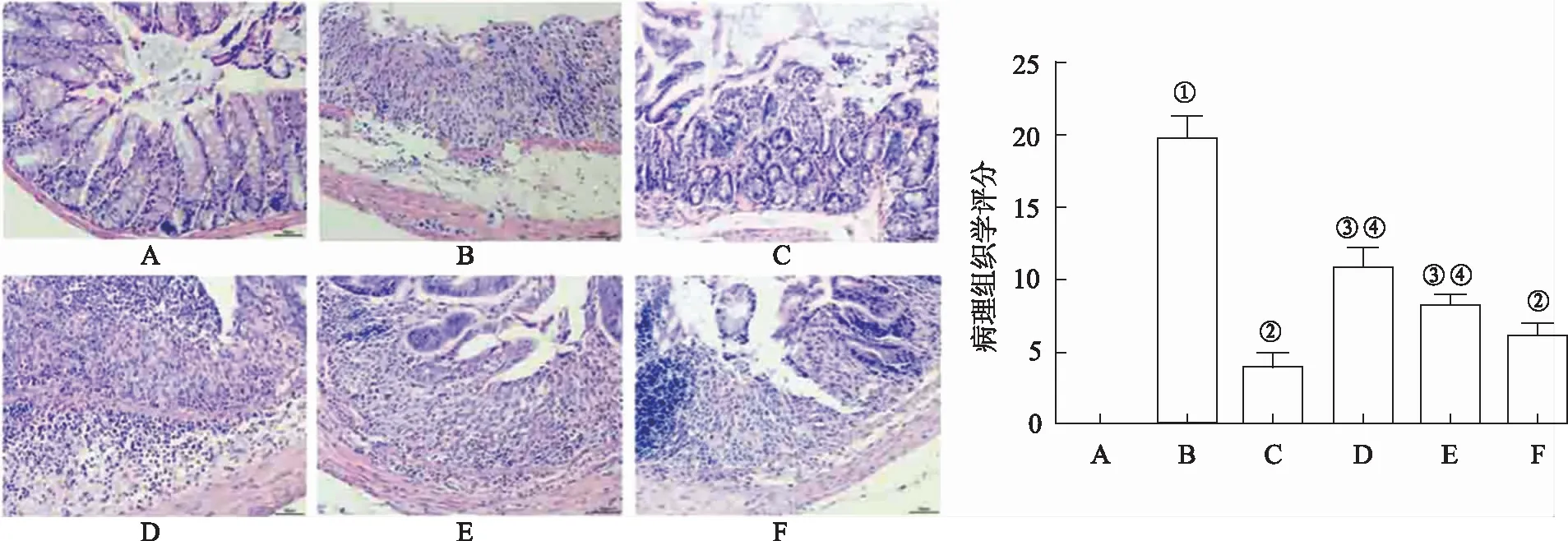
A.正常对照组;B.模型对照组;C.5-氨基水杨酸组;D.木兰花碱小剂量组;E.木兰花碱中剂量组;F.木兰花碱大剂量组。①与正常对照组比较,P< 0.01;②与模型对照组比较,P<0.01;③与模型对照组比较,P<0.05;④与5-氨基水杨酸组比较,P<0.01(F=103.500)。
2.3木兰花碱调节细胞炎症因子的表达 IL-1β、IL-18和TNF-α等 3个促炎症细胞因子含量在UC大鼠结肠组织中明显增加。与模型对照组比较,5-氨基水杨酸组大鼠结肠组织中上述 3个促炎症细胞因子含量降低(P<0.05或P<0.01),且木兰花碱各剂量组大鼠炎症因子含量不同程度降低(P<0.05或P<0.01);与5-氨基水杨酸组比较,木兰花碱小剂量组IL-1β和 3个不同剂量组IL-18、小剂量组TNF-α均显著增加(均P<0.05);木兰花碱 3个不同剂量组中,大剂量组IL-1β、IL-18、TNF-α的含量最低(图2)。

A.正常对照组;B.模型对照组;C.5-氨基水杨酸组;D.木兰花碱小剂量组;E.木兰花碱中剂量组;F.木兰花碱大剂量组。①与正常对照组比较,P< 0.01;②与模型对照组比较,P<0.01;③与5-氨基水杨酸组比较,P<0.05;④与模型对照组比较,P<0.05(F=34.822~55.787)。
2.4结肠组织中CD11b+巨噬细胞数量 因图1,2提示木兰花碱大剂量对UC的疗效较好,故免疫荧光法检测中以木兰花碱大剂量组为代表。结果显示,与正常对照组大鼠比较,模型对照组大鼠结肠组织中CD11b+巨噬细胞数量明显增加。与模型对照组比较,木兰花碱大剂量组大鼠结肠组织中CD11b+巨噬细胞数量明显减少(图3)。
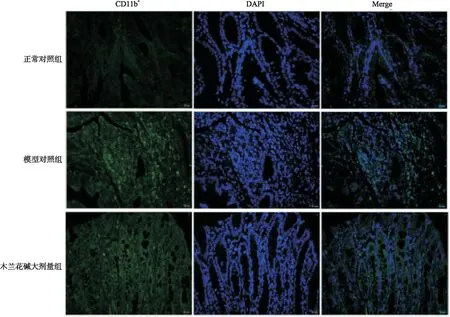
图3 3组大鼠结肠组织中CD11b+巨噬细胞免疫荧光分析(×200)
2.5木兰花碱抑制NF-κB激活 与正常对照组比较,模型对照组细胞核中p-NF-κB p65、p-IκBα、p-IKKβ蛋白表达显著增加(P<0.01),而细胞质中p-NF-κB p65蛋白表达降低(P<0.01),IκBα、IKKβ两个蛋白水平基本没有变化。木兰花碱各剂量组结肠组织中p-IκBα、p-IKKβ和细胞核p-NF-κB p65蛋白表达较模型对照组降低(P<0.05或P<0.01),细胞质p-NF-κB p65蛋白表达明显升高(P<0.05或P<0.01),IκBα、IKKβ蛋白水平亦无明显变化。木兰花碱各剂量组中,细胞质p-NF-κB p65蛋白在木兰花碱大剂量组中表达最高,细胞核p-NF-κB p65蛋白在木兰花碱中剂量组中表达最低,p-IκBα蛋白在木兰花碱大剂量组中表达最低,而p-IKKβ蛋白在木兰花碱 3个剂量组中表达基本一致,见图4。

A.正常对照组;B.模型对照组;C.木兰花碱小剂量组; D.木兰花碱中剂量组; E.木兰花碱大剂量组。①与正常对照组比较,P< 0.01;②与模型对照组比较,P<0.05;③与模型对照组比较,P<0.01( F=42.544~75.734)。
2.6木兰花碱抑制NLRP3炎性小体活性 由免疫组化结果可知,模型对照组NLRP3蛋白表达较正常对照组增加(图5)。Western blotting法分析结果亦表明,DSS能够提高大鼠结肠组织中NLRP3、cleaved caspase-1和ASC蛋白表达水平(P<0.01)。但是,木兰花碱中、大剂量组大鼠结肠组织中NLRP3和cleaved caspase-1蛋白表达水平降低(P<0.01),其中大剂量组中NLRP3蛋白含量最低,中剂量组与大剂量组中cleaved caspase-1蛋白含量基本一致;木兰花碱小、中、大剂量组大鼠ASC蛋白表达水平降低(P<0.01),其中大剂量组最低(图6)。

A.正常对照组;B.模型对照组;C.木兰花碱小剂量组; D.木兰花碱中剂量组; E.木兰花碱大剂量组。
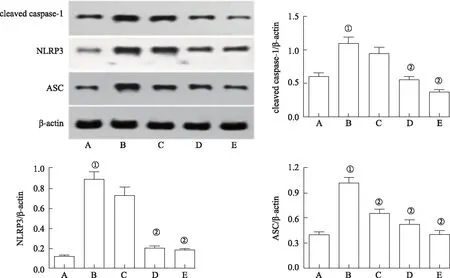
A.正常对照组;B.模型对照组;C.木兰花碱小剂量组; D.木兰花碱中剂量组; E.木兰花碱大剂量组。①与正常对照组比较,P< 0.01;②与模型对照组比较,P<0.01(F=34.132~74.964)。
3 讨论
目前,治疗UC的传统药物有氨基水杨酸类、糖皮质激素类和免疫抑制剂类等三大类,本研究选择5-氨基水杨酸为阳性对照药。结果显示,5-氨基水杨酸组和木兰花碱小、中、大剂量组UC模型大鼠的病理特征均明显改善,其中,木兰花碱小、中剂量组病理组织学评分显著大于5-氨基水杨酸组,而大剂量组与5-氨基水杨酸组差异无统计学意义。研究表明,IBD患者体内TNF-α、IL-1β和IL-18等促炎细胞因子水平较健康受试者升高[6]。TNF-α已被证明通过诱导血管通透和血管生成、增加巨噬细胞和T细胞产生促炎细胞因子、引起屏障破坏和促进肠上皮细胞死亡,发挥多种促炎功能[15]。抑制TNF是目前常用的治疗IBD的方法[16]。IL-1β和IL-18是结肠炎早期炎症级联反应是必不可少的[17]。IBD患者的血清和黏膜活检中IL-1β和IL-18表达水平升高[18]。本研究中,木兰花碱可显著抑制DSS诱导的UC大鼠结肠组织中IL-1β、IL-18和TNF-α含量。这可能与局部炎症反应的分子变化有关。先天免疫系统参与了DSS诱导的肠道炎症,这一观点已被广泛接受[19]。木兰花碱小剂量组IL-1β、TNF-α与小、中、大剂量组IL-18显著高于5-氨基水杨酸组,但是中、大剂量组IL-1β、TNF-α与5-氨基水杨酸组差异无统计学意义。提示5-氨基水杨酸和木兰花碱对UC均有疗效,但是5-氨基水杨酸优于木兰花碱,这可能与治疗周期、给药途径、给药剂量等因素有关,尚待进一步研究。IBD患者体内巨噬细胞的数量较健康受试者显著增加[20]。而且,巨噬细胞在UC模型中比例亦增加[21]。本研究显示,木兰花碱可降低DSS诱导的模型对照组大鼠结肠组织中巨噬细胞浸润。
在应对炎症因子、脂多糖或氧化剂等刺激时,IκBα被快速降解和磷酸化,激活NF-κB二聚体的释放和易位进入细胞核,从而上调靶基因的转录[22-23]。与正常对照组比较,UC大鼠结肠组织细胞核p-NF-κB p65、p-IκBα、p-IKKβ蛋白含量明显增加,细胞质中p-NF-κB p65蛋白表达下降,说明NF-κB被DSS激活。木兰花碱治疗后,细胞核p-NF-κB p65、p-IκBα、p-IKKβ蛋白含量下降,与DU等[24]研究羧胺三唑治疗UC的结果一致。以上结果表明,木兰花碱治疗UC可能与抑制NF-κB活性有关。
NLRP3炎性小体主要由巨噬细胞产生,与UC密切相关[25]。在急性UC的诱导过程中,NLRP3炎性小体被活化,巨噬细胞中产生更多的IL-1β[26]。BAUER等[27]证实小鼠NLRP3缺陷可抵抗DSS诱导的结肠炎。此外,FILARDY等[28]发现转录后NLRP3失去控制与结肠炎症有关。本研究显示,UC模型对照组大鼠的结肠组织中NLRP3、ASC、caspase-1蛋白表达较正常对照组升高,而木兰花碱可逆转上述蛋白含量的升高。说明木兰花碱可通过抑制NLRP3炎性小体活性发挥治疗UC作用。
综上所述,木兰花碱可减轻DSS诱导的UC的严重程度,降低炎症细胞因子含量,抑制NF-κB信号通路和NLRP3炎性小体活性。提示木兰花碱可能作为一种治疗UC的候选药物。

