不同猕猴桃品种果肉色素含量及关键酶活性变化规律
涂美艳,陈 栋,廖明安,李 靖,孙淑霞,宋海岩,徐子鸿,刘春阳,江国良
(1.四川省农业科学院园艺研究所/农业农村部西南地区园艺作物生物学与种质创制重点实验室,成都 610066;2.四川农业大学园艺学院,成都 611130;3.达州市农业农村局果茶站,四川 达州 635000)
【研究意义】猕猴桃果肉颜色丰富,在不同种间及种内均存在着广泛变异[1]。目前世界上主栽猕猴桃品种从果肉颜色上大致可以分为3类,即绿肉品种(如‘Hayward’‘徐香’等)、黄肉品种(如‘金艳’‘Hort16A’等)及红肉品种(如‘红阳’‘东红’等)。近年来,果肉颜色已成为猕猴桃选育种的重要性状和研究热点,但其呈色差异的机理依然不清楚。【前人研究进展】已有研究发现,猕猴桃绿色果肉的主要成色色素是叶绿素,黄色果肉是类胡萝卜素,红色果肉是花色素苷[2],而猕猴桃果肉颜色取决于色素类物质叶绿素、花青素和类胡萝卜素的含量、比例及空间分布,果肉中叶绿素a、叶绿素b和类胡萝卜素的绝对含量和相对比例决定了果肉是呈现绿色还是黄色或者还是介于这两种颜色之间[3]。中华猕猴桃果实成熟时果肉颜色很大程度上取决于果肉中残留叶绿素的含量,由于果实成熟时间和成熟贮藏过程中叶绿素降解程度差异,果实在达到食用成熟度时,果肉颜色由绿色到黄色存在较大差异[4]。前人先后对大籽猕猴桃、葛枣猕猴桃、四萼猕猴桃、对萼猕猴桃[5]、‘Hort16A’[6]、‘武植3号’和‘金丰’[7]等野生种或品种的果实发育不同阶段果肉色素代谢进行了研究,普遍认为随着果实的生长、成熟,果实叶绿素含量下降,其中叶绿素a的下降较快,而叶绿素b下降幅度较小[8]。不同品种猕猴桃果肉中类胡萝卜素含量的变化较为复杂,可能下降也可能不变[9],甚至在大籽猕猴桃果实发育过程中类胡萝卜素含量还会上升[5]。猕猴桃果肉中花色苷代谢更为复杂,常出现果肉中色素不稳定增减现象[10],甚至同一品种在不同地区出现明显呈色差异[11-12]。【本研究切入点】猕猴桃果肉颜色变化规律因品种和地域可能存在较大差异,而植物体内除了色素物质外,还有较多发色基团,它们的代谢变化也会使植物器官在不同的发育时期和生理条件下呈现不同的色泽[13]。【拟解决的关键问题】本研究以四川主栽的不同果肉颜色品种为试材,通过分析果实发育过程中色素含量及色素代谢相关酶活性变化规律,探讨红肉、黄肉和绿肉猕猴桃果肉呈色的生理机制,为今后开展果肉颜色调控提供理论参考。
1 材料与方法
1.1 试验材料
本试验以6个四川猕猴桃主栽品种为材料(表1)。其中,‘红阳’‘红实2号’‘金艳’‘金实1号’定植于四川省什邡市湔氐镇下院村四川省自然资源科学研究院试验基地(海拔637 m, 31°13′35″ N,104°01′12″ E),‘海沃德’和‘翠玉’定植于四川省彭州市小鱼洞镇草坝村龙门山猕猴桃基因库试验基地(海拔1017 m,31°09′38″ N,103°47′14″ E)。
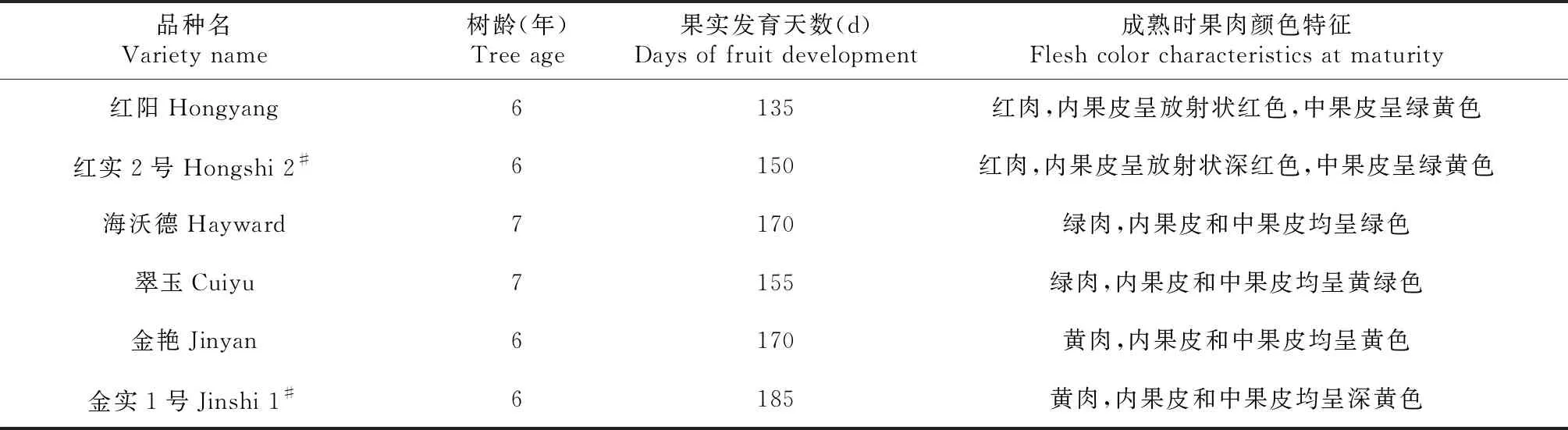
表1 试验材料基本情况
1.2 取样时期及测试方法
每个品种从花蕾期开始,每2~3 d从代表性植株各方位选取果形端正、大小一致、无病虫害花蕾或果实2个,带回实验室切横剖面观察果肉颜色变化规律,并拍照比对,直至各品种果实成熟。根据果肉颜色变化规律观察结果,选择6个品种果实发育的6个代表性时期进行采样,具体采样时期见表2。采样前,每个品种选择代表性植株3株挂牌标记,每次采样时从挂牌植株树冠各方位随机采集形状、大小均匀一致且无病虫害的果实(其中:S1时期50个/株,S2时期20个/株,S3、S4、S5、S6时期各5个/株)。采集样品后用冰盒保存迅速运回实验室,单株为1组,3株即为实验的 3 次重复。每组果去掉外果皮后,从中间横剖,再从横剖面上削薄片(去除干净所有种子)剪碎混匀并立即用液氮处理,贮存于-80 ℃超低温条件下备用。叶绿素及类胡萝卜素含量的测定参照王学奎[14]的方法;花青素含量测定参照熊庆娥[15]的方法。
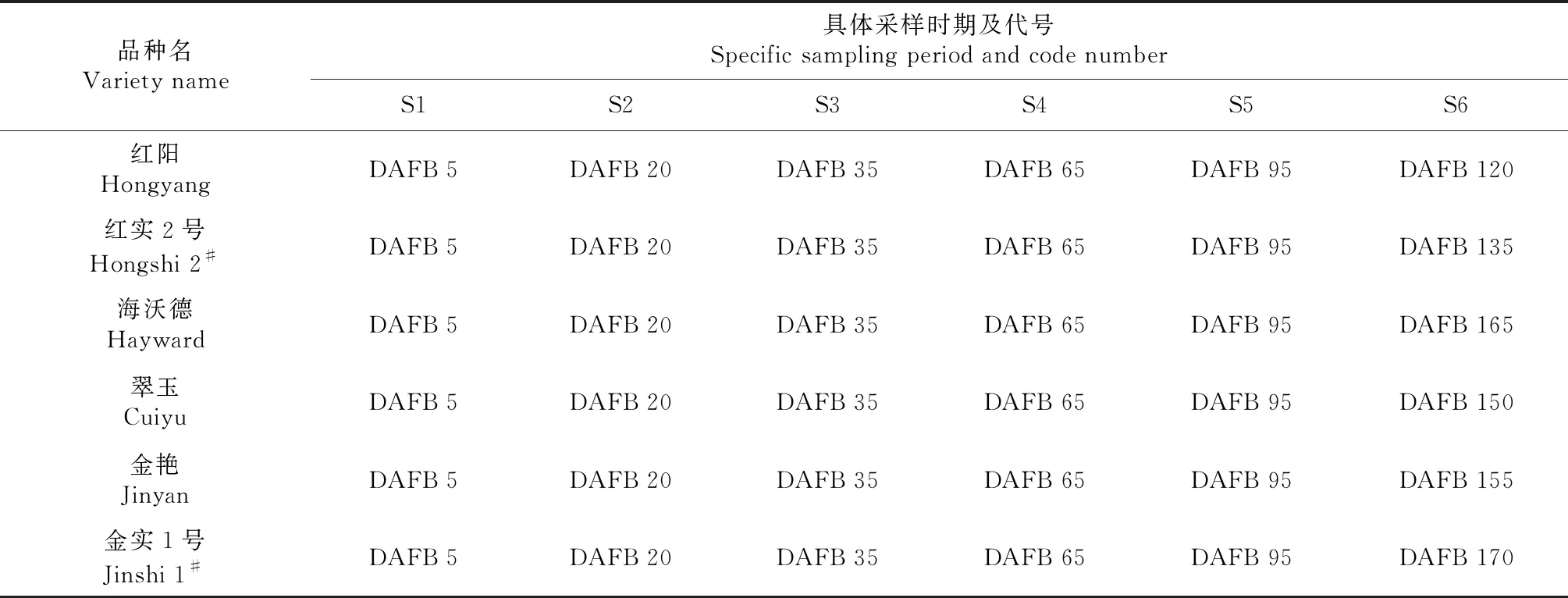
表2 第一部分试验采样时期
为研究不同果肉部位色素含量与色素代谢关键酶活性关系,选择‘红实2号’和‘金实1号’2个代表性品种4个关键时期的2个果肉部位进行采样,具体采样时期见表3。样品采集前,选取6株长势一致、无病虫害、果型大小一致的‘红实2号’和‘金实1号’植株进行挂牌。取样时,T1时期每株随机取代表性果实50个,T2、T3时期20个,T4时期2个,摘取果实后,迅速在冰块上按内果皮和中果皮切取样品,其中,T2、T3、T4时期在获取内果皮样品时,需快速剔除种子。所获样品分部位按单株混匀后,经液氮冻存并转移至-80 ℃保存备用。叶绿素酶和脱镁螯合酶提取液参照 Minguez-Mosquera等[16]方法;叶绿素酶活性测定参照 Fang等[17]的方法;略有修改;脱镁螯合酶活性测定参照李继兰等[18]的方法,略有修改;苯丙氨酸解氨酶液提取及测试参照欧阳光察和曹锦萍等[19-20]的方法;二氢黄酮醇还原酶液提取参照Murray[21]的方法,测试参照Stafford等[22-23]的方法。

表3 第二部分试验采样时期
1.3 数据分析
实验数据采用 Microsoft Excel 2003 软件进行初步分析并制作相应的趋势图;用SPSS 17.0 软件进行相关性和方差分析。
2 结果与分析
2.1 猕猴桃果实发育期果肉颜色变化规律
6个品种果肉颜色变化规律(图1)如下。
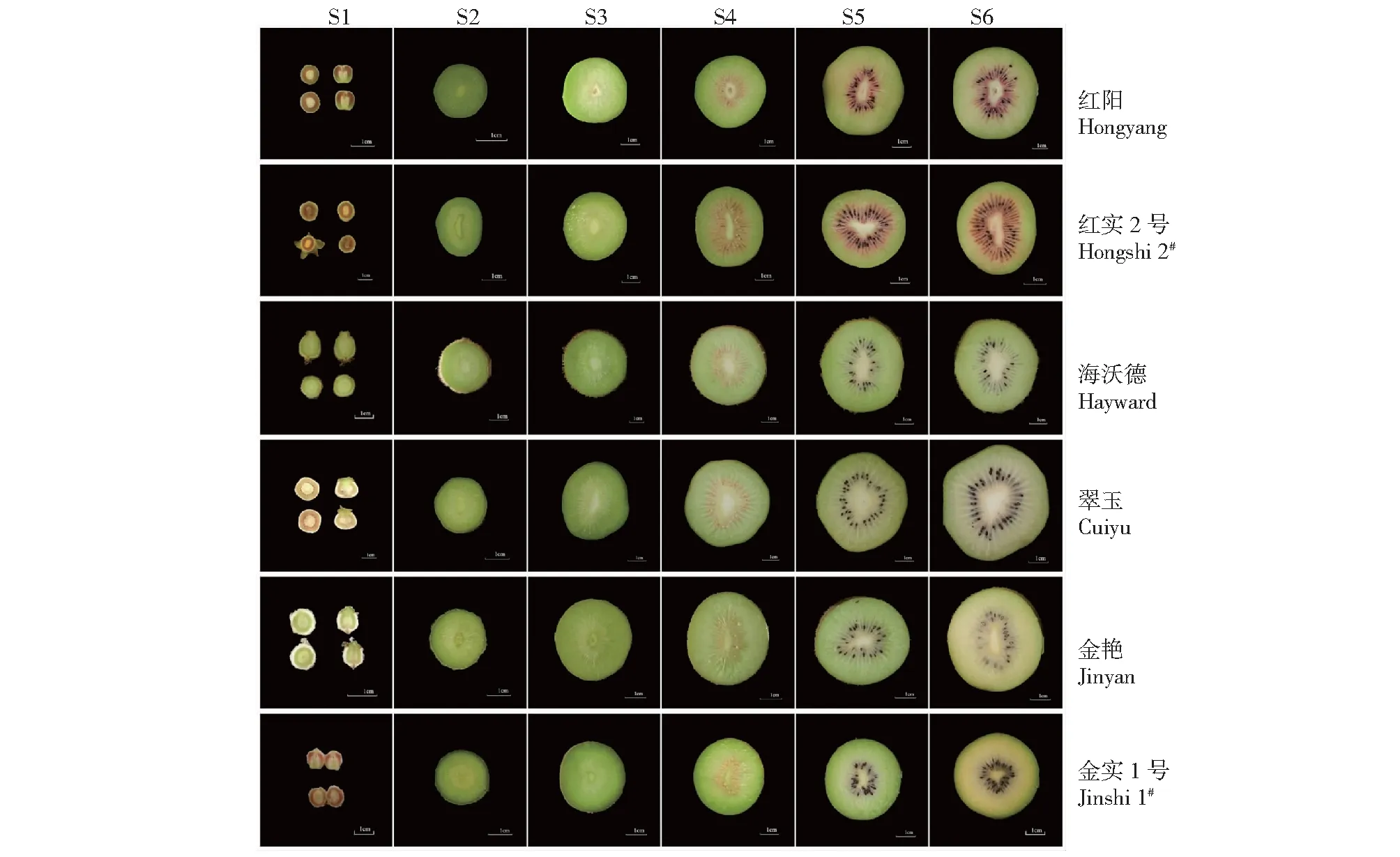
图1 6个猕猴桃品种果实发育期果肉颜色变化
‘红阳’:花蕾期至盛花后15 d中果皮由红色变为淡红色、内果皮保持淡绿白色;盛花后15~55 d,中果皮和内果皮均保持绿色;盛花后55 d至成熟期,中果皮由绿色变为淡黄色、内果皮由淡红色变为红色。
‘红实2号’:花蕾期至盛花后10 d中果皮由红色变为淡红色、内果皮保持淡绿白色;盛花后10~60 d,中果皮和内果皮均保持绿色;盛花后60 d至成熟期,中果皮由绿色变为淡黄色、内果皮由淡红色变为深红色。
‘海沃德’:花蕾期至盛花后7 d中果皮和内果皮均为淡绿白色,盛花后7 d至成熟期,中果皮和内果皮保持绿色。
‘翠玉’:花蕾期至盛花后5 d中果皮由红色变为淡红色、内果皮保持淡绿白色;盛花后5 d至成熟期,中果皮和内果皮由绿色变为淡绿色(或黄绿色)。
‘金艳’:花蕾期至盛花后7 d中果皮和内果皮均为淡绿白色,盛花后7~95 d,中果皮和内果皮由淡绿色变为淡黄色,盛花后95 d至成熟期,中果皮和内果皮由淡黄色变为黄色。
‘金实1号’:花蕾期至盛花后3 d中果皮由红色变为淡红色、内果皮保持淡绿白色;盛花后3~75 d,中果皮和内果皮均保持绿色;盛花后75 d至成熟期,中果皮和内果皮由淡黄色变为深黄色。
‘红阳’和‘红实2号’2个红肉品种果肉颜色变化基本一致,‘海沃德’和‘金艳’2个品种果肉颜色变化与传统认识也是一致的。但绿肉品种‘翠玉’和黄肉品种‘金实1号’首次发现在花蕾期至盛花后3~5 d也存在中果皮着红色的现象,这与红肉品种早期子房或幼果着色情况一样,但该现象花后持续时间较红肉品种短,且褪色后不再果肉任何部位启动着红色。
2.2 猕猴桃果实发育期果肉色素含量变化规律
从图2可以看出,不同品种在不同发育期果肉中叶绿素a、叶绿素b及叶绿素总量均存在一定差异,且该差异在盛花后35 d前表现非常明显。具体来看:叶绿素a含量上(图2-A),盛花后5 d‘红实2号’含量最高(42.49 mg/g),‘金实1号’和‘红阳’次之,分别为42.04、36.43 mg/g,绿肉品种‘海沃德’含量最低(12.38 mg/g),盛花后20 d以‘红阳’含量最高(39.38 mg/g),其次为‘红实2号’,2个绿肉品种和2个黄肉品种含量较低,仅为7.30~14.69 mg/g,盛花后65 d至采收前期,各品种果肉中叶绿素a含量均维持在较低水平,但在果实采收前期(S6),以绿肉品种‘海沃德’含量最高(5.39 mg/g),是其他品种的2.06~2.88倍。叶绿素b和叶绿素总量上的变化规律与叶绿素a基本一致(图2-B,2-C)。但叶绿素a/b值上(图2-D),各品种均存在一定波动性,以绿肉品种‘海沃德’波动最大,呈现先升后降再升又降的趋势,到果实采收前期(S6),以‘红阳’的叶绿素a/b值最大(2.19),其后依次为‘金实1号’‘红实2号’‘海沃德’‘翠玉’,以‘金艳’最低(0.89)。
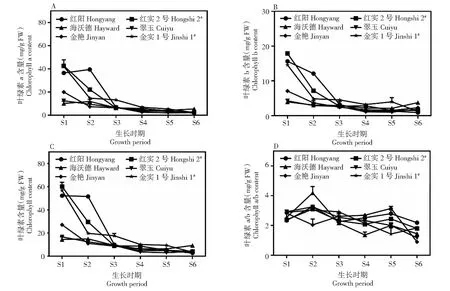
图2 不同猕猴桃品种果实发育期叶绿素含量变化
从图3可以看出,在果实发育早期(S1~S2),‘红阳’‘金实1号’‘红实2号’3个品种果实中类胡萝卜素含量显著高于其他3个品种,以盛花后5 d‘金实1号’含量最高,达10.21 mg/g,分别是‘翠玉’‘海沃德’的2.50和1.85倍,但在S1~S3阶段(盛花后5~35 d),‘红阳’和‘红实2号’果实中类胡萝卜素含量急速下降,‘金实1号’虽然也存在明显下降,但S3期较S2期又有所上升。S4~S6期(盛花后65 d至采收前期),虽然6个品种类胡萝卜素含量均维持在较低水平,但品种间依然存在一定差异,均以‘翠玉’的含量最低,‘海沃德’次之,这2个绿肉品种在这段时期内类胡萝卜素含量均低于1 mg/g,从果实采收前期(S6)结果看,以‘红实2号’类胡萝卜素含量最高(1.72 mg/g),‘红阳’和‘金实1号’次之,‘翠玉’最低,仅为0.66 mg/g。由此看来,黄肉品种在类胡萝卜素含量上的优势并不明显。但通过对叶绿素与类胡萝卜素含量比值分析发现(图4),盛花后5 d时,‘海沃德’和‘翠玉’等绿肉品种叶绿素/类胡萝卜素比值较其他品种稍低,但到果实采收前期(S6),这2个品种叶绿素/类胡萝卜素比值较其他品种都高,其中‘海沃德’为11.17,分别是‘红阳’‘红实2号’‘金艳’‘金实1号’的6.06、4.74、4.31和2.53倍。
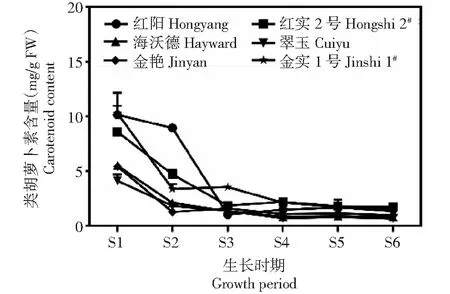
图3 不同猕猴桃品种果实发育期类胡萝卜素含量变化
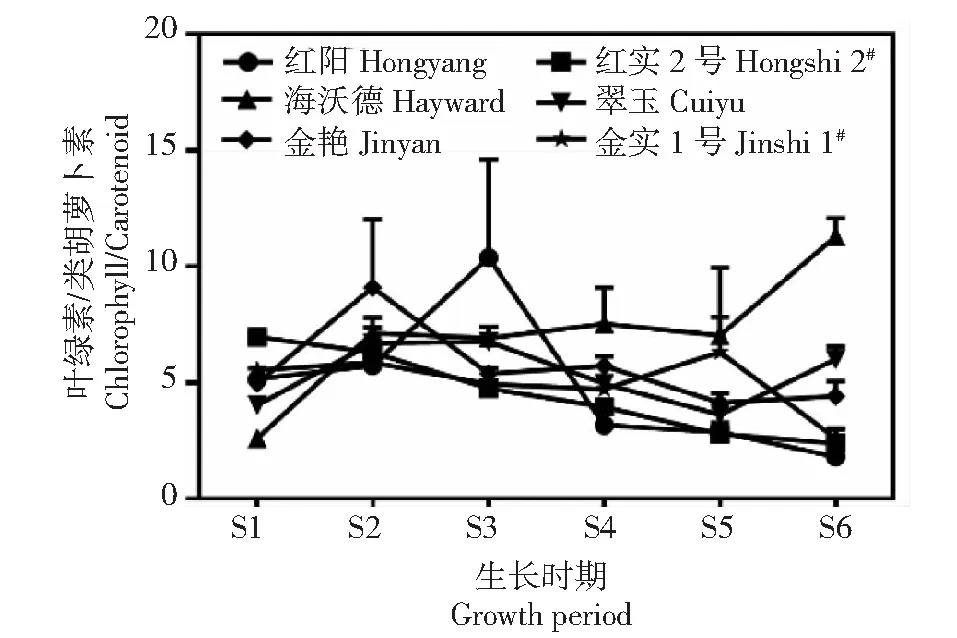
图4 不同猕猴桃品种果实发育期叶绿素与类胡萝卜素含量比值变化
从图5可以看出,在整个果实生长发育期,‘海沃德’虽然有少量花青素检出,但含量极低,仅为0.07~0.23 nmol/g;‘红阳’和‘红实2号’花青素含量变化规律基本一致,呈现先降后升趋势,但在盛花后5~20 d时,‘红阳’的花青素含量较‘红实2号’高,从盛花后65 d开始,‘红实2号’的花青素含量明显高于‘红阳’,到采收前期时,‘红实2号’的花青素含量较‘红阳’高出54.77 nmol/g;‘翠玉’‘金实1号’‘金艳’虽然为绿肉或黄肉品种,但在盛花后5 d时,果实中花青素含量分别为12.87、18.77、9.18 nmol/g,结合2.1.1果肉色泽变化规律观察结果,这与果实发育早期‘翠玉’和‘金实1号’中果皮呈红色的表型是吻合的,但‘金艳’在各时期果肉从未呈现任何红色,其整个发育期均有花青素检出,这可能与该品种所含花青素种类、与其他色素的比例、细胞液的内含物等有关。
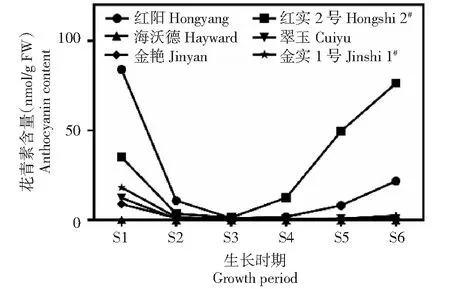
图5 不同猕猴桃品种果实发育期花青素含量变化
2.3 猕猴桃果实发育期色素代谢关键酶活性变化规律
叶绿素酶(Chlase)是叶绿素降解途径中的第一个关键酶,作用是脱去植醇基生成脱植基叶绿素a[24]。从图6-A可以看出,T1时期,‘红实2号’内果皮和中果皮的叶绿素酶活性均显著高于‘金实1号’,且以‘红实2号’内果皮的酶活性最高,达1.52 U/g;T2时期,2个品种和2个果肉部位间叶绿素酶活性的差距均明显缩小,但此时期以‘红实2号’中果皮的酶活性最高,为0.42 U/g,‘金实1号’中果皮酶活性最低,为0.07 U/g;T3和T4时期,‘红实2号’内果皮酶活性未明显变化,中果皮的酶活性较前2个时期有所下降,最后维持在0.13 U/g,但‘金实1号’中果皮和内果皮叶绿素酶活性有所上升,最后分别为0.35和0.38 U/g。
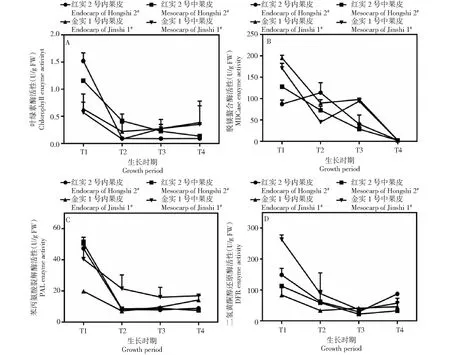
图6 猕猴桃果实发育期不同果肉部位色素合成关键酶活性变化
脱镁螯合酶(MDCase)的作用是使脱植基叶绿素a脱去Mg2+形成脱镁叶绿酸a,是叶绿素降解途径中第二个关键酶[25]。从图6-B可以看出,脱镁螯合酶在2个猕猴桃品种果实发育前期(T1、T2和T3时期)活性均较高,但不同品种不同果实部位含量在此3个时期依然存在较大差异,T4时期2个品种不同果实部位的脱镁螯合酶活性差异不明显,且均在个时期中含量最低。具体来看,T1时期,‘红实2号’中果皮的酶活性显著高于内果皮(高出40.62 U/g),但‘金实1号’内果皮的酶活性比中果皮高24.15 U/g;T2时期,‘红实2号’和‘金实1号’的内果皮酶活性均显著高于外果皮;T3时期,‘金实1号’中果皮和内果皮酶活性差异不明显,但‘红实2号’内果皮比中果皮酶活性高11.48 U/g。
苯丙氨酸裂解酶(PAL)是花青素生物合成途径中第一阶段的关键调控酶[26]。从图6-C可以看出,T1时期2个品种中果皮和内果皮的酶活性均显著高于其他3个时期,但‘红实1号’相同时期不同果实部位间的酶活性差异不明显,‘金实1号’则不同,其4个时期中果皮的酶活性均高于内果皮,且在T1、T2和T3时期,中果皮和内果皮酶活性差异显著。
二氢黄酮醇还原酶(DFR)则是花青素生物合成途径中第三阶段的关键调控酶,直接影响着花青素骨架的合成[26]。从图6-D可以看出,2品种不同时期不同果实部位DFR活性差异较大。具体来看,‘红实2号’4个时期内果皮的酶活性均高于中果皮,以T4时期差异最明显,内果皮高出中果皮54.90 U/g,T1时期次之(高出36.15 U/g),T2时期差距最小(仅相差3.17 U/g);‘金实1号’则不同,其T1、T2、T4时期中果皮的酶活性显著高于内果皮,以T1时期最显著(高出179.17 U/g),T2时期次之(高出54.86 U/g),T3时期虽然是内果皮的酶比中果皮高4.78 U/g,但两者间差异不显著。
2.4 猕猴桃果实色素含量与关键酶活性相关性
从表4可以看出,4个酶中,脱镁螯合酶活性与不同果肉部位色素含量相关性最小,该酶仅与‘金实1号’内果皮叶绿素a含量和‘红实2号’中果皮叶绿素b含量呈显著正相关。叶绿素酶活性与‘红实2号’果实色素含量的相关性比‘金实1号’更明显,其与‘红实2号’内果皮类胡萝卜素含量、中果皮叶绿素a和b含量均呈极显著正相关。苯丙氨酸裂解酶活性与两品种中果皮的色素含量相关性比内果皮更明显,这在‘红实2号’上表现更为突出,苯丙氨酸裂解酶与‘红实2号’中果皮花青素、类胡萝卜素、叶绿素a、叶绿素b含量和内果皮类胡萝卜素含量均呈极显著正相关,与‘金实1号’中果皮花青素和叶绿素含量呈极显著正相关。二氢黄酮醇还原酶活性与‘金实1号’果实色素含量的相关性比‘红实2号’更明显,其与‘金实1号’内果皮和中果皮花青素、类胡萝卜素、叶绿素a含量呈显著或极显著正相关,与‘金实1号’内果皮叶绿素b含量呈极显著负相关,与‘红实2号’内果皮花青素、类胡萝卜素含量以及中果皮花青素、类胡萝卜素、叶绿素a、叶绿素b含量均呈显著正相关。
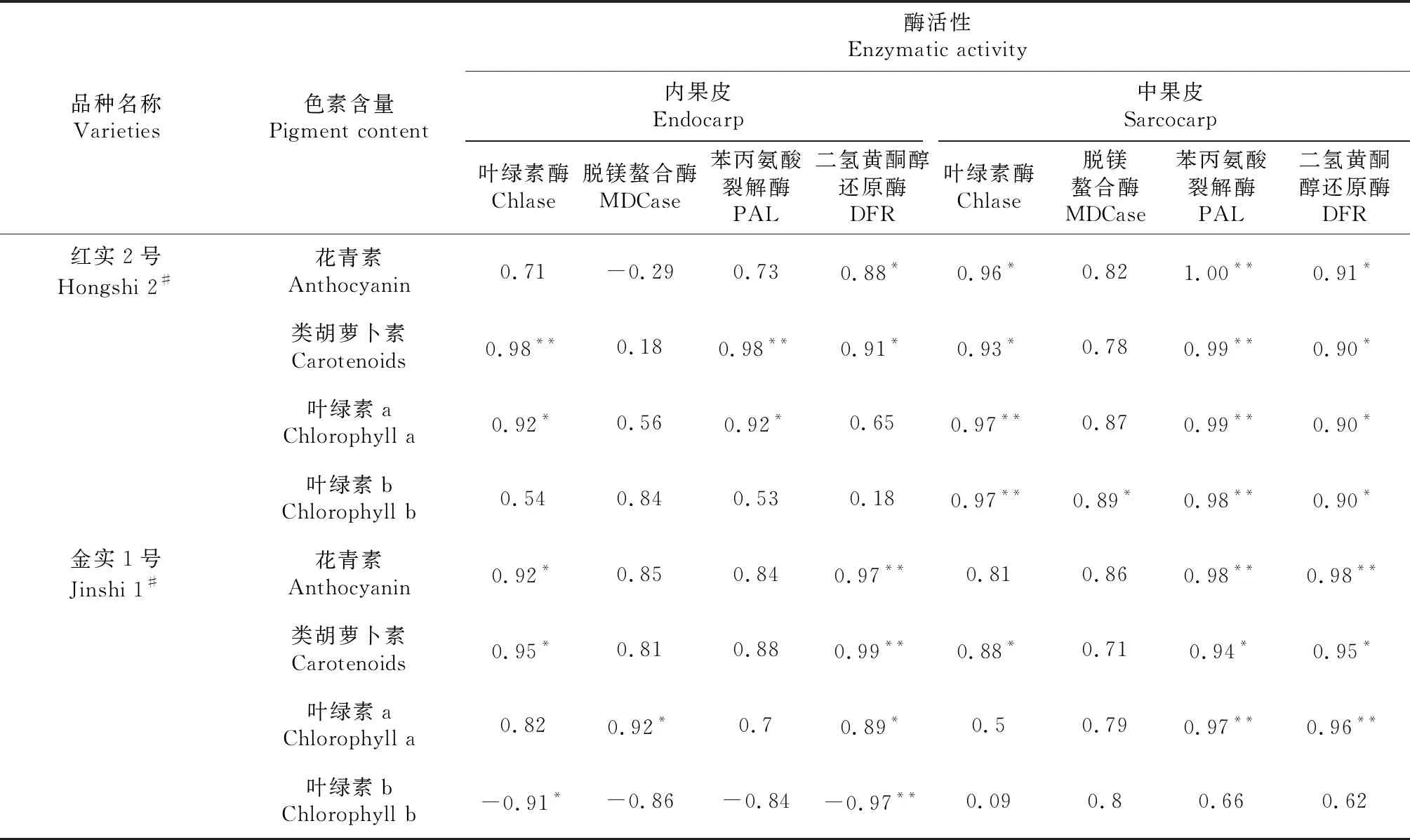
表4 ‘红实2号’和‘金实1号’不同果肉部位色素代谢关键酶与色素含量相关性分析
3 讨 论
3.1 不同猕猴桃品种果肉颜色变化差异及其与色素含量的关系
我国猕猴桃种质资源丰富,果肉颜色变异大,但猕猴桃果肉色素以叶绿素、类胡萝卜素和花青素为主,3种色素含量及比例差异是果肉最终呈色的重要影响因素。贾展慧[27]研究认为,叶绿素降解、果肉褪绿、叶绿素与类胡萝卜素含量之比迅速上升,以及类胡萝卜素显色是导致红阳猕猴桃果肉色泽由绿色转为黄色的呈色机理。李继兰[28]研究也发现绿肉和黄肉猕猴桃采后果实变黄是因为叶绿素降解的速度快于类胡萝卜素,导致类胡萝卜素显露出黄色。陶俊[29]在柑橘上的研究发现,不同品种的柑橘果实呈现红、橙、黄颜色差异的原因不是由于其果皮积累的色素种类不同,而是由于其果皮积累红、橙色类胡萝卜素的能力及其组成比例不同引起。章秋平[30]研究发现,在果肉纯色的白肉桃和黄肉桃中都存在着少量的花色苷,这表明果肉的颜色还受到果肉中其它物质含量的影响。翁文昕等[31]研究发现,在‘华秀’李果肉着色过程中,果实中的叶绿素降解,花青苷大量合成,类胡萝卜素在果肉由橙色期向红色期转变的过程中明显增加,黄色期果肉的叶绿素含量所占比例最高,花青苷含量所占比例较低;橙色期果实的叶绿素和花青苷含量所占比例均较高;红色期果实的花青苷含量所占比例远高于叶绿素和类胡萝卜素含量所占比例。
本研究结果显示,红肉、黄肉和绿肉3种果肉颜色猕猴桃品种在果实发育期颜色变化差异大,即使同是绿肉或黄肉品种,其果肉颜色的变化规律也截然不同。其中,‘红阳’和‘红实2号’2个红肉品种果肉颜色变化规律与Montefiori等[2]研究的红肉品种‘Hort22D’基本一致,均在花蕾期至花后短暂的一段时间内果实中花青素含量高,且中果皮显红色,之后随着花青素含量急剧下降,叶绿素/类胡萝卜素比值上升,整个果肉呈绿色,盛花后65~95 d,随着果实中花青素含量再次快速上升,内果皮(而非前期的中果皮)再次呈现出红色。在整个发育过程中,虽然幼果期‘红阳’的花青素含量高,但后期‘红实2号’花青素含量明显高出‘红阳’,这是造成果实成熟期‘红实2号’呈深红色的重要因素。绿肉品种‘海沃德’在整个果实发育期叶绿素含量变化不大,但在果实成熟前期类胡萝卜素下降明显,致使叶绿素/类胡萝卜素比值上升是其显翠绿色的主要因素。‘翠玉’虽然同为绿肉品种,但其与‘海沃德’明显不同的是,在花蕾期至幼果期,果实中检测出含有较高量花青素存在,且中果皮也与红肉品种一样显红色,只是后期褪色后,花青素含量明显下降,且像‘海沃德’一样,叶绿素/类胡萝卜素比值在上升,只是上升速度没有‘海沃德’明显,所以其成熟期果肉显淡绿色或黄绿色。黄肉品种‘金实1号’与‘翠玉’类似,也在花蕾期至幼果期因存在较高花青素含量而在中果皮显红色,但盛花75 d后,果实中叶绿素降解比类胡萝卜素快,造成叶绿素/类胡萝卜素比值下降明显,最后呈深黄色。‘金艳’同为黄肉品种,但与‘金实1号’不同的是,其在盛花后5 d果实中也检测到较高花青素含量(是同时期‘金实1号’含量的50%左右),但并未呈现任何红色,可能与该时期‘金艳’叶绿素和类胡萝卜素含量也高,3种色素综合影响下,呈现出淡绿白色,也可能与花青素种类、浓度、共色作用、液胞中pH的影响有关。
3.2 猕猴桃果实色素含量与代谢过程中关键酶活性的相关性
植物果实色素代谢过程涉及的酶种类多,而猕猴桃果实呈色主要与叶绿素降解和花青素积累有关。因此,本研究主要探讨了叶绿素降解途径2种关键酶(叶绿素酶和脱镁螯合酶)与花青素合成途径2种关键酶(苯丙氨酸解氨酶和二氢黄酮醇还原酶)对猕猴桃果肉呈色的影响。结果显示,在果实发育早期(盛花后5 d时),4种酶在黄肉品种‘金实1号’和红肉品种‘红实2号’中均有很高活性,随着果实生长,4种酶活性整体呈下降趋势。但到果实转色关键期(T3),‘金实1号’果实中的叶绿素酶和脱镁螯合酶活性均快速增加,而‘红实2号’果实中2个酶活性依然下降或保持不变,这可能是‘金实1号’在该时期出现绿色变淡黄色的重要原因。不过相关性研究结果表明,叶绿素酶与两品种果实中类胡萝卜素含量呈显著或极显著正相关,与‘金实1号’内果皮叶绿素b含量呈显著负相关,与‘红实2号’内果皮和中果皮叶绿素a含量呈显著或极显著正相关。而脱镁螯合酶仅与‘红实2号’中果皮的叶绿素b含量和‘金实1号’内果皮叶绿素a含量呈显著正相关。该相关性分析结果说明,叶绿素酶和脱镁螯合酶并不是2个品种所有发育时期显色差异的关键因素,但肯定在转色关键期(T3时期)起着重要作用。
Arakawa[32]研究表明,苯丙氨酸解氨酶(PAL)是花色苷合成的关键酶;Lister等[33]指出:只有在果皮变红时PAL活性才与花色苷的合成密切相关;王惠聪等[34]在荔枝上的试验结果认为,PAL活性与荔枝果皮中的花色苷合成无关。本研究结果显示,PAL与‘红实2号’和‘金实1号’中果皮的花青素含量、叶绿素a含量均呈极显著正相关,并与‘红实2号’内果皮类胡萝卜素含量、‘金实1号’中果皮叶绿素a含量呈极显著正相关。说明PAL虽然为花青素合成途径上的关键酶,但其与其他色素含量还有着密切关系,其作用机理还有待进一步研究。
据Murray等[35]报道,常春藤在幼年期叶片中二氢黄酮醇还原酶(DFR)的活性较高,茎和叶柄中有花色苷的积累,而在成熟阶段,虽然植物体内积累较多的栎精,但DFR却没有活性,也没有花色苷的积累,并从这一角度指出,DFR活性的缺乏会限制花色苷的积累。王惠聪等[34]在荔枝中的研究认为DFR与荔枝果皮中花色苷的合成无密切关系。王庆菊等[35]研究认为,PAL、CHI、DFR、UFGT 4个花色苷合成关键酶在紫叶稠李叶片花色苷合成过程中发挥着不同影响。花色苷的合成过程由DFR启动,CHI对花色苷合成起促进作用,可能导致PAL活性的提高,UFGT起到糖基转移的作用,提高了花色苷稳定性,是花色苷合成过程的延续,促进了花色苷的大量积累。因此,紫叶稠李叶片中花色苷的合成是4种酶共同作用的结果,不同时期由不同的酶起关键作用。本研究结果显示,DFR活性与‘红实2号’和‘金实1号’两个品种不同果肉部位的花青素和类胡萝卜素含量均呈显著正相关,且与‘金实1号’中果皮和内果皮花青素含量呈极显著正相关。由此可知,‘金实1号’在果实发育后期花青素含量极低可能与DFR活性下降明显有关。
4 结 论
猕猴桃在果实生长发育期间,果肉色素含量变化及3种色素之间比例是决定其呈色的关键。而猕猴桃果肉最终呈色差异与果实早期发育阶段着色情况关系不大,主要取决于发育中后期不同果肉部位色素的含量及比例。果实发育后期叶绿素降解和花青素积累是红肉品种着红色的主要因素,而果实发育后期较高的叶绿素/类胡萝卜素比值(≥6.0)是绿肉品种呈绿色的主因,红肉和黄肉品种均含有较高类胡萝卜素,但黄肉品种在果实采收前期更低的叶绿素/类胡萝卜素比值(2.6~4.4)可能是果肉呈黄色或深黄色的主因。另外,猕猴桃果肉呈色差异并不是单一色素含量的多少造成,而与色素间比值和多个酶活性密切相关。其中,脱镁螯合酶在红肉和黄肉品种色素代谢中作用不明显,叶绿素酶、苯丙氨酸裂解酶和二氢黄酮醇还原酶是不同果肉颜色猕猴桃品种色素代谢途径中调控的关键酶。

