尿酸酶缺失大鼠的血细胞和血液流变学变化*
万绪莲,李律宇,李 丹,罗光云,李 宁,云 宇,段为钢△
(1.云南中医药大学,云南 昆明,650500;2.云南中医药大学第三附属医院,云南 昆明 650500;3.昆明医科大学,云南 昆明 650500)
高尿酸血症已经成了危害人类健康的“第四高”[1],与痛风、高血压、糖尿病等疾病高度关联[2-3]。为了研究高尿酸血症的发病机制以及相关疾病的防治新策略,我们前期以SD大鼠为试验大鼠,采用CRISPR/Cas9技术成功研制了尿酸酶缺失大鼠(Kunming-DY大鼠)[4]。该大鼠血尿酸明显升高,与成年男性血尿酸相似或略高,可以稳定繁殖,成年后的1年生存率可达90%[4-5],尽管具有轻度的多器官损伤[6]。由于该大鼠无尿酸酶活性,其尿酸代谢与人进一步相似,可以避免造模剂带来的干扰,有望为高尿酸血症和相关疾病的防治研究提供更好的模型动物[5],同时该模型动物在研究高尿酸血症方面表现出一定的优势[7-9]。为此,本研究以45 d日龄SD大鼠为对照,特观察同龄尿酸酶缺失大鼠血细胞和血液流变学变化。
1 实验材料与方法
1.1 实验材料与仪器 雄性尿酸酶缺失大鼠(Kunming-DY大鼠)由实验室自制,按照SFP标准繁育。雄性SD大鼠(生产许可证号:SCXK(滇)K2015-0002)由昆明医科大学按照SPF标准繁育。尿酸检测试剂盒(磷钨酸法)(南京建成生物工程研究所)、氨丁三醇(Tris碱,>99.9%)(德国 BioFroxx公司)、全自动动物血细胞分析仪(型号:PE-3070VET)(深圳市普康电子有限公司)、全自动动物血液流变仪(型号:HL5000)(康宇医疗器械有限公司)、酶标仪(型33号:K6600-A)(北京凯奥科技发展有限公司)。
1.2 实验方法
1.2.1 动物分组 随机选取10只40 d日龄的SD大鼠(WT)和7只尿酸酶缺失大鼠(Uox-/-),适应性饲养到第45 d日龄称重置于代谢笼记录24 h出入量。实验后置于固定器从尾部采抗凝血(EDTA-K2抗凝)0.2 mL用于血细胞分析。动物用乌拉坦(1.0 g/kg)麻醉后从腹主动脉采抗凝血(肝素抗凝)3 mL用于血液流变学检测,同时采不抗凝血0.5 mL用于血尿酸检测。
1.2.2 血细胞检测 按照说明书操作开启全自动动物血细胞分析仪,选择大鼠模块,将采到的EDTA-K2抗凝血混匀后直接进样检测,收集检测数据。2 h内完成血样收集和血细胞检测。
1.2.3 血液流变学检测 按照说明书操作开启全自动动物血液流变仪,选择大鼠模块,将采到的肝素抗凝血混匀后置于预定的进样盘,自动检测,收集检测数据。2 h内完成血样收集和血液流变检测。
1.2.4 尿酸检测 血液样品凝固后于3 000 r/min,离心5 min制备血清,制备的血清直接用于尿酸检测。尿酸的含量测定方法则按照厂家提供的说明书进行。

2 结果
2.1 尿酸酶缺失大鼠的血尿酸水平、体质量和出入量变化 45 d日龄尿酸酶缺失大鼠的血尿酸明显高于野生型SD大鼠(图1A),但体质量略低于同龄野生型大鼠(图1B),且差异均有统计学意义(P<0.05),这与我们的前期研究结果一致。
不考虑体质量因素时,45 d日龄的尿酸酶缺失大鼠的24 h进食量无明显变化(图1C),但24 h饮水量(图1D)和24 h排尿量(图1E)明显增加,同时24 h排便量却有所减少(图1F)。考虑到体质量因素时,校正后的指标尿酸酶缺失大鼠24 h进食量则明显增加(图1G),且24 h饮水量(图1H)和24 h排尿量(图1I)进一步增加,同时24 h排便量却无明显差异(图1J)。见图 1。

图1 尿酸酶缺失大鼠的血尿酸水平、体质量和出入量变化
2.2 尿酸酶缺失大鼠的血细胞指标变化 45 d日龄尿酸酶缺失大鼠的白细胞、淋巴细胞、中性粒细胞和中间细胞(主要包含单核细胞、嗜酸性粒细胞和嗜碱性粒细胞)数目明显低于野生型SD大鼠(图2A);但尿酸酶缺失大鼠的淋巴细胞比例高于野生型SD大鼠,中性粒细胞略低,而中间细胞比例无明显变化(图2B)。
与野生型SD大鼠相比,45 d日龄尿酸酶缺失大鼠的红细胞数目无明显改变(图2C),红细胞压积和红细胞分布宽度CV(变异系数)无明显改变(图2D);但血红蛋白浓度、平均红细胞体积、平均红细胞血红蛋白含量、平均红细胞血红蛋白浓度以及红细胞分布宽度SD(标准差)明显减小(图2D)。
与野生型SD大鼠相比,尿酸酶缺失大鼠血小板数目、大血小板数目(图2E),血小板分布宽度和血小板压积(图2F)无明显改变;但血小板体积和大血小板比率明显减小(图2F)。见图2。

图2 尿酸酶缺失大鼠的血细胞指标变化
2.3 尿酸酶缺失大鼠的血液流变学指标变化 与野生型SD大鼠相比,45 d日龄尿酸酶缺失大鼠全血高切、中切和低切黏度以及血浆黏度均减小(图3A),但相应的相对黏度增加(图3B),相应的还原黏度则进一步显著增加(图3C)。
与野生型SD大鼠相比,45 d日龄尿酸酶缺失大鼠的血液屈服应力减小(图3D),相应的低切、中切和高切流阻减少(图3E)。与血细胞检测结果类似,尿酸酶缺失大鼠的血沉减慢(图3F),其方程K值也减小(图3G);红细胞压积(图3H)、红细胞刚性指数(图3I)和红细胞内黏度(图3J)减小,而红细胞聚集指数、红细胞变形指数和红细胞电泳指数(图3I)则增加。见图3。
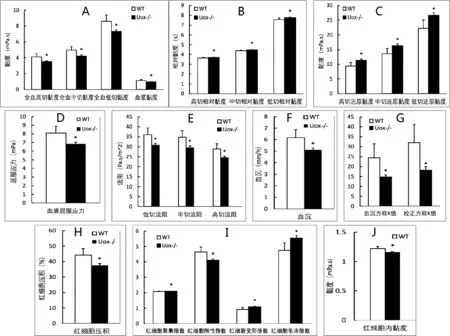
图3 尿酸酶缺失大鼠的血液流变学指标变化
3 讨论
野生型SD大鼠正常表达尿酸酶,表达丰度最高部位是肝脏。与传统的基因敲除不同,Kunming-DY大鼠是基于封闭群大鼠,即SD大鼠,采用CRISPR/Cas9技术敲除尿酸酶基因2~4号外显子区域[4]。先获得杂合子,通过不断交配获得纯合子,纯合子再相互交配选种获得性状较为稳定的尿酸酶缺失大鼠。
尿酸酶缺失后,该大鼠的血尿酸明显升高,但比文献报道的基于近交系C57/6J小鼠研制的尿酸酶缺失小鼠要明显的低[10],成年后的1年生存率达90%以上,虽然表现出生长略有减慢,多饮多尿现象,但表型基本健康,也能正常繁育[4-6,11]。这些现象也在本研究中得到重现,说明该大鼠生长略有减慢,多饮多尿现象能够稳定重现。
本研究发现,与同龄野生SD大鼠不同,尿酸酶缺失大鼠的白细胞数量偏少,且淋巴细胞比例增高,说明该大鼠可能存在慢性感染。尿酸酶缺失大鼠的红细胞数量无明显变化,但血红蛋白、红细胞体积、红细胞血红蛋白含量及浓度以及红细胞分布宽度SD明显减少,说明该大鼠具有营养性贫血倾向,可能存在一定的铁利用障碍,具有小细胞低色素特征的“贫血”倾向。尿酸酶缺失对血小板数量影响较小,但血小板体积和大血小板比率均减少,说明该大鼠的血小板功能更倾向于成熟,有利于止血。
从血液流变学指标看,尿酸酶缺失后,大鼠的全血黏度、血液屈服应力、血液流阻、血沉均出现明显下降。由于血液黏度主要受红细胞影响,变小的红细胞有利于全血黏度下降。由于红细胞内的血红蛋白浓度也是下降的,因此红细胞内的黏度也由此减小。与相关黏度指标下降不同,尿酸酶缺失大鼠的还原黏度是增加的。全血还原黏度是指单位红细胞压积时的全血黏度值,考察的是单位红细胞压积对全血相对黏度的贡献。这提示在尿酸酶缺失大鼠中,单位红细胞压积对血液的黏度贡献是增加的。由于红细胞内的血红蛋白含量有所减小,红细胞的刚性也有所减弱。因为红细胞体积变小,红细胞的流动性有所改善,在电场的作用下更容易发生迁移。本研究结果表明雄性尿酸酶缺失大鼠在45 d日龄时,血尿酸水平明显升高,且具有多饮多尿现象,但其白细胞数量略有减少,多个血液流变学指标也总体改善。

