橡胶树硫氧还蛋白基因HbCXXS1的克隆及表达分析
王帅 袁坤 何其光 胡义钰 冯成天 王真辉 刘进平 刘辉
(1.海南大学热带作物学院,海口 570228;2.中国热带农业科学院橡胶研究所 农业农村部橡胶树生物学与遗传资源利用重点实验室 省部共建国家重点实验室培育基地-海南省热带作物栽培生理学重点实验室,海口 571101)
橡胶树(Hevea brasiliensis)是大戟科(Euphorbiaceae)的一种重要热带经济作物,其产生的胶乳是重要工业原料和战略物资天然橡胶的主要来源。我国橡胶树种植区主要分布在热带北缘的海南省、云南省和广东省,处于非传统植胶区,易受低温寒害及干旱等非生物逆境危害。此外,橡胶树死皮的发生率也比较高。橡胶树死皮(或称割面干涸,tapping panel dryness)是一种复杂的生理综合症,主要症状表现为割胶后割线局部或全部不排胶。橡胶树死皮导致严重的产量和经济损失,是制约天然橡胶持续健康发展最主要的因素。分离鉴定调控橡胶树非生物胁迫抗性和死皮的关键基因,不仅有助于解析橡胶树逆境响应和死皮发生机制,还可为其遗传改良提供基因资源。
硫氧还蛋白是广泛存在于几乎所有生物体中的一种低分子量可溶性蛋白,分子量一般为12 kD 左右[1-3]。绝大多数硫氧还蛋白具有保守的WC(G/P)PC 活性中心,极少数硫氧还蛋白活性中心的第二个半胱氨酸变成了丝氨酸,为CXXS[4-5]。植物硫氧还蛋白家族成员众多,根据氨基酸序列及蛋白在细胞内的定位,植物硫氧还蛋白被分为f、m、x、y、z、h 和o 等不同类型。其中,f、m、x、y 和z 型主要定位于叶绿体;o 型主要定位于线粒体和细胞核;h型主要定位于细胞质,但有的也定位于细胞核、线粒体或内质网等[6-7]。h 型硫氧还蛋白是由多基因家族编码的[8],在拟南芥(Arabidopsis thaliana)、水稻(Oryza sativa)、高粱(Sorghum bicolor)、毛果杨(Populus trichocarpa)和葡萄(Vitis vinifera)中分别有11、7、6、10 和6 个h 型硫氧还蛋白基因[9]。系统进化分析表明,h 型硫氧还蛋白可分为3 个亚组,亚组1 成员的活性中心为WC(G/P)PC,亚组2 成员的活性中心为WCGPC,亚组3 成员的活性中心为WCGPC 或非典型的CXXS[8]。拟南芥中有2 个CXXS 硫氧还蛋白,AtCXXS1和AtCXXS2[10-11]。此外,在毛果杨[12]、蒺藜苜蓿(Medicago truncatula)[13]等中也存在CXXS 硫氧还蛋白。
硫氧还蛋白通过巯基-二硫键的相互转变调节细胞内的氧化还原状态,从而参与许多生物学进程,包括光合作用[14]、叶绿素生物合成[15]、植物再生[16]、种子萌发[13]、磷动态平衡[17]、激素合成及信号转导[18]、非生物胁迫应答[19-20]、植物免疫反应[21]等。在各类植物硫氧还蛋白中,h 型硫氧还蛋白成员是最多的,功能也是最广泛的。目前,已从多种植物中克隆并鉴定了h 型硫氧还蛋白基因,如拟南芥AtTRXh5[22]、水稻OsTRXh1[20]、花烟草(Nicotiana alata)NaTrxh[23]、甘蔗(Saccharumcomplex)Sc-TRXh1[24]、花生(Arachis hypogaea)AhTRXh[25]和小麦(Triticum aestivum)TaTrxh9[26]等。
2011年,Li 等[27]克隆并分析了橡胶树h 型硫氧还蛋白基因HbTRX1的组织表达特性,但尚未见h型硫氧还蛋白基因在橡胶树非生物胁迫应答和死皮中发挥功能的报道。Montoro 等[28]鉴定了与乙烯利诱导橡胶树死皮相关的基因,发现一硫氧还蛋白编码基因scaffold0616_558335(HbCXXS1)在死皮植株胶乳中表达显著下调。
本研究克隆HbCXXS1,并对其进行系统生物信息学分析,重点分析该基因在橡胶树各组织以及激素和非生物胁迫处理下的表达,为后续研究该基因的生物学功能奠定基础。
1 材料与方法
1.1 材料
选取中国热带农业科学院试验农场六队于2003年种植的橡胶树品种热研7-33-97 健康植株的嫩梢、成熟叶、衰老叶、雄花、雌花、树皮和胶乳样品,死皮植株胶乳取自割线死皮率在70%左右的死皮橡胶树,根组织样品取自移栽培养8 个月的热研7-33-97 组培苗。各组织样品采集后液氮速冻并磨碎,用于RNA提取。热研7-33-97组培苗移栽培养8个月后,挑选长势较好且一致的植株用于激素和非生物胁迫处理。
1.2 方法
1.2.1 激素和非生物胁迫处理 参考李双江等[29]方法进行植株激素和非生物胁迫处理。脱落酸(ABA)、乙烯利(ETH)、茉莉酸甲酯(MeJA)、水杨酸(SA)和过氧化氢(H2O2)的处理浓度分别为200 μmol/L、10 mmol/L、200 μmol/L、5 mmol/L 和20 mmol/L。低温处理温度为4℃,采用400 mmol/L 的NaCl 溶液进行盐胁迫处理,采用20%的PEG6000 溶液进行模拟干旱处理。分别在处理0、3、6、12、24 和48 h 时采集植株的第2、3 片叶,将3 株植株的叶片混为1个生物学样品,每时间点取3 次生物学重复。样品采集后液氮速冻并磨碎,用于RNA 提取。
1.2.2 总RNA 提取和反转录 采用RNAprep Pure多糖多酚植物总RNA 提取试剂盒(天根生化科技有限公司)提取胶乳总RNA,采用通用植物总RNA提取试剂盒(北京百泰克生物技术有限公司)提取嫩梢、成熟叶、衰老叶、雄花、雌花、树皮和根的总RNA,具体提取方法参照试剂盒说明书。采用琼脂糖凝胶电泳和NanoDrop 2000 超微量分光光度计(ThermoFisher 公司)检测提取RNA 的质量和浓度。参 照PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)(TaKaRa)试剂盒说明书将RNA反转录合成第一链cDNA。
1.2.3HbCXXS1的克隆 从橡胶树HeveaDB 数据库(http://hevea.catas.cn/home/index)获取scaffold0616_558335 的核苷酸序列,并在NCBI 数据库中进行BLASTn 序列搜索,获得该基因全长序列。利用Primer Premier 5.0 软件设计扩增该基因完整开放阅读框的引物(F:5′- AAAGTTGGCAAGCAGCATCT-3′和R:5′-CAAGCAACTCAAAACCCAGA-3′)。以胶乳cDNA 为模板,PCR 扩增目标基因,反应体系为cDNA 2 μL、5×TransStart®FastPfu Buffer 5 μL、Trans-Start®FastPfu DNA Polymerase(2.5 U/μL)0.5 μL、2.5 mmol/L dNTPs 2 μL、F 和R 引物(10 μmol/L)各0.5 μL 和ddH2O 14.5 μL。PCR 扩增程序为95℃ 3 min;95℃ 20 s,55℃ 20 s,72℃ 45 s,38 个循环;72℃10 min。产物经1%琼脂糖凝胶电泳检测、回收,与pEASY®-Blunt Simple Cloning Vector(北京全式金生物技术有限公司)连接,转化大肠杆菌DH5α 感受态细胞,挑取阳性单克隆送铂尚生物技术(上海)有限公司测序。
1.2.4 生物信息学分析 使用在线数据库SoftBerry(http://linux1.softberry.com/)中的FGENESH 程序预测基因开放阅读框及编码的氨基酸序列,通过在线程序Compute pI/Mw(http://web.expasy.org/compute_pi/)分析蛋白的分子量和等电点,使用CDD(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)、TMHMM 2.0(https://services.healthtech.dtu.dk/service.php?TMHMM-2.0)和ProtScale(http://web.expasy.org/protscale)预测蛋白的保守结构域、跨膜结构域和亲/疏水性,从NCBI 数据库获取其他植物h 型硫氧还蛋白序列,采用MEGA-X 软件中Neighbor-joining算法构建系统进化树。
1.2.5 实时荧光定量PCR(qPCR)分析 采用Primer Premier 5.0 软件设计用于qPCR 检测HbCXXS1的特异引物(F:5′-AGGCTGATAAGCTTGTGGGT-3′,R:5′-GCTAGGTTTTGGAAGCACGA-3′)。以HbUBC4为内参基因(F:5′-TCACCCTGAACCTGATAGCC-3′,R:5′-TTTCTTTGGTGACGCTGCAA-3′)。反应体系和反应条件参照TB Green®Premix Ex TaqTMII(Tli RNaseH Plus)(TaKaRa)说明书。采用2-ΔΔCt法计算基因的相对表达量。使用Excel 2010 处理数据,并制作图表。使用SAS 8.1 软件进行差异显著性分析,显著性检验水平为P<0.05。
2 结果
2.1 HbCXXS1的克隆及序列分析
通过NCBI 在线数据库BLASTn 搜索,获得scaffold0616_558335 完整序列,GenBank 登录号为XM_021781025.1。根据该序列设计引物进行扩增,获得一条与目的片段一致的条带(图1)。测序结果显示,该片段长度为622 bp。预测其开放阅读框为372 bp,编码123 个氨基酸。蛋白序列比对结果表明,该基因与其他植物thioredoxin-like 蛋白CXXS1 具有较高的同源性,故将该基因命名为HbCXXS1。
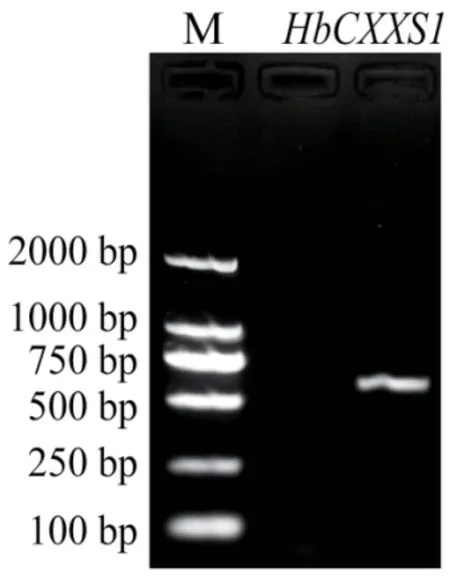
图1 HbCXXS1 的PCR 扩增Fig.1 PCR amplification of HbCXXS1 gene
预测HbCXXS1 蛋白的分子量为13.84 kD,理论等电点为5.67。保守结构域分析表明,HbCXXS1 含有硫氧还蛋白家族(TRX family)特有的保守结构域(位于第21-112 位氨基酸),其活性中心为CXXS,位于第42-45 位氨基酸,属于h 型硫氧还蛋白(图2-A)。跨膜结构域分析表明,HbCXXS1 蛋白不含跨膜结构域,为非跨膜蛋白(图2-B)。蛋白质亲/疏水性的预测结果(图2-C)显示,HbCXXS1 氨基酸序列第66 位苏氨酸分值最大,为1.733,是疏水性最强的氨基酸;第106 位谷氨酸分值最小,为-2.078,是亲水性最强的氨基酸。HbCXXS1 的亲水性平均系数为-0.016,属于亲水性蛋白。
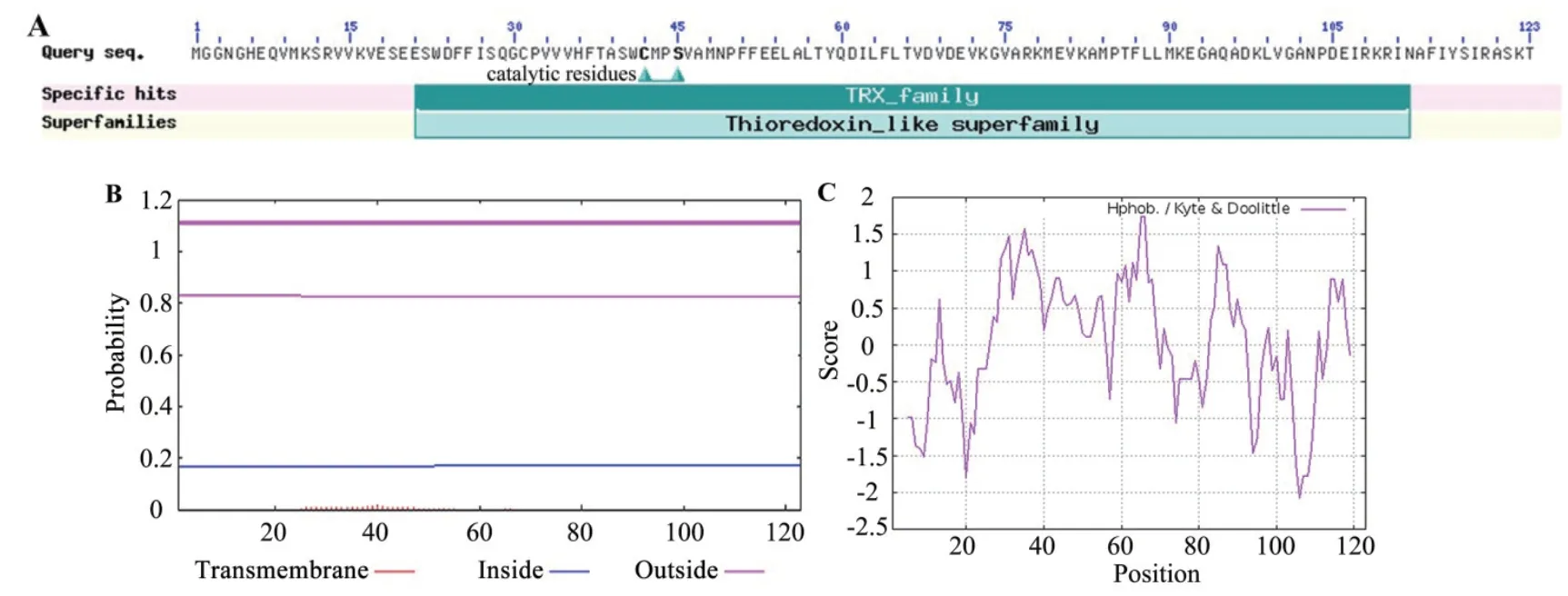
图2 HbCXXS1 蛋白保守结构域(A)、跨膜结构域(B)和亲/疏水性(C)分析Fig.2 Conserved domain(A),transmembrane domain(B)and hydrophilicity/hydrophobicity(C)analysis of HbCXXS1 protein
2.2 HbCXXS1蛋白的系统进化树分析
对HbCXXS1 蛋白序列进行BLASTp 同源性比对发现,HbCXXS1 与木薯(Manihot esculenta)MeCXXS1(XP_021595727.1)、橡胶树HbTRXh(AA D33596.1)和拟南芥AtCXXS1(NP_172620.1)的同源性分别为80.31%、72.50% 和63.72%,而与水稻OsTRX18 的同源性仅为38.14%。为进一步探究HbCXXS1 与其他植物h 型硫氧还蛋白的进化关系,构建HbCXXS1 与其他植物h 型硫氧还蛋白的系统进化树(图3),21 个h 型硫氧还蛋白被分为3组。拟南芥AtTRX1、AtTRX3 和AtTRX4、麻疯树(Jatropha carcas)JcTRXh、陆地棉(Gossypium hirsutum)GhTRXh、水稻OsTRXh1、玉米(Zea mays)ZmTRXh 聚为第I 组;拟南芥AtTRXh7 和AtTRXh8、水稻OsTRX10、欧美杂种山杨(Populus tremula×P.tremuloides)PpTRXh2、橡胶树HbTRXh7 和木薯MeTRXh7 聚类在第II 组;橡胶树HbCXXS1与拟南芥AtCXXS1、AtCXXS2 和AtTRXh10、木薯MeCXXS1、水稻OsTRX18、葡萄VvTRXh 聚为第III组。其中,HbCXXS1 与MeCXXS1 处于同一进化分支,亲缘关系最近。
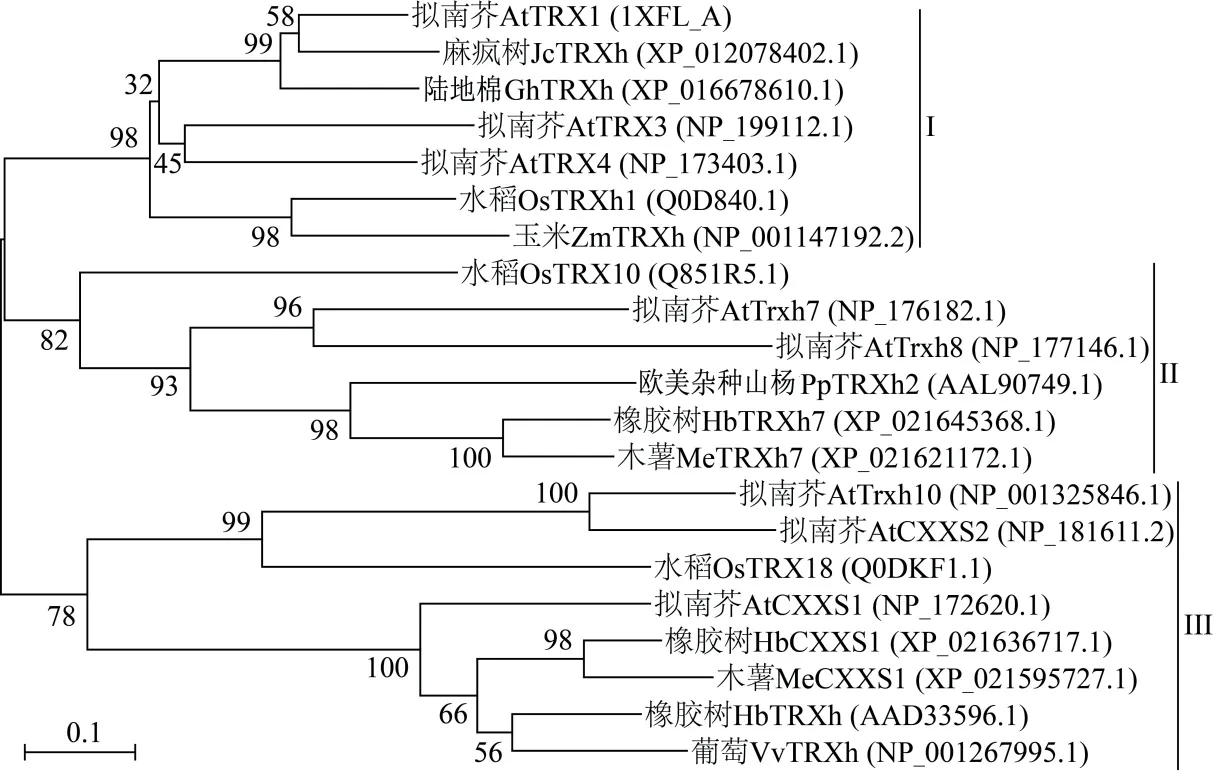
图3 HbCXXS1 和其他植物h 型硫氧还蛋白的系统进化树Fig.3 Phylogenetic tree of HbCXXS1 and thioredoxin h proteins in other plants
2.3 HbCXXS1的组织表达模式
HbCXXS1在橡胶树嫩梢、成熟叶、衰老叶、雄花、雌花、树皮、胶乳和根中表达如图4-A 所示。HbCXXS1在各组织中均有表达,但表达水平存在显著差异。HbCXXS1在胶乳中的表达量最高,显著高于其他组织;其次是雄花,但表达量仅为胶乳中的1/5;表达量最低的组织是衰老叶,其表达量不足胶乳的1%。由此可见,HbCXXS1主要在胶乳中表达。并且HbCXXS1在死皮植株胶乳中的表达显著低于健康植株(图4-B)。

图4 HbCXXS1 在橡胶树各组织(A)以及健康与死皮植株胶乳(B)中的表达Fig.4 Expressions of HbCXXS1 in various tissues(A)and latex from healthy and TPD rubber tree(B)
2.4 激素处理对HbCXXS1表达的影响
HbCXXS1在ABA、ETH、MeJA 和SA 处理后不同时间点的表达变化如图5所示。ABA 处理显著抑制了HbCXXS1的表达,在处理6 和12 h 时,表达量约为处理前的1/2。此后,HbCXXS1的表达逐步回升,在处理24 h 后基本恢复到正常水平。ETH 处理使HbCXXS1表达上调,在处理前24 h,HbCXXS1的表达无显著变化,在处理48 h 时,其表达显著上调,为处理前表达量的2.4 倍。MeJA 处理也显著抑制了HbCXXS1的表达,在处理3 和12 h 时,HbCXXS1的表达显著降低。其中,处理12 h 时,HbCXXS1的表达量最低,约为处理前的1/2。SA 处理也会影响HbCXXS1的表达,在处理6 和24 h 时,HbCXXS1的表达显著降低,而在处理12 h 时,其表达量显著上调。以上结果表明,HbCXXS1的表达受ABA、ETH、MeJA 和SA 等激素调控。
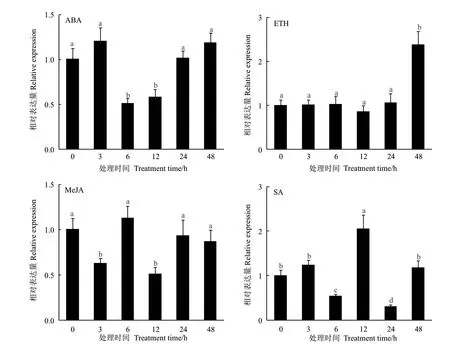
图5 激素处理后HbCXXS1 的表达变化Fig.5 Expression change of HbCXXS1 after hormone treatment
2.5 非生物胁迫下HbCXXS1的表达分析
HbCXXS1在低温、PEG 诱导干旱、盐和H2O2诱导的氧化胁迫下的表达变化如图6所示。低温处理诱导HbCXXS1表达,与对照相比,在处理3 h 时,HbCXXS1的表达显著上调,之后,其表达回归正常水平。干旱和盐胁迫下,HbCXXS1的表达变化趋势基本一致,整体呈逐步降低趋势,二者均在处理48 h 时表达量最低,分别为处理前的20%和2%。氧化胁迫下,HbCXXS1的表达先降低后升高,在处理6 h 时,HbCXXS1的表达降至最低(约为处理前的1/2),此后逐步回升,在处理12 和24 h 时,其表达量仍显著低于处理前,但在处理48 h 时则显著高于处理前。以上结果表明,HbCXXS1的表达受低温、干旱、盐和氧化等非生物逆境胁迫调控。
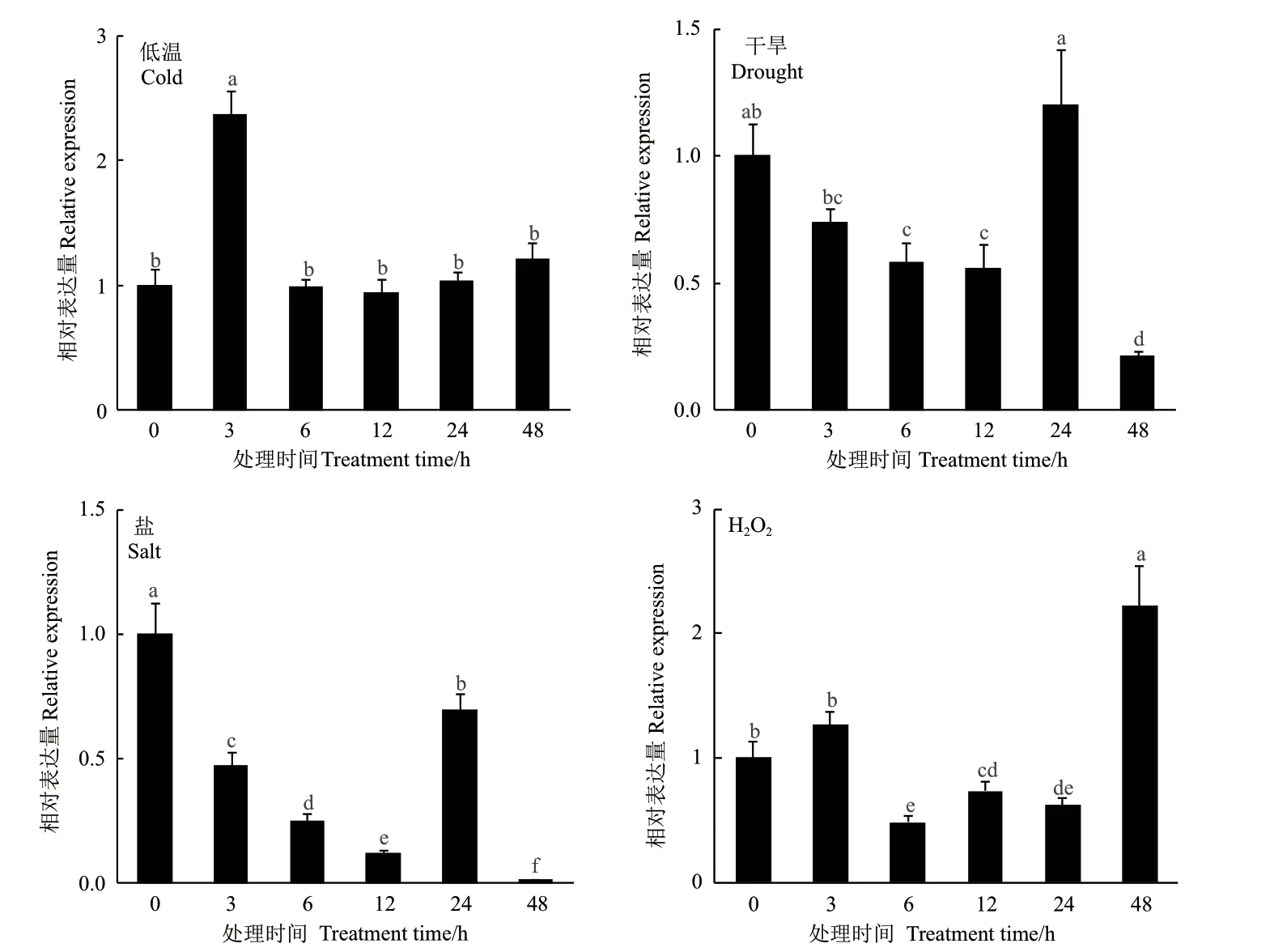
图6 非生物胁迫下HbCXXS1 的表达变化Fig.6 Expression change of HbCXXS1 under abiotic stress
3 讨论
本研究从橡胶树中克隆了硫氧还蛋白基因HbCXXS1,蛋白保守结构域分析表明,HbCXXS1 含有硫氧还蛋白保守结构域。与大多数硫氧还蛋白具有典型的WC(G/P)PC 活性中心不同,HbCXXS1的活性中心为非典型的CXXS,属于h 型硫氧还蛋白。Gelhaye 等[8]和Renard 等[13]研究结果表明,h型硫氧还蛋白可分为3 组。本研究对HbCXXS1 及其他植物h 型硫氧还蛋白进行了系统进化分析,结果表明,这些h 型硫氧还蛋白分为3 组,HbCXXS1与其他植物CXXS 硫氧还蛋白均属于第III 组,这与Gelhaye 等[8]和Renard 等[13]结果一致。
Nuruzzaman 等[30]对水稻硫氧还蛋白家族基因的研究表明,不同硫氧还蛋白基因具有不同的组织表达模式,一些硫氧还蛋白基因的表达具有组织特异性。本研究分析了HbCXXS1在橡胶树各组织中的表达,发现该基因在橡胶树各组织中均有表达,但在胶乳中的表达显著高于其他组织。Li 等[27]研究也发现,该基因在胶乳和愈伤组织中的表达明显高于其他组织。此外,本研究和Montoro 等[28]研究均发现,HbCXXS1在死皮植株胶乳中的表达显著低于健康植株。橡胶树死皮后,胶乳产量明显降低。HbCXXS1在胶乳中高表达,而在产排胶障碍的死皮植株胶乳中的表达显著下调,暗示HbCXXS1可能在橡胶树产排胶过程中发挥重要作用。
植物激素作为信号分子在基因表达调控中起着重要作用。郭晋隆等[24]研究发现,甘蔗ScTRXh1的表达受ABA 的抑制而受SA 的诱导。小麦叶片中TaTrxh9的表达也受ABA 的抑制[26]。为明确植物激素对HbCXXS1表达的调控作用,本研究分析了ABA、ETH、MeJA 和SA 处理对HbCXXS1表达的影响。ABA 和MeJA 处理均抑制了HbCXXS1的表达,但两处理下HbCXXS1的表达模式略有不同。ABA 处理后,HbCXXS1表达量的显著降低发生在6 h 和12 h,而MeJA 处理后,HbCXXS1表达量的显著降低发生在3 h 和12 h。与SA 处理上调ScTRXh1的表达不同,SA 处理后不同时间点HbCXXS1的表达有上调也有下调,处理6 h 和24 h 时,HbCXXS1的表达显著下调,而处理12 h 时,HbCXXS1的表达显著上调。ETH 处理也上调了HbCXXS1的表达,但上调发生在处理48 h 时。由此可见,HbCXXS1的表达受植物激素调控,但其对不同激素的响应模式存在差异。由于本研究未检测HbCXXS1在正常条件下不同时间点的表达,也不排除其表达受生物钟的影响。激素处理后,HbCXXS1的表达模式各不相同或许是激素和生物钟共同调控的结果。后续应检测HbCXXS1在正常条件下不同时间点的表达,以确定其表达是否受生物钟调控。
植物在非生物逆境胁迫下,活性氧会过量积累,导致氧化还原状态的失衡,对细胞造成损害。调节和维持细胞氧化还原平衡是植物抵御非生物逆境胁迫的重要生化调控途径[26]。研究表明,硫氧还蛋白是一类调控植物生长发育和非生物胁迫应答的重要氧化还原蛋白[31]。目前,已从许多植物中鉴定了参与非生物胁迫应答的硫氧还蛋白基因,如水稻OsTRXh1[20]、甘蔗ScTRXh1[24]和小麦TaTrxh9[26]等。本研究发现,HbCXXS1的表达受低温、干旱、盐和氧化胁迫调节。其中,干旱和盐胁迫以及氧化胁迫的早期显著抑制了HbCXXS1的表达。此外,HbCXXS1在死皮植株胶乳中的表达也被显著抑制,而橡胶树死皮的发生与氧化还原平衡失衡密切相关[32]。由此推测,HbCXXS1可能通过调节氧化还原平衡参与橡胶树死皮及非生物胁迫应答。HbCXXS1表达的下调可能会降低植株对非生物胁迫的抗性,并使植株更容易发生死皮。通过基因工程手段过表达HbCXXS1或许能改良橡胶树对非生物胁迫的抗性以及降低死皮的发生。
4 结论
从橡胶树中克隆了硫氧还蛋白基因HbCXXS1,其开放阅读框长372 bp,编码123 个氨基酸。HbCXXS1 蛋白分子量为13.84 kD,等电点为5.67,属于亲水性蛋白,活性中心为CXXS,属于h 型硫氧还蛋白的第III 组。HbCXXS1在橡胶树胶乳中的表达显著高于其他组织,且在死皮植株胶乳中的表达被显著抑制。HbCXXS1的表达受ABA、ETH、MeJA 和SA 等激素以及低温、干旱、盐和氧化胁迫等非生物逆境调节,可能参与了橡胶树产排胶和非生物胁迫应答调控。

