基于细胞代谢组学的药物研究方法及应用*
王艳丽,刘春花,潘 洁,孙 佳,刘 亭,李勇军2,,陆 苑△
(1贵州医科大学贵州省药物制剂重点实验室&省部共建药用植物功效与利用国家重点实验室,贵州贵阳550004;2贵州医科大学药学院,贵州贵阳550004;3贵州医科大学民族药与中药开发应用教育部工程研究中心,贵州贵阳550004)
生命科学研究促进了组学技术的发展,除了基因组、转录组和蛋白组可以从基因和蛋白功能等方面揭示生命科学活动外,生物体内还存在着十分精细的调控体系,既有直接参与能量代谢的糖类、脂质及其中间代谢物,也有对新陈代谢起重要调节作用的物质,它们在体内形成相互关联的代谢网络,共同参与对生命活动的调控。对于这些物质的研究,传统方法以生理学和药理学结合的针对性研究为主,缺乏高通量的整体研究技术,基于此代谢组学应运而生[1]。代谢组学通过动态监测细胞、组织或其它生物体系受刺激或扰动后(某个特定的基因变异或环境变化),相对分子质量小于1 000的内源性小分子的变化,以此阐明生物体系的代谢途径、揭示机体生命活动代谢本质[2]。不同组学在解释生命活动变化中具有不同的侧重点,其中代谢组学处于生物流调控的末端,更接近疾病表型。与其它组学相比,代谢组学研究具有以下特点(表1),已成为系统生物学研究的重要手段[3]。

表1 代谢组学技术的特征优势Table 1.Features and advantages of metabolomics study
细胞是生物体结构和功能的基本单位,其代谢物组成是遗传特征、基因表达调控、蛋白质表达和环境影响共同调控的结果[4]。细胞代谢组学可通过对不同生理状态下细胞内外小分子代谢物的定性、定量分析,找出与疾病发生和治疗相关的关键代谢物,解释作用机制。
目前代谢组学的研究大多基于动物样本(血液、尿液及组织等)进行,但其与人类的种属差异性以及代谢物极易受多种因素影响(如年龄、外界环境等),都会使实验结果产生偏差[5]。而细胞代谢组学则可借助于各种人源细胞模型,直接反映细胞生命活动的生物标志物信息。此外,细胞受外界因素影响较小、实验变化易于控制、实验重现性高、成本较低、结果更易解释,其代谢组学研究已被广泛应用于药物机制探究、毒理学评价以及中药活性成分筛选等领域[6-7]。本文将对其从研究流程和相关应用等方面进行相应的论述,旨在更全面地理解细胞代谢组学的研究发展。
1 细胞代谢组学的研究流程
细胞代谢组学实验是对细胞内和细胞外代谢物的定性、定量分析过程,主要流程为细胞处理、数据采集、数据分析和代谢标志物分析(图1)。

Figure 1.Research process of cell metabolomics.图1细胞代谢组学研究流程
1.1 细胞处理简单、快速且重现性好的处理方案是细胞代谢组学研究的基本要求。为此,研究人员需从以下因素进行考虑。
1.1.1 细胞培养细胞代谢组学研究通常选择各种哺乳动物细胞,包括原代细胞和可连续传代的细胞系。原代细胞保留了原有组织中大部分表型特征,可反映体内环境,是探究特定组织代谢和生化途径的首选体外模型[8]。然而由于原代细胞样本来源珍贵,特别是人类来源的原代细胞,细胞增殖速度慢且培养条件较严格,一定程度上限制了其在代谢组学研究中的应用。尽管其他来源细胞系(如肝、肾、肺、血、卵巢等)的代谢功能不同于原代细胞,但它们具有诸多优点,如易处理、几乎无限的寿命、标准化的培养条件以及不依赖于供体特征的稳定表型等,这使得其在代谢组学研究中被广泛应用[9]。
无论是原代细胞还是细胞系,合适的培养条件始终是细胞生长繁殖所必需的,因此培养基配方对细胞功能和新陈代谢的影响不容忽视。一项肿瘤细胞代谢组学研究中对比了199培养基、199培养基含2%胎牛血清、DMEM培养基、DMEM培养基含2%胎牛血清以及克-汉二氏重碳酸盐缓冲液,5种不同培养基对代谢物的影响,结果显示细胞内和细胞外代谢物种类和含量均有不同程度的改变[10]。另外,一项基于核磁共振(nuclear magnetic resonance,NMR)技术的人胰腺癌细胞系的代谢组学研究也揭示培养基会显著影响细胞的代谢轮廓特征,因此在设计代谢分析研究时应将培养基视为一个重要变量[11]。
在细胞培养研究中,一般认为纯化学合成培养基优于天然培养基。合成的纯化学培养基是已知量的高纯度化学试剂与蒸馏水配制而成,所含的成分(包括碳水化合物、各种无机盐、维生素和微量元素等)以及用量均确切可知。对于细胞代谢组学而言,往往需要考虑对培养基条件进行优化,以期获得最全面和精准的代谢轮廓。然而,过度优化的培养基条件却可能造成细胞生长抑制,对细胞培养的效果不如天然培养基[12]。复杂的天然培养基,如牛血清或胎牛血清,含有丰富的细胞生长必须的营养成分,培养效果好,广泛用于动物细胞的体外培养,缺点是成分复杂,批次间差异大。有研究表明血清类型和批次等的变化均可能导致外源性代谢物的污染和内源性细胞代谢物的改变[12]。因此在进行细胞代谢组学研究时,应在充分考虑研究目的和细胞生长特性的前提下选择合适的培养基,尽可能选择同一供应商来源的产品,同时尽量避免批次间的误差,以减少代谢差异。
细胞密度是可能导致细胞代谢轮廓改变的另一个重要因素。培养的不同密度的细胞可能处于细胞增殖期或生长停滞期,其代谢物轮廓可能会因此会产生差异。Miccheli等[13]对处于不同细胞密度的HepG2细胞进行了基于NMR的代谢组学分析,结果得到两种完全不同的代谢谱图,这证实了细胞密度对代谢轮廓的影响。目前,关于哺乳动物细胞代谢组学的多项研究都没有对细胞接种密度进行标准化规定。一般建议悬浮细胞的接种密度至少为1×107mL-1,但(2~50)×105mL-1的接种密度也被应用[14-15]。不同类型贴壁细胞的接种密度也表现出多样化,如HepG2细胞为0.2×105cm-2、原代人类肝细胞为1.7×105cm-2以及人类胚胎干细胞为7×105cm-2等[16-17],实际培养中仍需要根据所用细胞的生长特性进行选择。此外,研究还指出细胞传代数和表型差异也可能改变细胞代谢谱,在设计实验时应考虑[18]。总之,细胞培养是影响代谢轮廓的重要变量,涉及多方面的因素,实际操作中应尽可能减少差异条件,更好地控制细胞生长指数和表型稳定性,以保证代谢轮廓结果的可靠性和真实性。
1.1.2 细胞淬灭细胞淬灭是抑制细胞内酶活性,阻止代谢物变化的关键步骤。由于细胞代谢活动离不开酶的催化,部分代谢物能够在毫秒间实现代谢转化,如三磷酸腺苷(adenosine triphosphate,ATP)为1.5 mmol/s、二 磷 酸 腺 苷(adenosine diphosphate,ADP)为2.0 mmol/s和D-葡萄糖为1.0 mmol/s[18-19],而代谢组学仅能反映某一时刻下机体的代谢轮廓,因此提取前快速的细胞淬灭是保证代谢物水平微小变化以及避免偏差性结果的先决条件[15]。典型的淬灭技术多基于低温或酶变性原理进行,具体包括液氮淬灭、快速冷冻和添加冷有机溶剂等[20-21]。对于单独分析细胞内和细胞外的代谢物而言,淬灭技术还应尽可能保证细胞膜的完整性,避免胞内外代谢物的相互干扰[22]。多项研究发现,基于冷甲醇的淬灭可能造成胞内代谢物的流失,随着甲醇浓度的降低,代谢物信息损失显著降低[23-24]。Dietmair等[25]发现60%甲醇也会破坏细胞膜结构,而冰冷的0.9%生理盐水的淬灭则能在保证细胞膜完整性的同时,有效阻止ATP等高能物质的生物转化。此外,Kapoore等[26]研究指出60%甲醇和4-羟乙基哌嗪乙磺酸等不同缓冲盐添加剂的组合也是减少细胞内代谢物泄漏的有效淬灭方法。
不同细胞类型,淬灭方案亦有不同。Kostidis等[22]研究指出,悬浮细胞中以-40℃提前预冷的甲醇(含0.85%的碳酸氢铵)作为淬灭溶剂,随后在-20℃下以1 000 r/min离心1 min,可在保证细胞膜完整性的前提下,使胞内外代谢物充分分离并减少代谢失活。贴壁细胞则可以先通过低温快速移取的方法进行细胞内外代谢物的分离(必要时进行离心),随后用冰冷的磷酸盐缓冲液或0.9%生理盐水洗涤,这不仅能够去除培养皿的残留,还能有效减缓细胞的代谢活动,为代谢物的淬灭操作提供时间[21]。常用技术中,液氮淬灭被认为是简单、快速和高效的方法,而且液氮的快速处理可对细胞膜形成即时的损伤,有利于后续的代谢物提取[21,27]。除了上述方法外,部分基于热甲醇、热乙醇、甲醇-氯仿、酸、碱和热水等进行的细胞淬灭也取得了一定效果[16],实际应用中应根据细胞类型和实验目标进行选择及优化。
1.1.3 细胞提取细胞提取是代谢物充分释放的过程,有效的提取方法应以获得最全面的代谢轮廓为前提。提取溶剂是决定代谢物提取量的重要因素之一。普遍认为以甲醇-水、乙腈-水以及氯仿等有机溶剂为代表的液-液萃取法是较好的选择。为此,一些研究在充分考虑并评估代谢物回收率后,认为50%乙腈、82%甲醇、90%甲醇-氯仿以及纯甲醇等作为提取溶剂的方案可被普遍应用[25,28]。此外,对不同目标代谢物提取条件的方法优化也被广泛探讨,Lorenz等基于超高效液相色谱-四极杆-飞行时间质谱联用(UPLC-QTOF-MS)技术,分别以乙腈、乙醇、甲醇、70%甲醇和75%甲醇-氯仿混合溶液(9∶1)作为提取溶剂,通过对参与糖酵解和三羧酸循环的27种代谢物定量分析比较,发现75%甲醇-氯仿混合溶液的提取可以最大程度上保证代谢物的回收率和稳定性[28]。而对于还原型辅酶Ⅱ(NADPH)、ATP等高能代谢物,常规的淬灭方式难以完全立即终止酶的活性,造成其进一步转化成烟酰胺腺嘌呤二核苷酸磷酸(AMP)等其它代谢物。因此,对这些代谢物的提取,Jang等[20]建议采用有机溶剂加酸的方法进行,其中以乙腈∶甲醇∶水(2∶2∶1)与0.1 mol/L甲酸的混合溶液作为提取溶剂,几分钟后加入碳酸氢盐以中和样品的方法能够有效地提取这些代谢物。Dietmair等[25]则通过比较混合标准品中核苷酸(尿嘧啶和腺嘌呤等)、氨基酸(精氨酸和亮氨酸等)和有机酸(柠檬酸和富马酸等)等物质的代谢回收率,对乙腈、甲醇及甲醇-氯仿等12种常用提取方案进行评价,结果表明50%乙腈的提取方法可获得较好的代谢回收率,适用于此类物质的提取。除了根据实验目的和代谢物的理化性质(如极性大小)选用合适溶剂提取外,细胞的破碎程度也十分重要,如超声处理、机械均质化和冻融循环均能有效增强细胞通透性,实验中可根据具体条件进行选择。
温度是影响代谢物提取产量的另一个因素,为了避免代谢物的进一步转化降解,有研究建议提取过程应尽量保持低于-20℃的低温环境,实验中可通过调节提取溶剂的温度进行控制[23]。Kostidis等[21]研究表明,以-80℃的有机溶剂进行提取,可获得较全面和重复性高的实验结果。尽管还有报道指出,过低的溶剂温度可能会降低代谢物的溶解度,不利于代谢组学分析[25],但-40℃、-20℃及4℃等不同温度的提取溶剂仍常用[29]。总之,目前尚无针对某一类型细胞或特定代谢物的标准化提取方法,实验中仍需要综合考虑。
1.2 数据采集代谢组学的分析方法要求具有高灵敏度、高通量以及无偏向性等特点,然而生物代谢物的复杂性,使得这一目标往往需要多种分析手段的结合才能实现,基于NMR或质谱(mass spectrometry,MS)系统的分析是目前代谢组学研究中的主要手段。
1.2.1 基于NMR的检测技术NMR可用于结构解析和定量,具有快速测定和高度重现性等优势,已被大量用于代谢组学研究中。NMR检测对样品的处理和分析要求较为简单,基本可实现样品的无创性和无偏向性检测要求,有效地保证了原始代谢信息的完整性和客观性,尤其以1H-NMR为主的代谢组学分析被广泛应用,如唐孟秋等利用1H-NMR技术检测得到人参煎治疗2型糖尿病的代谢标志物,包括甘氨酸、α-葡萄糖和β-葡萄糖等血清代谢物以及牛磺酸和肌酸等尿液代谢物[30];Zhang等[31]通过1H-NMR测定临床高尿酸患者的代谢谱,揭示了疾病可能的作用机制。然而,NMR的主要缺点在于检测灵敏度和分辨率较低,无法满足低丰度代谢物的准确检测。为此研究人员通过配备超低温探头,以提高NMR技术的灵敏度[32]。同时,高分辨率魔角旋转(high-resolution magic angle spinning,HR-MAS)及液相色谱-NMR联用(liquid chromatography-NMR,LC-NMR)等技术被用于提高测定分辨率[33],目前这些技术也逐渐被用于代谢组学研究中,例如,Akira等[34]在遗传性高血压大鼠中,利用LC-NMR技术测定到与牛磺酸结构相似的低丰度琥珀酰牛磺酸,这为遗传性高血压疾病的探究提供了新的切入点。Gogiashvili等[35]采用HR-MAS技术为乳腺癌患者的40种代谢物提供了准确的定性、定量信息。这些技术的使用有效地扩展了以NMR为分析手段的代谢组学在药物毒性、基因功能以及临床疾病诊断等方面的应用。
1.2.2 基于MS的检测技术MS技术因具有较高的灵敏度和专属性被广泛应用,特别是基于分离的MS技术可通过对样品进行预先分离,从而提高代谢物的覆盖率,其中以液质联用(liquid chromatographymass spectrometry,LC-MS)和气质联用(gas chromatography-mass spectrometry,GC-MS)最为常用。GCMS因具有高分辨率、高灵敏度、标准的代谢数据库(如NIST、Willey等多种数据库)以及易于定性等优点,多用于代谢组学研究中。如常晋霞等[36]基于GCMS代谢组学方法,鉴定出多个与刺五加总苷提取物治疗糖尿病密切相关的代谢物,包括氨基酸、脂肪酸和有机酸等物质。但GC-MS多适用于挥发性化合物(如甾醇类、醋酸盐类等)或极性较小化合物的检测(如短链脂肪酸),且检测样本多需进行衍生化操作,预处理繁琐。而LC-MS除具有较高分辨率和灵敏度外,还拥有较宽的动态检测范围,可覆盖多数中高极性化合物的分析(如脂质、核苷酸、糖类等)。此外,LC-MS分析还能够有效避免GC-MS中繁杂的样品前处理,且代谢物数据库信息更为全面而被广泛应用。LC-MS分析中,合适的分离系统是影响代谢物检测偏向性的重要因素,其中基于反相色谱的预分离仅适用于极性相对较小的脂质、有机酸等代谢物,而糖类、氨基酸等多数亲水性代谢物则表现出弱保留行为[20]。因此为了获得更全面的代谢物信息,建议将不同分离性质色谱柱的分析结果相互补充。如Palmer等[35]利用互补的亲水色谱柱(hydrophilic interaction chromatography,HILIC)和反相C18色谱柱得到了更为全面代谢物信息。D′Elia等[37]基于HILIC和C18色谱柱的UHPLC-MS技术,全面评估了与蓖麻毒素中毒密切相关的代谢标志物。此外,二维液相系统的发展为样品在反相和亲水作用色谱柱的同时检测提供了可能。其它的分析技术,如毛细管电泳-质谱、傅里叶变换离子回旋共振质谱以及毛细管高效液相色谱-质谱等多种检测手段也在不断探索中。
目前,尚无一种分析技术能够达到代谢组学分析全面性的要求,为此多种分析平台的结合在代谢组学研究中备受关注,其可通过信息互补来提高代谢物的覆盖率。研究已经总结出多种针对哺乳动物细胞代谢组学的分析平台[9],并对基于NMR和MS技术的代谢分析特征进行了具体的比较[38],实验者可根据研究重点或实验条件进行选择。
1.3 数据分析代谢组学得到的是大量、多维的数据信息,而样品制备和仪器分析中引入的微小误差,很可能造成代谢物信息的偏差或缺失[5]。因此,为了准确挖掘所获得数据中的潜在信息,对原始数据矩阵的分析处理十分重要。细胞代谢组学研究的数据处理包括数据归一化以及基于统计分析的数据挖掘。
1.3.1 数据归一化代谢物的准确定量关乎后续数据建模和代谢标志物挖掘的可靠性,然而细胞代谢组学研究中,细胞密度和处理条件的微小变化往往造成细胞的增殖差异,使其难以在同一水平上进行代谢物浓度的比较,最终导致实验结果的偏差,因此需要对原始数据进行归一化处理[7,28]。目前,常用的归一化方法包括细胞数量归一化、蛋白质浓度归一化以及DNA浓度归一化[9]。不同研究者也对它们的合理性进行了比较或考察,如Muschet等[39]开发了一种基于荧光的DNA定量方法,用于测定代谢组学样品中的细胞数量,结果发现大多数代谢物(占比约82%~97%)的浓度与细胞数量呈线性正相关,这为细胞数量归一化的合理应用提供了依据。Cao等[28]利用气相色谱-飞行时间质谱法对两种不同细胞系中存在的11种代谢标志物进行测定,结果发现这些代谢物的信号强度与蛋白质含量呈现良好的线性关系,证明了蛋白浓度归一化的可行性。Silva等[40]则对细胞数量归一化、蛋白质浓度归一化和DNA浓度归一化方法进行了比较,结果发现DNA浓度与细胞接种数量的相关性最强,且这种归一化方法能有效避免成团生长的细胞系难以准确计数和由提取溶剂可能引起的蛋白质回收率差等问题,更适用于贴壁细胞数据的归一化处理。Abdel等[41]对糖酵解生物途径的相关代谢物进行靶向分析,并将三种细胞系所获得的数据分别进行细胞数量和DNA浓度归一化处理,结果显示这两种归一化方式的分析结果无明显差异。此外,还有研究者在基于GC-MS探究乳腺癌细胞的代谢轮廓时,发现总离子流图和细胞数量归一化的结果相似,因此后续分析可选择省略细胞数量归一化的步骤[42]。尽管有研究认为,在多种归一化方式中,细胞数量归一化是最常用的方式[6],但实验时仍需根据不同细胞系间的差异和操作可行性等问题选择合适的归一化方法。
1.3.2 数据统计分析基于NMR和MS的代谢组学研究都会生成大量数据,因此识别其中的重要信息,并将其与生物体的生物特征进行关联,进而用于了解和发现生物学规律,是代谢组学研究的重要步骤。代谢组学常用的多元统计分析包括无监督和有监督分析。主成分分析(principal component analysis,PCA)属于无监督模式,可在样本来源未知的情况下,通过提取拟合能力最大的几个主成分,对原始数据进行降维处理。PCA通常在组学数据处理的早期阶段进行,用于识别样本大致分类情况并发现异常值[43]。偏最小二乘法判别分析(PLS-DA)是有监督模式的一种,其在已知样本分组的前提下,通过建立数学模型,达到提高样本分类的目的,但是这种模式通常需要使用其它的验证方法来检验模型是否出现过拟合情况[44]。在模型检验符合要求后,可进一步结合变量重要性投影(VIP)、S-plot等各种形式的载荷图,用于继续筛选在样本分类中有重要贡献的
差异代谢物。除上述方法外,支持向量机(SVM)和人工神经元网络(ANN)等其它统计方法可进一步优化样本分类并提高模型可信度,正逐渐被用于代谢组学分析中[45-46]。此外,单变量统计分析P值以及差异变化倍数(fold change,FC)也被进一步结合,用于寻找各实验组间具有显著性变化的代谢标志物。尽管大量统计软件的出现为代谢组学的数据分析提供了便利,但这些软件执行背后的算法知识仍需充分考虑,以确保筛选信息的完整性和准确性。
1.4 代谢标志物分析代谢标志物的分析是识别关键代谢物,准确解释机体变化的关键步骤。主要包括代谢物的识别和生物解析。
1.4.1 代谢物鉴定代谢标志物的准确鉴定直接影响其潜在生物途径的准确性。一些代谢数据库的开发对于代谢物的识别和生物学机理的揭示具有十分重要的作用,具体包括HMDB、METLIN、MetaCyc、Golm Metabolome Database、Lipid Maps、LipidBank、MetaboLights和Metabolomics Workbench等含 丰富代谢物信息的生化数据库以及PubChem、ChemSpider、NIST和MoNA等仅供物质鉴定的综合数据库[29],具体网址见表2。这些数据库大多含有大量代谢产物的MS/MS图谱,部分数据库还提供了不同仪器和碰撞能量下产生的碎片离子,研究人员可根据自身情况进行匹配。
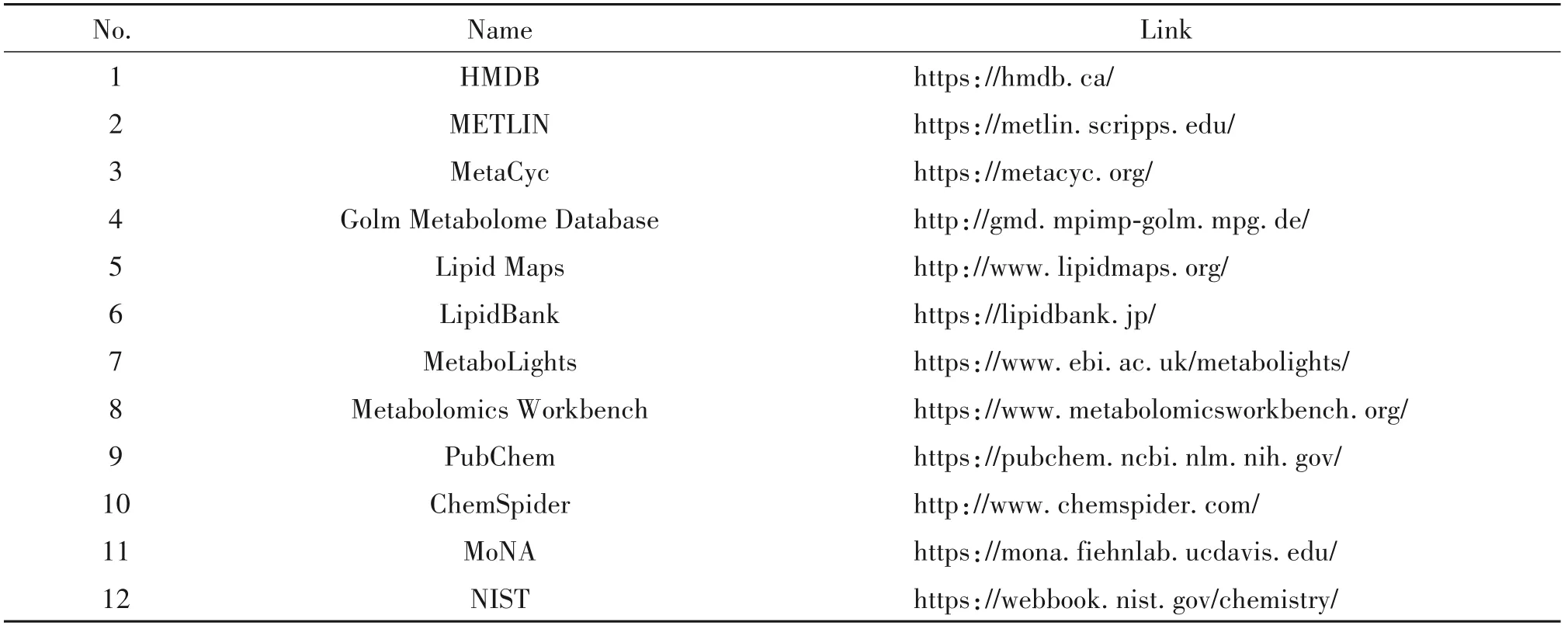
表2 代谢组学研究中常用的代谢物鉴定数据库Table 2.Databases for metabolite identification in metabolomics study
1.4.2 生物解析当代谢组学用于医学研究时,代谢标志物一般用作疾病的早期诊断或阐明作用机制,为了初步判断代谢物标志物诊断相关疾病的能力,通常需要绘制受试者工作特征曲线(ROC)进行评判,并以曲线下面积大于0.7作为具有准确诊断能力的标准[47]。同时代谢标志物的聚类热图可以将其在不同状态下的浓度变化进行可视化,以进一步明确数据差异[20]。生物学意义的阐释是代谢组学医学研究的重点,为此需要将相关代谢标志物和代谢通路整合分析,HMDB、KEGG(https://www.kegg.jp/)以及MetaboAnalyst(https://www.metaboanalyst.ca/)等在线数据库的开发为建立它们的生物关联和功能解释提供了便利,被大量应用于代谢组学研究中[20]。除借助上述生化数据库外,研究者还应不断更新对代谢物生化功能的认识,以确保代谢组学结果的真实性。
2 细胞代谢组学的药物研究进展
细胞代谢组学是通过细胞层面直观认识生物事件的有力工具,尤其是检测技术的不断进步,为识别、量化和了解更多的细胞代谢物提供了可能。目前细胞代谢组学在药物研究方面的应用涉及药物研发、活性成分研究以及机制探究等多个方面。
2.1 药物研发多数情况下,疾病会导致机体发生代谢变化,而代谢组学因可以更精确地分析表型差异并提供关于代谢物生化功能信息的特征,在识别疾病靶标,寻找针对性治疗药物方面具有重要作用。例如,Vastag等基于LC-MS技术对甲型流感(influenza A virus,IAV),1型单纯疱疹病毒(herpes simplex virus type-1,HSV-1)人巨细胞病毒(human cytomegalovirus,HCMV)感染的细胞进行代谢组学分析,结果发现不同病毒的代谢变化具有特异性,其中乙酰神经氨酸和脱氧嘧啶可分别作为IAV和HSV-1的治疗标志物,而HCMV感染的细胞代谢结果则表明柠檬酸和N-乙酰天冬氨酸等代谢物可作为病毒治疗的潜在靶标,这为后续相关靶标药物的开发利用提供了依据[48]。在肿瘤靶点发现上,细胞代谢组学的研究也在进行,如Liu等研究了小檗碱对胰腺癌(pancreatic cancer,PC)的治疗能力,初步揭示了小檗碱可通过扰乱PC细胞的能量代谢,使得肿瘤细胞的生存和转移能力显著下降,进一步的靶向分析结果表明柠檬酸在整个能量代谢途径中发挥着关键作用,可能成为药物开发和针对PC治疗的新靶点,值得深入研究[49]。陆苑等基于UHPLC QE Orbitrap-MS/MS细胞代谢组学技术,初步探究了银杏黄酮苷元联合阿霉素协同抗肝癌的作用及机制,结果表明两者合用的协同抗肿瘤作用,可能与调控亮氨酸、酪氨酸和精氨酸等多种代谢靶点,进而影响肿瘤细胞的能量供应有关,这为银杏黄酮苷元在联合抗肿瘤方面的进一步开发应用提供了可能[6]。而在对不同侵袭性肿瘤细胞系的研究中,Nomura等发现多类肿瘤细胞系中,单酰基甘油含量较低而游离脂肪酸的含量较高,这是由于此类细胞中单酰基甘油脂肪酶的活性较高造成,因此,单酰基甘油脂肪酶可能成为抗肿瘤靶标的新选择[50-51],后续可进行相关药物的实验研究。
2.2 药物活性成分研究药物活性成分研究对于明确药物的作用机理,制定出合理的用量标准具有指导意义。尤其是中药成分复杂,明确其发挥药效的物质基础,是提高中药疗效、稳定中药质量、推动中药现代化进程的重要手段。吕经纬等基于NMR细胞代谢组学结合分子对接技术筛选补肾壮骨汤促睾酮合成的活性成分,明确了樱桃苷、原儿茶酸等14个化学成分可作为补肾壮骨汤促睾酮合成潜在活性成分,为此复方的药效物质基础研究提供了参考[52]。Feng等提出了一种基于靶向细胞代谢组学评价二至丸抗衰老效果并筛选有效提取物的新策略,指出石油醚提取物可能是二至丸抗衰老作用的潜在活性提取物,其作用途径与三羧酸循环和糖酵解代谢相关,这与体外实验结果一致[53]。Hao等结合细胞代谢组学和网络药理学技术,表明人参的免疫调节作用,可能与人参皂苷Re、人参皂苷Rg1以及山奈酚等活性成分对巨噬细胞的影响有关[54]。
2.3 药物机制探究作用机制研究是理解药物作用效应,从而更好地指导临床合理用药的重要环节,细胞代谢组学是在细胞水平上阐明药物作用生化途径的重要技术之一。栀子豉汤具有神经保护作用,Zhang等以GC-MS细胞代谢组学技术分析出谷氨酸、亮氨酸以及十八烷酸等多种代谢物,证明了栀子豉汤可通过恢复能量代谢,氨基酸代谢和脂质代谢等生物途径,发挥抗氧化和抗凋亡的作用[55]。艾迪注射液和阿霉素联合用药是临床肿瘤治疗的方案之一,Wang等基于UHPLC-MS/MS平台分析了两者联合抗肝癌的作用效果和机制,结果得出包括苯丙氨酸代谢、精氨酸生物合成、三羧酸循环和嘌呤代谢等7条生物途径被显著改变,证明了两者联合可通过平衡氨基酸和能量相关物质的代谢来发挥协同抗肿瘤作用[56]。Liao等建立了基于UPLC-QTOFMS的细胞代谢组学方法,揭示了红景天苷治疗缺氧损伤的机制可能与维持能量和脂质代谢的稳态有关[57]。Zhang等利用细胞代谢组学,研究了丹参对阿尔茨海默病的治疗机制,结果表明丹参可能通过调控精氨酸和脯氨酸代谢、谷胱甘肽代谢、丙氨酸天冬氨酸和谷氨酸代谢、组氨酸代谢、泛酸和辅酶A生物合成、苯丙氨酸酪氨酸和色氨酸生物合成、柠檬酸盐循环以及甘油磷脂代谢等生物途径发挥治疗作用,这为丹参在阿尔茨海默病疾病中的应用和进一步研究提供了理论依据[58]。
2.4 药物安全性评价毒性研究对于保证药物安全性至关重要,细胞代谢组学将细胞模型与系统生物学技术相结合,通过比较不同状态下代谢标志物的变化,为药物毒性研究提供了有利的支撑。Chaudhari等基于1H-NMR技术,对阿霉素诱导的心脏毒副作用进行分析,结果发现阿霉素可使正常细胞对丙酮酸和乙酸盐的利用率降低并造成甲酸盐的积累,进而导致能量产生不足和线粒体功能障碍,因此这些物质的变化可以用来评估阿霉素诱导的心脏毒性[59]。Wu等通过细胞代谢组学方法研究了伏立康唑治疗真菌干扰时诱导的肝毒性机制,结果表明伏立康唑诱导的肝毒性与氧化应激有关,且在毒性检测方面,由α-酮戊二酸、乙醇胆酸盐和β-N-乙酰氨基葡萄糖组成的代谢物组合优于常规肝功能检查[60]。Luo等使用HepG2细胞评估了栀子果的肝脏毒性,最终得出了与体内模型分析一致的结果,其中L-精氨酸、L-蛋氨酸、乙醇胆酸盐、5,6-二氢尿嘧啶、黄嘌呤和胸苷因其在体内和体外肝损伤模型中均有显著变化,可作为栀子果诱导肝损伤的首选生物标志物[61]。
综上所述,细胞代谢组学等高通量测序技术的发展,为全面了解与生物系统相关的生物学信息提供了可能。除了上述应用外,细胞代谢组学的研究还涉及细胞培养条件的优化、营养学研究、干细胞重编程研究以及环境科学研究等更多领域[23]。
3 展望
总体而言,细胞代谢组学在研究细胞中低分子量代谢物,进而理解代谢物如何影响细胞行为和功能方面有着重要意义。但作为一门新兴发展的科学,当前细胞代谢组学的应用仍面临挑战。首先,机体代谢物容易受到各种因素的影响,因此合理的实验方案对于保证代谢谱的真实性至关重要,对于不同类别的细胞代谢组学而言,合适细胞系的选择和标准化的细胞处理方案仍有待探索。其次,由于代谢物化学成分的异质性和现有分析仪器的特定局限性,全面代谢谱的获得仍需以多种分析平台的结合使用为前提。由于标准化合物不易获得且缺乏标准的可通用代谢数据库,生物标志物的识别鉴定也是代谢组学研究的难点之一,功能完善的代谢物数据库仍有待开发。再者,低丰度代谢物的检测和大量组学数据的正确分析是保证全面代谢谱,挖掘特异性生物标志物的前提,这对仪器的性能(如灵敏度和分辨率)和数据处理方法提出了更高的要求,值得关注。此外,细胞代谢组学和其它技术方法的有效整合(如与其它组学的整合以及体内动物模型的整合等)有助于理解复杂生物问题,也是需要研究的方向。总之,细胞代谢组学为生物学研究提供了非常有价值的信息,随着技术的不断完善和应用领域的不断扩展,其前景必将十分广阔。

