我院维持性血液透析和腹膜透析患者的血管钙化情况比较
白丽 秦纪平 荆力宝 黄红燕 朱淳
慢性肾脏病(chronic kidney disease,CKD)已被公认为全球主要的公共卫生问题,而且患病率也呈逐年升高的趋势,已经成为各个国家沉重的经济负担,目前我国成人CKD 患病率高达10.8%,患病人数高达1.2 亿人[1]。而终末期肾脏病常见的死亡原因为不良心血管事件,血管钙化极易导致终末期肾脏病患者出现不良心血管事件,血管钙化会引起动脉硬化,表现为动脉中膜的硬化,从而引起血管壁僵硬,血管顺应性降低,收缩压、平均动脉压升高,最终引起左心室肥厚、心功能下降、心力衰竭,引发不良心血管事件[2]。血管钙化是CKD 患者心血管疾病死亡率和全因死亡率增加的独立危险因素[3]。对于终末期肾脏病患者而言,腹膜透析(peritoneal dialysis,PD)和维持性血液透析(maintenance hemodialysis,MHD)是目前主要的两种替代治疗方式,两种治疗方式各有优势,血液透析在专门的透析中心进行治疗,2~3 次/周,4~6 h/次,由专业的护士来操作,对患者本人的操作没有要求,但对其心功能有一定要求,不同类型的治疗模式,可以清除不同分子大小的毒素;PD 有利于患者残余肾功能(residual renal function,RRF)的保护,且每日均可进行,对容量的控制和毒素的清除更加有利,但易于丢失白蛋白,且易出现腹膜炎。本研究通过搜集两种肾脏替代治疗方式患者的临床资料以及心脏瓣膜钙化、腹主动脉钙化情况的数据,比较两种透析方式下血管钙化的发生情况。
1 资料与方法
1.1 一般资料 选取2019 年1 月~2022 年1 月在上海新华医院崇明分院进行规律肾脏替代治疗的223 例终末期肾脏病患者,按照透析方法的不同分为MHD 组(165 例)和PD 组(58 例)。纳入标准:①年龄18~80 岁;②终末期肾脏病,目前在本院接受MHD 和PD,透析龄>1 年;③签署知情同意书。排除标准:①患有恶性肿瘤,或在筛选期30 d 内接受其他的临床试验;②怀孕或哺乳期患者。本研究经上海新华医院崇明分院伦理委员会批准。
1.2 方法
1.2.1 生化指标检测 患者入组时立即进行实验室检查,包括甲状旁腺激素(parathyroid hormone,PTH)、β2微球蛋白(β2-microglobulin,β2-MG)、超敏C 反应蛋白(high sensitive C-reactive protein,hs-CRP)、白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、血钙、血磷、血镁、血白蛋白、甘油三酯、总胆固醇、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇、脂蛋白a 等。
1.2.2 腹主动脉钙化评分(AAC) 患者入组当天检查腰椎侧位X 线片,并采用半定量积分法对患者第1~4 节腰椎对应的腹主动脉钙化情况进行评分。根据腹主动脉前壁和后壁钙化斑块的长度给予评分(0~3 分),其中0 分:无钙化;1 分:钙化范围小于动脉壁长度的1/3;2 分:钙化范围累及动脉壁长度的1/3~2/3;3 分:钙化范围大于动脉壁长度的2/3。每节腰椎对应的腹主动脉部分最高积6 分,总积分为24 分。由2 位不知情且富有经验的放射科医生独立进行腹主动脉钙化评分,最后取两个数值的平均分作为最后评分,根据总积分结果,将患者分为无钙化(0 分)、轻度钙化(1~4 分)、中度钙化(5~15 分)、重度钙化(≥16 分)。
1.2.3 心脏瓣膜钙化情况 由1 位不知情且富有经验的超声科医生进行心脏瓣膜钙化情况及左心室射血分数测定,其中有血管钙化评为1 分,无血管钙化评为0 分。
1.3 统计学方法 采用SPSS26.0 统计学软件进行统计分析。计量资料以均数±标准差()表示,采用t检验;计数资料以率(%)表示,采用χ2检验;等级计数资料采用秩和检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1 两组患者临床资料及生化指标比较 两组患者年龄、性别、透析时间、原发病、服用药物情况及IL-6、β2-MG、hs-CRP、TNF-α、血钙、甲状旁腺激素、血镁、甘油三酯、总胆固醇、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇水平比较,差异无统计学意义(P>0.05);PD 组收缩压、舒张压、血磷、脂蛋白a、血白蛋白均低于MHD 组,差异有统计学意义(P<0.05)。见表1。
表1 两组患者临床资料及生化指标比较[ ,n(%)]

表1 两组患者临床资料及生化指标比较[ ,n(%)]
注:与MHD 组比较,aP<0.05
2.2 两组患者腹主动脉钙化情况比较 PD 组患者腹主动脉钙化情况优于MHD 组,差异有统计学意义(P<0.05)。见表2。
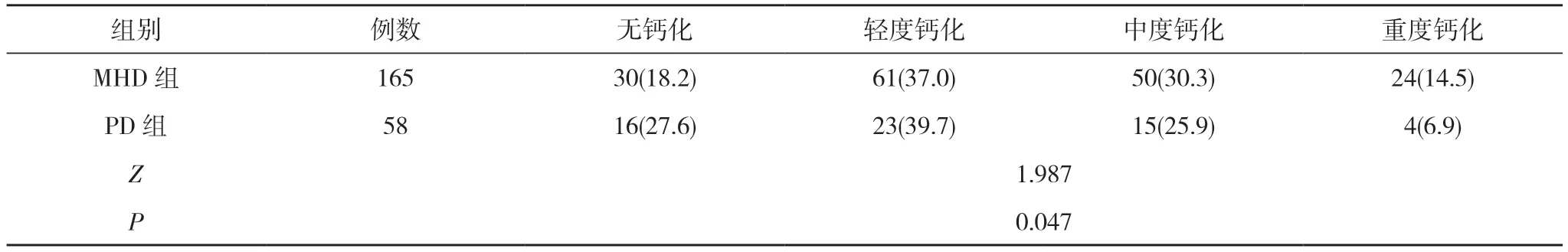
表2 两组患者腹主动脉钙化情况比较[n(%)]
2.3 两组患者心脏瓣膜钙化、左心室射血分数<60%及不良心血管事件发生率比较 PD 组心脏瓣膜钙化发生率为41.4%,左心室射血分数<60%发生率为17.2%,不良心血管事件发生率为13.8%;MHD 组心脏瓣膜钙化发生率为58.2%,左心室射血分数<60%发生率为30.9%,不良心血管事件发生率为26.7%。PD 组心脏瓣膜钙化、左心室射血分数<60%及不良心血管事件发生率均低于MHD 组,差异具有统计学意义(P<0.05)。见表3。
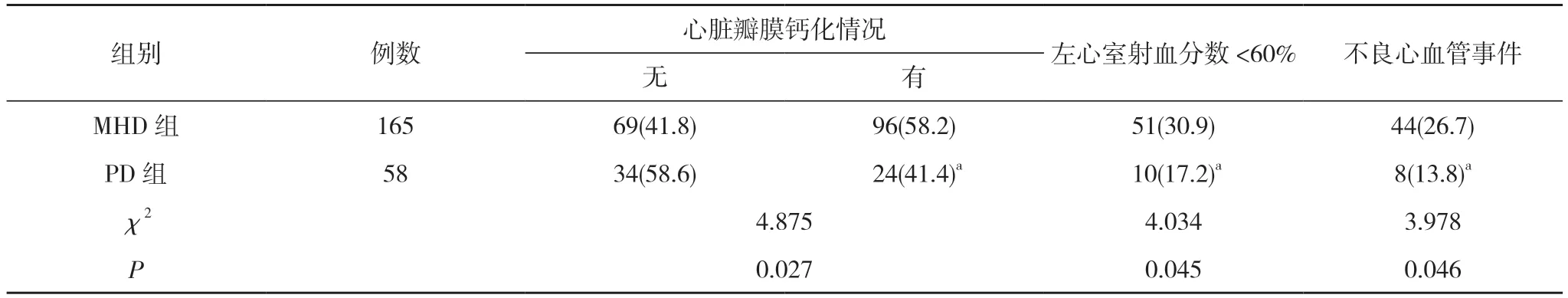
表3 两组患者心脏瓣膜钙化、左心室射血分数<60%及不良心血管事件发生率比较[n(%)]
3 讨论
终末期肾脏病患者的死亡原因主要是心脑血管事件,透析患者的心血管疾病死亡风险远远高于普通人群,是普通人群的5~30 倍[4]。尿毒症心肌病也成为CKD 患者最为常见的心血管并发症和首位的死亡原因,主要表现为心肌肥大、变性和心肌间质纤维化[5]。血管钙化的严重程度与心脑血管事件的发生呈正相关,所以明确哪些因素与血管钙化有关,及早且能有效控制,对于减少血管钙化的发生、延缓进展非常重要。透析患者血管钙化目前已知与高龄、男性、长透析龄、糖尿病、高血压、吸烟、饮酒、高磷血症、高钙血症、甲状旁腺功能亢进、使用高剂量维生素D、炎症和低白蛋白血症等均有关系,但以上因素在造成血管钙化严重性中的权重却不是很明确。高磷血症是由终末期肾脏病患者机体离子紊乱引发的,其可直接导致血管钙化的出现,是促进和发生血管钙化的主要诱因[6],在心血管钙化发生、发展中起着重要的作用,被认为是预测冠状动脉钙化及心脏瓣膜钙化的独立危险因素。高磷酸盐不仅可以直接引起血管钙化,还会引起继发性甲状旁腺功能亢进,机体的高甲状旁腺激素水平进一步使得成纤维细胞生长因子-23 的水平升高进而促进血管钙化[7-9]。在本研究中发现,PD 组患者血磷及心脏瓣膜钙化、左室射血分数下降<60%、不良心血管事件发生率均低于MHD 组,且腹主动脉钙化情况优于MHD 组,差异具有统计学意义(P<0.05)。提示MHD 患者血管钙化发生率更高、更严重,也印证了高磷血症可引起、加重血管钙化,血管钙化严重的患者不良心血管事件的发生率更高,远期死亡率可能也更高[10-12]。
高血压可直接引起动脉粥样硬化、血管钙化,导致冠心病、脑血管疾病、血栓栓塞性疾病等缺血性心脑血管事件的发生,血容量控制不佳可以导致和加重高血压,PD 患者每日均可进行治疗,且能较好的保护残余肾功能,而MHD 患者治疗时间为10~12 h/周,水分的清除为间断性,治疗间期血容量控制不佳可加重高血压。在本次研究中也发现,PD 组的收缩压及舒张压均低于MHD 组,也能说明这点。
在本次研究中发现,PD 组脂蛋白a 低于MHD 组,差异有统计学意义(P<0.05)。脂蛋白a 水平是一种脂蛋白颗粒,可能作为促进血管钙化和促炎因子的运载载体,当内皮细胞损伤后(机械应力损伤心脏瓣膜的瓣叶或动脉粥样硬化斑块)被诱导时,脂蛋白a 携带氧化磷脂、酶、自体生长蛋白到损伤区域,而这些物质可以增强这些病变的钙化过程。最近的研究也发现脂蛋白a 在主动脉瓣狭窄过程中的作用涉及核因子-κB(NF-κB)级联反应,它可诱导IL-6、骨形态发生蛋白2(BMP2)和RUNX2[13-15]。
在本次研究中发现,PD 组血白蛋白低于MHD 组,差异有统计学意义(P<0.05)。营养状况较MHD 组差。PD 可以流失人血白蛋白,特别是PD 相关性腹膜炎时导致腹膜通透性高,更容易丢失白蛋白,故导致PD 患者更容易出现低蛋白血症。
综上所述,心脏瓣膜钙化和腹主动脉钙化在MHD与PD 患者中较为普遍,PD 患者每日均进行透析,能更好的清除毒素和水分,控制血压,能更好的改善钙磷代谢紊乱,降低血管钙化的发生,但更容易丢失血白蛋白,营养状况较差。MHD 患者腹主动脉钙化情况更严重,且心力衰竭、心肌梗死、急性冠状动脉综合征、恶性心律失常等不良心血管事件的发生率较高,至于血管钙化进展情况以及患者生活质量和远期生存率有待于后续的观察。

