急性Stanford A 型主动脉夹层术后死亡的危险因素分析
潘兴纳 蒲磊 梁荣鑫 李伯海 钟志敏
在心血管疾病中主动脉夹层是一种常见的、严重的突发性疾病,可随着病情发展威胁其生命健康。随着对主动脉夹层的不断深入研究,依据内膜口部位的病变情况,临床上将主动脉夹层分为Stanford A 型和Stanford B 型。其中,Stanford A 型最为常见,其发病十分凶险,并且预后效果较差。临床研究发现[1],Sanford A 型主动脉夹层在发病2 d 内的死亡率以1%/h的速度递增。目前,对Stanford A 型主动脉夹层的治疗以置换夹层血管等手术为主,可以有效提高患者生存率。若未进行及时有效治疗,其2 周内的死亡率将超过70%,死亡率极高。此外,尽管对Sanford A 型主动脉夹层进行及时有效手术治疗,但术后1 个月的死亡率仍在1%~20%,这与术后并发症等因素有关[2,3]。因此,急性Stanford A 型主动脉夹层术后如何对死亡危险因素进行有效预防,对于更好地提高预后效果及生存率均有十分重要的意义,是优化手术治疗的重要依据。因此,本文以本院2020 年1 月~2021 年12 月收治的120 例急性Stanford A 型主动脉夹层患者作为研究对象,分析术后死亡的危险因素,结果报告如下。
1 资料与方法
1.1 一般资料 选取本院2020 年1 月~2021 年12 月收治的120 例急性Stanford A 型主动脉夹层患者作为研究对象,根据患者术后是否死亡分为存活组(105 例)和死亡组(15 例)。其中,男82 例,女38 例;年龄29~71 岁,平均年龄(48.73±8.62)岁;体质量46~87 kg,平均体质量(58.12±10.58)kg。纳入标准:①经医学影像等诊断确诊为急性Stanford A 型主动脉夹层者;②无严重肝肾等脏器异常者;③无其他恶性肿瘤者。排除标准:①外伤所致的急性Stanford A 型主动脉夹层者;②合并有严重免疫系统或血液系统疾病者;③合并有严重凝血功能等障碍者;④临床资料不完整者。本次研究经患者及其家属同意,并报院伦理会审批通过。
1.2 方法 回顾性分析统计120 例急性Stanford A 型主动脉夹层患者的一般资料(年龄、性别、既往病史、合并症等);观察记录患者相关检测指标(心功能、D-二聚体、肾功能等)结果及相关手术指标、时间及术后并发症等内容。以患者是否生存为因变量,以患者一般资料、相关检测指标及术后并发症等作为自变量,分析急性Stanford A 型主动脉夹层患者术后死亡的危险因素。见表1。

表1 自变量赋值表
1.3 统计学方法 采用SPSS22.0 统计学软件进行数据统计分析。计量资料以均数±标准差 ()表示,采用t检验;计数资料以率(%)表示,采用χ2检验;危险因素采用Logistic 回归分析。P<0.05 表示差异具有统计学意义。
2 结果
2.1 急性Stanford A 型主动脉夹层术后死亡的单因素分析 死亡组年龄≥60 岁、D-二聚体水平≥90 mg/L、体外循环时间≥270 min、术后并发症占比均高于存活组,差异具有统计学意义(P<0.05)。两组合并高血压、伴心功能不全、合并冠心病、输血量、手术时间、脑缺氧时间比较,差异无统计学意义(P>0.05)。见表2。
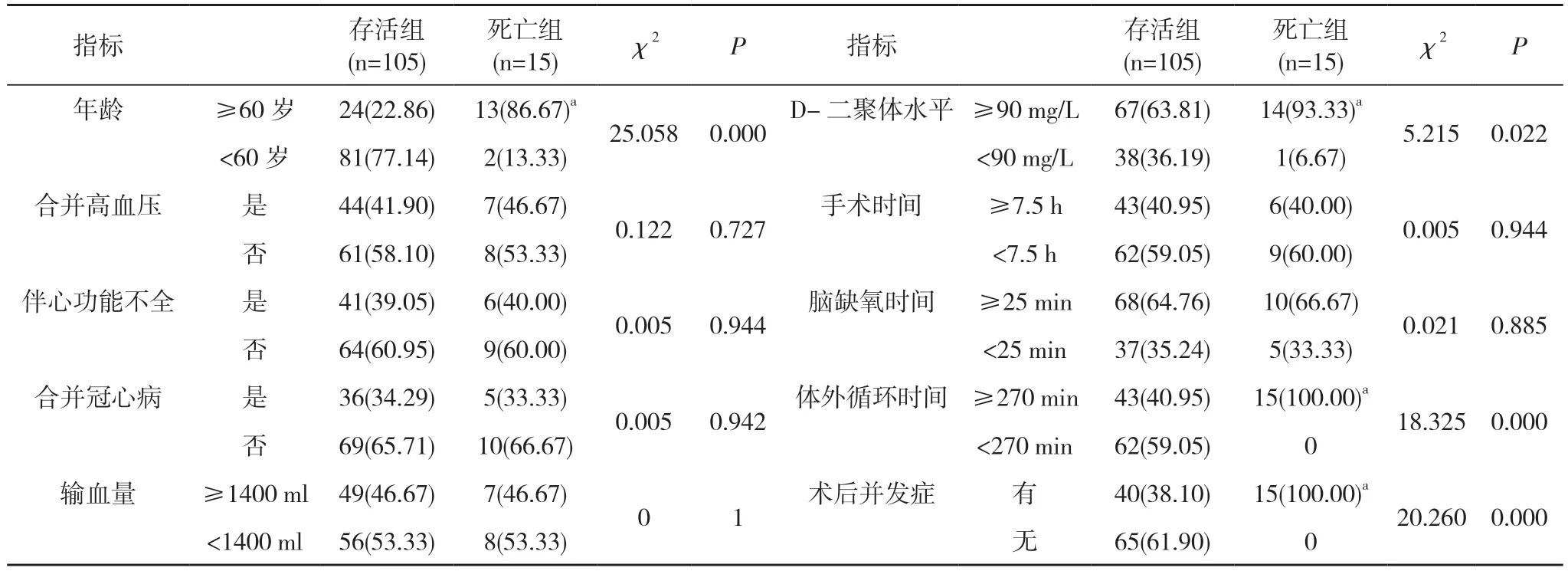
表2 急性Stanford A 型主动脉夹层术后死亡的单因素分析[n(%)]
2.2 急性Stanford A 型主动脉夹层术后死亡的危险因素分析 Logistic 回归分析显示,年龄、D-二聚体水平、体外循环时间和术后并发症是急性Stanford A 型主动脉夹层术后死亡的危险因素(OR=4.162、5.715、5.487、5.953,P<0.05)。见表3。
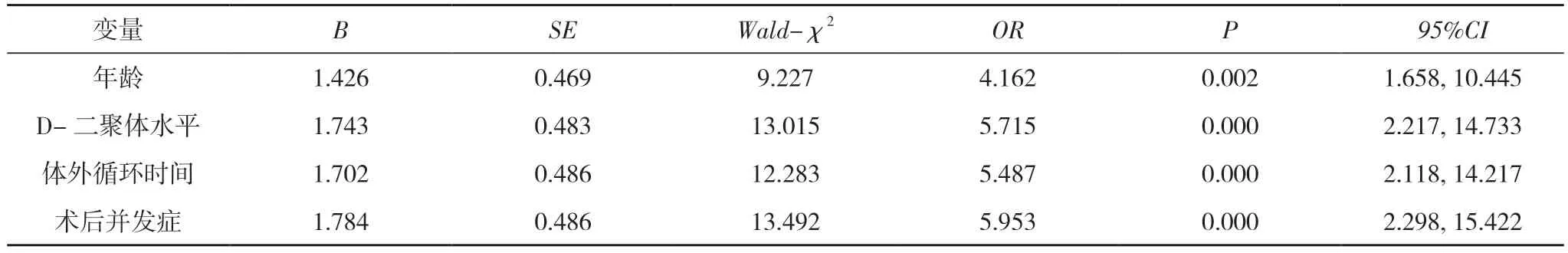
表3 急性Stanford A 型主动脉夹层术后死亡的危险因素分析
2.3 急性Stanford A 型主动脉夹层术后死亡危险因素对术后生存的预测作用 ROC 曲线分析显示:各危险因素联合预测效能均明显高于年龄、D-二聚体水平、体外循环时间及术后并发症(AUC=0.925、0.732、0.872、0.763、0.853,P<0.05);各危险因素联合预测的敏感度、特异度均明显高于年龄、D-二聚体水平、体外循环时间、术后并发症单一预测的敏感度与特异度,差异有统计学意义(P<0.05)。见表4,图1。
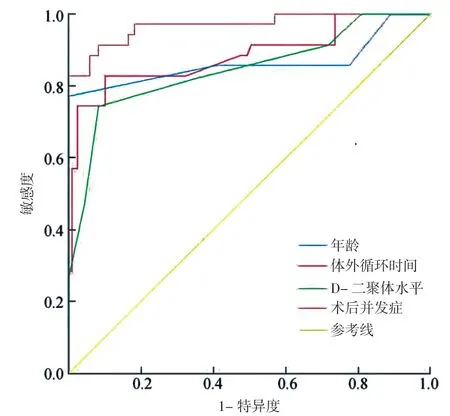
图1 各危险因素对术后生存预测的ROC 曲线
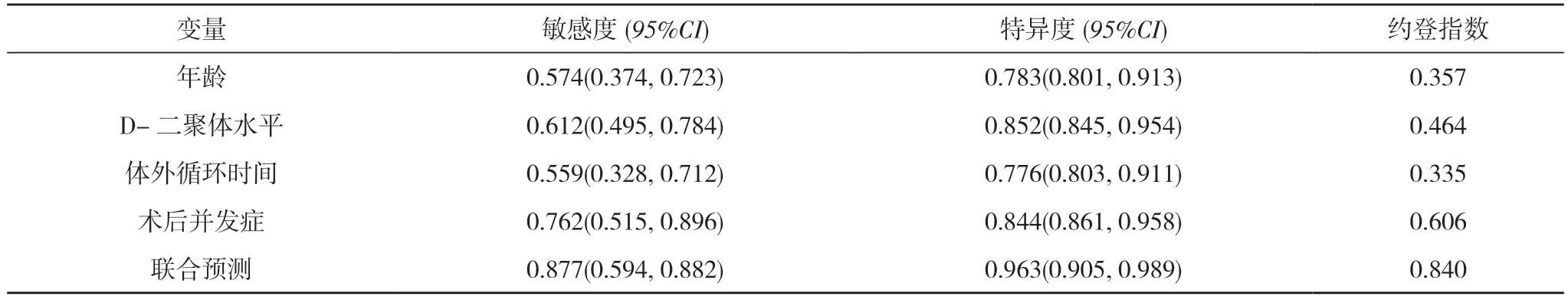
表4 各危险因素对术后生存的预测效能
3 讨论
我国是主动脉夹层的高发国家,这与现代人的饮食方式、生活习惯改变等有关。目前,临床依据内膜破口部位及病变情况对主动脉夹层进行了分类,分为Stanford A 型和Stanford B 型。其中Stanford A 型最为常见,其发病十分凶猛,死亡率较高,并且患者的预后不理想,可严重影响患者正常机能及生活[4,5]。虽然,对Stanford A 型主动脉夹层及时进行有效手术治疗可提高患者的生存率,但受术后并发症等因素影响,可导致患者在1 个月内出现死亡。为此,为更好地预防Stanford A 型主动脉夹层术后死亡情况,术后死亡相关因素的分析尤为重要,是当前研究的重要内容。
本文研究结果显示,Logistic 回归分析显示,年龄、D-二聚体水平、体外循环时间和术后并发症是急性Stanford A 型主动脉夹层术后死亡的危险因素(OR=4.162、5.715、5.487、5.953,P<0.05)。分析原因为:①年龄。对于年龄较大的Stanford A 型主动脉夹层患者而言,身体机能明显退化,并且多伴有高血压、心功能不全等情况,这也就导致患者机体出现血液灌注不足等情况。在手术治疗后机体出现不可逆损伤及并发症,极易导致年龄较大患者的死亡[6,7]。故而,年龄成为术后死亡的危险因素。为此,对于年龄≥60 岁的患者,要在术后密切关注其生命体征等情况,并且基于相关既往病史,及时做好预防,提高患者术后生存率[8]。②D-二聚体水平。D-二聚体是对急性Stanford A 型主动脉夹层病变诊断及病变累及范围判断的重要指标。研究发现[9,10],D-二聚体水平的升高说明急性Stanford A 型主动脉夹层的病变累及范围处于持续扩大状态,可为病情判断提供依据。本文研究结果显示,D-二聚体水平≥90 mg/L 可对患者术后效果造成较大影响。故而,在患者术后应注重D-二聚体异常水平的检测,通过灌注新鲜血小板的方法实现对凝血因子的有效补充,实现纤维-凝血系统的平衡[11,12]。③体外循环时间。在本次研究中,体外循环时间≥270 min是急性Stanford A 型主动脉夹层术后死亡的危险因素。对于人体而言,体外循环的程度、时间是确保血液灌注维持的重要基础。在体外循环时间≥270 min 的情况下,可对人体炎性反应形成激活作用,并且部分患者可出现凝血功能损伤及代谢性酸中毒,这均可以导致患者并发症发生,故而导致患者死亡率增加[13,14]。对于急性Stanford A 型主动脉夹层术后的护理,应加强对患者生命体征变化、血气、尿量、心电图、出凝血时间、神志、肌力等的密切观察,有效缩短体外循环时间,降低相关并发症发生,以此降低死亡率[15]。④术后并发症。临床研究发现,急性Stanford A 型主动脉夹层术后并发症较多,主要包括呼吸衰竭、肾衰竭、出血、神经系统等并发症,可对患者生命形成较大威胁。一方面,手术的创伤较大,对于部分患者手术可导致弥散性渗血等情况发生,导致术中失血量增加,影响机体循环功能[16];另一方面,术后神经系统并发症比较常见,故而术后应密切关注患者的神志、瞳孔、肌力等变化情况[17]。此外,Stanford A 型主动脉夹层手术复杂,术后极易出现呼吸衰竭等并发症,故而在术后应密切关注患者生命体征、肺部情况,并根据血气、胸片等检查结果调整呼吸机参数,更好地改善患者术后气体交换功能,并做好呼吸道护理[18]。急性肾功能不全也是术后常见并发症,这主要是由于Stanford A 型主动脉夹层术后患者易并发心力衰竭,故而出现肾灌注量不足等问题[19,20]。因此,在术后48 h 应密切监测患者肾功能、尿量,以降低急性肾功能不全的发生率。
综上所述,年龄、D-二聚体水平、体外循环时间、术后并发症是急性Stanford A 型主动脉夹层术后死亡的危险因素,应强化死亡相关因素的预防,并且通过对死亡相关因素的预测,对手术治疗效果和预后进行科学评估,进而为术后临床治疗和护理提供科学依据,具有重要的研究价值。
——体外循环质量控制的基石

