预充式导管冲洗器的生物相容性评价
张 磊,叶小惠,周 宙
(安徽省食品药品检验研究院,合肥 230051)
0 引言
随着我国医疗卫生行业的不断进步和发展,患者和医护人员的安全卫生意识逐步提升,静脉留置针在临床上的使用率逐年增高。在静脉留置针的使用过程中,冲管、封管是非常重要的环节,只有正确进行冲管和封管操作才能确保输液通畅、安全。预充式导管冲洗器是一种无针化、可预充0.9%氯化钠注射液的导管冲洗装置,其设计的活塞锁止环能有效防止血液回流,可以有效、安全地封管,因此预充式导管冲洗器备受广大患者和医护人员的青睐[1-2]。近年来,各国监管部门越来越重视医疗器械的生物学评价,尤其在ISO 10993-1:2018发布及实施后,国内的医疗器械生物学评价工作进入高速发展期[3]。为了预测预充式导管冲洗器在与人体间接接触过程中可导致的潜在不良反应,有必要对其进行一系列的生物学性能评价。本研究参考GB/T 16886.1—2011[4]生物学评价总则,拟通过细菌内毒素试验、热原试验、体外细胞毒性试验、溶血试验、凝血试验、皮肤致敏试验、皮内刺激试验及急性全身毒性试验来评价预充式导管冲洗器的生物相容性,以期为预充式导管冲洗器的质量控制提供参考。
1 材料和方法
1.1 材料
一次性预充式导管冲洗器,由安徽省某生物技术有限公司提供。其他涉及材料包括小鼠成纤维细胞L-929(中国科学院典型培养物保藏中心昆明细胞库)、改良的Eagle培养基(Gibco)、弗氏完全佐剂(Sigma)、棉籽油(J&K)、胎牛血清(Gibco)等。
1.2 试验动物
普通白化豚鼠30只,体质量300~500 g,由南京市浦口区莱芙养殖场提供[SCXK(苏)2019-0005];无特定病原体级小鼠20只,体质量18~22 g,由北京斯贝福生物技术有限公司提供[SCXK(京)2019-0010];新西兰兔6只,体质量>2.0 kg,由南京市浦口区莱芙养殖场提供[SCXK(苏)2019-0005]。所有试验动物饲养于本院动物房[SYXK(皖)2020-005],饲养条件均为温度21~26℃、相对湿度40%~70%、换气次数>8次/h、12 h光照与12 h黑暗。
1.3 仪器设备
仪器设备包括生物安全柜(BSC-1604IIA2)、立式高压灭菌器(YM50)、紫外可见分光光度计(Cary 60)、全自动血凝仪(ACL Elite Pro)、倒置荧光显微镜(CKX41)、二氧化碳细胞培养箱(Thermo3111)、酶标仪(Synergy2)、细菌内毒素凝胶法测定仪(ET-96)、智能热原仪(ZRY-2D)。
1.4 试验方法
1.4.1 细菌内毒素试验
在无菌环境下,将预充式导管冲洗器内的氯化钠注射液经无菌操作全部排出作为供试品溶液,参照《中华人民共和国药典:四部》(2020年版)通则1143“细菌内毒素检查法”进行试验[5],选择凝胶法。根据细菌内毒素含量应<0.5 EU/mL的要求,按照表1制备供试品管溶液、供试品阳性管溶液、阳性对照管溶液和阴性对照管溶液,每组平行2管。将全部试管置于细菌内毒素凝胶法测定仪上,在37℃下保温60 min后,观察试验结果,未形成凝胶并从管壁滑落为阴性,且预充式导管冲洗器内的0.9%氯化钠注射液的细菌内毒素含量应<0.5 EU/mL。

表1 细菌内毒素试验溶液的制备方法
1.4.2 热原试验
在无菌环境下,将预充式导管冲洗器内的氯化钠注射液经无菌操作全部排出作为供试品溶液,参照《中华人民共和国药典:四部》(2020年版)通则1142“热原检查法”进行试验[5]。选取3只新西兰兔,根据新西兰兔体质量按10 mL/kg由耳缘静脉注射供试品溶液,注射后每隔30 min测量一次温度,连续测量6次,取6次温度中最高的一次温度减去注射前温度,记录为最大温升。每只新西兰兔体温升高不得超过0.6℃,3只新西兰兔体温升高总和不得超过1.3℃。
1.4.3 体外细胞毒性试验
参照GB/T 16886.12—2017中的试验方法[6],取不含0.9%氯化钠注射液的导管冲洗器,以含10%胎牛血清的改良的Eagle培养基为浸提介质,按照每0.2 g加入1 mL浸提介质的比例,在37℃条件下浸提24 h,制备供试品溶液1。再取含0.9%氯化钠注射液的预充式导管冲洗器,于37℃条件下浸提24 h后,将预充式导管冲洗器内的0.9%氯化钠注射液作为供试品溶液2,另设置空白对照液(同批浸提介质)、阴性对照液(高密度聚乙烯)和阳性对照液(5 g/L苯酚)。参照GB/T 16886.5—2017附录C中的噻唑蓝比色法[7],选用小鼠成纤维细胞L-929,分别将待测样品加入到已接种细胞的96孔板中,在37℃、5%CO2条件下培养24 h后,观察细胞形态。吸出培养液加入噻唑蓝溶液50 μL,继续培养2 h后除去噻唑蓝溶液加入异丙醇100 μL,轻微震荡后在570 nm处测量吸光度,并根据以下公式计算细胞存活率:细胞存活率>70%则视为无潜在细胞毒性风险。

1.4.4 溶血试验
参照GB/T 16886.4—2003中的试验方法[8],取不含0.9%氯化钠注射液的导管冲洗器,剪碎待用。试验前采集健康新西兰兔心脏血20 mL配制成新鲜抗凝兔血稀释液备用。设置阴性对照组、阳性对照组和供试品组,在阴性对照组的3支试管中分别加入10 mL 0.9%氯化钠注射液,阳性对照组的3支试管中各加入10 mL纯化水,供试品组的3支试管中各加入导管冲洗器碎块5 g及10 mL 0.9%氯化钠注射液。将所有试管于37℃恒温水浴箱中静置30 min,然后每管加入新鲜抗凝兔血稀释液0.2 mL,轻轻混匀后继续保温60 min。倒出管内液体,以800g的离心力离心5 min,取上清液用紫外可见分光光度计测量吸光度(波长为545 nm),并根据以下公式计算溶血率:溶血率应低于5%。

1.4.5 凝血试验
参照GB/T 16886.4—2003中的试验方法[8],取不含0.9%氯化钠注射液的导管冲洗器,剪碎待用。取新西兰兔动脉血后离心收集贫血小板血浆(PPP)。设置供试品组、对照品组及空白组,每组6支试管。供试品组的每支试管按照0.2 g/mL比例加入导管冲洗器碎块和PPP,对照品组的每支试管按照0.2 g/mL比例加入剪碎的市售同类型导管冲洗器碎块和PPP,空白组的每支试管仅加入PPP。将全部试管封闭置于37℃恒温水浴箱中保持15 min,然后转移至全自动血凝仪专用测试杯中,采用试剂盒在全自动血凝仪上检测各组的凝血酶原时间(PT)。
1.4.6 皮肤致敏试验
参照GB/T 16886.12—2017中的试验方法[6],取不含0.9%氯化钠注射液的导管冲洗器,剪碎待用。分别以0.9%氯化钠注射液和棉籽油为浸提介质,按照0.2 g/mL的比例,在37℃条件下浸提72 h,制备0.9%氯化钠注射液样品浸提液和棉籽油样品浸提液。取同批号0.9%氯化钠注射液和棉籽油,不加剪碎的导管冲洗器碎块,分别于37℃条件下保持72 h,记为空白溶剂对照液。选用30只白化豚鼠,随机分为2组,每组15只(其中样品浸提液组10只、空白溶剂对照组5只),参照GB/T 16886.10—2017中的方法[9],采用豚鼠最大剂量试验(guinea-pig maximization test,GPMT),试验前剃除白化豚鼠背部区域毛发,在其背部两侧部位进行皮内注射诱导,注射部位如图1所示。A部位左右两侧样品浸提液组分别注射含50%样品浸提液、50%弗氏安全佐剂的混合液,空白溶剂对照组分别注射50%空白溶剂对照液、50%弗氏安全佐剂的混合液;B部位左右两侧样品浸提液组分别注射样品浸提液,空白溶剂对照组仅注射相应空白对照溶剂;C部位左右两侧样品浸提液组分别注射含25%样品浸提液、25%弗氏安全佐剂、50%空白溶剂对照液的混合液,空白溶剂对照组分别注射空白溶剂对照液与弗氏安全佐剂配制成的乳化剂。皮内注射7 d后在白化豚鼠背部两侧区域进行局部敷贴诱导,48 h后去除敷贴片。局部敷贴诱导结束后14 d剃除白化豚鼠腹部毛进行激发。最后在除去腹部敷贴片24 h和48 h后观察腹部皮肤的红斑和水肿情况,对样品浸提液组和空白溶剂对照组白化豚鼠激发部位的皮肤情况进行分级。
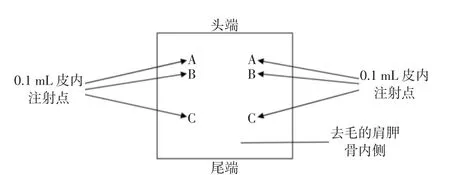
图1 皮内注射部位
1.4.7 皮内刺激试验
参照GB/T 16886.12—2017中的试验方法[6],取不含0.9%氯化钠注射液的导管冲洗器,剪碎待用。分别以0.9%氯化钠注射液和棉籽油为浸提介质,按0.2 g/mL的比例在37℃条件下经72 h制备2种样品浸提液,并在相同条件下制备0.9%氯化钠注射液和棉籽油的溶剂对照液。参照GB/T 16886.10—2017中的方法[9],选用3只体质量大于2.0 kg的新西兰兔,试验前在兔脊柱两侧部位剃毛,4 h后在两侧部位进行皮内注射,一侧10个注射点,每点注射0.2 mL。一侧前5个点注射由0.9%氯化钠注射液制备的样品浸提液,后5个点注射其溶剂对照液。另一侧前5个点注射由棉籽油制备的样品浸提液,后5个点注射其溶剂对照液。注射后立刻观察新西兰兔注射部位的皮肤状况,且分别在24、48和72 h记录注射部位皮肤状况。根据皮内反应记分系统分别计算出2种样品浸提液与其溶剂对照液注射部位的总平均记分之差,对供试品在该试验条件下产生的刺激反应潜能做出评定。
1.4.8 急性全身毒性试验
参照GB/T 16886.12—2017中的试验方法[6],取不含0.9%氯化钠注射液的导管冲洗器部分,分别以0.9%氯化钠注射液和棉籽油为浸提介质,按照0.2 g/mL比例在37℃条件下经72 h制备样品浸提液。取同批号0.9%氯化钠注射液和棉籽油在相同条件下制备溶剂对照液。选用无特定病原体级小鼠20只,5只尾静脉注射0.9%氯化钠注射液浸提液、5只尾静脉注射0.9%氯化钠注射液对照液(作为样品浸提液组),5只腹腔注射棉籽油浸提液、5只腹腔注射棉籽油对照液,注射剂量为50 mL/kg(作为溶剂对照组)[10]。注射完毕后,观察小鼠的即时反应,并于4、24、48和72 h观察和记录各组小鼠的反应,包括所有小鼠状态和死亡数量,最后于72 h记录临床毒性表现和小鼠死亡数量。
2 结果
2.1 细菌内毒素试验
将所有试管缓慢倒转180°,可见供试品阳性管和阳性对照管管内均形成凝胶,且凝胶不变形、不滑落,结果为阳性。供试品管和阴性对照管管内均未形成凝胶,结果为阴性。预充式导管冲洗器内的0.9%氯化钠注射液的细菌内毒素含量<0.5 EU/mL,符合安全性要求。
2.2 热原试验
热原试验结果详见表2。试验中的3只新西兰兔体温升高分别为0.00、0.00和0.28℃,均未超过0.6℃,体温升高总和为0.28℃,远远低于1.3℃。结果表明,预充式导管冲洗器内的0.9%氯化钠注射液无致热作用,符合安全性要求。
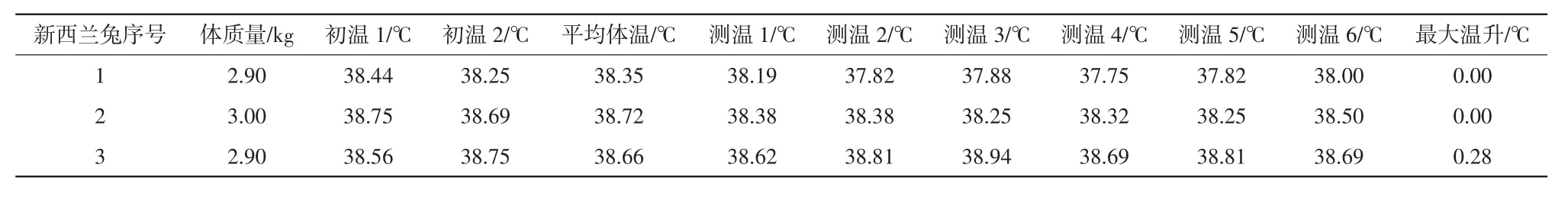
表2 热原试验结果
2.3 体外细胞毒性试验
体外细胞毒性试验显微镜观察结果如图2所示。空白对照液和阴性对照液的细胞形态均正常,无明显形态学方面的改变,贴壁生长良好。供试品溶液1和供试品溶液2的细胞形态均正常,呈菱形或不规则三角形,贴壁生长良好。阳性对照液的细胞皱缩,呈圆形,细胞层几乎完全破坏。各溶液的细胞存活率比较结果如图3所示。供试品溶液1和供试品溶液2的细胞存活率分别为92%和94%,均大于70%,细胞毒性分级均为1级,阴性对照液细胞存活率为98%,阳性对照液细胞存活率为12%。结果显示,试验成立且样品无潜在细胞毒性风险。
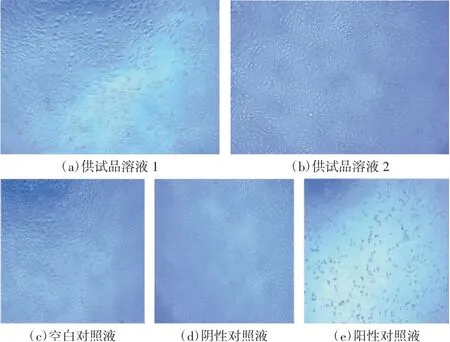
图2 体外细胞毒性试验显微镜观察结果
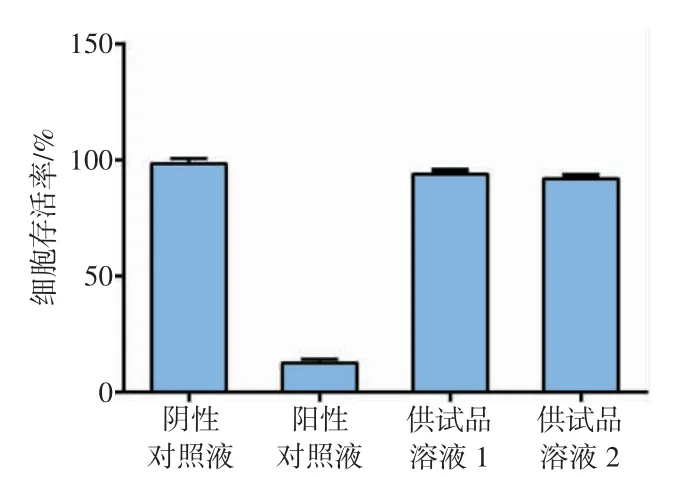
图3 体外细胞毒性试验中各溶液的细胞存活率比较结果
2.4 溶血试验
离心后观察各组试管,其中阴性对照组和供试品组试管内的上清液澄清透明,红细胞沉底。阳性对照组试管内的红细胞破裂分散于溶液中,溶液鲜红。经计算可得溶血率为0.59%,远低于5%。结果显示,溶血率符合产品安全性要求。
2.5 凝血试验
空白组、对照品组与供试品组的PT比较结果如图4所示,供试品组与对照品组的PT差异无统计学意义(P>0.05)。结果显示,预充式导管冲洗器未导致凝血发生,具有良好的血液相容性。

图4 凝血试验中各组PT比较结果
2.6 皮肤致敏试验
在除去敷贴片后24 h和48 h观察期内,样品浸提液组和空白溶剂对照组白化豚鼠腹部的皮肤均未出现红斑、焦痂或水肿情况,如图5所示。根据Magnusson和Kligman分级标准,样品浸提液组与空白溶剂对照组的分级均为0,试验中未发生皮肤致敏反应,符合安全性要求。
图5 皮肤致敏试验结果
2.7 皮内刺激试验
在72 h观察期内,对每只新西兰兔注射部位的皮肤进行观察,2种样品浸提液和其溶剂对照液注射部位的皮肤均无明显异常现象,如图6所示。根据皮内反应记分系统记分,2种样品浸提液与其溶剂对照液平均记分之差均为0,未见皮肤刺激现象。
图6 皮内刺激试验结果
2.8 急性全身毒性试验
在72 h观察期内,样品浸提液组和其溶剂对照组的小鼠均没有发生死亡现象,临床观察所有小鼠的呼吸、肌肉运动、痉挛和反射等症状均正常,没有明显异常的情况出现,同时小鼠的体质量普遍增加,未见小鼠明显急性全身毒性反应。
3 讨论
目前,临床上大部分病患都需要通过外周或者中心静脉置管装置进行输液、输血和药物治疗,外周静脉和中心静脉置管的广泛应用使导管相关性血流感染等并发症的发生率越来越高,因此封管成为临床关注的重点[11]。常规封管是采取生理盐水稀释肝素钠的方法。在长期临床实践中发现,该方法需反复抽吸,同样存在导管相关性感染和静脉炎等并发症的风险,对患者十分不利。而预充式导管冲洗器是一种采用高标准灭菌技术、一次性使用无菌包装、灌注0.9%氯化钠注射液的新型医疗器械。研究表明,其与手工配置的肝素钠稀释液冲管、封管相比,能够减少堵管的发生率,降低导管相关性感染并发症的发生率,可有效保证封管质量及后续输液通畅[12]。同时,预充式导管冲洗器使用方便,可减少操作时间,无需进行传统的配药操作,可减少配药剂量差错,提高用药的准确性和疗效[13]。
在临床使用过程中,预充式导管冲洗器与患者的血液、组织存在间接接触,其生物相容性安全与否直接关系着患者的生命健康。然而,相关文献仅报道了预充式导管冲洗器的临床使用价值,比如其在正压型无针连接式留置针封管中的应用价值[14]、对预防中心静脉导管相关性血流感染的系统综述[15]。对于与人体直接或间接接触的医疗器械来说,生物相容性评价是风险管理过程中非常重要的方面,贯穿于产品全生命周期,需对此类医疗器械进行充分、可靠的生物相容性评价。参照现行的GB/T 16886.1—2011标准附录A中推荐的生物学评价终点,考虑器械的物理/化学信息、与人体接触的程度、频次和时间(即预期用途),预充式导管冲洗器与人体接触的性质属于外部接入器械中的与血路直接、间接接触的器械,接触时间分类为短期(接触时间<24 h),不存在反复多次接触。故本研究选择细菌内毒素、热原、血液相容性(溶血和凝血)、体外细胞毒性、皮肤致敏、皮内刺激和急性全身毒性试验对预充式导管冲洗器进行生物相容性评价。
热原反应是临床静脉输液过程中常见的不良反应之一,对药品、医疗器械及药包材进行热原检测,使其致热物质含量控制在一定限度范围内,是临床使用的重要保障。细菌内毒素试验和热原试验(家兔法)是目前应用最多的材料致热原性检测方法。细菌内毒素试验是利用鲎试剂遇到内毒素会产生凝集的原理进行测定;热原试验(家兔法)是利用测量家兔温度变化情况来判断供试品是否具有潜在致热作用[16]。细菌内毒素试验仅能检测由革兰氏阴性菌产生的细菌内毒素,不能检测其他类型引起的热原反应。考虑其各自固有的缺点,本研究采用2种方法结合的方式检测预充式导管冲洗器内的氯化钠注射液的热原含量是否超过限度,为患者使用提供安全保障。本次试验中预充式导管冲洗器内的0.9%氯化钠注射液的细菌内毒素含量<0.5 EU/mL,3只新西兰兔体温升高均低于0.6℃,最大体温升高总和为0.28℃,低于1.3℃的要求,表明供试品无潜在致热作用。
血液相容性研究对于与人体血液、血液成分直接或间接接触的医疗器械至关重要,目前主要采用体外、半体内和体内试验进行评价,而体外试验由于快速、经济等特点,在血液相容性初步筛选试验中得到了广泛应用。溶血试验一直是一种重要的反映器械材料与血液相互作用的筛选试验,而凝血试验主要是判断器械是否对机体凝血系统造成影响[17]。本研究选取溶血试验和凝血试验对预充式导管冲洗器进行血液相容性评价,试验结果表明供试品溶液的溶血率为0.59%,远远<5%,符合安全标准,且其PT测定结果与同类型对照品比较,差异无统计学意义(P>0.05)。
体外细胞毒性试验是医疗器械生物安全性评价的一个重要检测项目,因其简便、快捷、敏感度高等优点被列为首选试验项目,并作为评价医疗器械生物相容性的重要指标。其中噻唑蓝比色法因具有分级清晰、敏感度高等优点被广泛应用[18]。鉴于预充式导管冲洗器所含氯化钠注射液虽然用于不同药物治疗的间隙,处于封闭、冲洗导管的管路末端,但会有一定体积的液体进入人体循环系统,为保证产品的安全性,本研究对导管冲洗器部分和预灌封的0.9%氯化钠注射液分别进行体外细胞毒性检测,试验结果表明二者均无潜在的细胞毒性,细胞相容性良好。
皮内刺激试验是通过皮内注射样品浸提液,对其在试验条件下产生刺激反应的潜能做出评定[16]。GPMT试验是评价样品是否导致豚鼠产生致敏反应的最敏感、最常用的试验方法[17]。而急性全身毒性试验可以判断样品是否会造成不可预知的毒性作用。因此本文选择上述3个试验研究供试品的刺激性和毒性。试验结果表明,预充式导管冲洗器内的0.9%氯化钠注射液未引起新西兰兔刺激反应,未导致白化豚鼠出现皮肤致敏反应,未见小鼠明显急性全身毒性反应。
生物学评价研究是医疗器械质量控制的关键环节,良好的生物相容性是医疗器械临床使用安全有效的重要保证。本研究主要参照GB/T 16886.1—2011中推荐的生物相容性试验进行评价研究,但需要注意的是,并不能仅依据生物学试验数据确认医疗器械是否可以上市使用,还应该结合器械的材料表征、动物研究或临床数据进行综合分析判断。

