基于网络药理学方法研究“黄芪-人参”药对治疗胃癌的作用机制*
郭凯凯,赵艺蔓,陈晓宇,凌慧,李洲强,郭东霖,张颖,侯恩存
广西中医药大学附属瑞康医院,广西 南宁 530011
胃癌作为一种常见的恶性肿瘤,其致死率在全球所有恶性肿瘤中居第二位[1]。有研究表明胃癌的演变过程主要分为5个阶段,分别是慢性浅表性胃炎、慢性萎缩性胃炎、肠上皮化生、异型增生、胃腺癌[2]。胃癌的治疗方式包括手术、放疗、化疗等,虽然一定程度上能够延长患者生命,但研究发现治疗后患者会出现消化道出血、恶心呕吐、厌食等一系列并发症,严重影响患者生活质量[3]。
胃癌属中医学“胃脘痛”“积聚”“癥瘕”等范畴[4]。《素问·遗篇·刺法论篇》载:“正气存内,邪不可干。”正气虚弱是胃癌发生的主要因素,脏腑阴阳失衡为胃癌的形成提供了条件[5]。有研究表明化疗的同时,配合中医益气扶正能有效缓解胃癌患者临床症状,改善患者生活质量,减轻化疗毒副作用[6]。有研究表明人参、黄芪中的有效成分能抑制肿瘤增殖,加速胃癌细胞凋亡[7]。
本研究根据网络药理学方法构建“药物-成分-靶点”网络,探讨“黄芪-人参”药物活性成分、潜在靶点以及作用机制,进一步阐释“黄芪-人参”药对治疗胃癌的作用机制及其新方法、新思路。
1 材料与方法
1.1 数据库及软件中药系统药理学分析平台(traditional Chinese medicine systems pharmacology,TCMSP,http://tcmspw.com/tcmsp.php)、人类基因数据库(the human gene database,GeneCards,https://www.genecards.org)、比较毒物基因组学数据库(http://ctd.mdibl.org/)、蛋白-蛋白相互作用网络平台STRING v11.0(https://string-db.org/)、生物信息注释数据库(DAVID,https://david.ncifcrf.gov/)、Cytoscape 3.2.1软件(http://www.cytoscape.org/)。
1.2 “黄芪-人参”有效化合物及作用靶点获取以TCMSP数据库为依托,以黄芪、人参为检索关键词,以口服生物利用度(oral bioavailability,OB)和药物相似性(drug-likeness,DL)的筛选条件(OB≥30%,DL≥0.18)进行筛选,获取“黄芪-人参”药对有效化合物及作用靶点。
1.3 胃癌相关靶点搜集利用GeneCards、CTD数据库,以“Stomach Neoplasms”为检索词,检索胃癌相关靶点。
1.4 “黄芪-人参”治疗胃癌潜在靶点预测将药物预测的靶点与疾病靶点进行映射,生成药物-化合物-靶点的药理网络图,获得“黄芪-人参”药对治疗胃癌的潜在靶点,并利用Cytoscape 3.2.1软件构建“药物-化合物-靶点”图。
1.5 蛋白-蛋白相互作用网络(protein-protein interactions,PPI)构建通过Cytoscape 3.2.1软件Bisogenet插件构建PPI蛋白互作网络。利用Cyto NCA插件构建PPI网络。
1.6 基因本体论功能富集分析(gene ontology,GO)及KEGG富集分析(kyoto encyclopedia of genes and genomes,KEGG)将获得的“黄芪-人参”治疗胃癌的22个潜在靶点输入DAVID6.8中,以P<0.01,FDR<0.01为筛选条件进行富集分析,对富集分析结果按照P值由小到大排序,并使用Omic Share云平台绘制成高级气泡图。
2 结果
2.1 “黄芪-人参”有效化合物和作用靶点在TCMSP平台数据库中,删除重复后,“黄芪-人参”共有41个化合物,共筛出对应的作用靶点384个。见表1。
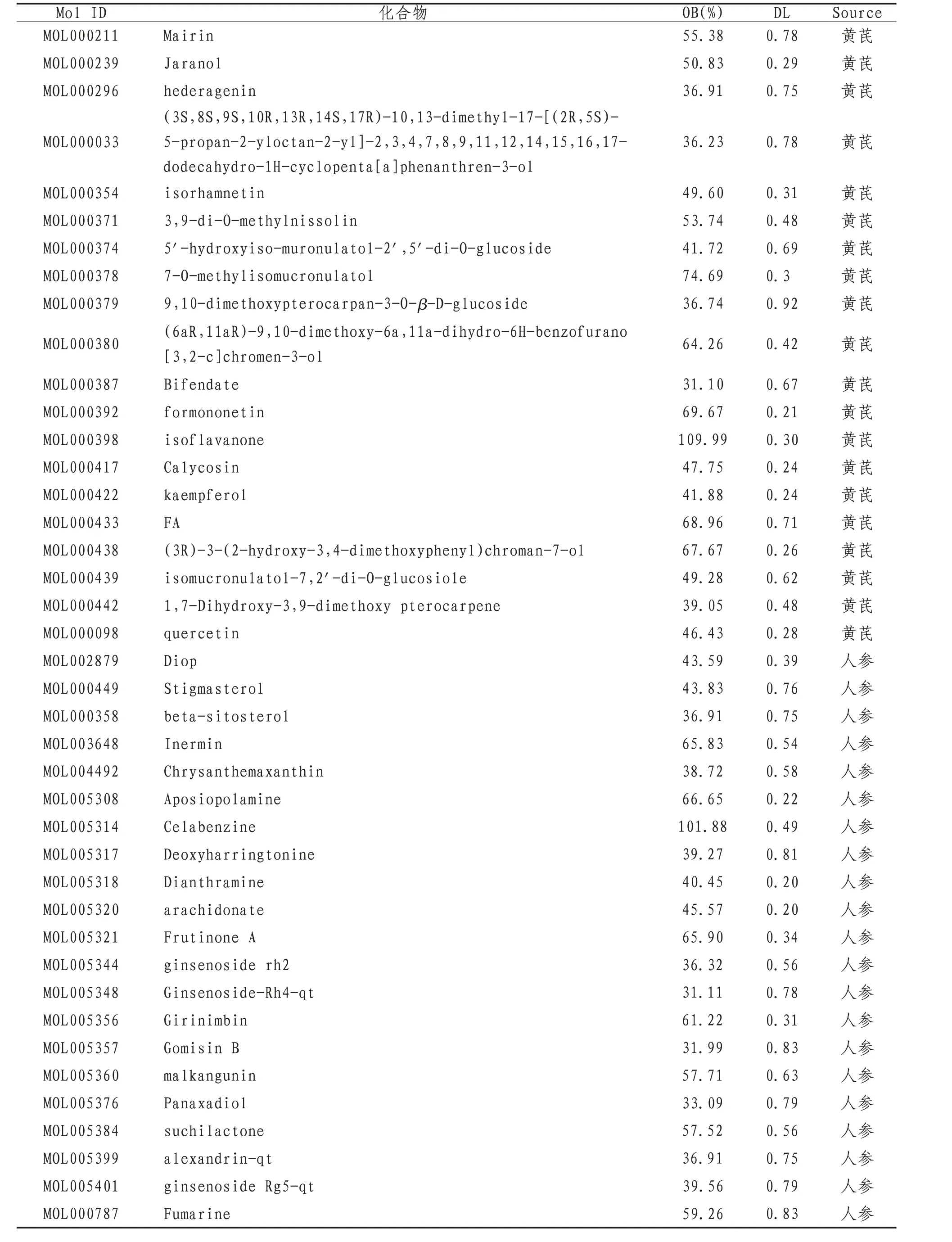
表1 “黄芪-人参”药对化合物信息
2.2 药物成份-靶点网络构建将上述41个化合物与384个靶点以Excel文件格式分别定义数据和属性文件,用Cytoscape 3.2.1软件得到“黄芪-人参”成分-靶点网络图,通过网络拓扑分析,筛选自由度(degree)靠前的靶点,蓝色为显著富集,黑色为非显著富集。其中三角形代表药物分子,圆形代表药物作用靶点,共得到266个节点,645条边。见图1。
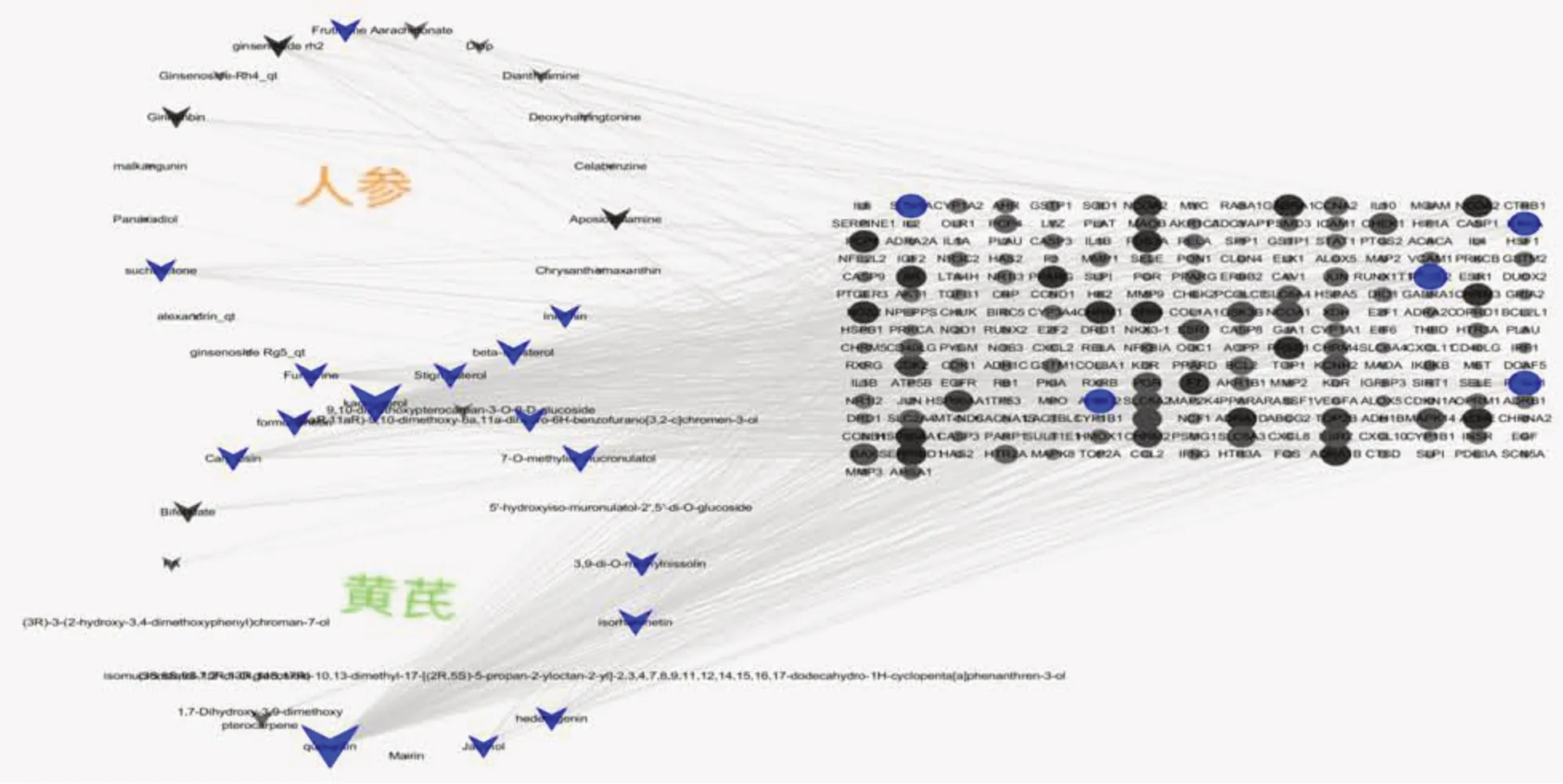
图1 “黄芪-人参”成份-靶点网络
2.3 疾病靶点筛选通过GeneCards、CTD数据库以疾病名称进行检索,删除重复项后,在GeneCards、CTD数据库中共收集到473个疾病靶点,根据推理得分(Inference Score)筛选出前200个疾病靶点,以减少冗杂。
2.4 药物及胃癌靶点标准化及共有靶点PPI网络将上述药物依次上传至靶点标准化数据库STRING进行蛋白基因化,得到基因名。并通过Venny 2.1.0与胃癌靶点绘制蛋白韦恩图,见图2。成分与疾病共有靶点22个蛋白主要涉及丝氨酸/苏氨酸蛋白激 酶1(serine/threonine protein kinase 1,Akt1)、丝裂原活化蛋白激酶8(mitogen activated protein kinase,MAPK8)、胱天蛋白酶3(Caspase-3,CASP3)、前列腺素内过氧化物合成酶2(prostaglandin-endoperoxide synthase 2,PTJS2)、胱天蛋白酶9(Caspase-9,CASP9)等。将交集靶点通过Cytoscape 3.2.1软件绘制得到联系紧密的PPI网络图,见图3。
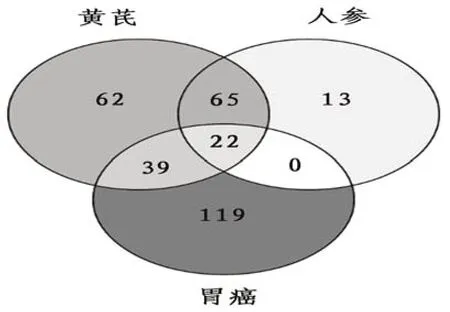
图2 韦恩图
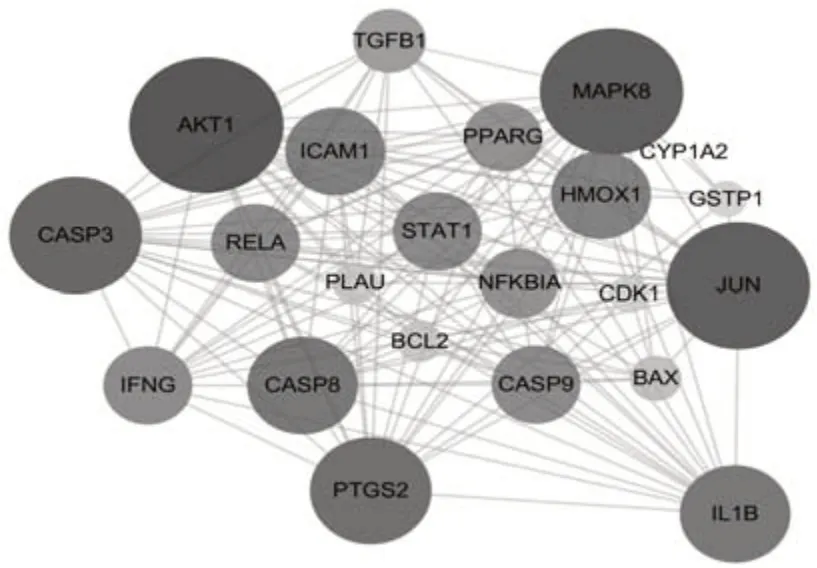
图3 蛋白相互作用网络(PPI)
2.5 GO功能富集及KEGG通路富集分析通过GO富集分析功能得出67个生物过程(biological process,BP),涉及血管平滑肌增殖、凋亡过程、对细胞因子的反应等;8个分子功能(molecular function,MF),涉及DNA结合、蛋白质同聚活性、染色质结合等;6个细胞组成(cellular component,CC),涉及原子核、细胞质、内质网膜等。见图4—6。柱状图长度越长则富集基因数目越多、富集越显著。
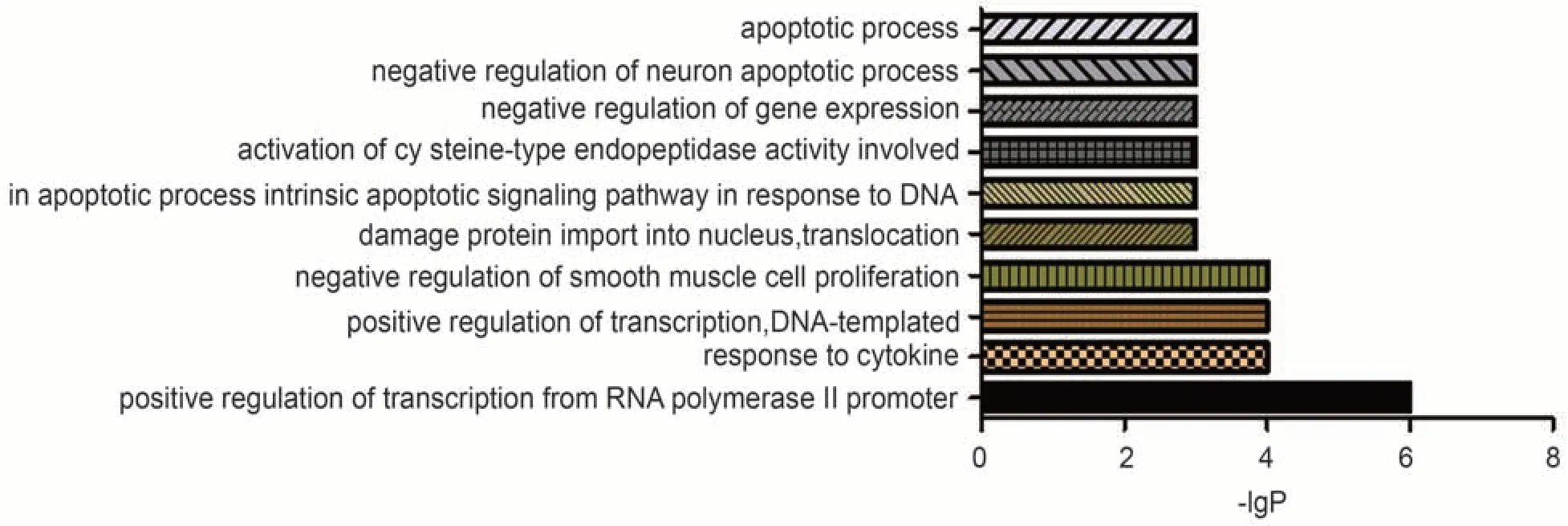
图4 “黄芪-人参”有效作用靶点BP柱状图
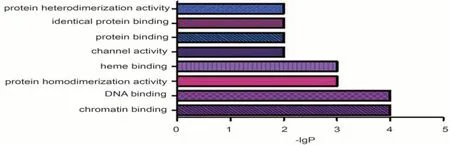
图5 “黄芪-人参”有效作用靶点MF柱状图

图6 “黄芪-人参”有效作用靶点CC柱状图
通过KEGG通路富集分析得到65条通路,其共同靶点主要富集于病毒致癌、小细胞肺癌等疾病及神经营养蛋白信号通路、TOll受体(TLR)信号通路、TNF等。泡泡节点越大则富集基因数量越多,颜色越红则富集越显著。见图7—8。
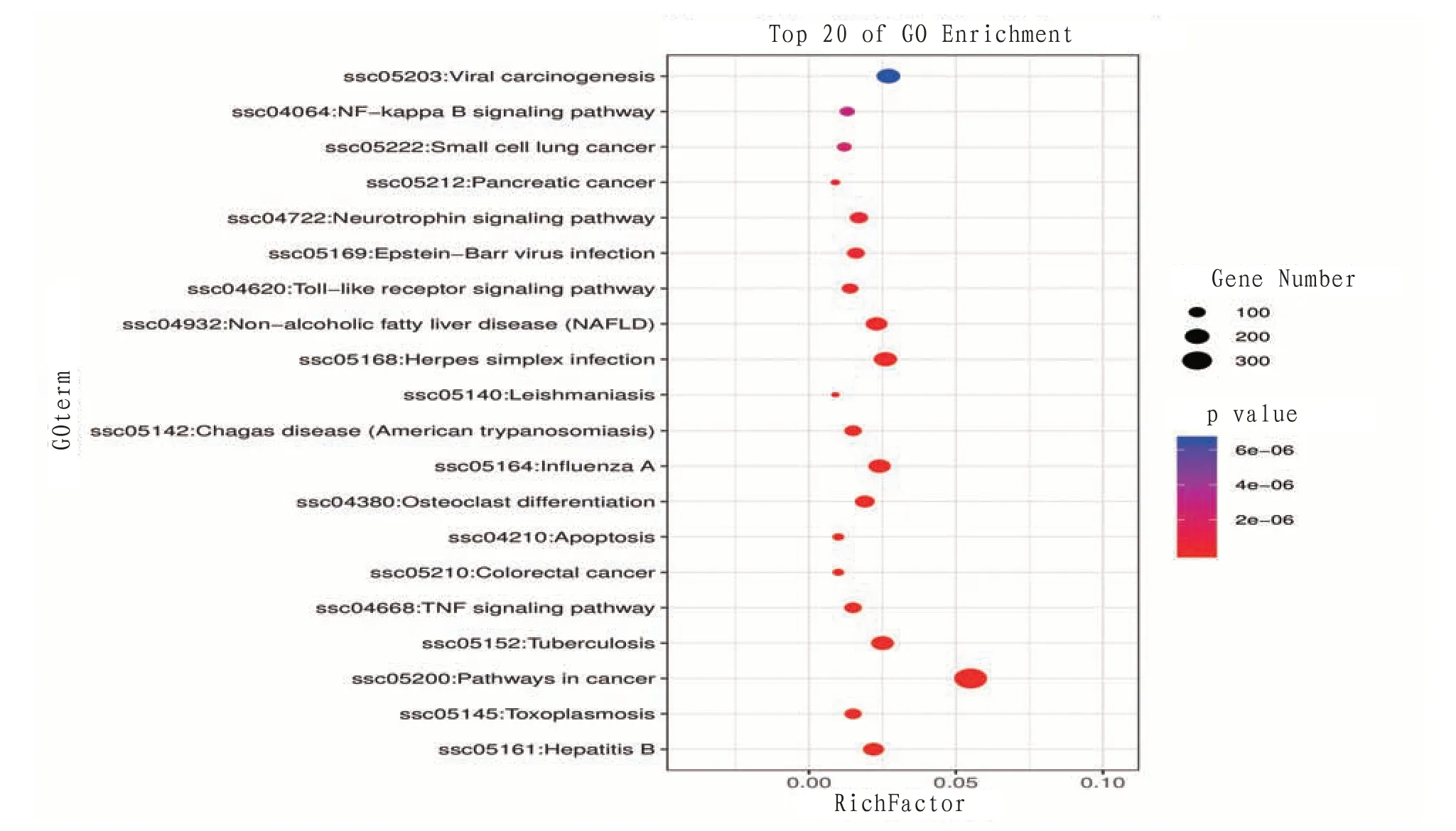
图7 黄芪-人参与胃癌有效作用靶点KEGG富集分析气泡图

图8 KEGG信号通路
3 讨论
本研究利用网络药理学方法,通过TCMSP数据库平台,最终确定了“黄芪-人参”药对中41个活性成分,384个作用靶点,筛选出“黄芪-人参”药对中的5个主要有效成分,β-谷甾醇(betasitosterol)、槲 皮 素(quercetin)、山 奈 酚(kaempferol)等。孙玉成等[8]人体内外实验结果表明,β-谷甾醇具有抗胃癌肿瘤细胞的作用,主要作用机制可能与下调P13K/AKT/m TOR信号通路蛋白表达、诱导SGC-7901细胞发生自噬有关。有研究表明,β-谷甾醇能加速共刺激细胞增殖,进一步增强对胃癌肿瘤细胞的杀伤作用,其机制可能与上调共刺激细胞中孔蛋白(pore-forming protein,PFP)等表达及活化细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)信号通路相关[9]。耿威等[10]的研究表明,槲皮素能限制胃癌细胞繁殖和攻击,可能与小窝蛋白1(caveolin-1,Cav-1)表达有关。槲皮素能抑制胃癌MKN-45细胞,细胞的繁殖和增加,并且有可能进一步加速其凋亡,其作用机制可能与调节Caspase-3和Caspase-9活性相关[11]。山奈酚是多种植物的有效组成成分,具有显著抗癌作用[12]。胃癌细胞内CDK1/Cyclin B激酶复合物、下游G2/M周期相关蛋白的表达在山奈酚的调控下,能加速胃癌细胞凋亡[13]。
通过筛选发现AKT1、MAPK8、CASP3、CASP9、PTJS2、JUN等是“黄芪-人参”在对胃癌患者扶正过程中的主要靶点。在肿瘤细胞生长、繁殖、凋亡的生物过程中,AKT信号通路起一定调控作用,而AKT1信号通路能调控肿瘤细胞繁殖和凋亡,限制AKT1表达,缓解胃癌细胞的多种药物耐药性[14]。AKT信号通路主要作用之一是调控衰老细胞,AKT1的表达主要通过miR-30b限制,进而干预干细胞的多能性、畸胎瘤的演变和增殖[15]。MAPK8信号通路和癌症细胞的形成变化有一定关系,磷酸化肿瘤细胞核内的丝氨酸/苏氨酸位点能使转录活性增强,肿瘤细胞进一步恶化[16]。Mapk8基因是MAPK家族成员中重要的信号通路,其功能涉及细胞增殖、分化、凋亡的各个阶段[17]。CASP3、CASP9可直接调控肿瘤细胞凋亡,限制肿瘤细胞繁殖和生长[18]。研究发现胃癌细胞中CASP3表达和肿瘤的临床症状以及预后有关[19]。PTJS2是前列腺素合成的关键酶,主要作用是促进产生PGE2等炎症介质,进而在“黄芪-人参”防治胃癌的过程中起扩张血管作用[20]。C-jun是一种转录因子,同时也是促分裂原活化蛋白激酶信号通路的主要成员之一。
从GO分析结果可知,BP主要涉及血管平滑肌增殖、凋亡过程、对细胞因子反应等。从KEGG富集分析可知,涉及的通路有TOll受体信号通路、TNF信号通路、NGF信号通路等信号通路。通路上含有的靶点越多,则通路发挥作用的可能就越大。TOll受体信号通路可通过TLR受体激动剂来调控TLR信号通路,从而提高机体对病原体的免疫力进而达到抑制肿瘤的目的,同时还可通过TLR受体抑制剂调控TLR过表达以及TLR信号转导,最终达到抑制肿瘤增殖和演变的目的[21]。TNF信号通路在机体内外都能杀伤、抑制肿瘤细胞增殖和形成,TNF-α对机体免疫调控主要是通过加强T细胞的表达而杀伤、抑制肿瘤细胞[22]。此外,富集与此信号通路上的JUN基因,作为重要的原癌基因,能调控细胞生长、分化,并且与多种肿瘤的形成有关。杨雪梅等[23]的研究表明,c-Jun mRNA、c-Jun的表达与炎症因子TNF-α表达有显著关联性,主要通过限制巨噬细胞蛋白激酶信号通路上c-Jun表达而减少TNF-α释放,进而有效调控炎症反应和减轻内毒素程度,进一步促进细胞凋亡。神经生长因子(nerve growth factor,NGF)可与靶细胞表面的NGF受体特异性结合而导致生物学效应的产生,并调控神经、血管及肿瘤等多种病理、生理过程,同时NGF还能作为丝裂原促进肿瘤细胞分裂、凋亡,在肿瘤形成与进展过程中起重要作用[24]。
综上所述,本研究基于网络药理学对“黄芪-人参”药对治疗胃癌的作用机制进行了初步探讨,其可能通过抑制血管平滑肌增殖、凋亡过程、细胞因子应答等过程治疗胃癌并起扶正作用,但由于网络药理学本身所具有的局限性以及忽略中药成分含量等诸多因素,导致本研究获得的结果可能存在一定偏差,有待临床中的进一步验证和证实。

