芦荟皮提取物对急性酒精性肝损伤的保护作用与机制
褚佳豪,居瑞军,樊远红,吴发亮,彭效明,杨思敏
(北京石油化工学院,恩泽生物质精细化工北京市重点实验室,北京 102617)
肝脏是人体代谢酒精的关键器官。酒精性肝病(Alcoholic liver disease,ALD)是长期大量饮酒引起的一种肝脏疾病,每年导致约330万的死亡人数,占全球疾病负担的5.1%,并且是60多种主要疾病的风险因素,在全球疾病和残疾风险因素中排名第三[1],已经成为世界范围内一个重要的健康和经济问题。尽管ALD具有严重的有害影响,但在治疗方面进展甚微。因此,为了改善酒精性肝损伤,人们尝试使用抗氧化剂和抗炎药物来增强肝脏的抗氧化和抗炎能力[2-4],但在长期给药中存在毒性[5]。近年来,从传统药用植物中开发出预防和治疗ALD的药物,具有多个靶点和较少的毒副作用等特点,在ALD的预防和治疗方面越来越有吸引力[6-9]。因此,开发安全有效的传统药用植物是十分迫切的。
芦荟是一种经典的传统药食同源植物,含有多种生物活性成分,并具有抗氧化、抗炎等[10-14]作用。在酒精性肝损伤研究中,发现芦荟素可以加快酒精氧化速度[15],并减轻慢性酒精性肝损伤的脂质积累,氧化应激和脂多糖诱导的炎症反应[9]。芦荟凝胶[16]可以通过降低MDA和增加谷胱甘肽来减少酒精诱导的氧化应激,对慢性饮酒导致的肝损伤具有保护作用。以上结果都说明芦荟的有效成分对慢性酒精性肝损伤有保护作用。叶青等[17]发现芦荟苷和芦荟粗多糖对急性酒精中毒小鼠具有明显的解酒作用,能够明显降低小鼠血液中的乙醇浓度,这一结果说明芦荟的有效成分对急性酒精毒性也有缓解作用,但针对其主要作用分子机制还未有报道。在芦荟胶生产过程中大量的芦荟皮被丢弃,芦荟皮中也具有多种活性成分[18],芦荟皮提取物对急性酒精性肝损伤是否有保护作用以及具体的保护机制,尚未有文献报道,因此本研究通过建立急性酒精性肝损伤体内外模型,检测细胞和小鼠肝脏中分子水平和生化指标的变化,观察小鼠肝脏病理组织,探究急性酒精性肝损伤的保护效应与相关分子机制,可为库拉索芦荟作为潜在天然保肝保健药物或食物的综合开发利用提供方向,为后续芦荟皮相关产品研发提供了理论依据。
1 材料与方法
1.1 材料与仪器
C57BL/6J雄性小鼠(8周龄) 30只,体重20±2 g,均由北京维通利华实验动物技术有限公司提供,实验动物许可证:SCXK(京)2021-0006,动物福利伦理审查批文号:P2021088;胎牛血清、双抗 伊奥邦公司;人肝癌 HepG2 细胞 亿奥邦公司,用含 10% 胎牛血清的 Dulbecco’s Modified Eagle Medium (DMEM) 培养基培养,并加入 1% 双抗,于 37 ℃、5% CO2培养箱中培养;库拉索芦荟 四年生,由云南万绿公司提供;抗坏血酸、无水甲醇、无水乙醇 国药集团化学试剂有限公司;芦荟苷 大连美仑生物技术有限公司(纯度≥98%);1,1-二苯基-2-三硝基苯肼(DPPH)梯希爱化成工业发展有限公司;2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)、二甲基亚砜(DMSO)、噻唑蓝溴化四唑(MTT) 上海阿拉丁生化科技股份有限公司;过硫酸钾 阿法埃莎化学有限公司;水杨酸 MREDA;30%过氧化氢、硫酸亚铁 北京化工厂;MDA试剂盒 南京建成生物工程研究所;All-in-One™First-Strand cDNA Synthesis Kit 美国Gene Copoeia公司;BCA试剂盒、TriQuick Reagent总RNA提取试剂、AST试剂盒、ALT试剂盒 北京索莱宝科技有限公司;2X Fast qPCR Master Mixture 北京迪宁生物科技有限公司。
ZN-20L型粉碎机 北京兴时利和科技发展有限公司;XH-100A型微波催化合成萃取仪 北京祥鹄科技发展技术有限公司;TF881型电热鼓风干燥箱
上海一恒科学仪器有限公司;Thermo二氧化碳恒温培养箱 赛默飞世尔科技有限公司;YT-CJ-1ND型超净工作台 北京亚泰科隆实验科技开发中心;荧光定量PCR仪 美国Bio-Rad公司;酶标仪 美国伯腾仪器有限公司;R-1020型旋转蒸发仪 郑州长城科工贸有限公司;HY-4型调速多用振荡器 国华电器有限公司;Nikon Eclipse E100型正置光学显微镜、Nikon DS-U3型成像系统 日本尼康。
1.2 实验方法
1.2.1 样品制备 参考韩宗元[19]的方法,并略有改进,具体方法如下;取新鲜的芦荟叶片洗净剥皮,取芦荟皮,剪断后55 ℃热风循环烘干,粉碎机粉碎并过60目筛,取30 g芦荟干粉,25 ℃下47%乙醇浸提40 min,25 ℃微波功率400 W萃取2 min,加入10倍体积的去离子水提取3次,合并提取液后40 ℃减压浓缩至合适体积后冷冻干燥,得到红棕色的芦荟皮提取物(ABE),得率为44.07%,4 ℃保存备用。
1.2.2 体外抗氧化活性测定
1.2.2.1 DPPH自由基清除率的测定 称取0.1984 g DPPH用无水甲醇溶解并定容至50 mL,配制成0.1 mmol/L DPPH储备质量浓度液。用无水甲醇分别配制成质量浓度0.01、0.25、0.5、1.5、4、6、8、10 mg/mL的ABE溶液。准确吸取200 μL样品加入1.5 mL离心管中待用,每管再加入600 μL DPPH溶液,充分振荡混匀,室温避光反应30 min。设置对照组,即各个浓度的提取物200 μL,加入600 μL甲醇。8000 r/min离心2 min,以甲醇为参比,以VC为阳性对照,分别配制质量浓度为0.005、0.01、0.25、0.5、1、2 mg/mL,每组分别设置3个平行,在517 nm处检测吸光值[20]。计算公式如下:

式中:A0:空白的Abs;Ai:样品显色后的Abs;Aj:样品自身的Abs。
1.2.2.2 ABTS自由基清除率的测定 将10 mL、7 mmol/L ABTS溶液和440 μL、140 mmol/L过硫酸钾混合,在25 ℃避光条件下孵育12~16 h,作为ABTS储备液。将储备液用0.1 mol/L磷酸盐缓冲液(pH7.4)稀释20倍。用无水甲醇分别配制成质量浓度0.01、0.25、0.5、1.5、4、6、8、10 mg/mL的ABE溶液。准确吸取200 μL样品加入1.5 mL离心管中待用,每个离心管中加入800 μL ABTS溶液,设置对照组,即不同浓度的提取物200 μL,加入600 μL甲醇,在30 ℃水浴中反应6 min。以甲醇为参比,以VC为对照,分别配制质量浓度为0.01、0.05、0.25、0.5、1、1.5、2 mg/mL,每组分别设置3个平行,在734 nm处测定吸光值[21]。计算公式如下:

式中:A0:空白的Abs;Ai:样品显色后的Abs;Aj:样品自身的Abs。
1.2.2.3 羟基自由基清除率的测定 用无水甲醇配制成质量浓度为0.01、0.25、0.5、1.5、4、6、8、10 mg/mL的ABE溶液,准确吸取200 μL样品加入1.5 mL离心管中待用,依次加入9 mmol/L硫酸亚铁、9 mmol/L水杨酸、8.8 mmol/L过氧化氢溶液各200 μL。设置对照组,即不同浓度提取物200 μL,加入600 μL甲醇。充分混匀,在37 ℃水浴中反应30 min后。以甲醇为参比,以VC为对照,分别配制质量浓度为0.01、0.05、0.25、0.5、0.7、1、2 mg/mL,在510 nm处测定吸光值[22]。计算公式如下:

式中:A0:空白的Abs;Ai:样品显色后的Abs;
Aj:样品自身的Abs。
1.2.3 细胞实验
1.2.3.1 酒精及ABE对HepG2细胞活力的影响HepG2细胞在96孔板中以每孔8×104个细胞接种,12 h后,每孔用含不同浓度(100、200、400、600、800、1000、2000 mmol/L)的含乙醇或ABE(0、5、10、40、60、80、100、200 μg/mL)的培养基37 ℃处理24 h,加入5 mg/mL的MTT溶液,孵育4 h后,加入150 μL二甲基亚砜(DMSO),25 ℃振荡10 min,在492 nm处测吸光值,计算HepG2细胞活力,计算公式如下。每组做6个复孔,重复三次。在乙醇处理过程中,用Parafilm密封平板。

1.2.3.2 ABE对细胞酒精损伤模型的保护作用 将HepG2细胞在96孔板中以每孔8×104个细胞接种。12 h后,对照组加入正常培养基,给药组和酒精模型组每孔用含732 mmol/L乙醇的培养基预处理6 h,然后给药组用含不同浓度ABE(5、10 μg/mL)的培养基处理18 h,模型组继续用含732 mmol/L乙醇的培养基处理18 h。加入5 mg/mL的MTT溶液,孵育4 h后,弃去上清,加入150 μL的DMSO,摇床振荡10 min,492 nm测定吸光度。每组做6个复孔,重复三次。
1.2.3.3 ABE对细胞酒精损伤模型转氨酶及氧化损伤产物的影响 将HepG2细胞以每孔8×105个细胞接种于在6孔板中。12 h后,对照组加入正常培养基,给药组和酒精模型组每孔用含732 mmol/L乙醇的培养基预处理6 h,然后给药组用含不同浓度ABE(5、10 μg/mL)的培养基处理18 h,模型组继续用含732 mmol/L乙醇的培养基处理18 h。按照商品化试剂盒检测ALT、AST和MDA含量。每组做3个复孔,重复三次。
1.2.3.4 ABE对细胞酒精损伤模型中酒精代谢和炎症细胞因子表达水平的影响 用Tri Quick Reagent从细胞中提取总RNA,使用All-in-One™ First-Strand cDNA Synthesis Kit反转录成cDNA。采用SYBR®Green Mix和CFX96TM实时PCR系统进行PCR。细胞样本引物序列如表1所示。

表 1 引物序列信息Table 1 Primer sequence information
1.2.4 动物实验
1.2.4.1 造模及给药方式 取雄性C57BL/6J小鼠30只,适应环境3 d后,随机分为5组,每组6只。实验过程中需每天测量小鼠体重。分别设置空白组、酒精模型组(50%乙醇,14 mL/kg)[23]、低、中、高剂量组(50、100、200 mg/kg)[24],各给药组每天给药1次,给药体积为15 mL/kg,空白组给予相同剂量的生理盐水。末次给药前12 h给予酒精造模(造模前需禁食12 h)。末次给药6 h后处死小鼠,收集肝脏组织用于后续检测。
1.2.4.2 ABE对小鼠肝组织病理变化的影响 在左肝叶同一部位,同时取小块肝组织以4%多聚甲醛溶液固定,做常规石蜡包埋、切片以及苏木精-伊红染色法(Hematoxylin-eosin staining,H & E),观察肝组织病理改变。
1.2.4.3 ABE对小鼠酒精性肝损伤中血清及肝脏组织各项生化指标的影响 末次灌胃酒精6 h后处死小鼠,心脏取血,静置30 min,4 ℃下6000 r/min离心10 min,常规分离血清。称取100 mg肝组织置于提取液中匀浆,制备10%肝脏匀浆液,离心后收集上清。按试剂盒说明书要求,用微量法分别测定血清中丙ALT、AST和肝组织中MDA含量。
1.2.4.4 ABE对小鼠酒精肝损伤中酒精代谢基因表达水平的影响 用TriQuick Reagent从小鼠组织中提取总RNA,并反转录成cDNA。采用SYBR®Green Mix和RT-PCR系统进行扩增实验(如表2、3)。

表 2 qRT-PCR 反应体系Table 2 qRT-PCR reaction system

表 3 qRT-PCR程序设置Table 3 qRT-PCR program settings
1.3 数据处理
统计分析数据以均数±标准差表示,该数据来自至少三个独立的实验。使用Excel 2016对结果进行单因素方差分析比较。P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 ABE的体外抗氧化能力
ABE的自由基清除能力如图1所示,ABE对DPPH、ABTS、羟基自由基的清除活性在不同浓度下均较明显,清除能力呈浓度依赖性增加。通过计算可知,ABE和VC的DPPH自由基清除率的IC50分别为2.03和0.003 mg/mL,ABTS自由基清除率的IC50分别为0.131和0.03 mg/mL,羟基自由基清除率的IC50分别为0.74和0.33 mg/mL。根据IC50可知ABE具有良好的自由基清除能力,但相对于VC较弱。酒精代谢产生大量的OH-、超氧阴离子(O2-·)及H2O2等ROS,一次大量饮酒会造成体内抗氧化系统紊乱,氧化还原水平失衡,引起氧化应激[25],对机体补充外源抗氧化剂可以清除体内活性氧,降低酒精对肝脏的损伤程度。基于芦荟皮提取物对DPPH、ABTS和羟基自由基具有很好的清除能力,可以作为天然抗氧化剂治疗ALD。
2.2 细胞实验
2.2.1 酒精及ABE对HepG2细胞活力的影响 细胞活力检测可直接反映药物对细胞存活和增殖的影响。基于细胞活力检测,能够确定酒精对肝细胞的体外损伤剂量并观察ABE对细胞损伤的保护作用。图2显示,随着酒精浓度在100~2000 mmol/L范围内增加,HepG2细胞活力呈剂量依赖性降低,IC50值为732 mmol/L,因此本研究选择732 mmol/L作为诱导肝细胞损伤的浓度。随着ABE浓度的增加,未表现出明显的细胞毒性,因此在一定浓度范围内ABE使用安全无明显毒性。与对照组相比,732 mmol/L酒精作用24 h后,HepG2细胞活力极显著降低(P<0.01),加入ABE后,细胞活力显著增加(P<0.05)。图2(C)中显示了ABE对酒精损伤细胞的保护作用。在ABE的作用下,与模型组的细胞相比,细胞存活率分别提高了35.91%和39.07%,说明ABE对酒精诱导的肝细胞损伤有保护作用。

图 1 不同浓度ABE对DPPH、ABTS和羟基自由基清除率的影响Fig.1 Effects of ABE at different concentrations on the scavenging efficiency of DPPH, ABTS and hydroxyl radicals
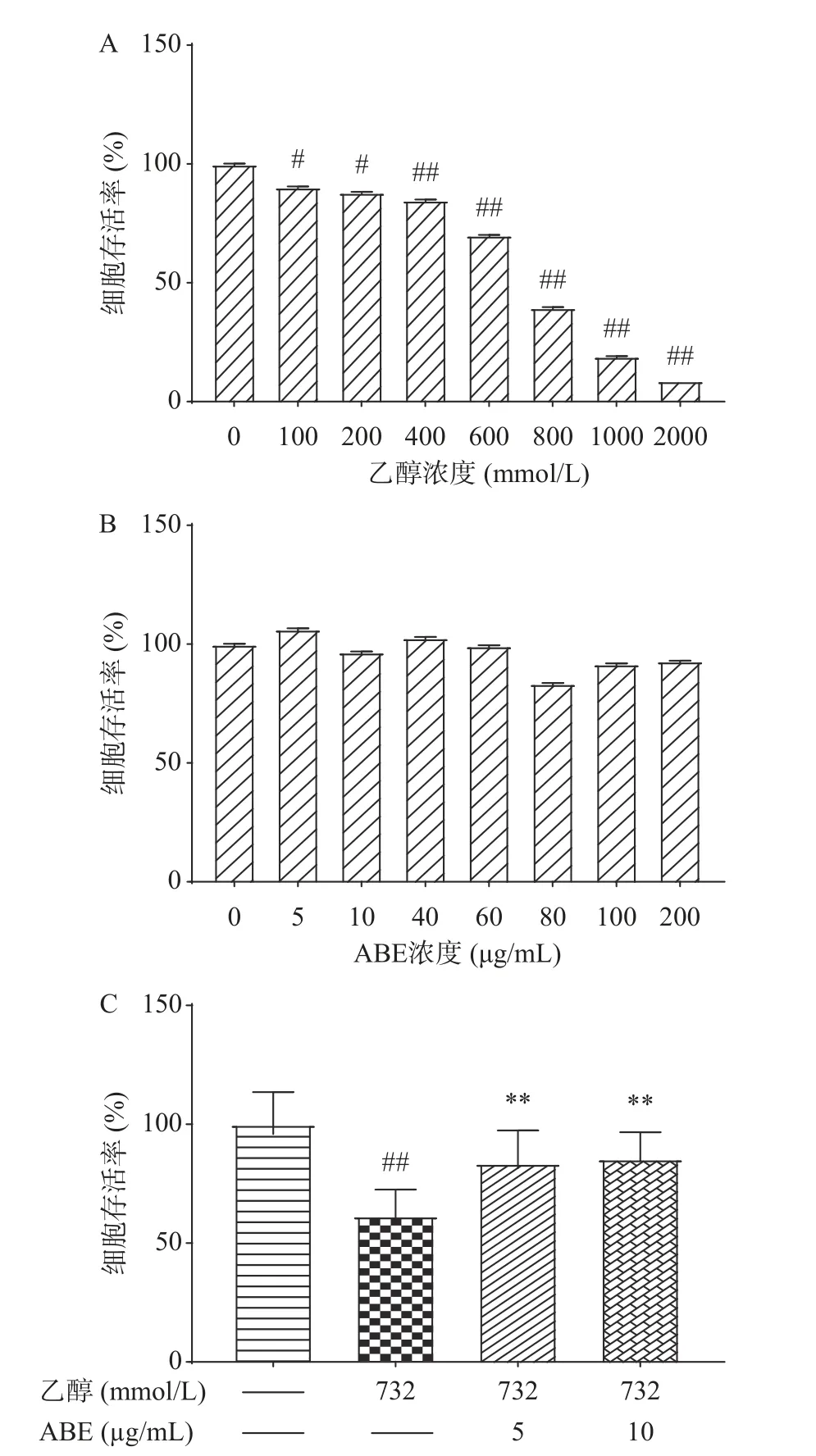
图 2 不同浓度的酒精和ABE对HepG2细胞活力的影响Fig.2 Effects of different doses of ethanol and ABE on the viability of HepG2 cells
2.2.2 ABE对细胞酒精损伤模型转氨酶及氧化损伤产物的影响 ALT及AST是评价肝损伤的核心生化指标也是临床常用指标,MDA是评价组织和细胞氧化损伤程度的重要指标。因此,通过把ALT、AST和MDA的检测初步判断ABE对酒精造成的肝细胞损伤的保护效应。图3显示了酒精损伤细胞模型中ALT和AST水平的变化。与对照组相比,急性酒精摄入导致ALT和AST极显著升高(P<0.01),分别提高了123.44%、43.26%。说明急性酒精性肝损伤细胞模型成功建立。与模型组相比,ABE低、高剂量组细胞ALT水平分别降低了36.91%和33.75%;AST水平分别下降18.05%和26.17%,结果显示,ABE可以抑制酒精导致的细胞中AST、ALT水平的升高。与对照组相比,急性酒精摄入极显著增加了细胞MDA水平(P<0.01),为正常组的328.39%,表示大量摄入酒精可增加肝脂质过氧化。与模型组相比,ABE低、高剂量组的MDA活性分别降低了34.52%和58.16%。结果表明,ABE可抑制酒精引起的脂质过氧化。
2.2.3 ABE对细胞酒精损伤模型中酒精代谢和炎症细胞因子表达水平的影响 酒精可造成肝细胞氧化应激和炎性损伤,因此本研究对酒精代谢、抗氧化酶及炎症因子相关基因的表达进行了检测。如图4所示,与对照组相比,模型组中Nrf2和SOD的mRNA表达下调(P<0.05,P<0.01),ABE低、高剂量组中Nrf2和SOD的mRNA表达较模型组显著上调(P<0.05,P<0.01),说明ABE通过上调Nrf2和SOD的mRNA的表达来增加肝细胞的抗氧化能力,缓解酒精诱导的氧化应激,结果表明,ABE可通过调控体内抗氧化基因的表达,来保护酒精诱导的肝脏氧化应激。与对照组相比,模型组中IL-1β和IL-6的mRNA表达极显著上调(P<0.01),ABE低、高剂量组中IL-1β和IL-6的mRNA表达下调(P<0.05,P<0.01);说明ABE可抑制酒精导致的炎症因子的表达,来保护酒精诱导的炎症反应。在肝细胞中,酒精的代谢涉及多种代谢酶,其中乙醇脱氢酶(ADH)和乙醛脱氢酶(ALDH)是酒精代谢过程中重要的两种酶[26]。与对照组相比,模型组中ADH的mRNA表达极显著下调(P<0.01),ABE低、高剂量组中ADH的mRNA表达显著上调(P<0.05,P<0.01),说明ABE可提高ADH的mRNA表达水平,可加速乙醇向乙醛转化。而ABE同时还能提高Nrf2和SOD的表达,说明ABE具有促进乙醛代谢的潜力。综合以上结果,ABE可通过加速酒精代谢,来减轻急性酒精性肝损伤。
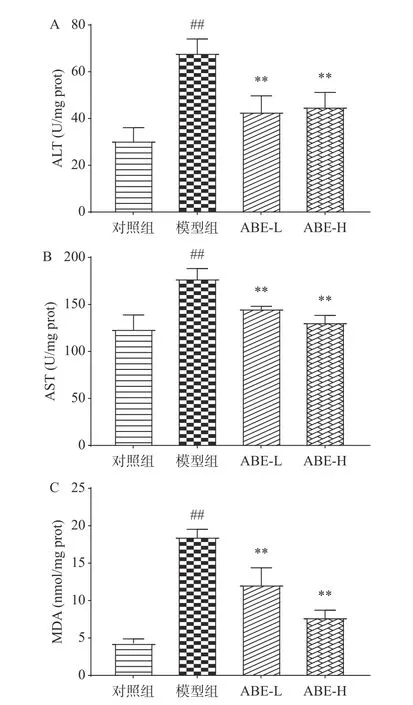
图 3 不同剂量的ABE对酒精损伤HepG2细胞内ALT(A)、AST(B)活性和MDA(C)含量的影响Fig.3 Effects of different doses of ABE on ALT (A), AST (B)activities and MDA (C) content in alcoholic -injured HepG2 cells
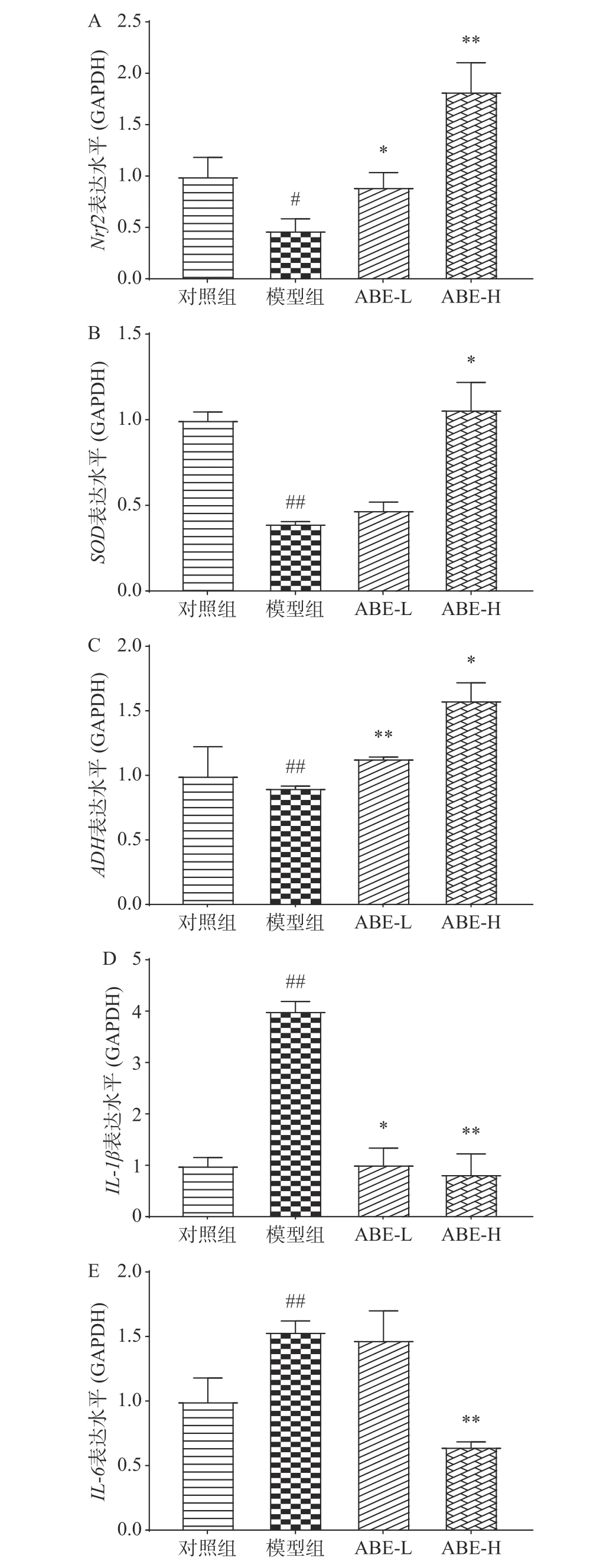
图 4 不同剂量ABE对酒精损伤HepG2细胞中Nrf2(A)、SOD(B)、ADH (C)、IL-1β(D)、IL-6(E)水平的影响Fig.4 Effects of different doses of ABE on Nrf2 (A)、SOD (B)、ADH (C)、IL-1β (D)、IL-6 (E)in alcoholic -injured HepG2 cells
2.3 动物实验
2.3.1 ABE对小鼠肝组织病理变化的影响 组织病理学检测可通过组织切片直观的判定组织病变损伤的程度和特点,此处使用H&E染色对小鼠肝脏组织进行观察。如图5所示,正常对照组小鼠的肝细胞形态结构完整,排列整齐,细胞核正常,未发生脂肪变性。酒精组肝形态细胞结构不完整,细胞间排列紊乱,细胞间的界限模糊不清,还出现了广泛的空泡变性。相对于酒精模型组,ABE低、中、高剂量组均能不同程度地减少细胞浆内的空泡变性。单次大量饮酒会导致严重的肝脏氧化应激、炎症和脂肪变性,而其中脂肪变性是最早和最常见的酒精性肝损伤形式。以上结果表明,ABE可以有效改善急性酒精性肝损伤。

图 5 ABE对酒精性肝损伤小鼠肝组织形态结构的影响(200×)Fig.5 Effects of ABE on the morphological structure of liver tissue in mice with alcoholic liver injury (200×)
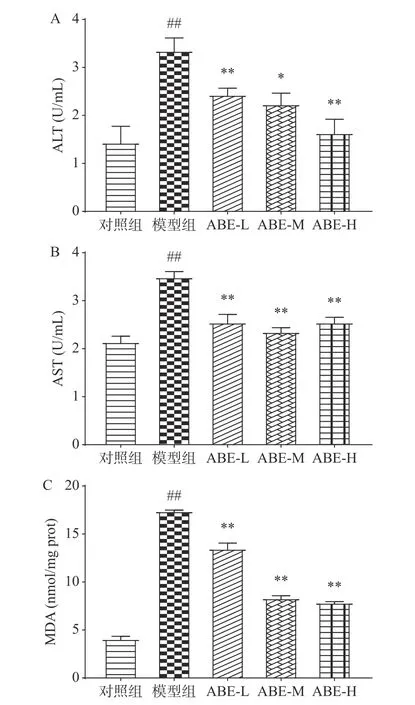
图 6 不同剂量ABE对急性酒精性肝损伤小鼠血清ALT(A)、AST(B)及肝脏MDA(C)水平的影响Fig.6 Effects of different doses of ABE on serum ALT (A),AST (B) and liver MDA (C) levels in mice with acute alcoholic liver injury
2.3.2 ABE对小鼠酒精性肝损伤中血清及肝脏组织各项生化指标的影响 在动物实验中,本研究检测小鼠血清中转氨酶水平以及肝脏组织中MDA的水平,用于评价酒精损伤小鼠模型中ABE的保肝作用。如图6所示,与正常组相比,急性酒精摄入导致ALT、AST极显著升高(P<0.01),分别提高了133.5%、63.3%。说明急性酒精性肝损伤动物模型成功建立。与酒精组相比,ABE低、中、高剂量组小鼠肝脏ALT水平分别降低了27.42%、33.32%和51.28%;AST水平分别降低了27.05%、32.72%和27.05%;结果表明,ABE可抑制急性酒精性肝损伤小鼠中AST、ALT水平的升高。与正常组相比,急性酒精摄入极显著增加小鼠肝脏MDA水平(P<0.01),为正常组的327.27%,表示大量摄入酒精可增加肝脂质过氧化。与酒精组相比,ABE低、中、高剂量组的MDA活性分别降低了22.53%、52.15%和54.90%。结果表明,ABE具有抑制酒精引起的脂质过氧化的作用。
2.3.3 ABE对小鼠酒精肝损伤中酒精代谢基因表达水平的影响 基于细胞实验的结果,本研究进一步对酒精代谢相关酶的表达水平进行了检测。如图7所示,与对照组相比,模型组中HO-1和SOD的mRNA表达极显著下调(P<0.01),Nrf2和CAT的mRNA表达显著上调(P<0.05,P<0.01)。ABE低、中、高剂量组中Nrf2、HO-1、CAT和SOD的mRNA表达均较模型组上调(P<0.05,P<0.01),说明ABE通过上调Nrf2、HO-1、CAT和SOD的mRNA的表达来缓解酒精诱导氧化应激。以上结果中Nrf2和CAT的表达亦受到酒精的调控,可能是由于酒精导致的肝脏ROS产生增加,应激性的刺激Nrf2表达的上调,进而对CAT的表达产生影响[25,27]。结果表明,ABE可通过调控体内抗氧化基因的表达,来保护酒精诱导的肝脏氧化应激。在肝细胞中,乙醇可由ADH代谢为乙醛,再由乙醛脱氢酶(ALDH)代谢为无毒的乙酸。与对照组相比,酒精模型组中ADH的mRNA表达极显著上调(P<0.01),模型组中ALDH的mRNA表达下调,ABE低、中、高剂量组中ADH和ALDH的mRNA表达水平较模型组上调(P<0.05,P<0.01),说明ABE可提高ADH和ALDH的mRNA表达水平。以上结果中ADH的表达亦受到酒精的调控,主要由于机体大量摄入酒精后会应激刺激肝脏组织上调ADH以帮助酒精分解,但其对ADH的影响与酒精的剂量和作用时间密切相关[28]。综上所述,ABE通过增加酒精代谢基因的水平来促进酒精的分解代谢,减轻急性酒精性肝损伤。

图 7 不同剂量ABE对急性酒精性肝损伤小鼠肝脏中Nrf2(A)、HO-1(B)、SOD(C)、CAT(D)、ADH(E)、ALDH(F)水平的影响Fig.7 Effects of different doses of ABE on Nrf2 (A), HO-1 (B), SOD (C), CAT (D), ADH (E) and ALDH (F) levels in the liver of mice with acute alcoholic liver injury
3 讨论
随着酒精消费量的增加,酒精已成为引起肝病的重要原因[29],近年来,ALD的发病率也逐年上升,已成为继病毒性肝炎之后,肝损伤的第二大原因[30],然而,关于ALD的治疗方法还很少,人们尝试使用合成抗氧化剂,但是发现存在一定毒性[5],所以开发植物来源的生物活性成分,是本领域研发的一个趋势。芦荟是一种经典的传统药物,含有丰富的生物活性成分,具有多种药理作用。本研究旨在探索芦荟皮提取物对酒精诱导的HepG2细胞及动物模型肝损伤的保护作用及潜在机制,为今后开发治疗急性酒精性肝损伤的新型药物提供依据。
酒精在肝脏中可通过三条途径进行代谢:a.细胞质基质上的乙醇脱氢酶系代谢途径;b.内质网上的细胞微粒氧化途径(MEOS);c.过氧化氢酶体上的过氧化氢酶氧化途径。其中ADH代谢是最主要的代谢途径,该代谢途径中ADH和ALDH表达对酒精代谢至关重要。在本研究中,对ADH和ALDH基因的表达进行了检测,结果显示给药组能够显著上调ADH和ALDH的表达。因此ABE能够促进酒精的代谢,酒精代谢的加速能够很大程度上降低酒精对肝脏造成的损伤。
细胞质内的ALT和AST会在肝细胞发生严重坏死或破坏时泄露到全身循环中。因此,这两种酶是肝功能检测的重要指标,血浆中两种酶的升高初步表明肝组织造成的损伤,其中ALT是检测肝脏损伤程度更为准确的指标[31-32]。在本研究中,AST和ALT水平的变化以及组织学检查的结果证实了急性酒精引起的肝损伤。给药组显著抑制了细胞内和小鼠心脏血浆中AST和ALT水平的升高,表明ABE对急性酒精性肝损伤有保护或治疗作用。此外,本研究通过H&E染色,观察了ABE对酒精诱导的肝组织形态学变化的影响。结果表明ABE能显著减轻酒精引起的肝组织形态变化。
在酒精代谢的过程中会产生ROS。ROS的产生和积累造成了肝细胞的氧化应激,过氧化会导致细胞膜结构的渗透性和完整性的改变[33-34],是引发ALD的一个重要因素[35-36]。本研究发现芦荟皮提取物对自由基具有良好的清除能力,对ALD体内外实验都具有明显的防治作用,可以作为未来治疗ALD的潜在药物。MDA作为脂质过氧化的主要终产物,通常用作评价自由基诱导的氧化应激的指标[37]。在本研究中,体内和体外酒精模型组中MDA浓度的增加,说明酒精诱导的ROS积累增加了肝细胞脂质过氧化,这将进一步导致肝脏组织的损伤以及抗氧化防御系统的失效[38-39]。Zhu等[40]证明了芦荟通过抑制脂质过氧化和炎症来减轻乙醇诱导的大鼠胃损伤。Gupta等[41]证明了芦荟叶的水提取物可以明显改善农药中毒的Wistar大鼠血清中AST和ALT的活性以及大鼠肝脏中MDA的活性水平。由此来看,芦荟对于抑制脂质过氧化是非常有效的。与该结果对应,在给药组中,芦荟皮提取物显著抑制了细胞和小鼠肝脏中MDA的增加,表明芦荟皮提取物对急性酒精性诱导的脂质过氧化有抑制作用。
机体具备一套抗氧化防御系统,其中酶促和非酶促抗氧化剂共同发挥作用清除ROS并减少氧化应激[42]。因此,增强机体自身的抗氧化放于体系,这可有效清除急性酒精诱导产生的ROS并降低氧化应激,缓解酒精造成的损伤。Nrf2(核因子红系2相关因子2)是一种在氧化刺激下诱导细胞保护信号的重要转录因子,其下游调控多种抗氧化酶的表达,如HO-1和SOD等[27]。SOD是内源性抗氧化防御系统清除ROS和维持细胞氧化还原平衡[43]。有研究表明,Nrf2的激活在酒精性肝损伤的保护中发挥重要作用[44]。因此,上调转录因子Nrf2,可以增加多种抗氧化酶的表达,包括HO-1、CAT及SOD等,以此可显著降低ROS水平,降低机体的氧化应激损伤。证据表明[8,45-46],氧化应激、炎症损伤和脂质积累是引发ALD的主要诱因。因此,炎症因子表达异常是ALD的另一个主要特征[47],TNF-α、IL-1β和IL-6是重要的炎症细胞因子,且IL-1β在ALD中发挥重要作用。本文进一步研究了ABE对急性酒精性肝损伤的保护作用是否与炎症因子的表达有关。结果表明,ABE可通过增加抗氧化基因表达的同时抑制炎症因子的表达来减轻急性酒精性肝损伤。
4 结论
综上所述,本研究对芦荟皮进行探究,发现其对急性酒精性肝损伤具有保护作用。结果表明,芦荟皮提取物具有良好的体外抗氧化活性,可以抑制AST、ALT的释放,清除MDA,显著抑制了急性酒精导致肝脏受损和脂质过氧化。机制结果表明,芦荟皮提取物可通过增加抗氧化mRNA和抑制炎症因子mRNA的表达来减轻急性酒精性肝损伤,可能是缓解了酒精引起的肝脏细胞氧化应激和炎症,并促进酒精在肝脏中代谢,从而达到护肝的功效。因此,芦荟皮提取物可能是成为一种预防或改善急性酒精性肝损伤的药物或食品的潜在活性原料。

