神经系统副肿瘤综合征诊断标准的更新与变化
路爱军 胡怀强
神经系统副肿瘤综合征(paraneoplastic neurological syndromes,PNS)是一种由免疫介导的肿瘤远隔效应所引起的神经系统症状,而不是由肿瘤直接浸润、转移所致,也非感染、代谢因素或其他形式抗肿瘤治疗等所引起[1]。目前基于人群PNS的流行病学调查很少,而且免疫抑制剂在肿瘤治疗中的广泛应用可能会导致类似PNS的症状发生率增加,使其诊断较为困难[2-4]。2004年国际专家小组制定了一项应用于临床和研究的PNS推荐诊断标准[5]。之后随着PNS领域研究的不断进展,发现了许多新的相关抗体,2021年专家小组通过对临床表型、抗体和肿瘤之间的一致性重新评估,更新了相关概念并提出了新的临床评分系统,即PNS-Care评分[1]。本文就PNS诊断标准的更新变化展开阐述,以期提高临床决策水平。
1 PNS诊断标准的更新
2004年推荐诊断标准中基于肿瘤的存在与否以及经典PNS和特异性抗神经元抗体的证据提出了两个级别来定义PNS的诊断级别:明确的PNS和可能的PNS[5]。在2021年诊断标准中将其定义为一类特殊的神经系统疾病:(1)可累及神经系统任何部位,临床表现常较为刻板;(2)其发生与肿瘤相关;(3)存在免疫介导的发病机制,其可由经常出现的特定神经元抗体支持。并结合临床表型、抗体及肿瘤一致性,通过PNS-Care评分将PNS划分为3个诊断级别,即明确的、很可能的和可能的PNS(表1)[1]。
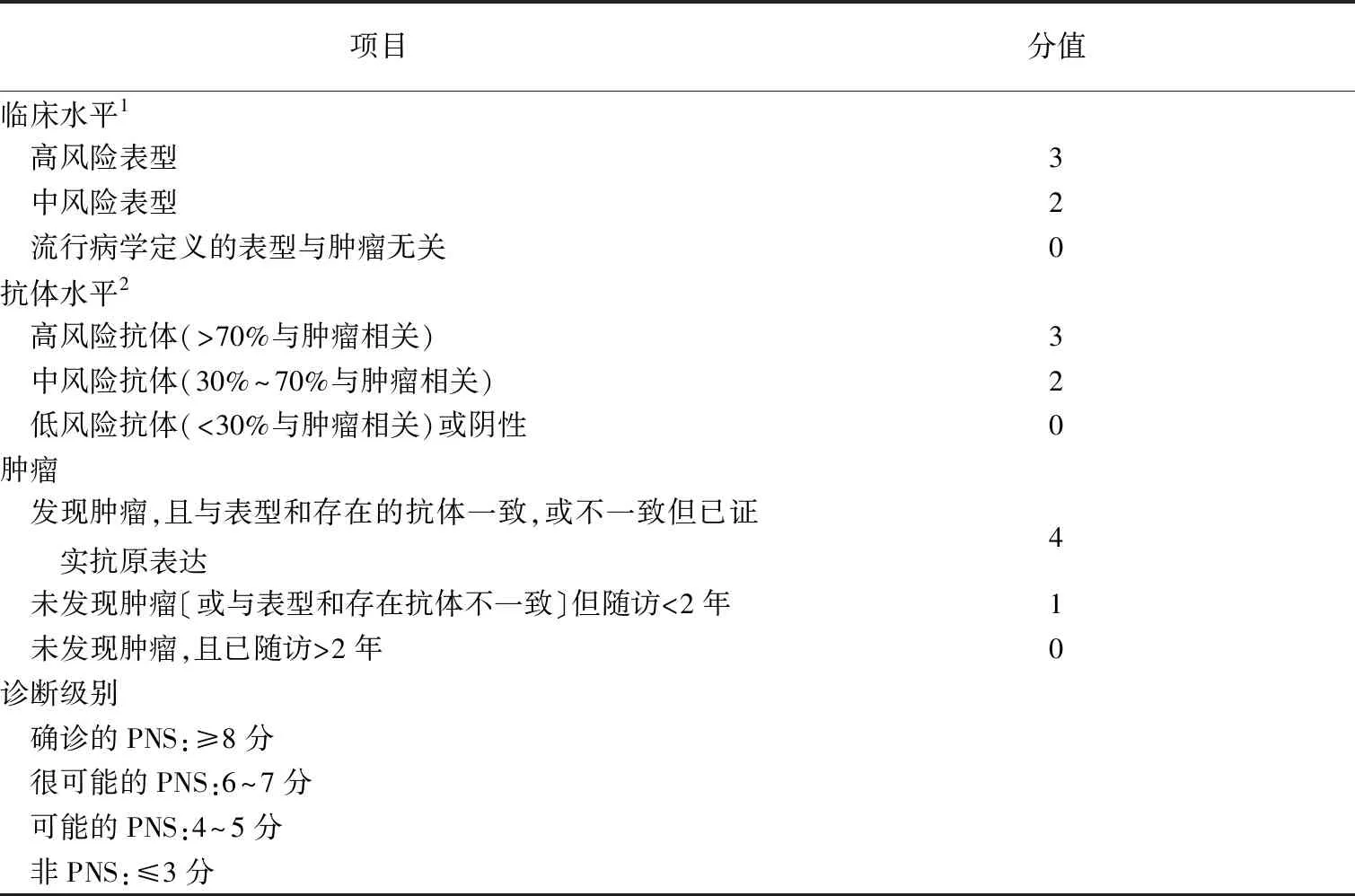
表1 PNS-Care评分量表[1]
需要注意的是,诊断级别为“可能的”或“很可能的”PNS会随着随访时间(大于或小于2年)的推移而发生改变。但如果超过2年仍未发现肿瘤或与表型、抗体不一致的肿瘤,则应降低诊断级别。例如Lambert-Eaton肌无力综合征(Lambert-Eaton myasthenic syndrome,LEMS)伴电压门控钙通道(VGCC)抗体阳性,但在诊断时没有肿瘤的患者的评分为6分(“很可能的”)。如果在18个月后发现小细胞肺癌(SCLC),诊断将升级为“确诊的”(9分),但如果超过2年未发现肿瘤或不一致的肿瘤,则诊断将降级为“可能的”(5分)。
2 PNS的临床表型
2004年将PNS分为经典综合征和非经典综合征,其中经典PNS综合征包括脑脊髓炎(encephalomyelitis,EM)、边缘性脑炎(limbic encephalitis,LE)、亚急性小脑变性、斜视性眼阵挛-肌阵挛(opsoclonus-myoclonus syndrome,OMS)、感觉神经元病(sensory neuropathy,SNN)、慢性胃肠道假性梗阻(chronic gastrointestinal pseudo-obstruction)、LEMS及皮肌炎。2021年国际专家小组则建议用高风险表型一词替代经典综合征,并引入中风险表型的概念。尤为重要的更新是对于几种可能与肿瘤有关的神经系统疾病,如炎症性肌病(皮肌炎、多发性肌炎和坏死性肌病)、重症肌无力(myasthenia gravis,MG)、单克隆丙种球蛋白病伴多发性神经病和副肿瘤性视网膜病、视神经炎和耳蜗-前庭病等未纳入到新的修订标准中,而这些曾在2004年推荐标准中为非经典症状。
2.1 高风险表型专家小组把部分特定的临床表现定义为高风险表型,替代经典型PNS,常提示副肿瘤性病因。肿瘤是这些表型的重要触发因素,因此,它们可帮助寻找潜在肿瘤,搜索肿瘤的范围取决于患者的人口统计学特征和神经元抗体类型(表2~4)。高风险表型包括:(1)脑脊髓炎;(2)LE;(3)快速进展性小脑综合征(rapidly progressive cerebellar syndrome)既往称为“亚急性小脑变性”;(4)OMS;(5)感觉神经元病;(6)胃肠道假性梗阻;(7)LEMS。其中,LE和快速进展性小脑综合征内容变化较大。
2.1.1LE:LE的诊断标准于2016年更新[6],该表型自2004年以来,在抗体发现方面取得了较大的进展。作为主要与肿瘤相关表型的历史概念在过去16年中发生了巨大变化[7]。由于LE一些少见的类型几乎总与肿瘤相关,故仍被视为高风险表型。目前副肿瘤性和非副肿瘤性LE患者的神经系统表现可能无法区分,一些相关抗体如抗GABABR抗体和抗AMPAR抗体在超过50%的病例中可表现为副肿瘤性LE。此外,抗Hu抗体和抗Ma2抗体几乎总见于成人患者,并与潜在的肿瘤有关,而在儿童患者中检测到抗Hu抗体非常罕见,且常不伴肿瘤。
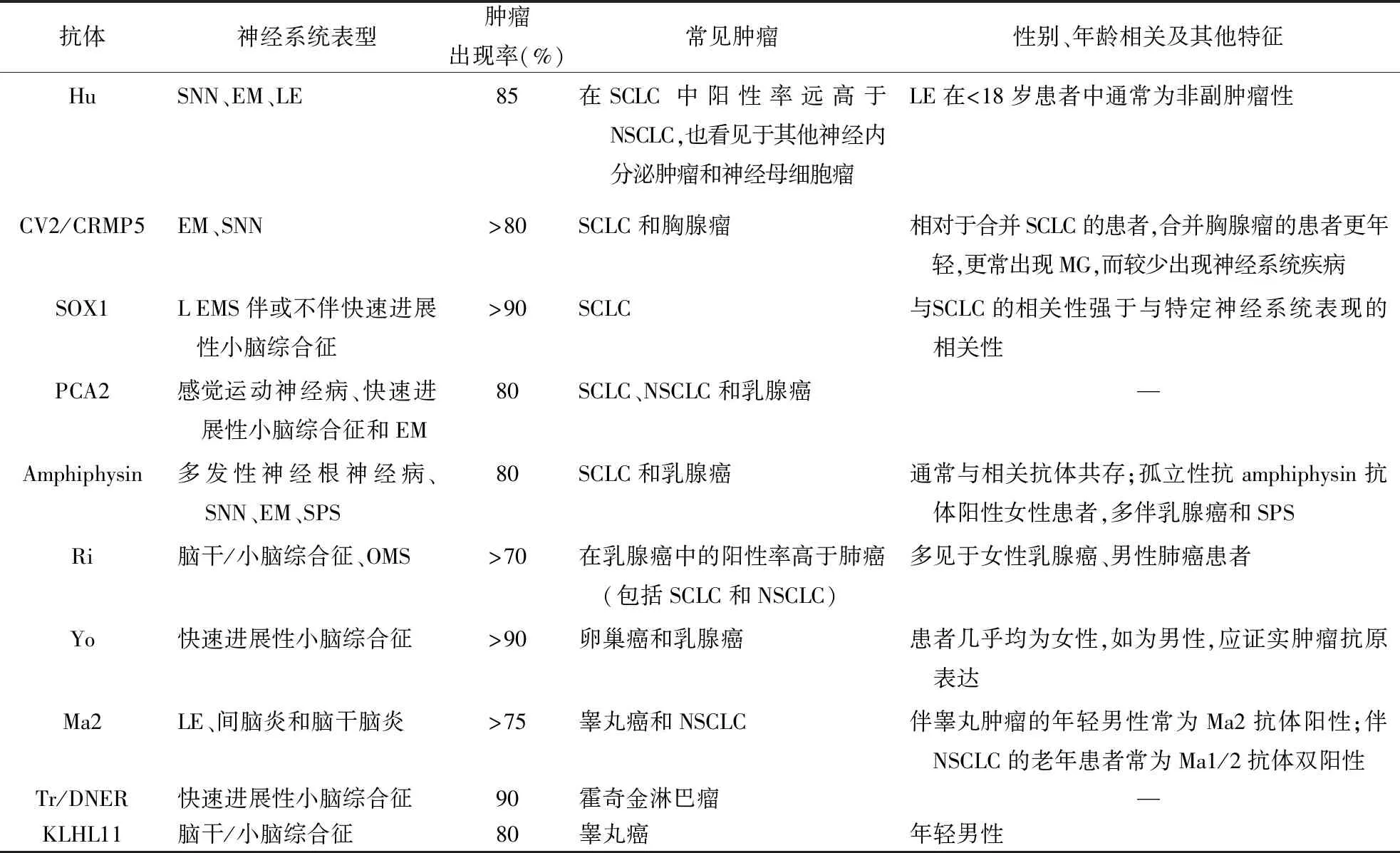
表2 高风险抗体在PNS中的分布情况(>70%与肿瘤相关)
2.1.2快速进展性小脑综合征:既往称亚急性小脑变性,2021年诊断标准中将其定义为快速进展性小脑综合征,以快速进展的小脑症状为特征,疾病早期无实质性小脑萎缩。步态共济失调可能是主要的或惟一的初始表现,但在病程后期出现躯干和肢体受累才能将其称为快速进展性小脑综合征。曾有学者报道过超急性起病,缓慢进展或隐匿性临床过程貌似神经退行性疾病的病例[8]。一般情况下,患者常在不到3个月的时间内迅速发展为严重的双侧小脑综合征,日常活动受限。专家小组提出目前无法鉴别伴或不伴肿瘤病例的临床表现,因此在提及临床综合征时应避免使用“副肿瘤性小脑变性”。
2.2 中等风险表型专家小组建议,当发病后迅速进展(<3个月),或脑脊液检测结果、脑/脊髓MRI提示炎症发现时,则考虑为可能的中风险表型,并列出了部分最具提示性的表型。如果符合“可能的”自身免疫性脑炎诊断标准并检测到高或中风险抗体,则可将其视为中风险表型(确诊的LE除外)。这尤其适用于不局限于边缘系统的多灶性或弥漫性受累的病例,如抗GABAAR脑炎在成人患者中与恶性胸腺瘤相关[9]。
2.2.1抗NMDAR脑炎:抗NMDAR脑炎是一种具有明确诊断标准但不常见肿瘤关联的疾病[6]。儿童和成年男性患者很少合并肿瘤,但18~35岁的女性常合并卵巢畸胎瘤,发病率在35%~50%之间。该病患者中未成熟的卵巢畸胎瘤虽不常见,但出现率比一般人群高,其他恶性肿瘤几乎只见于老年患者。
2.2.2脑干脑炎:通常见于抗Ma2抗体阳性的睾丸肿瘤或非小细胞肺癌(NSCLC)[10]。Ma2抗体阳性的脑干脑炎可伴有间脑受累,表现为白天过度嗜睡/发作性睡病、食欲亢进、体温过高和内分泌异常。球部功能障碍和中枢性低通气是Hu抗体的特征,而OMS和下颌肌张力障碍常见于Ri抗体[11]。感音神经性耳聋常见于KLHL11抗体阳性合并睾丸癌或畸胎瘤的脑干脑炎。
2.2.3Morvan综合征:恶性胸腺瘤是其最常见的肿瘤,常伴重症肌无力。Morvan综合征多伴CASPR2抗体阳性,有时可同时与LGI1和轴突生长诱向因子(Netrin)1受体抗体共存[12]。值得注意的是,LE和神经性肌强直同时发生不应该被认为是Morvan综合征。
2.2.4孤立性脊髓病:孤立性脊髓病作为副肿瘤表现可能有不同的临床演变,主要与乳腺癌和肺癌有关,伴CV2/CRMP5抗体和/或amphiphysin抗体阳性。但有些患者可能无神经元抗体,在这种情况下,当MRI表现为孤立脊髓病变又无其他诊断选择时,应考虑副肿瘤来源的可能性。
2.2.5僵人综合征(stiff-person syndrome,SPS):副肿瘤性SPS主要与amphiphysin抗体阳性的乳腺癌有关,非副肿瘤SPS主要与抗GAD65抗体相关。与非副肿瘤SPS相比,amphiphysin相关的副肿瘤SPS患者年龄较大,且常累及颈部和上肢。
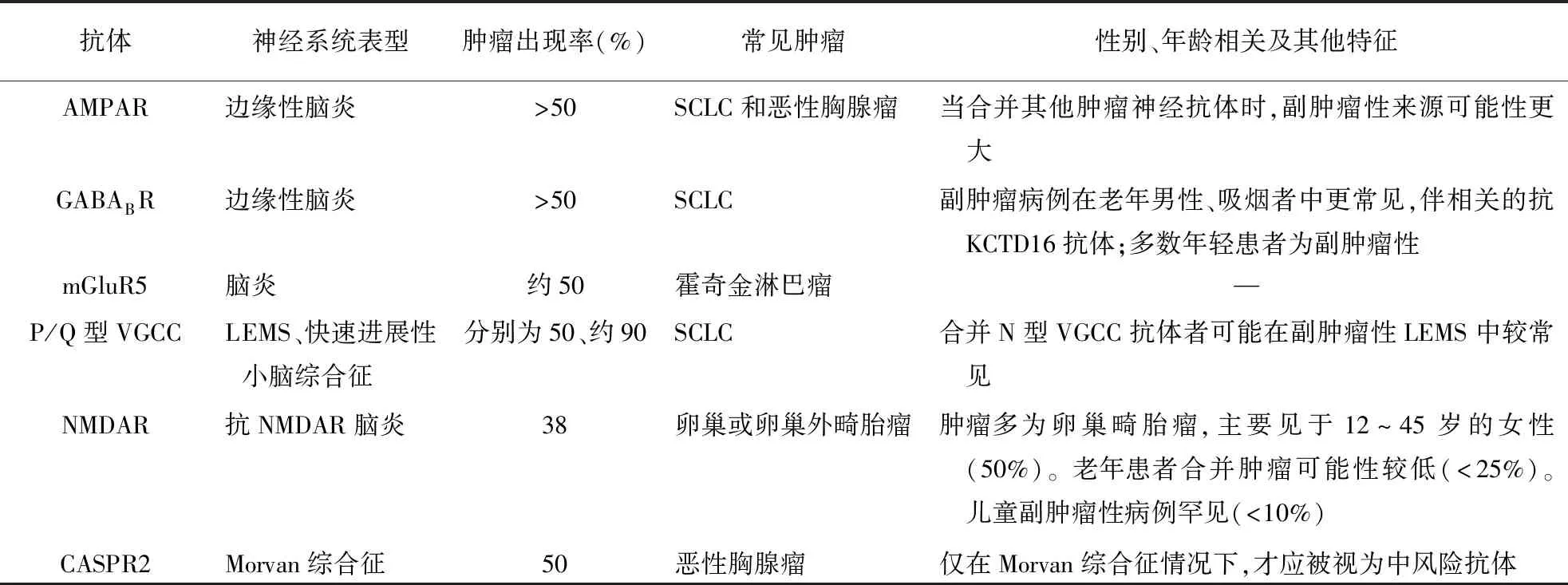
表3 中风险抗体在PNS中分布情况(30%~70%与肿瘤相关)
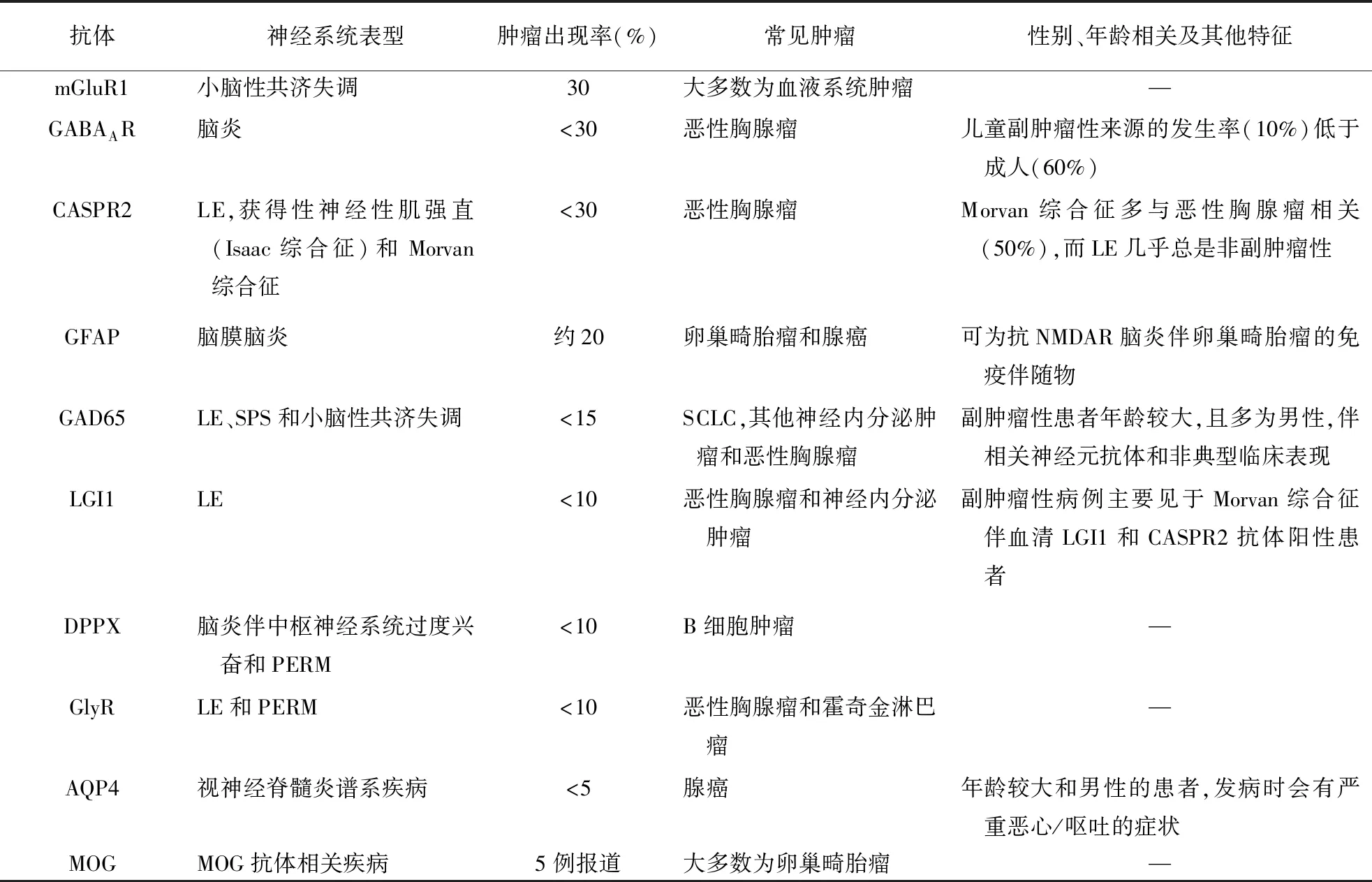
表4 低风险抗体在PNS中的分布情况(<30%与肿瘤相关)
2.2.6副肿瘤性多发性神经根神经病:该病最常见的抗体是抗CV2/CRMP5抗体、amphiphysin抗体和PCA2/MAP1B抗体,通常出现在SCLC或乳腺癌中。在肿瘤患者中,出现符合吉兰-巴雷综合征或慢性炎性脱髓鞘性多发性神经病诊断标准的神经病变不应被认为是副肿瘤性,除非证实存在高风险抗体。
3 PNS相关抗体及其与肿瘤的关联
临床研究表明,PNS相关抗体倾向于与某些特定类型的肿瘤相关,且存在年龄和性别依赖性,因此PNS相关抗体对寻找潜在肿瘤十分重要。2004年推荐标准提出PNS相关抗体分为:特征性抗体和部分特征性抗体,其中特征性抗体有抗Hu、Yo、CV2、Ri、Ma2、Anti-amphiphysin抗体,部分特征性抗体有抗Tr、ANNA3、Anti-Zic4、PCA2、Anti-mGluR1抗体。近16年来,多种新的针对神经元细胞内蛋白的抗体在PNS中被鉴定和描述,而且发现针对神经元表面抗原的致病性抗体可伴或不伴肿瘤,因此2021年专家小组对肿瘤抗神经元抗体进行了新的定义。根据与肿瘤关联率,将其分为三组:高风险抗体(>70%与肿瘤相关),多见于高风险表型,主要针对细胞内抗原,目前被认为不具有直接致病性,而仅是PNS的生物学标志物。中风险抗体(30%~70%与肿瘤相关),与肿瘤的关联程度较低,但目标抗原在神经元和肿瘤中都有表达,常见于高风险表型和中风险表型。低风险抗体(<30%与肿瘤相关),抗原在相关肿瘤中低表达或不表达。并提出除OMS外,明确的PNS诊断需要存在高或中危险抗体,但作为例外情况,神经母细胞瘤或SCLC相关的OMS可无特异性相关抗体(表2~4)。
4 PNS相关抗体的检测
神经元抗体已成为PNS非常重要的生物标志物,证实神经元抗体的存在对诊断PNS具有特别意义,目前金标准检测方法包括啮齿动物脑组织免疫组织化学/免疫荧光(IHC/IF),以及使用重组蛋白免疫印迹(针对大多数靶向细胞内抗原的抗体)或基于细胞底物的实验(CBA法,针对细胞表面或突触蛋白抗体)进行验证性研究[8]。其中脑免疫组化不适用于P/Q型VGCC抗体和甘氨酸受体抗体2种抗体的检测,组织免疫组化对于SOX1抗体的检测价值尚不明确。2021年更新的诊断标准中形成了有关抗体检测的建议(表5)。

表5 关于PNS相关抗体检测的一些建议
5 肿瘤的筛查
在临床研究中如何寻找潜在的肿瘤,2004年推荐标准中并未提及,2021年标准中提出当怀疑为PNS时,应及时按上述表型或抗体类型启动肿瘤筛查。患者可以同时合并1种及/或以上的肿瘤,因此,如果发现的肿瘤对于所怀疑表型或抗体类型属于非典型者,则应考虑筛查是否存在其他肿瘤。当初次肿瘤筛查为阴性时,对于高风险表型伴高风险抗体或中风险抗体的患者,应每4~6个月进行复查并持续2年,最终根据筛查结果并结合危险因素、临床演变等进行诊断级别的调整;对于不符合上述情况的患者以及伴较低风险抗体的患者,在初始诊断评估时进行全面的肿瘤筛查即可;对难治性或复发性神经系统疾病(如抗NMDAR脑炎)患者可考虑进行肿瘤再次筛查。
综上,PNS领域的研究在不断进步,不断发展,PNS诊断标准也在不断完善。2021年版PNS诊断标准的更新,在很大程度上提高了对PNS的临床认知程度及决策水平。当然,当前关于PNS相关抗体与肿瘤之间关系的研究,仍然是一项具有挑战性的任务,尚需进一步探索。

