甲状腺抗体阳性NMOSD-ON和MOGAD-ON临床特征及预后因素分析
刘雪菲 崔世磊 彭静婷 江汉秋 王佳伟
视神经脊髓炎谱系疾病(neuromyelitis optica spectrum disorders,NMOSD)是一种严重的炎症脱髓鞘疾病,主要累及视神经和脊髓[1]。 大约50%的NMOSD患者以视神经炎(optic neuritis,ON),即NMOSD相关ON(neuromyelitis optica spectrum disorders related optic neuritis,NMOSD-ON)为首发表现,是神经眼科常见的致盲性疾病之一[2]。
近年来研究发现抗髓鞘少突细胞糖蛋白免疫球蛋白G抗体(anti-myelin oligodendrocyte glycoprotein-IgG,MOG-IgG)相关疾病(MOG-IgG associated disorders,MOGAD)与多发性硬化、NMOSD相比具有不同的临床特征,是一种独立的中枢神经系统炎症脱髓鞘疾病[3]。MOGAD成年患者约90%可出现视神经受累,MOGAD相关视神经炎(MOGAD related optic neuritis,MOGAD-ON)易累及双侧,早期视功能损害重,预后相对较好,与NMOSD-ON有所不同[4]。
约20%~30%NMOSD患者合并自身免疫疾病,最常见的器官特异性自身免疫性疾病为自身免疫性甲状腺疾病(autoimmune thyroid disease,AITD)[5]。抗甲状腺抗体(anti-thyroid antibodies,ATAbs)包括抗甲状腺过氧化物酶抗体(anti-thyroid peroxidase antibodies,aTPOAb)和抗甲状腺球蛋白抗体(anti-thyroglobulin antibodies,aTGAb),它们在AITD的发病过程中起着重要作用,是诊断AITD的特异性指标[6]。目前国内外有文献报道合并ATAbs的NMOSD患者易累及延髓,出现长节段横贯性脊髓炎(longitudinally extensive transverse myelitis,LETM)[7-10]。但是对伴有ATAbs的NMOSD-ON研究不多,尚无伴ATAbs的MOGAD-ON的相关报道。本文章主要回顾分析伴ATAbs的NMOSD-ON、MOGAD-ON的临床资料,并对入组患者进行随访,探讨视力预后及复发的风险因素。
1 对象和方法
1.1 研究对象收集2018年1月至2019年12月于首都医科大学附属北京同仁医院神经内科住院AQP4-IgG阳性的NMOSD和MOGAD患者。入组标准:(1)从最初发病至就诊仅以ON为临床表现,ON符合《视神经炎诊断和治疗专家共识》[11]中的诊断标准;所有患者均无除视神经外其他脑实质及脊髓受累临床表现及体征,颅脑及脊髓MRI无亚临床病灶。(2)AQP4-IgG阳性的NMOSD符合2015年NMOSD诊断标准国际共识[12]中的诊断标准;(3)MOGAD符合《抗髓鞘少突胶质细胞糖蛋白免疫球蛋白G抗体相关疾病诊断和治疗中国专家共识》[4]中的诊断标准;(4)具有甲状腺功能〔游离三碘甲状原氨酸(FT3)、游离甲状腺素(FT4)、促甲状腺素(TSH)〕、ATAbs(aTGAb、aTPOAb)、甲状腺超声、视功能评估等检查结果。排除标准:(1)除外系统性红斑狼疮、干燥综合征等其他自身免疫疾病。(2)除外本次就诊前6个月使用糖皮质激素及免疫抑制剂治疗者。(3)患者资料不完整者。
本研究经院伦理委员会通过。
1.2 方法
1.2.1收集患者临床资料:(1)一般及临床资料:性别、年龄、发病年龄、起病情况、病程及眼部相关临床特征。眼部相关临床特征包括患病眼是单眼或双眼发病、是否存在视盘水肿、是否为复发眼(入组前有视神经炎发作)、达峰时间(视功能发展至最差视力所需时间)、患病眼最差视力(视功能发展至最严重时视力)。(2)实验室指标:抗核抗体(antinuclear antibody,ANA)、甲状腺功能、ATAbs。(3)影像学资料:甲状腺超声是否存在甲状腺结节、视神经MRI患眼视神经受累节段数,是否存在视神经鞘膜或视交叉受累。(4)电生理检查:图形视觉诱发电位(P-VEP)P100潜伏期和波幅。(5)治疗方案:急性期是否应用激素治疗,缓解期是否应用免疫抑制剂治疗及治疗方案、住院时间及出院时患眼视力。(6)随访资料:随访时间(入组至随访终点时间)、随访终点视力、随访终点前是否复发、复发部位、年复发率(首次发病至随访结束复发次数/首次发病至随访结束总年数)。
采用酶联免疫吸附技术(ELISA法)测定ANA,采用免疫发光法测定甲状腺功能及ATAbs。
患者采用国际标准视力表测量视力,小数法记录最佳矫正视力(best corrected visual acuity,BCVA)作为视功能评估指标。对无法测量的严重低视力采取如下评定:眼前指数评定为0.005,手动评定为0.0025,光感评定为0.001,无光感评定为0.0001。
1.2.2临床资料分析:将血清中aTGAb和(或)aTPOAb阳性者分别定义为NMOSD-ON-ATAbs阳性组(下文简称“NMOSD-ON阳性组”)、MOGAD-ON-ATAbs阳性组(下文简称“MOGAD-ON阳性组”),血清中aTGAb和aTPOAb均阴性者分别定义NMOSD-ON-ATAbs阴性组(下文简称“NMOSD-ON阴性组”)和MOGAD-ON-ATAbs阴性组(下文简称“MOGAD-ON阴性组”)。
分别分析NMOSD-ON阳性组与阴性组,MOGAD-ON阳性组与阴性组的患者资料,比较相应组别的一般资料、临床特征、实验室指标及影像学特征差异。
1.2.3预后及复发风险因素分析:对入组患者进行随访,以2020-8-1作为随访终点,如在随访终点前反复发作,则选择入组后首次复发作为随访终点。如患者失访率大于20%,则不进行视力预后及复发的风险因素分析。
(1)结局指标:①视力:随访终点时患病眼矫正视力≥0.1为视力预后良好,<0.1为视力预后差[12]。如在随访终点前复发,则记录入组后首次复发前视力为结局指标。②复发:有新症状出现和(或)原症状加重,并有客观临床证据证实的新发急性中枢神经系统脱髓鞘事件,与上次发作间隔至少30 d,并且症状、体征至少持续24 h[13]。
(2)单因素分析:随访终点时,对视力预后差与预后良好的患眼,以及复发与未复发的患者进行对比,分别比较性别、双眼发病、患眼为复发眼、患眼最差视力<0.1、ANA阳性、ATAbs阳性〔aTGAb阳性和(或)aTPOAb阳性)〕、aTGAb阳性、aTPOAb阳性、甲状腺结节阳性、VEP波形未引出、视神经鞘膜受累、视交叉受累、急性期激素治疗、免疫抑制剂治疗、年龄、FT3水平、FT4水平、TSH水平等指标。
(3)多因素分析:将单因素分析中有统计学差异者(P<0.05)分别进行多因素分析。
1.3 统计学处理采用SPSS 23.0软件进行分析。连续变量进行正态性检验,对计量资料中符合正态分布者采取均数±标准差进行描述,两组间比较采取两组独立样本t检验;对非正态分布者以中位数(四分位数)描述,两组间比较采用两独立样本Mann-WhitneyU检验;对计数资料用例数和百分数描述,两组间比较采用四格表χ2检验,如两组计数资料样本数均为该组全部或0,则不进行χ2检验。将可能影响视功能预后、复发的多个自变量先进性单因素分析,之后采用二分类Logistic多元回归分析对差异有统计学意义者(P<0.05)进行多因素分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 患者一般资料共收集NMOSD-ON患者共67例,男11例、女56例,男∶女为1∶5.09,NMOSD-ON阳性组23例(33.75%)、阴性组44例(66.25%),两组间性别比例、年龄、发病年龄、病程差异无统计学意义(表1)。MOGAD-ON患者共35例,男13例、女22例,男∶女为1∶1.69,MOGAD-ON阳性组10例(28.57%)、阴性组25例(71.43%)。两组间在性别比例、年龄、发病年龄、病程差异无统计学意义(表1、2)
2.2 眼部相关临床特征NMOSD-ON患者67例(患眼84只),均急性起病,NMOSD-ON阳性组23例(患眼29只),NMOSD-ON阴性组44例(患眼55只)。与NMOSD-ON阴性组比较,阳性组入组时患病眼最差视力<0.1比例高(P<0.05),两组之间双眼发病比例、视盘水肿比例、复发眼比例、达峰时间差异均无统计学意义(P>0.05,表1)。
MOGAD-ON患者35例(患眼48只),均急性起病,MOGAD-ON阳性组10例(患眼13只),MOGAD-ON阴性组25例(患眼35只)。与MOGAD-ON阴性组比较,阳性组视盘水肿比例高〔12(92.31%)比19(54.29%)〕,P<0.05)。两组之间双眼发病比例、复发眼比例、达峰时间、患病眼最差视力<0.1比例差异无统计学意义(P>0.05,表2)。
2.3 实验室指标结果NMOSD-ON阳性组与阴性组相比,MOGAD-ON阳性组与阴性组相比,ANA抗体阳性率以及FT3、FT4、TSH水平差异均无统计学意义(P>0.05,表1、2)。
2.4 影像学结果NMOSD-ON阳性组与阴性组相比,视神经受累节段数、视神经鞘膜受累比例、视交叉受累比例差异均无统计学意义;MOGAD-ON阳性组与阴性组相比,视神经受累节段长〔3.00(1.00~3.00)比1.00(0.00~2.00),P<0.05〕,视神经鞘膜及视交叉受累比例差异均无统计学意义(P>0.05)。具体见表2。
2.5 电生理检查结果NMOSD-ON阳性组与阴性组相比,P-VEP波形未引出比例高〔20(68.97)比24(43.63),P<0.05〕,其他P-VEP异常比例差异无统计学意义,VEP正常两组均为0例,未进行χ2检验;MOGAD-ON阳性组与阴性组相比,P-VEP异常比例差异均无统计学意义(P>0.05,表1、2)。
2.6 治疗及转归67例NMOSD-ON患者中,65例急性期静脉注射甲泼尼龙冲击治疗 ;1例患者合并真菌性鼻窦炎,未加用糖皮质激素及免疫抑制剂;1例患者合并肺结核,急性期未加用糖皮质激素治疗,缓解期应用吗替麦考酚酯治疗,同时联合抗结核药物。NMOSD-ON阳性组与阴性组相比,住院时间差异无统计学意义,出院时NMOSD-ON阳性组患眼视力<0.1比例高于阴性组(75.86%比47.27%,P<0.05),表1)。
65例患者NMOSD-ON阳性组23例,其中14例接受缓解期免疫抑制剂治疗(包括硫唑嘌呤4例,吗替麦考酚酯6例,利妥昔单抗4例,9例未加用免疫抑制剂),7例复发,16例未复发;NMOSD-ON阴性组42例,其中27例接受缓解期免疫抑制治疗(包括硫唑嘌呤4例,吗替麦考酚酯23例,15例未加用免疫抑制剂),其中10例复发,32例未复发。余2例未复发。
35例(48只患眼)MOGAD-ON患者急性期均静脉注射甲泼尼龙冲击治疗,其中11例住院期间还接受免疫抑制剂治疗(包括吗替麦考酚酯10例、硫唑嘌呤1例),10只眼视力预后差,38只眼视力预后良好。MOGAD-ON阳性组与阴性组比较,住院时间及出院时两组之间患眼最差视力<0.1的比例差异无统计学意义。具体见表2。
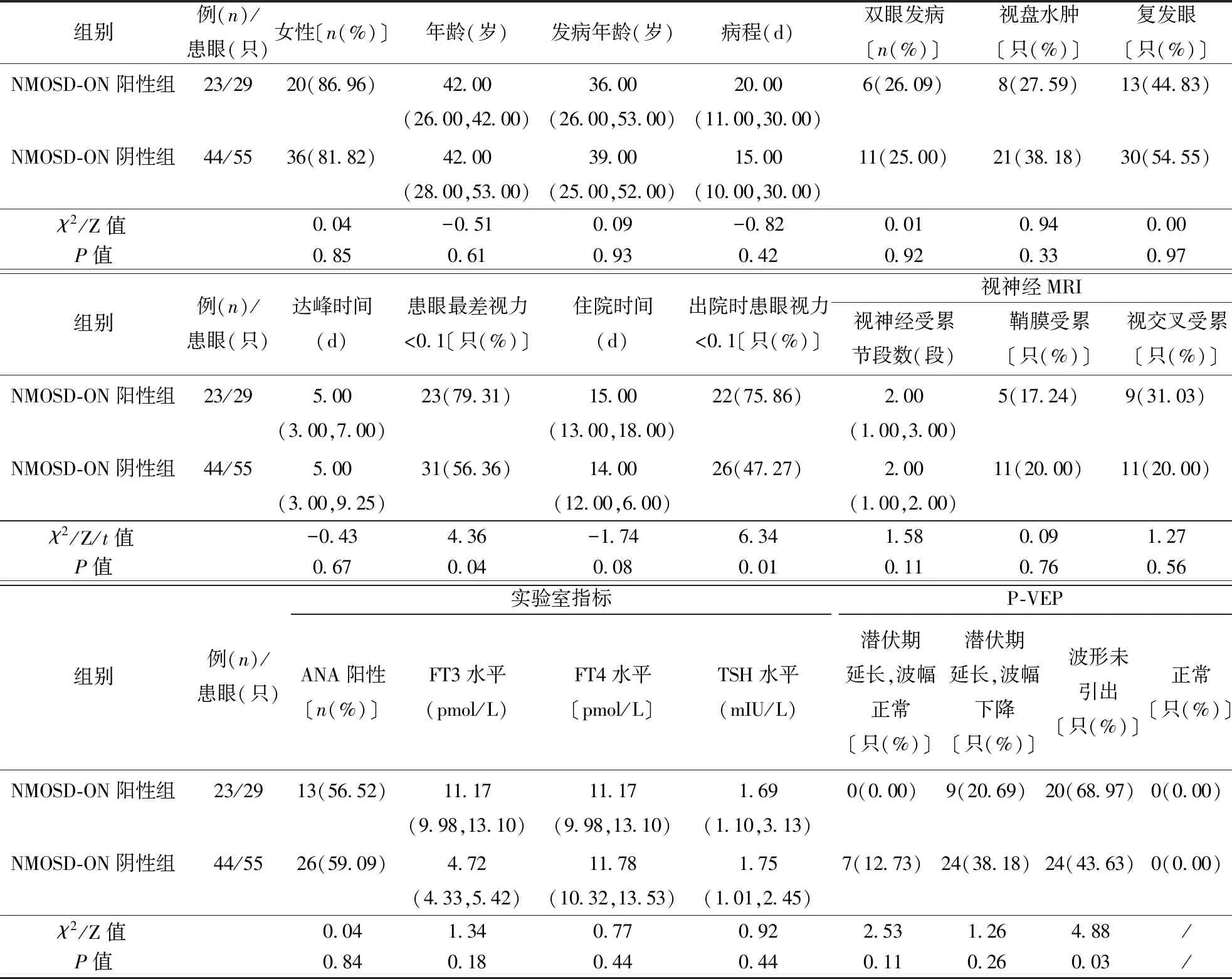
表1 NMOSD-ON患者一般及临床资料
随访终点时有10例患者失访,缓解期治疗情况不详,余25例患者中MOGAD-ON阳性组9例,3例患者采用吗替麦考酚酯进行缓解期治疗,6例患者未加用任何药物,其中1例复发8例未复发。MOGAD-ON阴性组16例,6例患者接受吗替麦考酚酯治疗,2例患者采用小剂量激素维持(甲泼尼龙4~8 mg/d),余8例患者未加用任何药物,4例复发,余12例未复发。
2.7 随访资料分析NMOSD-ON阳性组与阴性组相比,MOGAD-ON阳性组与阴性组相比,随访时间差异无统计学意义。
与NMOSD-ON阴性组比较,阳性组患病眼预后差比例高〔19(65.52%)比20(36.36%),P<0.05〕,复发比例及年复发率差异无统计学意义(表3)。NMOSD-ON阳性组7例患者复发,其中1例(14.29%)累及延髓,2例(28.57%)累及脊髓,余4例(57.14%)累及视神经,NMOSD-ON阴性组10例复发,其中1例(10%)累及脊髓,余9例(90%)累及视神经,两组间视神经、脊髓复发比例差异无统计学意义(P>0.05),因NMOSD-ON阴性组延髓复发例数为0,故延髓复发未进行统计分析。具体见表3。
MOGAD-ON组10例患者失访,余25例患者中MOGAD-ON阳性组9例(患眼12只),阴性组16例(患眼21只),MOGAD-ON阳性组患病眼预后差比例、复发比例、年复发率均低于阴性组,但差异均无统计学意义(表3)。MOGAD-ON阳性组1例复发,复发部位为视神经(100.00%),MOGAD-ON阴性组4例复发,复发部位均为视神经(100.00%),因样本数为全部或0,未进行χ2检验(表3)。 因MOGAD-ON患者失访率大于20%,后续未再对其进行视力预后及复发风险因素分析。
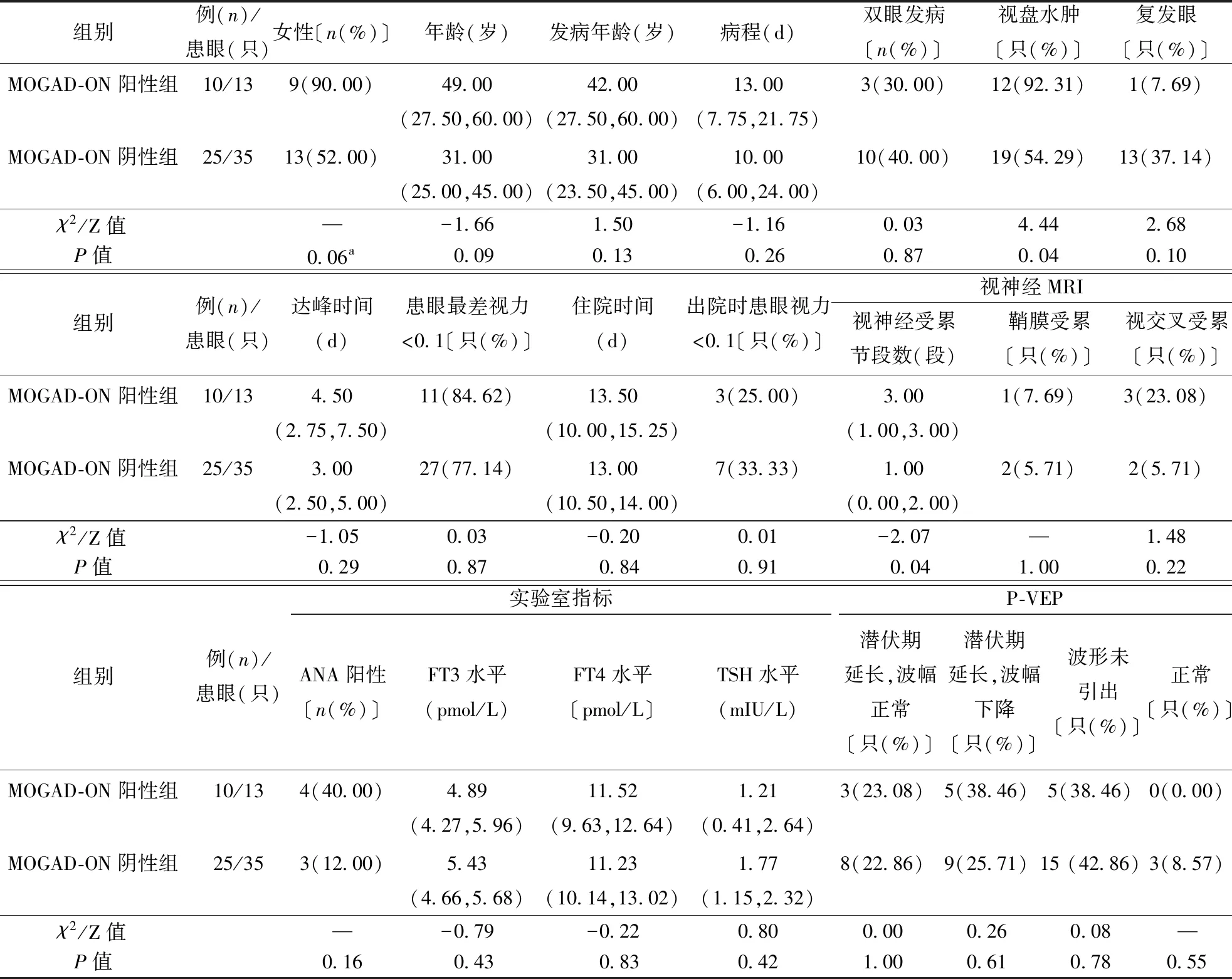
表2 MOGAD-ON患者一般及临床资料
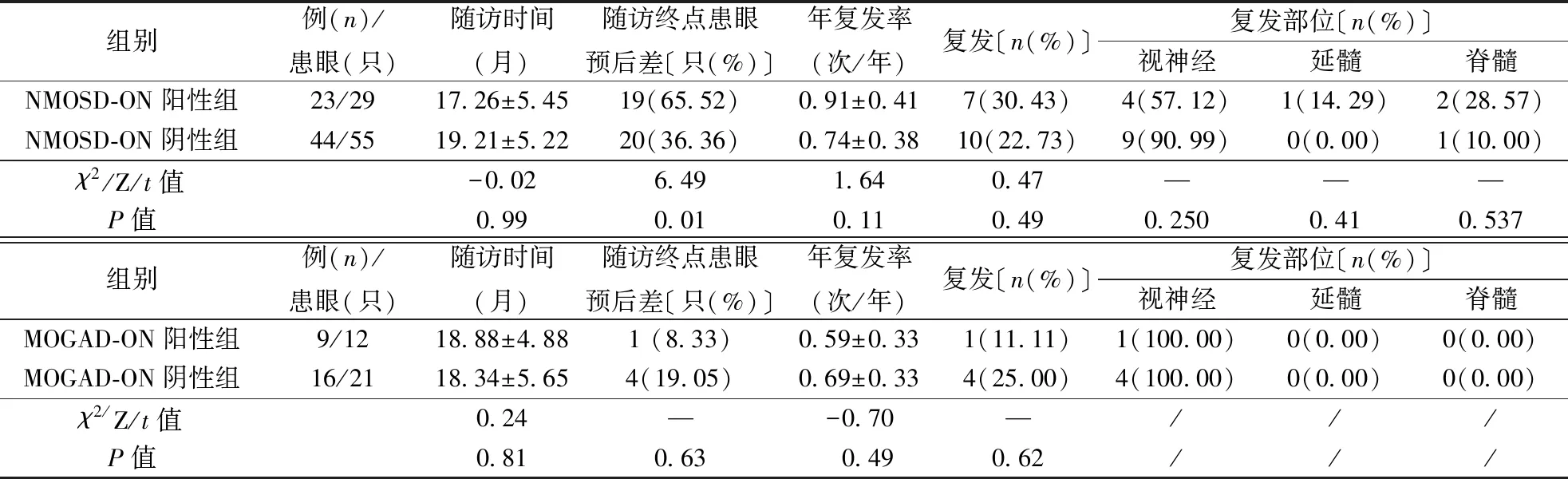
表3 NMOSD-ON、MOGAD-ON随访资料
2.8 NMOSD-ON患者视力预后及复发分析
2.8.1视力预后情况分析:单因素分析中患眼为复发眼、患病眼最差视力<0.1、FT3水平、ATAbs阳性、aTPOAb阳性,甲状腺结节阳性、VEP波形未引出等指标差异具有统计学意义(均P<0.05)(表4),将其纳入二分类Logistic回归分析,结果显示患眼为复发眼(OR=8.56,P<0.05)、患病眼最差视力<0.1(OR=18.32,P<0.05)为视力预后差的风险因素(表5)。
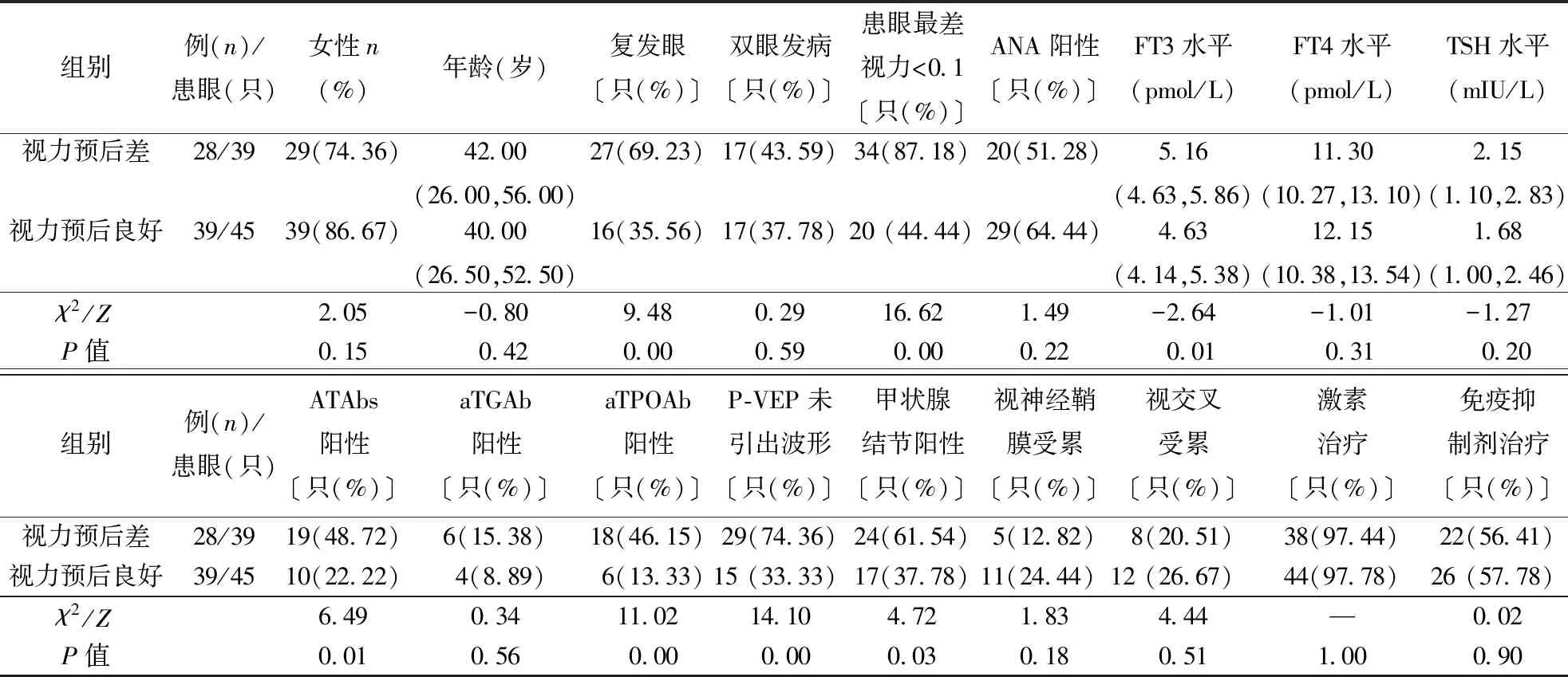
表4 NMOSD-ON随访终点视力预后单因素分析
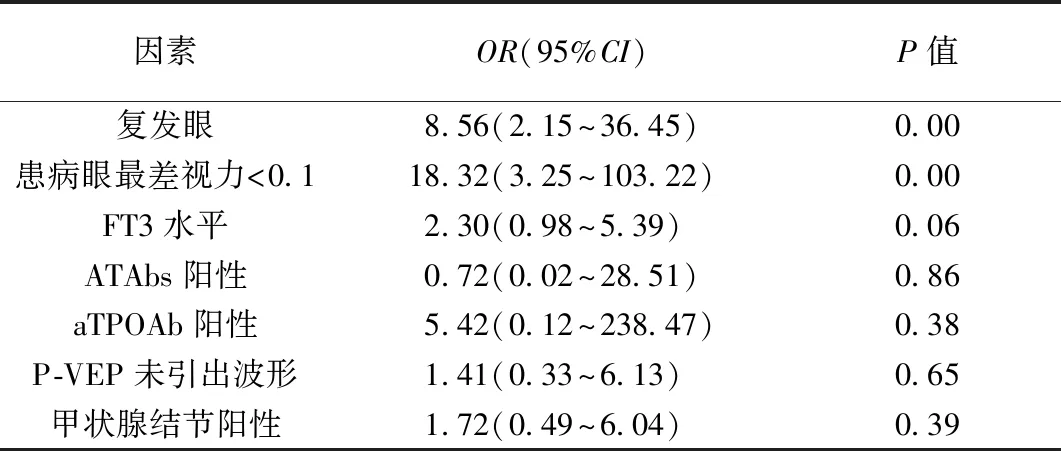
表5 NMOSD-ON患者随访后视力预后多因素分析
2.8.2NMOSD-ON患者复发因素分析:单因素分析中ANA抗体阳性、视交叉受累、应用免疫抑制剂等指标差异具有统计学意义(均P<0.05)(表6),将其纳入二分类Logistic回归分析,结果显示ANA抗体阳性(OR=22.98,P<0.05),累及视交叉(OR=19.11,P<0.05)为复发风险因素,使用免疫抑制剂治疗(OR=0.02,P<0.05)为复发的保护性因素(表7)。
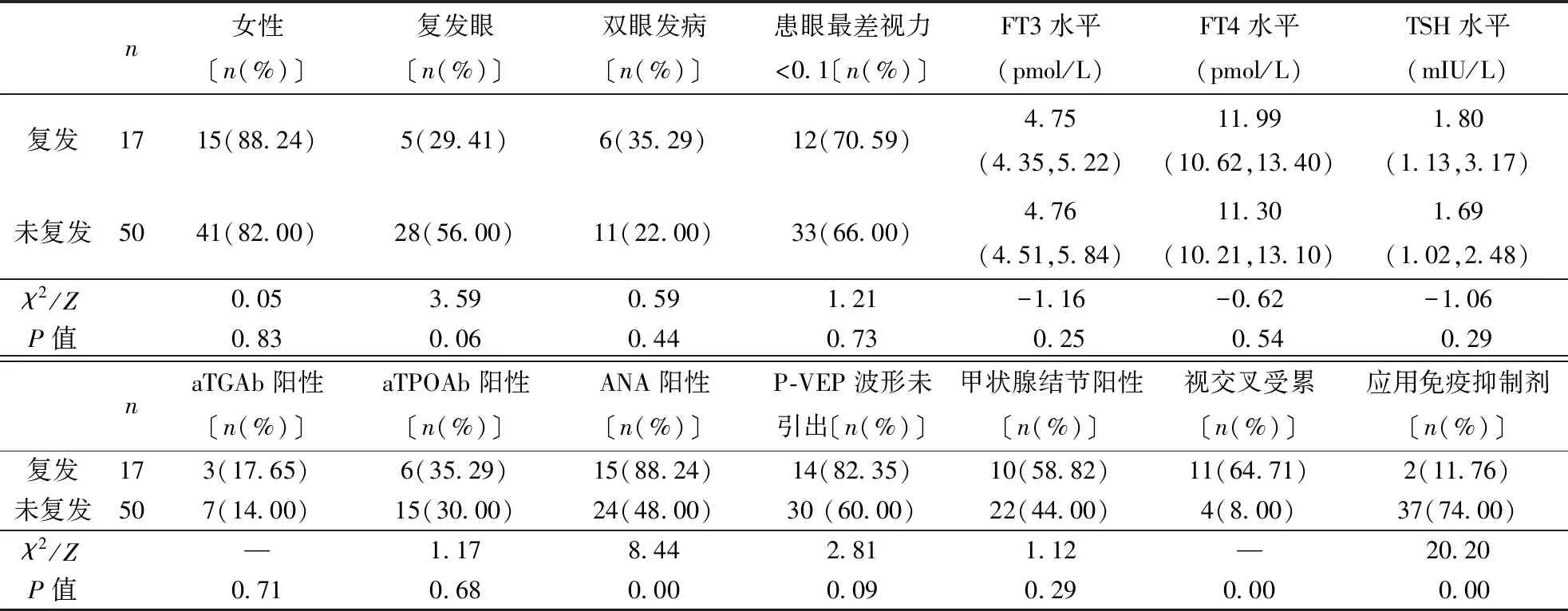
表6 NMOSD-ON复发因素的单因素分析

表7 NMOSD-ON复发因素的多因素分析
3 讨论
自身免疫性甲状腺疾病是NMOSD患者最常合并的器官特异性自身免疫疾病[5],但是少有文献研究ATAbs与NMOSD-ON临床特征及预后、复发的关系。MOGAD则是近年来提出的一种免疫介导的中枢神经系统脱髓鞘疾病,目前尚无文献研究ATAbs对MOGAD-ON临床特征、预后及复发是否有所影响。本研究对伴ATAbs的NMOSD-ON、MOGAD-ON的临床特征及视力预后及复发的风险因素进行探讨。
在本研究中,NMOSD-ON阳性组较阴性组患病眼最差视力<0.1比例高(79.31% 比56.36%,P<0.05),P-VEP波形未引出比例高(68.97%比43.63%,P<0.05),提示伴ATAbs的NMOSD-ON患者视神经的髓鞘及轴索均受损,视功能损害更为严重。有文献报道ATAbs阳性的NMOSD患者较阴性患者EDSS评分高,提示其中枢神经系统损伤更重[10],这与本研究结果类似。AQP4-IgG目前被认为是NMOSD的病理基础,既往研究提示AQP4-IgG靶抗原为星形胶质细胞[14],ATAbs,尤其是aTPOAb可与恒河猴小脑星形胶质细胞和人脑星形胶质细胞的选择性结合[15],可能是由于ATAbs与AQP4抗体具有相同的作用靶点,免疫反应存在叠加作用,导致靶器官损伤更为严重。另外也有研究发现在正常甲状腺滤泡细胞中可检测到AQP4-IgG[16],但甲状腺异常是否可导致AQP4-IgG过度分泌,加重靶器官损伤,尚需进行进一步研究证实。Zhao等[17]发现ATAbs阳性NMOSD-ON患者与阴性患者相比,患病眼最差视力、视力预后差异无统计学意义,与本研究结论不同。考虑可能原因为作者科室收治患者重度视功能损伤患者比例高,存在一定选择偏倚,尚需进行多中心研究验证结论。
本研究分析伴或不伴ATAbs的MOGAD-ON临床特征差异,结果发现伴ATAbs的MOGAD-ON患者仅视盘水肿比例更高(92.31%比54.29%,P<0.05),视神经受累节段长〔3.00(1.00,3.00)比1.00(0.00,2.00),P<0.05〕。但患病眼最差视力<0.1比例在两组中无统计学差异,提示ATAbs并未加重MOGAD-ON的视力损害,这与NMOSD-ON患者有所不同,考虑与NMOSD和MOGAD具有不同发病机制有关。
既往有研究报道甲状腺激素与脱髓鞘疾病有关[18]。T3可激活神经干细胞分化为少突胶质前体细胞,并促进其向成熟的少突胶质细胞转化,从而促进髓鞘再生[19]。NMOSD急性期低T3综合征的比例高于缓解期,T3水平与EDSS评分呈负相关[20]。高FT4水平与NMOSD患者的神经功能低下和高复发率相关[9]。TSH在中枢神经系统脱髓鞘疾病中与脊髓炎独立相关[5],而本研究中NMOSD-ON阳性组与阴性组相比,MOGAD-ON阳性组与阴性组相比,FT3、FT4、TSH水平均差异无统计学意义,与Wang等[8]的研究结果类似。本研究为回顾性分析,缺乏T3、T4水平及缓解期甲状腺激素相关记录,未来可通过进行前瞻性研究,全面收集甲状腺功能相关数据以进一步探讨甲状腺功能与脱髓鞘疾病之间的关系。
以随访终点时NMOSD-ON患病眼预后差作为结局指标,采用二分类Logistic回归分析进行多因素分析,发现本次患病眼为复发眼、患病时最差视力<0.1为预后差的风险因素。提示在临床工作中,对于具有上述特征患者,应密切关注视力情况,排除禁忌后尽早启动大剂量激素冲击治疗。本研究中激素治疗后NMOSD-ON阳性组出院时患眼视力<0.1比例高于阴性组(75.86%比47.27%,P<0.05),提示伴有ATAbs的NMOSD-ON患者激素治疗效果欠佳,可积极联合血浆置换、免疫球蛋白等其他方式以最大程度挽救视力[21]。既往研究报道首发视神经炎患者尽早使用激素治疗是视功能预后良好的保护性因素[22],而在本研究中并未发现使用激素治疗对视功能改善差异具有统计学意义。考虑与本研究大部分患病眼为复发眼(51.19%),反复发作可导致视神经损伤叠加,影响激素治疗效果有关。
ATAbs阳性NMOSD-ON患者与阴性相比,ATAbs阳性患者的复发比例、年复发率均高于阴性患者,虽差异均无统计学意义,仍提示伴ATAbs的NMOSD-ON患者存在易复发的趋势,应予关注。复发部位易累及脊髓、延髓,这与既往研究结果类似[7-10]。对NMOSD-ON患者以随访终点时复发为结局指标,二分类Logistic多因素回归分析结果发现,视交叉受累、ANA阳性为复发的危险因素,加用免疫抑制剂治疗为复发的保护因素。Wingerchuk等[12]提出NMOSD-ON更易累及视神经后部及视交叉。一项拉丁美洲的多中心回顾性分析提示了视交叉受累率约20.2%[23]。目前国内尚无关于视交叉受累率的相关研究,但由于NMOSD更好发于亚裔及非洲裔人群,推测我国NMOSD患者视交叉受累率可能更高。
ANA阳性也为NMOSD-ON复发的风险因素。ANA主要是针对细胞核内成分产生的抗体,该抗体可通过攻击细胞核从而导致炎性细胞基因表达,炎性细胞被激活后引起血脑屏障破坏,并且为AQP4-IgG诱发NMOSD提供所需的炎症环境,从而促使NMOSD的发生[24]。在临床工作中,视交叉受累、ANA阳性为NMOSD-ON复发提供警示作用,对具有上诉特征的患者,需要更加积极制定缓解期治疗方案以预防复发。
众所周知,缓解期加用免疫抑制剂是预防复发的有效方式[12],本研究结果也证实了此观点。近年来,NMOSDs靶向药物临床试验进展迅速,主要包括CD19单克隆抗体Inebilizumab、补体C5单克隆抗体Eculizumab、白细胞介素-6受体(IL-6R)单克隆抗体Satralizumab、APRIL/TAcI靶向治疗、硼替佐米及造血干细胞疗法等[2]。其中Inebilizumab、Eculizumab、Satralizumab均被临床试验证实可有效降低NMOSD患者复发率[25]。相信随着新药物的不断涌现,即将开启NMOSD靶向药物治疗的新时代。
目前国内外尚无研究报道ATAbs与MOGAD-ON的关系。本研究中MOGAD-ON阳性组激素治疗后出院时患眼视力<0.1比例低于阴性组,随访发现MOGAD-ON阳性组视力预后差比例、复发比例及年复发率均低于阴性组,虽然差异均无统计学意义,仍显示ATAbs阳性的MOGAD-ON可能较阴性者激素治疗效果好,视力预后好、复发风险低的趋势,提示ATAbs可能对MOGAD-ON存在一定保护作用,但因样本量不足未行统计分析,尚需扩大样本量进一步研究,临床应予关注。
总之,本研究发现,伴ATAbs的NMOSD-ON患者,其视功能损害更重,存在激素治疗效果欠佳,易复发趋势。患病眼为复发眼、患病时最差视力<0.1的患者视力预后差,除外禁忌后需要尽早加用免疫治疗以挽救视力;而视交叉受累,ANA抗体阳性的患者易复发,缓解期需要积极加用免疫抑制剂以预防复发。ATAbs阳性的MOGAD-ON患者视盘水肿比例高,视神经受累节段长,但ATAbs并未加重急性期视力损害,ATAbs阳性的MOGAD-ON患者可能较阴性者激素治疗反应好,视力预后好、复发风险低,但因本研究样本量少、失访率高、存在选择偏倚未行统计分析。总体而言,ATAbs与NMOSD-ON及MOGAD-ON的关系,尚需扩大样本量,多中心前瞻研究进一步探讨。

