阿昔替尼联合免疫药物治疗晚期肾癌的初步疗效观察
张岩 李凡 赵振宇 张宗彪 管维 王少刚
肾癌是一种常见的泌尿外科肿瘤,其中约有16%的肾癌患者初次诊断时已经发生转移[1]。目前用于治疗晚期肾癌的药物包括靶向药物及免疫检查点阻断剂,而两者的联合用药可达到更好的治疗效果[2-3]。阿昔替尼联合针对程序性死亡蛋白1(programmed cell death protein-1, PD-1)的新型免疫治疗单克隆抗体(阿维单抗及帕博利珠单抗)已经被中国临床肿瘤学会肾癌诊疗指南及欧洲泌尿外科学会指南在内的多部临床治疗指南推荐用于转移性肾癌的一线治疗。本研究采用阿昔替尼联合国内已经上市的免疫药物治疗晚期肾癌,并初步观察其疗效及药物不良反应的发生情况。
对象与方法
一、临床资料
本研究按照前瞻性、单臂、单中心临床研究方法设计。选取2020年9月至2021年7月华中科技大学同济医学院附属同济医院收治的8例晚期肾癌患者为研究对象。本研究经华中科技大学同济医学院医学伦理委员会批准,患者及家属均签署知情同意书。
纳入标准:①转移或不可切除的且经组织学确诊为晚期肾细胞癌的一线治疗患者,或既往未接受过免疫治疗且经化疗或靶向药物治疗失败的患者;②年龄30~70岁;③距离手术时间>4周;④预计生存时间>3个月,美国东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)评分0~1分;⑤依据实体瘤疗效评价标准(response evaluation criteria in solid tumors, RECIST)1.1版,至少有一处有可测量的病灶;⑥患者临床资料完整;⑦患者有足够的器官功能。
排除标准:①存在脑转移、脊髓压迫、癌性脑膜炎;②有活动性自身免疫疾病或自身免疫性疾病病史;③有严重心血管疾病病史;④未控制的活动性乙型肝炎、丙型肝炎;⑤近2周使用糖皮质激素或其他免疫抑制药物;⑥首次给药前4周内接受过主要脏器外科手术(不包括穿刺活检)或出现严重外伤,存在未愈合的伤口;⑦首次给药前的过去5年内患有其他活动性恶性肿瘤;⑧既往抗肿瘤治疗的不良反应尚未恢复到常见不良事件评价标准(common terminology criteria for adverse events, CTCAE)5.0版等级评价≤1级(脱发除外);⑨既往接受过PD-1或程序性死亡配体1(programmed death ligand 1, PD-L1)阻断剂治疗的患者。
二、治疗方法
本研究共纳入8例晚期转移性肾癌患者,所有患者均出现远处转移。8例患者均采用阿昔替尼联合免疫药物治疗,其中1例采用阿昔替尼联合帕博利珠单抗治疗,1例采用阿昔替尼联合信迪利单抗治疗,6例采用阿昔替尼联合替雷利珠单抗治疗。联合治疗方案为阿昔替尼 5 mg,每日2次,连续口服,免疫药物使用替雷利珠单抗/信迪利单抗/帕博利珠单抗200 mg静脉滴注,每3周1次。治疗持续至肿瘤进展或因严重不良反应退出为止。
三、观察指标及随访
于治疗2个周期(6 周)后随访并复查MRI或CT,由专业研究人员统一选定靶病灶。根据RECIST 1.1版进行1次疗效评价,将疗效分为完全缓解(complete remission, CR)、部分缓解(partial remission, PR)、稳定(stable disease, SD) 及进展(progressive disease, PD),其中疾病控制率(disease control rate, DCR)=(CR例数+PR例数+SD例数)/总例数×100%,客观缓解率(overall response rate, ORR)=(CR例数+PR例数)/总例数×100%。
按照CTCAE 5.0版对药物不良反应进行分级,主要记录患者局部或全身症状、血压、肝肾功能、电解质、尿常规、血常规、皮质醇、甲状腺功能、凝血功能和心电图等,出现1~2级药物不良反应时主要采用对症处理,出现3级及以上药物不良反应时需根据情况停药、减量或进行针对性处理。
所有受试者均在治疗开始后,每2个周期进行1次复查随访,评价治疗疗效。 采用门诊、电话及微信相结合的方式进行随访,随访截止日期为2021年11月1日。
结 果
一、一般资料
8例晚期肾癌患者的中位年龄为51.90(34.03~62.00)岁,一般资料见表1。

表1 患者一般资料
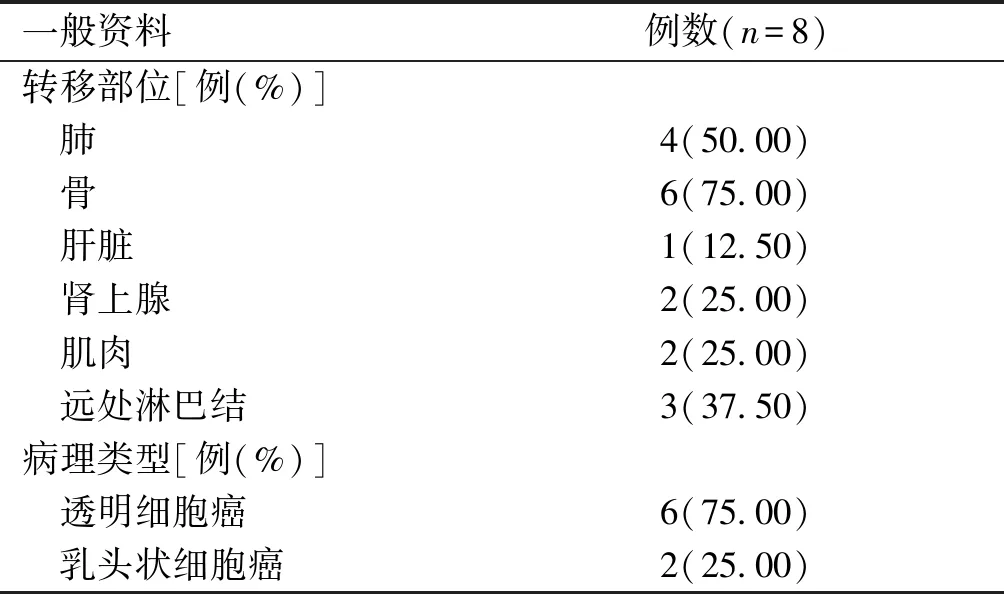
续表1 患者一般资料
二、近期疗效
8例患者中,阿昔替尼联合免疫药物治疗的中位时间为6.58(4~14)个月,随访的中位时间为5.08(3~12)个月。8例患者均可评价疗效,其中未见CR病例,PR有4例, SD有2例, PD有2例, DCR为75.00%(6/8),ORR为50.00%(4/8)。因随访时间较短,尚未达到中位无进展生存期(progression-free survival, PFS)和中位总生存期(overall survival, OS)。
图1A显示1例患者右侧腹膜后的典型肿块,而图1B显示经过联合治疗后右侧腹膜后转移灶明显缩小。
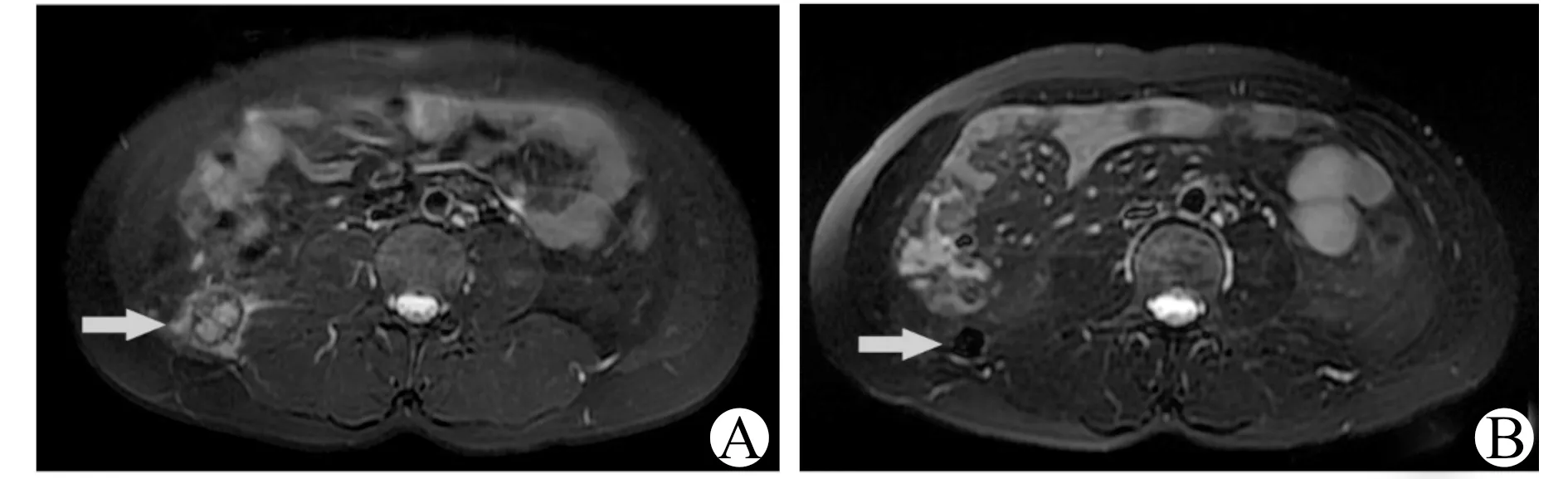
A:阿昔替尼联合免疫药物治疗前;B:阿昔替尼联合免疫药物治疗后图1 患者在阿昔替尼联合免疫药物治疗后右侧腹膜后转移灶明显缩小(箭头所指)
三、安全性评价
8例患者均出现不同程度的药物不良反应,主要为1~2级,3~4级较少。全身关节肌肉疼痛1级2例;全身乏力1级1例;高血压 3级2例;腹泻 1级3例,3级1例;胃痛 1级1例;甲状腺功能减退1级4例,2级1例;肾上腺功能不全1级2例;便秘1级1例;肾功能不全1级1例,2级1例;皮疹1级2例;皮肤瘙痒1级2例;手足综合征1级1例;咽痛2级1例;牙痛1级1例;口腔黏膜炎1级1例;口干1级1例;鼻腔黏膜炎1级1例;转氨酶升高1级1例,2级2例,3级1例;蛋白尿1级1例,2级1例;血尿1级1例;血小板减少1级1例;高尿酸血症1级1例;高胆固醇血症2级1例。其中2例患者高血压3级,服用降压药物后,血压控制可;1例患者转氨酶升高3级,予以停用免疫药物、阿昔替尼减量、糖皮质激素及护肝治疗后好转;另有1例患者腹泻3级,予以停用免疫药物、阿昔替尼减量、糖皮质激素及对症治疗后好转。其余所有药物相关不良反应经对症处理后好转,患者耐受良好。
讨 论
全身药物治疗是晚期肾癌的主要治疗方式。近15年以来,作用于血管内皮生长因子通路的抗血管生成的酪氨酸激酶抑制剂显著的改善了晚期肾癌的治疗效果。其中,一线药物舒尼替尼、培唑帕尼可显著延长晚期肾癌的中位OS至26~29个月[4-5]。近年来,免疫检查点阻断剂的出现大大丰富了晚期肾癌的治疗策略。免疫检查点阻断剂均为单克隆抗体,可在体内靶向并阻断T细胞表面受体PD-1或细胞毒性T淋巴细胞相关蛋白4,从而修复肿瘤特异性T细胞的免疫应答[6]。基于免疫检查点阻断剂的联合治疗在晚期肾癌的治疗中逐渐占据着重要地位。阿昔替尼联合帕博利珠单抗及阿昔替尼联合阿维单抗已被推荐为晚期肾癌的一线治疗。但是目前阿维单抗尚未引入国内,而帕博利珠单抗国内适应症尚未包括晚期肾癌的治疗。本研究采用阿昔替尼联合国内已经上市的免疫药物治疗晚期肾癌,并初步观察其疗效及药物不良反应,其效果显著。
KEYNOTE-426研究对比了阿昔替尼联合帕博利珠单抗与舒尼替尼一线治疗晚期肾癌的效果[7],联合治疗组患者的中位PFS时间为15.1个月,显著高于舒尼替尼组的11.1个月。联合治疗组患者的ORR可达59.3%,远高于舒尼替尼组的35.7%,且联合治疗可显著降低47%的死亡风险(P<0.001)。进一步亚组分析显示,所有IMDC危险分组、PD-1表达组及PD-1非表达组均有临床获益,但中危组和高危组的获益更明显。另外一项研究也证实了阿昔替尼联合阿维单抗的PFS及ORR显著优于舒尼替尼[3]。国内也有多项研究发现阿昔替尼联合免疫药物治疗晚期肾癌具有较高的缓解率[8-9]。本研究对阿昔替尼联合免疫药物治疗晚期肾癌的近期疗效进行分析,发现DCR为75.00%,ORR为50.00%,疗效显著。小鼠体内试验研究表明,阻断PD-1可促进T细胞向肿瘤浸润,促进局部免疫反应,而阻断血管内皮生长因子通路可显著抑制血管生成,且可减少免疫治疗中T细胞耗竭表型,故两者具有协同抗肿瘤作用[10-11]。本研究中ORR较国内外文献报道稍低,分析原因可能为:①多脏器转移患者占比较高,肿瘤负荷大,且其中骨转移患者占比高,多提示预后不良[12];②患者IMDC危险分组中,没有低危患者,所有患者均存在危险因素[13]。
阿昔替尼联合免疫药物为晚期肾癌的治疗提供了更多选择,但也要高度关注其带来的不良反应。有研究报道阿昔替尼联合阿维单抗的总体及3级以上不良事件发生率与舒尼替尼单药一致[3]。阿昔替尼联合阿维单抗治疗组最常见的不良反应为腹泻(62.2%)、高血压(49.5%)和疲劳(41.5%)。本研究发现在予以阿昔替尼联合免疫药物治疗过程中所出现的药物不良反应主要为1~2级,且以甲状腺功能减退(5例)、腹泻(4例)、转氨酶升高(4例)等多见。阿昔替尼联合阿维单抗治疗中,3级及以上不良反应最常见为高血压(25.6%)、腹泻(6.7%)及谷丙转氨酶升高(6.0%)[3]。本研究中3级不良反应共4例,其中2例高血压,1例腹泻,1例转氨酶升高,与既往报道相似。其中,高血压3级不良反应在予以有效降压药物治疗后好转,而转氨酶升高及腹泻均通过停用免疫药物、阿昔替尼减量、糖皮质激素及对症治疗后好转。联合用药过程中出现的药物不良反应包括免疫相关不良反应及阿昔替尼相关不良反应,这两种不良反应有部分重叠,其中转氨酶升高及腹泻的原因鉴别较困难,故本研究中采取了对两种药物均进行减量或停药的处理。而高血压及蛋白尿通常为靶向药物所导致可能性大[14],在必要时可对其剂量进行调整。本研究中所有患者在治疗期间暂未出现免疫相关性肺炎、心肌炎及重症肌无力等严重不良反应。
本研究还存在以下不足之处,第一,本研究中还未出现患者因疾病进展而死亡,原因可能是纳入的研究病例数少且随访时间短,尚未达到中位PFS和中位OS时间,还需持续随访并进行长时间疗效评价。第二,本研究未对患者肿瘤的PD-L1表达进行检测。肾细胞癌中PD-L1表达阳性与更晚的肿瘤分期、淋巴结受累、远处转移、肿瘤坏死有关,多提示预后不良[15]。但是PD-L1表达阳性对免疫治疗的预测价值目前仍有争议。Rizzo等[16]对多项基于免疫治疗的联合治疗临床试验进行了分析,PD-L1表达阳性的患者及未经选择的患者OS的合并风险比(hazard ratio,HR)分别为0.71及0.75,PFS的合并HR分别为0.68及0.63,两者无显著差异,提示PD-L1表达无法有效预测基于免疫治疗的联合治疗疗效。
综上所述,本研究表明阿昔替尼联合免疫药物治疗对晚期肾癌具有较好的疗效及安全性。但因本研究样本量小、随访时间短,PFS和OS尚未达到,仍需持续随访并进行长时间疗效评价。

